糖尿病是一种以高血糖为主要特征的代谢性综合征, 糖尿病的发病率在全球范围内呈逐年升高的趋势, 根据国际糖尿病联合会统计, 目前全世界约有3.82亿人受到糖尿病的影响[1]。长期高血糖会导致全身多器官特别是神经系统、心脏、血管、肾脏和眼等的功能障碍, 严重危害人类健康。
糖尿病神经性疼痛 (diabetic neuropathic pain, DNP) 是糖尿病最常见的慢性并发症之一, 病理机制尚未完全清楚。高血糖的毒性作用在DNP的发展过程中起重要作用, 另外, 周围神经营养血管的变化, 神经胶质细胞激活、离子通道表达的变化, 以及最近提出的中枢疼痛机制如丘脑血管分布的增加和促进/抑制下行通路的失衡等[2]都在DNP的发生、发展过程中发挥重要的作用。
脊髓背根神经节 (dorsal root ganglion, DRG) 是躯体初级感觉传入神经元的细胞体聚集处, 能对感觉信息进行转换和调制, 并将其传递到脊髓。由于其在调节伤害性疼痛和神经性疼痛等感觉处理方面的重要性, DRG在神经性疼痛治疗方面已成为重要的靶向组织。研究表明, 在DNP的发展过程中, 外周神经受损会伴随DRG神经元的兴奋性和放电频率增加, 并产生异位放电, 同时DRG上的离子通道的种类、数量及电生理特性都将发生相应的改变。因此本文对近年来与DNP相关的外周神经系统离子通道的研究进展, 及相应的药物发现进行了总结。
1 离子通道在糖尿病神经病理性疼痛发生中的作用在糖尿病神经病理性疼痛的发生过程中, 多种离子通道已被报道参与该疾病的发生。糖尿病的离子通道机制以及可能的药物干预环节如图 1所示。
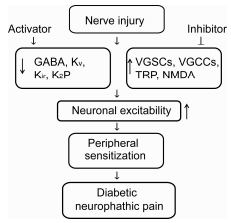
|
Figure 1 Proposed model for the mechanism of diabetic neuropathic pain |
钾离子通道是亚型最多、作用最复杂的一类离子通道, 在调节静息膜电位、动作电位的复极以及神经递质释放具有重要作用[3]。主要包括电压门控钾离子通道 (Kv)、内向整流钾离子通道 (Kir) 和双孔钾离子通道 (K2P) 等。
电压门控钾通道家族成员按照α亚单位分组, 包括12个成员 (Kv1.x~Kv12.x), 该类通道在控制神经元兴奋性方面有重要的作用, 功能下调将导致神经元兴奋性增加[4]。其中针对表达于初级感觉神经元的Kv通道研究最多, 主要包括Kv1、Kv2、Kv3、Kv4以及Kv7等家族成员。基于失活动力学以及对四乙胺 (tetraethylammonium, TEA) 和四氨基吡啶 (4-aminopyridine, 4-AP) 的敏感性, 主要包括两种类型: TEA敏感的慢失活延迟整流钾电流 (IK) 和4-AP敏感的快失活瞬时A型钾电流 (IA)。IK电流主要由Kv1.1、Kv1.2、Kv2.1和Kv2.2等组成, 而IA电流主要由Kv1.4、Kv3.4、Kv4.2和Kv4.3组成[5]。研究发现链脲霉素 (streptozotocin, STZ) 诱发的1型糖尿病神经性疼痛模型分离的DRG神经元, 表现为静息膜电位去极化、神经元兴奋性升高等。进一步的研究表明, 电压门控钾通道如4-AP敏感的IA电流和亚单位 (Kv1.4、Kv3.4、Kv4.2和Kv4.3) mRNA表达均下降; TEA敏感钾通道的电流虽然降低, 但基因表达却无显著改变 (Kv1.1、Kv1.2、Kv2.1和Kv2.2)[6]。
Kv7是钾通道家族中另一重要成员, 其中KCNQ2与KCNQ3是Kv7家族的主要钾通道成员, 分布于中枢神经系统的海马神经元、外周神经系统的交感神经节和背根神经节等[7], 是形成神经元静息电位的主要基础, 是公认的治疗癫痫和疼痛的药物靶点。KCNQ钾离子通道的激活电压接近动作电位发生的阈电位, 一旦激活后能够降低神经元兴奋性, 从而限制神经元动作电位的发放[8]。KCNQ钾离子通道的遗传缺陷或药理学抑制将导致神经元过度兴奋, 而KCNQ钾离子通道开放剂具有兴奋抑制效应, 可阻止神经元的异常放电[9-11]。尽管KCNQ钾通道在糖尿病神经性疼痛病理生理机制方面鲜有报道, 但是研究发现KCNQ2钾通道开放剂在包括STZ诱发的DNP等多种神经性疼痛模型均可显著缓解疼痛[12]。
在Kv家族中Kv9.1也是一个不容忽视的重要成员, 该通道自身不能形成有功能的通道, 但可与Kv2.1形成异聚体来调节Kv2.1通道的功能; 研究发现Kv9.1表达或功能下调, 可导致有髓鞘神经纤维兴奋性增加, 促进神经性疼痛行为的进展等[13]。
Kir家族是一类内向整流钾离子通道, 其中ATP敏感型钾通道 (KATP) 与DNP有密切的关系[14]。KATP是一种受细胞内ATP浓度调节的通道, 在生理条件下该通道基本处于关闭状态, 当细胞内ATP/ADP比值下降时被激活, 进而将细胞代谢状态和膜兴奋性快速协调起来, 从而形成一种独特的细胞保护机制。KATP通道是由内向整流钾通道 (Kir6.1和Kir6.2) 和磺酰类受体 (SUR1、SUR2A和SUR2B) 两部分亚基组成的八聚体, 不同的组合构成了功能多样的KATP通道复合体, 其中与糖尿病紧密相关的为胰腺型KATP通道 (Kir6.2/SUR1), 主要调节胰岛素的分泌。磺酰脲类降糖药即为靶向KATP通道的抑制剂。KATP通道还调节可兴奋性细胞如神经细胞的动作电位发放特性[15]。研究发现, 在轴索切断的动物模型中, 初级传入神经元中的KATP电流减少。由此推断, 可以通过增加这类通道的开放来调节神经元的兴奋性。因此, KATP通道不但是治疗糖尿病的重要靶点, DRG神经元的KATP通道为DNP的治疗也提供了新的靶位。
K2P型钾离子通道, 由四次跨膜片段和两个孔道结构域 (2P) 组成。双孔钾离子通道主要功能是维持神经元细胞的超极化静息膜电位, 在神经元细胞兴奋过程中起着重要作用[16]。TRESK与TREK-1是DRG最主要的背景电流[17], TREK-l已被证明参与多种类型的疼痛[18, 19]; TRESK大量表达于DRG神经元, 研究提示TRESK可能也与不同类型疼痛发生相关[20-24]。因此, 并不排除TRESK也可能参与DNP的发生、发展过程。
1.2 钠离子通道电压门控钠离子通道 (voltagegated sodium channels, VGSCs) 共有9种亚型 (Nav1.1~Nav1.9), 除Nav1.4和Nav1.5外, 其余亚型主要分布于中枢和周围神经系统[25], 参与动作电位的产生和疼痛的传导[26]。近年研究发现, 多种钠通道亚型的表达在糖尿病神经性疼痛过程中发生改变, 影响疾病的进程, 主要表现为钠通道亚型表达上调。如在STZ诱导的1型糖尿病大鼠模型中, Nav1.3和Nav1.7的基因表达显著上调[27], 而Nav1.6在发病早期表达有所下降, 到了后期, 其表达量则呈增加的趋势。同样在2型糖尿病小鼠模型的DRG神经元, Nav1.6的表达也有显著的增加[28]。除了钠通道亚单位mRNA表达水平改变外, 糖尿病神经性疼痛也会导致通道的翻译后修饰反应。如在STZ诱导的1型糖尿病模型中, 糖酵解的代谢产物甲基乙二醛, 可诱导Nav1.8的翻译后修饰, 进而导致伤害感受器神经元的超兴奋性和易化放电[29]。
降低钠通道的功能活性可显著地缓解疼痛, 如给予靶向Nav1.7的miRNA以及药物如GABA、加巴喷丁后, 疼痛得到显著缓解[30, 31]。与非选择性钠离子通道阻断剂利多卡因相比, Nav1.8选择性阻断剂在糖尿病神经病变模型中, 疼痛缓解作用更加显著[29, 32]。
1.3 钙离子通道电压门控钙离子通道 (voltage-gated calcium channels, VGCCs), 通过影响神经元兴奋性和突触传递来调节疼痛通路的功能。基于门控离子电流的膜电位, VGCCs被分为高电压 (high-voltage activated, HVA)、低电压 (low-voltage activated, LVA) 或者瞬时电流 (T-channels) 激活的钙通道。T型钙通道在神经元兴奋性方面起独特的作用, 细胞膜去极化后先激活T电流, 进而影响静息膜电位的水平[33]。
到目前为止, 对VGCCs在感觉神经元异常兴奋中的作用, 以及在糖尿病神经性疼痛中的作用知之甚少。STZ诱导的1型糖尿病模型发现, DRG细胞T电流上调了两倍而HVA电流并没有明显改变[34], 如选择性地敲除DRG上T型Cav3.2通道, 可以有效地逆转机械痛觉过敏和热痛觉过敏。此外, 在瘦素缺失 (ob/ob) 糖尿病神经病理性疼痛模型中, DRG神经元Cav3.2 mRNA水平明显增加, 同样T电流有明显的上调[35]。如应用选择性T通道拮抗剂ECN[(3b, 5a, 17b)-17-hydroxyestrane-3-carbonitrile], 可有效地逆转糖尿病ob/ob小鼠的疼痛行为, 而在Cav3.2敲除的糖尿病小鼠中则完全无效。因此通过阻断DRG细胞中的Cav3.2通道, 可能有助于缓解糖尿病患者的顽固性疼痛[36]。
1.4 瞬时感受器电位通道瞬时感受器电位 (transient receptor potential, TRP) 基因超家族, 编码能够通透钙离子的非选择性阳离子通道。到目前为止, 已经在哺乳动物中发现了TRP家族的近30个成员, 分为6个亚家族, 在感觉神经系统中, TRP家族的成员广泛分布于外周感觉神经元, 且多数以通透Ca2+为主[37], 而与DNP有关的主要是TRPA和TRPV亚家族。
瞬时感受器香草素亚型1 (transient receptor potential vanilloid 1, TRPV1) 是一种配体门控的非选择性阳离子通道, 大量分布于神经系统。在脊神经损伤所致的病理性疼痛模型中, TRPV1的mRNA和蛋白表达水平均明显升高[38]。而在DNP状态下, 已经确定TRPV1是痛觉的关键因子[39]。
TRPV4是近年来研究较多的TRPV亚家族成员之一, TRPV4主要表达于DRG神经元。研究表明, 与野生型小鼠相比, TRPV4敲除小鼠对伤害性机械刺激的阈值明显升高[40], 另外, TRPV4敲除小鼠对糖尿病诱导的机械性疼痛也变得不敏感[41], 这些研究提示TRPV4可能参与了疼痛的产生, 同时TPRV4的拮抗剂可能具有治疗缓解DNP的作用。
TRPA1是在DRG和三叉神经节中发现的一种非选择性钙离子通透的阳离子通道。糖尿病可造成感觉神经病变和氧化应激反应, 后者可能导致TRPA1的活化进而调节伤害性感受器的兴奋性, 诱导糖尿病神经病理性疼痛的发生。药理学实验表明, 腹腔注射TRPA1拮抗剂Chembridge-5861528 (CHEM) 能明显缓解糖尿病诱导的疼痛[42]。
1.5 GABA受体GABA受体包括3种亚型: GABAA、GABAB和GABAC。近年来, 对神经性疼痛的研究主要集中在GABAA和GABAB两种受体。GABAA受体是一种由5个亚基组成的跨膜氯离子通道受体。GABAB受体是一种G-蛋白偶联受体, 以两个亚型GABAB1与GABAB2的异二聚体形式发挥细胞信号传导功能。在STZ诱发的DNP大鼠模型中, 脊髓背角神经元GABAB1受体mRNA水平以时间依赖性方式降低, 大鼠痛阈明显下降[43]。说明GABAB1受体的表达下调可能导致脊髓背角神经元兴奋性亢进和DNP的发生。
1.6 NMDA受体NMDA受体 (N-methyl-D-aspartic acid receptor, NMDA) 即为N-甲基-D-天冬氨酸受体, 是离子型谷氨酸受体的一个亚型, NMDA受体是一种独特的双重门控通道, 它既受膜电位控制也受神经递质调控。NMDA受体被激活后, 主要对Ca2+有通透性, 介导持续、缓慢的去极化过程。
DNP大鼠脊髓背角投射神经元活性明显增高, 对伤害性刺激产生超敏反应, 脊髓背角神经元释放的兴奋性谷氨酸递质也显著增加, 而过多的谷氨酸将激活脊髓背角神经元突触后膜的NMDA受体, 使神经细胞内钙离子浓度迅速增高, 从而触发一系列钙依赖性第二信使级联反应[44]。NMDA受体活性的增加, 引起神经胞体内溶酶体酶和蛋白酶活性增强, 导致GABAB受体下调, 从而降低谷氨酸能神经元GABAB受体的突触抑制作用[45], 进一步提高其兴奋性, 使神经元抑制性与兴奋性递质释放失衡, 诱发疼痛。
2 糖尿病神经性疼痛的治疗现状糖尿病的始作俑者是高血糖, 因此严格控制血糖水平无疑是预防和延缓DNP最重要的治疗方案之一, 但对于疼痛状态难以忍受且已经严重影响生活质量的患者, 相关的疼痛治疗则显得尤为关键。由于尚无针对DNP的药物问世, 目前主要应用广谱的镇痛药物进行对症治疗。推荐的一线治疗药物包括抗抑郁药 (三环类抗抑郁药和5-羟色胺再摄取抑制剂) 和抗惊厥药 (加巴喷丁和普瑞巴林) 等。现将用于治疗DNP的离子通道药物列述如下。
2.1 抗惊厥药抗惊厥药物在神经性疼痛治疗中有很好的疗效, 但只有α2-δ配体钙离子通道拮抗剂目前被推荐为一线治疗药物, 如加巴喷丁 (gabapentin) 和普瑞巴林 (pregabalin)。加巴喷丁和普瑞巴林属γ-氨基丁酸 (GABA) 衍生物, 可通过抑制中枢神经系统中电压依赖Ca2+通道中的α2-δ亚单位, 减少Ca2+的内流, 抑制兴奋性神经递质, 如SP、去甲肾上腺素和谷氨酸盐等的释放, 从而有效缓解DNP的症状[46]。
2.2 抗抑郁药根据抗抑郁药物化学结构和药理机制进行分类, 包括三环类抗抑郁药 (tricyclic antide pressants, TCAs) (如阿米替林、去甲替林和丙咪嗪)、选择性5-羟色胺再摄取抑制剂 (如氟西汀)、去甲肾上腺素再摄取抑制剂 (selective norepinephrine reup take inhibitors, SNRIs) (如文拉法辛和度洛西汀)、单胺氧化酶抑制剂 (如甲氯苯酰胺) 等。超过12个随机对照试验证明了TCAs能够有效治疗糖尿病神经性疼痛、带状疱疹感染后神经痛以及中枢性卒中后疼痛 (central post-stroke pain, CPSP) 等[47, 48]。TCAs以盐酸阿米替林为代表, 其作用主要是通过调控神经传导下行通路中的多种靶点如5-羟色胺和去甲肾上腺素 (noradrenaline, NE) 能系统、多巴胺能系统、阿片受体、Na+、K+及Ca2+离子通道、NMDA受体等发挥镇痛作用。SNRIs如度洛西汀和文拉法辛, 可通过抑制突触前膜上NE的再摄取, 对于治疗糖尿病神经病理性疼痛有着较好的效果。与TCAs相比, 它们的镇痛效果更好, 不良反应较少, 在患者不能使用TCAs时仍可选用[48, 49]。
2.3 局部用药利多卡因主要通过抑制电压门控钠离子通道而发挥镇痛的作用。利多卡因还可抑制与神经纤维紧密相连的皮肤角质细胞释放疼痛介质, 进而达到缓解疼痛的作用。利多卡因贴剂对皮肤有额外的冷却效果, 并对疼痛部位提供保护。辣椒素 (capsaicin) 是香草素受体TPRV1的激动剂, 长期以来一直通过激活TRPV1受体进而使之脱敏作为治疗神经性疼痛的策略, 先激活热痛觉神经, 产生强烈的烧灼感, 由于过度刺激, 最终致使痛觉通路脱敏, 目前辣椒素已广泛用于临床, 如辣椒素透皮贴用于治疗DNP[50]、带状疱疹神经痛以及癌性疼痛等[51]。由于TRPV1激动剂会产生一定的不良反应, 如局部使用辣椒素数天或数周后会导致痛觉丧失, 以及对各种有害刺激失去反应。而TRPV1拮抗剂可有效缓解神经性疼痛症状, 目前一些TRPV1拮抗剂 (SB-705498和MK2295/NGD8243) 已经进入Ⅱ期临床试验[52]。
3 正在研发的靶向疼痛的离子通道药物由于离子通道在糖尿病神经性疼痛中的重要作用, 以及其作为靶点在神经性疼痛中的重要性, 目前有多种离子通道药物正处在研发阶段。下面着重介绍以电压门控钾通道、钠通道和钙通道为靶点的离子通道药物。
3.1 钾离子通道激动剂钾通道家族成员众多, 参与许多重要的生理病理过程的调节。理论上靶向钾离子通道药物具有非常重要的治疗前景, 但由于钾离子通道的普遍存在及亚型众多等原因, 造成这些药物选择性差, 很容易产生不良反应等。目前阶段靶向Kv7钾通道的开放剂表现出一定的治疗前景。ICA-105665是Kv7.2/7.3/7.5钾离子通道的开放剂[53], 对糖尿病神经痛表现出明显的作用, 目前正处于Ⅱ期临床试验阶段[54]。
3.2 Nav1.7选择性抑制剂由于仅在感觉神经和伤害感受系统表达, Nav1.7已经成为一个热门的治疗疼痛的药物靶标。临床数据表明, 钠离子通道Nav1.7亚型有潜力成为治疗包括DNP在内的所有类型神经性疼痛的重要靶点[55-57]。目前处于临床Ⅱ~Ⅲ期的钠通道阻断剂药物包括如下几种:
PF-05089771是一个磺胺类衍生物, 相对其他钠通道亚型以及心脏钙通道和钾通道, 它对Nav1.7具有1 000倍的强效选择性 (IC50=11.0 nmol·L-1)。到目前为止, 临床Ⅰ期的研究表明PF-05089771是安全的, 并具有良好的耐受性和体外药效。PF-05089771作为一种新型疼痛治疗药物, 目前处于Ⅱ期临床试验阶段[58]。
CNV1014802是一个在外周和中枢都有作用的钠通道抑制剂, 相比其他亚型如Nav1.1、Nav1.2、Nav1.5和Nav1.6, 其对Nav1.7具有更高的选择性。同时该化合物还是单胺氧化酶抑制剂B (MAO-B) 的可逆选择性抑制剂。目前处于临床Ⅱ期三叉神经痛的疗效评价阶段[59]。
另一种Nav1.7选择性抑制剂XEN402 (IC50=80 nmol·L-1) 是螺旋吲哚衍生物, 对治疗先天性红斑肢痛症 (congenital erythromelalgia) 有明显的作用。在临床Ⅰ期的研究中, XEN402表现出安全以及良好的耐受性, 目前处于Ⅱ期临床研究[60]。
3.3 钙通道拮抗剂针对钙通道拮抗剂的开放, 主要靶向N型和T型钙通道。对N型钙通道的药理学研究, 主要是基于对ω-芋螺毒素 (ω-conotoxins) 的发现, 这种从地纹芋螺 (Conus geographus) 中分离得到的物质, 可以有效地减少各种刺激所引起的疼痛行为并降低脊髓背角的活动[61]。齐考诺肽 (ziconotide) 是ω-芋螺毒素的一种合成形式, 主要用来治疗顽固性疼痛。但由于严重的神经系统和心脏不良反应, 治疗窗窄以及给药方式的局限性等原因, 限制了其应用[55]。而小分子化合物Z160克服了齐考诺肽的上述问题, 可剂量依赖性地阻断N型钙通道 (Cav2.2) 电流, 是一种口服有效的治疗疼痛药物。目前Z160已作为治疗腰骶神经根病变 (lumbosacral radiculopathy, LSR) 和带状疱疹后神经痛 (postherpetic neuralgia, PHN) 的药物进入Ⅱ期临床试验[62]。
T型钙通道在调控细胞兴奋性方面有重要的作用, 因此能够调节T通道的化合物可能会影响疼痛通路中的周围和中枢敏化神经元。Z944是一个新型的状态依赖性、选择性T型钙通道调节剂, 已经在多种疼痛模型中证实有效。目前正在进行Ⅱ期临床研究[63]。此外还有针对DNP的化合物CNV-2197944和ABT-639, 也已进入Ⅱ期临床阶段[54]。
电压门控钙离子通道辅助蛋白α2δ-1亚基是普瑞巴林和加巴喷丁的分子靶点, 这两种药物已经被允许用于神经性疼痛的治疗。Mirogabalin (DS-5565) 是α2δ的配体, 当它们结合时, 可以减少神经末梢钙离子的内流, 进而减少疼痛相关神经递质的释放。Mirogabalin目前正作为糖尿病神经痛的治疗药物在进行Ⅲ期临床试验[64]。
3.4 TRP拮抗剂目前对于小分子TRPV1拮抗剂的开发, 多处于临床Ⅰ期和Ⅱ期的试验阶段。靶向其他参与痛觉感知的TRP通道 (包括TRPV3、TRPV4、TRPM8以及TRPA1) 的药物开发, 尚处于早期开发阶段[65]。
4 总结与展望糖尿病神经性疼痛是神经系统损伤引起的一种慢性疼痛, 其发病机制复杂, 治疗棘手。虽然目前已阐明了某些离子通道在其发生、发展中的作用, 但究竟哪种或哪几种离子通道起主导作用至今仍不清楚。因此还需要进一步了解各种离子通道在糖尿病神经性疼痛发生、发展过程中的相互联系及其作为药物靶点的可行性, 以便开发出特异性的离子通道调节剂, 用于指导临床的治疗。同时, 由于糖尿病神经性疼痛与其他类型的神经性疼痛具有很多共同的离子通道机制, 因此针对糖尿病神经性疼痛药物的开发和治疗, 也可遵循类似的原则。尽管参与DNP过程的离子通道靶点众多, 但是考虑到离子通道的组织分布特异性, Nav1.7无疑是一个优秀的靶点。同时, 随着高通量药物筛选仪器的发明问世以及不断改进的方法, 靶向Nav1.7钠通道的选择性药物的成功开发指日可待, 必将为DNP的治疗带来新的变革。
| [1] | Schreiber AK, Nones CF, Reis RC, et al. Diabetic neuropathic pain:physiopathology and treatment[J]. World J Diabetes, 2015, 6: 432–444. DOI:10.4239/wjd.v6.i3.432 |
| [2] | Tesfaye S, Boulton AJ, Dickenson AH. Mechanisms and management of diabetic painful distal symmetrical polyneuropathy[J]. Diabetes Care, 2013, 36: 2456–2465. DOI:10.2337/dc12-1964 |
| [3] | Kim J, Wei DS, Hoffman DA. Kv4 potassium channel subunits control action potential repolarization and frequency-dependent broadening in rat hippocampal CA1 pyramidal neurones[J]. J Physiol, 2005, 569: 41–57. DOI:10.1113/jphysiol.2005.095042 |
| [4] | Catacuzzeno L, Fioretti B, Pietrobon D, et al. The differential expression of low-threshold K+ currents generates distinct firing patterns in different subtypes of adult mouse trigeminal ganglion neurones[J]. J Physiol, 2008, 586: 5101–5118. DOI:10.1113/jphysiol.2008.159384 |
| [5] | Chien LY, Cheng JK, Chu D, et al. Reduced expression of A-type potassium channels in primary sensory neurons induces mechanical hypersensitivity[J]. J Neurosci, 2007, 27: 9855–9865. DOI:10.1523/JNEUROSCI.0604-07.2007 |
| [6] | Cao XH, Byun HS, Chen SR, et al. Reduction in voltage-gated K+ channel activity in primary sensory neurons in painful diabetic neuropathy:role of brain-derived neurotrophic factor[J]. J Neurochem, 2010, 114: 1460–1475. |
| [7] | Lawrence JJ, Saraga F, Churchill JF, et al. Somatodendritic Kv7/KCNQ/M channels control interspike interval in hippocampal interneurons[J]. J Neurosci, 2006, 26: 12325–12338. DOI:10.1523/JNEUROSCI.3521-06.2006 |
| [8] | Zaika O, Lara LS, Gamper N, et al. Angiotensin Ⅱ regulates neuronal excitability via phosphatidylinositol 4, 5-bisphosphate-dependent modulation of Kv7(M-type) K+ channels[J]. J Physiol, 2006, 575: 49–67. DOI:10.1113/jphysiol.2006.114074 |
| [9] | Cooper EC, Jan LY. M-channels:neurological diseases, neuromodulation, and drug development[J]. Arch Neurol, 2003, 60: 496–500. DOI:10.1001/archneur.60.4.496 |
| [10] | Gamper N, Zaika O, Li Y, et al. Oxidative modification of M-type K+ channels as a mechanism of cytoprotective neuronal silencing[J]. EMBO J, 2006, 25: 4996–5004. DOI:10.1038/sj.emboj.7601374 |
| [11] | Peretz A, Sheinin A, Yue C, et al. Pre-and postsynaptic activation of M-channels by a novel opener dampens neuronal firing and transmitter release[J]. J Neurophysiol, 2007, 97: 283–295. DOI:10.1152/jn.00634.2006 |
| [12] | Munro G, Dalby-Brown W. Kv7(KCNQ) channel modulators and neuropathic pain[J]. J Med Chem, 2007, 50: 2576–2582. DOI:10.1021/jm060989l |
| [13] | Tsantoulas C, Zhu L, Shaifta Y, et al. Sensory neuron downregulation of the Kv9.1 potassium channel subunit mediates neuropathic pain following nerve injury[J]. J Neurosci, 2012, 32: 17502–17513. DOI:10.1523/JNEUROSCI.3561-12.2012 |
| [14] | Kamei J, Kawashima N, Narita M, et al. Reduction in ATP-sensitive potassium channel-mediated antinociception in diabetic mice[J]. Psychopharmacology (Berl), 1994, 113: 318–321. DOI:10.1007/BF02245203 |
| [15] | Liss B, Roeper J. Molecular physiology of neuronal K-ATP channels (review)[J]. Mol Membr Biol, 2001, 18: 117–127. DOI:10.1080/09687680110047373 |
| [16] | Honoré E. The neuronal background K2P channels:focus on TREK1[J]. Nat Rev Neurosci, 2007, 8: 251–261. |
| [17] | Kang D, Kim D. TREK-2(K2P10.1) and TRESK (K2P18.1) are major background K+ channels in dorsal root ganglion neurons[J]. Am J Physiol Cell Physiol, 2006, 291: C138–C146. DOI:10.1152/ajpcell.00629.2005 |
| [18] | Alloui A, Zimmermann K, Mamet J, et al. TREK-1, a K+ channel involved in polymodal pain perception[J]. EMBO J, 2006, 25: 2368–2376. DOI:10.1038/sj.emboj.7601116 |
| [19] | Cohen A, Sagron R, Somech E, et al. Pain-associated signals, acidosis and lysophosphatidic acid, modulate the neuronal K2P2.1 channel[J]. Mol Cell Neurosci, 2009, 40: 382–389. DOI:10.1016/j.mcn.2008.12.004 |
| [20] | Dobler T, Springauf A, Tovornik S, et al. TRESK two-pore-domain K+ channels constitute a significant component of background potassium currents in murine dorsal root ganglion neurones[J]. J Physiol, 2007, 585: 867–879. DOI:10.1113/jphysiol.2007.145649 |
| [21] | Czirják G, Tóth ZE, Enyedi P. The two-pore domain K+ channel, TRESK, is activated by the cytoplasmic calcium signal through calcineurin[J]. J Biol Chem, 2004, 279: 18550–18558. DOI:10.1074/jbc.M312229200 |
| [22] | Mathie A. Neuronal two-pore-domain potassium channels and their regulation by G protein-coupled receptors[J]. J Physiol, 2007, 578: 377–385. DOI:10.1113/jphysiol.2006.121582 |
| [23] | Noda Y, Kodama K, Yasuda T, et al. Calcineurin-inhibitor-induced pain syndrome after bone marrow transplantation[J]. J Anesth, 2008, 22: 61–63. DOI:10.1007/s00540-007-0574-2 |
| [24] | Czirják G, Enyedi P. Targeting of calcineurin to an NFAT-like docking site is required for the calcium-dependent activation of the background K+ channel, TRESK[J]. J Biol Chem, 2006, 281: 14677–14682. DOI:10.1074/jbc.M602495200 |
| [25] | Wood JN, Boorman JP, Okuse K, et al. Voltage-gated sodium channels and pain pathways[J]. J Neurobiol, 2004, 61: 55–71. DOI:10.1002/(ISSN)1097-4695 |
| [26] | Waxman SG, Zamponi GW. Regulating excitability of peripheral afferents:emerging ion channel targets[J]. Nat Neurosci, 2014, 17: 153–163. DOI:10.1038/nn.3602 |
| [27] | Tan AM, Samad OA, Dib-Hajj SD, et al. Virus-mediated knockdown of Nav1.3 in dorsal root ganglia of STZ-induced diabetic rats alleviates tactile allodynia[J]. Mol Med, 2015, 21: 544–552. |
| [28] | Ren YS, Qian NS, Tang Y, et al. Sodium channel Nav1.6 is up-regulated in the dorsal root ganglia in a mouse model of type 2 diabetes[J]. Brain Res Bull, 2012, 87: 244–249. DOI:10.1016/j.brainresbull.2011.10.015 |
| [29] | Bierhaus A, Fleming T, Stoyanov S, et al. Methylglyoxal modification of Nav1.8 facilitates nociceptive neuron firing and causes hyperalgesia in diabetic neuropathy[J]. Nat Med, 2012, 18: 926–933. DOI:10.1038/nm.2750 |
| [30] | Chattopadhyay M, Zhou Z, Hao S, et al. Reduction of voltage gated sodium channel protein in DRG by vector mediated miRNA reduces pain in rats with painful diabetic neuropathy[J]. Mol Pain, 2012, 8: 17. |
| [31] | Chattopadhyay M, Mata M, Fink DJ. Vector-mediated release of GABA attenuates pain-related behaviors and reduces NaV1.7 in DRG neurons[J]. Eur J Pain, 2011, 15: 913–920. DOI:10.1016/j.ejpain.2011.03.007 |
| [32] | Mert T, Gunes Y. Antinociceptive activities of lidocaine and the Nav1.8 blocker a803467 in diabetic rats[J]. J Am Assoc Lab Anim Sci, 2012, 51: 579–585. |
| [33] | Perez-Reyes E. Molecular physiology of low-voltage-activated t-type calcium channels[J]. Physiol Rev, 2003, 83: 117–161. DOI:10.1152/physrev.00018.2002 |
| [34] | Jagodic MM, Pathirathna S, Nelson MT, et al. Cell-specific alterations of T-type calcium current in painful diabetic neuropathy enhance excitability of sensory neurons[J]. J Neurosci, 2007, 27: 3305–3316. DOI:10.1523/JNEUROSCI.4866-06.2007 |
| [35] | Latham JR, Pathirathna S, Jagodic MM, et al. Selective T-type calcium channel blockade alleviates hyperalgesia in ob/ob mice[J]. Diabetes, 2009, 58: 2656–2665. DOI:10.2337/db08-1763 |
| [36] | Messinger RB, Naik AK, Jagodic MM, et al. In vivo silencing of the CaV3.2 T-type calcium channels in sensory neurons alleviates hyperalgesia in rats with streptozocin-induced diabetic neuropathy[J]. Pain, 2009, 145: 184–195. DOI:10.1016/j.pain.2009.06.012 |
| [37] | Clapham DE. SnapShot:mammalian TRP channels[J]. Cell, 2007, 129: 220. |
| [38] | Xiao L, Cheng J, Zhuang Y, et al. Botulinum toxin type A reduces hyperalgesia and TRPV1 expression in rats with neuropathic pain[J]. Pain Med, 2013, 14: 276–286. DOI:10.1111/pme.12017 |
| [39] | Pabbidi RM, Yu SQ, Peng S, et al. Influence of TRPV1 on diabetes-induced alterations in thermal pain sensitivity[J]. Mol Pain, 2008, 4: 9. |
| [40] | Liedtke W, Friedman JM. Abnormal osmotic regulation in trpv4-/- mice[J]. Proc Natl Acad Sci U S A, 2003, 100: 13698–13703. DOI:10.1073/pnas.1735416100 |
| [41] | Chen Y, Yang C, Wang ZJ. Proteinase-activated receptor 2 sensitizes transient receptor potential vanilloid 1, transient receptor potential vanilloid 4, and transient receptor potential ankyrin 1 in paclitaxel-induced neuropathic pain[J]. Neuroscience, 2011, 193: 440–451. DOI:10.1016/j.neuroscience.2011.06.085 |
| [42] | Wei H, Hämäläinen MM, Saarnilehto M, et al. Attenuation of mechanical hypersensitivity by an antagonist of the TRPA1 ion channel in diabetic animals[J]. Anesthesiology, 2009, 111: 147–154. DOI:10.1097/ALN.0b013e3181a1642b |
| [43] | Nguyen HT, Bhattarai JP, Park SJ, et al. Enhanced GABA action on the substantia gelatinosa neurons of the medullary dorsal horn in the offspring of streptozotocin-injected mice[J]. J Diabetes Complications, 2015, 29: 629–636. DOI:10.1016/j.jdiacomp.2015.03.007 |
| [44] | Daulhac L, Mallet C, Courteix C, et al. Diabetes-induced mechanical hyperalgesia involves spinal mitogen-activated protein kinase activation in neurons and microglia via N-methyl-D-aspartate-dependent mechanisms[J]. Mol Pharmacol, 2006, 70: 1246–1254. DOI:10.1124/mol.106.025478 |
| [45] | Wang XL, Zhang Q, Zhang YZ, et al. Downregulation of GABAB receptors in the spinal cord dorsal horn in diabetic neuropathy[J]. Neurosci Lett, 2011, 490: 112–115. DOI:10.1016/j.neulet.2010.12.038 |
| [46] | Peltier A, Goutman SA, Callaghan BC. Painful diabetic neuropathy[J]. BMJ, 2014, 348: g1799. DOI:10.1136/bmj.g1799 |
| [47] | Attal N, Cruccu G, Baron R, et al. EFNS guidelines on the pharmacological treatment of neuropathic pain:2010 revision[J]. Eur J Neurol, 2010, 17: 1113. DOI:10.1111/j.1468-1331.2010.02999.x |
| [48] | Szczudlik A, Dobrogowski J, Wordliczek J, et al. Diagnosis and management of neuropathic pain:review of literature and recommendations of the Polish Association for the study of pain and the Polish Neurological Society-part one[J]. Neurol Neurochir Pol, 2014, 48: 262–271. |
| [49] | Dworkin RH, O'Connor AB, Audette J, et al. Recommendations for the pharmacological management of neuropathic pain:an overview and literature update[J]. Mayo Clin Proc, 2010, 85: S3–S14. |
| [50] | Burness CB, McCormack PL. Capsaicin 8% patch:a review in peripheral neuropathic pain[J]. Drugs, 2016, 76: 123–134. DOI:10.1007/s40265-015-0520-9 |
| [51] | Derry S, Sven-Rice A, Cole P, et al. Topical capsaicin (high concentration) for chronic neuropathic pain in adults[J]. Cochrane Database Syst Rev, 2013, 28: CD007393. |
| [52] | Wong GY, Gavva NR. Therapeutic potential of vanilloid receptor TRPV1 agonists and antagonists as analgesics:recent advances and setbacks[J]. Brain Res Rev, 2009, 60: 267–277. DOI:10.1016/j.brainresrev.2008.12.006 |
| [53] | Kasteleijn-Nolst Trenité DG, Biton V, French JA, et al. Kv7 potassium channel activation with ICA-105665 reduces photoparoxysmal EEG responses in patients with epilepsy[J]. Epilepsia, 2013, 54: 1437–1443. DOI:10.1111/epi.12224 |
| [54] | Gilron I, Dickenson AH. Emerging drugs for neuropathic pain[J]. Expert Opin Emerg Drugs, 2014, 19: 329–341. DOI:10.1517/14728214.2014.915025 |
| [55] | Rahman W, Dickenson AH. Voltage gated sodium and calcium channel blockers for the treatment of chronic inflammatory pain[J]. Neurosci Lett, 2013, 557(Pt A): 19–26. |
| [56] | Kharatmal SB, Singh JN, Sharma SS. Voltage-gated sodium channels as therapeutic targets for treatment of painful diabetic neuropathy[J]. Mini Rev Med Chem, 2015, 15: 1134–1147. DOI:10.2174/1389557515666150722112621 |
| [57] | Huang Y, Zang Y, Zhou L, et al. The role of TNF-alpha/NF-kappa B pathway on the up-regulation of voltage-gated sodium channel Nav1.7 in DRG neurons of rats with diabetic neuropathy[J]. Neurochem Int, 2014, 75: 112–119. DOI:10.1016/j.neuint.2014.05.012 |
| [58] | Bagal SK, Chapman ML, Marron BE, et al. Recent progress in sodium channel modulators for pain[J]. Bioorg Med Chem Lett, 2014, 24: 3690–3699. DOI:10.1016/j.bmcl.2014.06.038 |
| [59] | Zakrzewska JM, Palmer J, Ettlin DA, et al. Novel design for a phase IIa placebo-controlled, double-blind randomized withdrawal study to evaluate the safety and efficacy of CNV1014802 in patients with trigeminal neuralgia[J]. Trials, 2013, 14: 402. DOI:10.1186/1745-6215-14-402 |
| [60] | Goldberg YP, Price N, Namdari R, et al. Treatment of Nav1.7-mediated pain in inherited erythromelalgia using a novel sodium channel blocker[J]. Pain, 2012, 153: 80–85. DOI:10.1016/j.pain.2011.09.008 |
| [61] | Perret D, Luo ZD. Targeting voltage-gated calcium channels for neuropathic pain management[J]. Neurotherapeutics, 2009, 6: 679–692. DOI:10.1016/j.nurt.2009.07.006 |
| [62] | Salat K, Kowalczyk P, Gryzło B, et al. New investigational drugs for the treatment of neuropathic pain[J]. Expert Opin Investig Drugs, 2014, 23: 1093–1104. DOI:10.1517/13543784.2014.916688 |
| [63] | Tringham E, Powell KL, Cain SM, et al. T-type calcium channel blockers that attenuate thalamic burst firing and suppress absence seizures[J]. Sci Transl Med, 2012, 4: 121ra119. |
| [64] | Hutmacher MM, Frame B, Miller R, et al. Exposure-response modeling of average daily pain score, and dizziness and somnolence, for mirogabalin (DS-5565) in patients with diabetic peripheral neuropathic pain[J]. J Clin Pharmacol, 2016, 56: 67–77. DOI:10.1002/jcph.567 |
| [65] | Brederson JD, Kym PR, Szallasi A. Targeting TRP channels for pain relief[J]. Eur J Pharmacol, 2013, 716: 61–76. DOI:10.1016/j.ejphar.2013.03.003 |
 2017, Vol. 52
2017, Vol. 52


