肿瘤细胞多药耐药性(multidrug resistance, MDR)[1-4]是临床上导致患者化疗失败的主要原因之一。多药耐药性是指肿瘤细胞对多种结构和作用机制完全不同的化疗药物产生交叉耐药性的现象。多药耐药的产生是个错综复杂的过程, 但是肿瘤细胞中由MDR1基因编码的P-糖蛋白(P-glycoprotein, P-gp)[5-9]的过表达被认为是重要的原因之一。P-gp是一种分子质量为170 kDa的跨膜糖蛋白, 属于ABC (ATP-binding cassette) 转运蛋白超家族, 可以转运多种结构与功能不同的化疗药物。其耐药机制主要是含有外排泵将药物泵出胞外, 降低化疗药物在耐药肿瘤细胞中的蓄积。目前, 随着基因治疗的深入研究, RNA干扰技术[10-13] (RNA interference, RNAi) 为逆转肿瘤的多药耐药性提供了一个更加高效、特异和低毒的方法。
RNA干扰是将与目的基因同源的含21~23个核苷酸的小分子干扰RNA片段(small interfering RNAs, siRNA) 转染至靶细胞, 与细胞内的内切酶形成诱导沉默复合体(RNA in-duced silencing complex, RISC), 引起特定mRNA的降解, 从而在mRNA水平抑制靶蛋白的表达, 实现特定基因沉默的技术。但是由于siRNA分子携带负电荷, 不易通过细胞膜, 且易被核酸酶降解等, 使其难以到达靶细胞发挥基因沉默作用, 因此需要安全稳定高效的基因传递载体以保护siRNA在体内稳定传递并高效地作用于靶细胞[14, 15]。
聚乙烯亚胺(polythyleneimine, PEI)[16]是目前应用广泛的一类聚阳离子载体。一般来说, 随着PEI分子量的增加, 其进入细胞的转染能力也增强, 但是同时PEI毒性也随之提高。当分子质量达到25 kDa时, 转染效率最高, 但毒性也增大; 而分子质量较低时( < 2 kDa), 虽然毒性较低, 但不能有效结合和压缩DNA而导致转染效率降低, 这在很大程度上限制了PEI的应用和发展。
聚谷氨酸[17]是一种人体生物酶降解的多聚肽类化合物, 在体内可降解为内源性物质谷氨酸, 具有生物相容性、低毒性和低免疫原性的特点。其已广泛应用于缓控释药物载体、基因载体及组织工程的研究。
聚乙二醇(polyethylene glycol, PEG)[18-20]属无毒、无免疫原性的材料, 由于其自身的特殊结构性质, 可与水形成氢键, 形成水化“晕”层, 且具有一定的流动性, 可有效降低与体内蛋白的吸附作用, 不容易被网状内皮系统(RES) 识别, 具有长循环效应, 是一种应用广泛前景良好的生物材料。目前PEG修饰大多采用单甲氧基聚乙二醇(mPEG), 其性能与PEG相似, 且可避免在修饰其他化合物过程中发生交联或团聚。
本文设计并构建低毒高效的PEG-b-PLG-g-PEIs (GGI) 聚合物载体, 其结构主要是以生物可降解的聚乙二醇-聚谷氨酰胺两嵌段共聚物为骨架, 利用低分子量的聚乙烯亚胺PEI 800表面伯胺基通过氨解反应接枝于谷氨酰胺侧链上, 以期得到一个高转染效率、低细胞毒性和可生物降解的基因载体, 且以MDR1基因为靶基因, 试图下调P-gp表达, 逆转肺癌细胞的多药耐药性, 降低抗肿瘤药物的给药量。
材料与方法材料 L-谷氨酸(L-glutamic acid, L-Glu, 国药集团化学试剂有限公司); 甲氧基聚乙二醇胺(mPEG-NH2, MW=2 kDa), 聚乙烯亚胺(polyethylenimine, PEI 800, Mw=25 kDa), 四甲基偶氮唑盐[3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyletrazolium bromide, MTT], DDP (Aldrich-Sigma公司); 人肺癌细胞系A549和A549/DDP购自中国科学院上海生命科学研究院细胞资源中心; FAM-siRNA (5-carboxyfluorescein siRNA), MDR1 siRNA (上海吉玛生物科技有限公司); MDR1一抗, 甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH) 一抗(Cell Signalling, 美国), Alexa Fluor 488标记山羊抗兔IgG (H+L) (碧云天生物技术研究所)。
聚合物GGI的合成
聚乙二醇-b-谷氨酸苄酯(PEG-b-PBLG) 的合成以L-谷氨酸为原料, 采用苯甲醇对其γ-羧酸进行酯化保护, 再通过三光气法合成中间产物L-谷氨酸γ苄酯-N羧酸酐(BLG-NCA)。称取BLG-NCA单体6 g于无水氯仿中(20:1, w/v), 按单体BLG与引发剂甲氧基聚乙二醇胺为50:1比例, 室温搅拌反应72 h。反应结束后用无水乙醚沉淀反应液, 过滤, 真空干燥, 得淡黄色半透明固体PEG-b-PBLG。
聚合物PEG-b-PLG-PEIs (GGI) 的合成 称取上述合成的PEG-b-PBLG嵌段聚合物1 g, 溶解于无水N, N-二甲基甲酰胺(DMF) (20:1, w/v), 按一定比例加入PEI 800 (MolPEI 800/MolBLG=10:1) 和催化剂2-羟基吡啶(2-HP) (Mol2-HP/MolBLG=5:1), 于40 ℃搅拌反应48 h。反应结束后, 用大量冰冷乙醚沉淀反应物, 透析, 冻干, 得白色疏松粉末GGI。
聚合物GGI的1H NMR表征 以D2O或CDCl3为溶剂, 四甲基硅烷(TMS) 为内标, 温度为25 ℃, 在核磁共振谱仪上(Varian INOVA500NB, 美国Varian公司) 对所得样品mPEG-NH2、PEI 800、PEG-b-PBLG及GGI进行测定。通过1H NMR, 可以根据PEG特征峰a的峰面积与苄基e峰的峰面积, 估算PEG-b-PBLG的聚合度(DPPBLG) 及GGI的分子质量。公式如下:
| $ \text{D}{{\text{P}}_{\text{PBLG}}}\text{=}\frac{\text{2000}}{\text{44}}\text{ }\!\!\times\!\!\text{ }\frac{\text{2e}}{\text{a}} $ |
GGI/siRNA复合物的制备与粒径电位的测定 以水为介质, 将GGI和siRNA分别在去离子水和无核酶水中配成一定浓度的溶液, 按照不同的N/P比(nGGI中氨基基团/nDNA中磷酸基团), 将两者等体积混合, 涡旋30 s, 室温静置30 min, 即得GGI/DNA复合物纳米粒, 终体积为1 mL。采用动态光散射粒度分析仪(Zetasizer Nano Series90, 英国Malvern公司) 对复合物粒径和电位进行测定。设定自动扫描模式, 测试温度为25 ℃, 每个样品测定3次。
细胞毒性实验 采用MTT法检测聚合物载体GGI的细胞毒性。以细胞数5×103个/孔将A549、A549/DDP细胞接种于96孔板中, 在37 ℃、5% CO2条件下生长24 h后, 吸弃培养液, 分别加入200 μL不同浓度的GGI溶液(以不含血清培养基溶解), 4 h后更换为含10%血清培养基继续培养44 h, 加入MTT处理, 于570 nm和630 nm波长下检测各孔吸光度(OD) 值, 计算细胞的存活率, 公式如下:
| $ \text{细胞存活率=}\frac{\text{O}{{\text{D}}_{\text{570}\left( \text{样品} \right)}}\text{-O}{{\text{D}}_{\text{630}\left( \text{样品} \right)}}}{\text{O}{{\text{D}}_{\text{570}\left( \text{空白} \right)}}\text{-O}{{\text{D}}_{\text{630}\left( \text{空白} \right)}}}\text{ }\!\!\times\!\!\text{ 100 }\!\!%\!\!\text{ } $ |
GGI/FAM-siRNA纳米粒的细胞摄取 采用流式细胞术评价GGI/FAM-siRNA的细胞摄取情况。取对数生长期的A549、A549/DDP细胞以5×104个/孔接种于12孔板中, 在37 ℃、5% CO2条件下生长24 h后, 吸弃培养液, 加入不同N/P比的GGI/FAM-siRNA复合物, 继续孵育4 h后, 通过倒置荧光显微镜观察结果, 并消化收集细胞, 用PBS清洗3次以除去背景, 于流式细胞仪上测定细胞摄取率及其荧光强度。实验中以PEI 25K和Lipofectamine 2000为对照。
GGI/MDR1 siRNA复合物的细胞转染 将A549、A549/DDP细胞以1×105个/孔接种于6孔培养板中, 37 ℃、5% CO2条件下培养24 h后弃去培养基, 加入不同N/P的GGI/MDR1 siRNA复合物, 在无血清培养基条件下于37 ℃孵箱中孵育4 h, 换含10%完全培养基继续培养48 h。同时设置GGI/siRNANC、PEI/MDR siRNA、Lipofectamine 2000/MDR siRNA、裸MDR1 siRNA和空白对照组。
实时定量PCR (RT-PCR) 采用TRIZOL试剂法提取细胞转染后各组细胞的总RNA, 按Promega反转录试剂盒操作合成cDNA, 以GAPDH基因为检测的内参照, PCR反应引物由Invitrogen公司合成, MDR1序列如下:上游: 5'-GGAUAUUAGGACCAU AAAUTT-3';下游: 5'-AUUUAUGGUCCUAAUAUC CTG-3'。GAPDH序列:上游5'-GAACGGGAAGCTC ACTGG-3':下游: 5'-GCCTGCTTCACCACCTTCT-3'。设置PCR反应条件为94 ℃预变性3 min, 之后94 ℃ 1 min、58 ℃ 1 min、72 ℃ 1.5 min, 循环33次, 72 ℃ 15 min终止反应。于琼脂糖凝胶电泳上检测PCR产物, 条件为:电压100 V, 时间10 min。于凝胶成像系统扫描, 以Image J软件分析。公式如下:目的基因mRNA表达量=每例标本目的基因平均荧光强度值/同一标本GAPDH平均荧光强度值。
Western blot法检测P-gp蛋白的表达 转染实验结束后, 用RIPA裂解液充分裂解细胞提取总蛋白, 运用BCA蛋白检测试剂盒测定总蛋白含量。采用10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE) 凝胶电泳分离蛋白, 按一定比例的MDR1一抗孵育过夜, Alexa Fluor 488标记山羊抗兔二抗孵育, 曝光, 显影, 凝胶成像, Image J软件分析P-gp与GAPDH条件的灰度比。
MDR1 siRNA干扰后对顺铂的敏感性 采用MTT法检测转染前后A549和A549/DDP细胞的顺铂敏感性。以细胞数5×103个/孔接种于96孔板, 加入各组载体/MDR1 siRNA复合物转染48 h后, 加入一定浓度的顺铂溶液(A549和A549/DDP细胞给药质量浓度分别为7、20 μg·mL-1), 于37 ℃、5% CO2条件下继续培养24 h, 在570 nm和630 nm处测定各孔OD值, 并计算顺铂对A549及A549/DDP细胞的生长抑制率, 以顺铂浓度为横坐标, 细胞存活率为纵坐标绘制曲线图。
Annexin V-FITC/PI双染法检测细胞凋亡 A549和A549/DDP经各组载体/MDR1 siRNA复合物转染48 h后, 胰酶消化收集细胞, 并用PBS清洗3次, 重悬于Binding Buffer, 加入Annexin V-FITC 5 μL避光孵育15 min后, 加入PI溶液10 μL, 避光孵育5 min, 于流式细胞仪上检测, 激发波长488 nm。
统计学处理 采用SPSS 18.0统计软件处理数据, 对以上结果均进行t检验与方差分析, P < 0.05说明具有统计学差异。
结果与讨论 1 聚合物GGI的1H NMR分析聚合物GGI的合成见反应路线图 1。氢核磁谱见图 1, A和C为原料mPEG-NH2和PEI 800的1H NMR谱图, 其中PEG嵌段为特征峰(-CH2CH2-) a的化学位移为3.65, PEI 800中有乙撑基(-CH2CH2NH-, 2.12~2.96) 的吸收峰, B为中间产物PEG-b-PBLG, BLG-NCA开环后形成聚合物, 出现聚谷氨酰胺骨架上(-CH-, 3.91) 的e峰, 其次还有侧链上谷氨酸一端羧基保护后的苄基(-CH2Ph-, 5.024) e峰和苯环(-C6H5-, 7.24) f峰。证明PEG-b-PBLG聚合成功。而在GGI (D) 中, 该e和f峰消失, 出现新的酰胺键j峰(-CONH-, 7.094) 以及小分子PEI 800的乙撑基特征峰i和h, 说明经过PEI 800氨解反应, 侧链上苄基脱去, 成功接枝上了PEI 800, 形成GGI聚合物。同理可得GGI各组分分子质量的估算值, PEG为2 000, PLG为10 160, 而PEI为46 626, 由此可知, 聚合物GGI的相对分子质量为58 786。
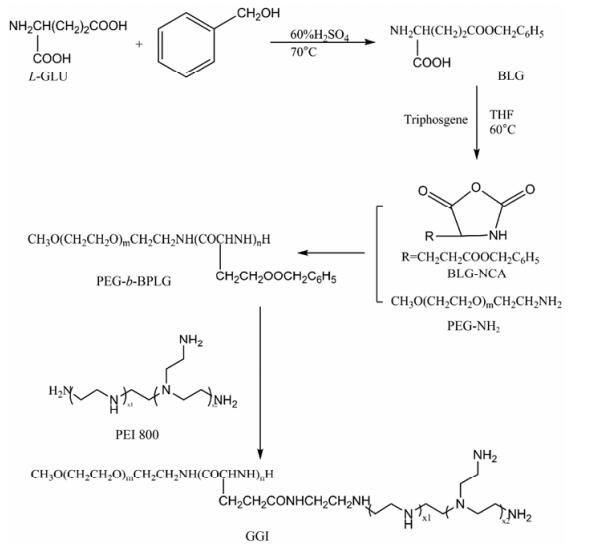
|
Scheme1 Synthesis pathway of PEG-b-PLG-g-PEI (GGI) polymer |
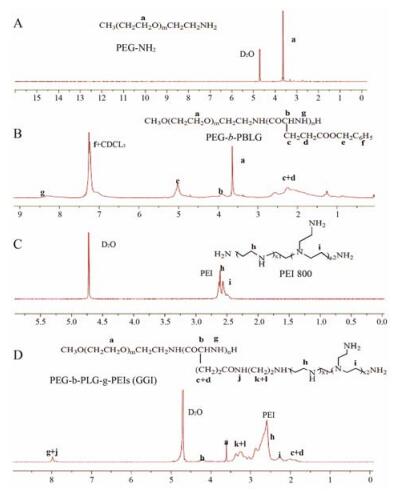
|
Figure 1 The 1H NMR spectra of polymers and molecular formula. A: mPEG-NH2(D2O); B: PEG-b-PBLG (CDCl3); C: PEI 800 (D2O); D: GGI (D2O) |
GGI/siRNA纳米复合物在不同的N/P值下粒径均保持在150~200 nm, 随N/P比的增大, 复合物粒径变化不大(图 2A), 说明GGI/siRNA复合物在适当N/P比范围内能保持适合细胞转染的粒径, 如图 2B所示, 不同N/P的PEI 25K/siRNA纳米复合物的电位值维持在+19.7~36.7 mV, 具有较高的正电荷密度, 而GGI/siRNA复合物电位在各N/P比例下的电位值均低于PEI组, 维持在+16~28.6 mV, 有利于细胞内吞作用的同时降低对细胞的毒性。且在N/P=20时, GGI/siRNA复合物呈正态分布, 多分散系数(PDI) 小, 分布集中(图 2C)。阳离子聚合物的电荷密度对进入细胞的效率有重要的影响。正电荷过高, 易与带负电的细胞膜相互作用内吞进入细胞, 同时也会造成严重的细胞毒性; 而密度过低, 则会极大影响其进入细胞的效率。GGI/siRNA复合物在N/P=20时的电位在25 mV左右, 既能保持进入细胞的效率又不会造成严重的细胞毒性。
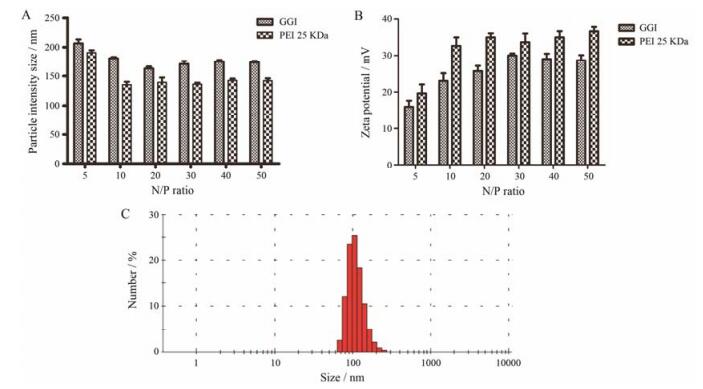
|
Figure 2 Particle intensity size (A) and zeta potential (B) of GGI/siRNA and PEI/siRNA nanopaticles at various N/P ratios, intensity number of N/P=20 (C) |
采用MTT法考察聚合物GGI在不含血清条件下对A549和A549/DDP细胞的毒性。由图 3可知, 在质量浓度范围为10~125 μg·mL-1时, 聚合物GGI在A549和A549/DDP细胞毒性均低于PEI 25K。聚合物GGI相比PEI 25K具有更好的生物相容性及更广泛的应用前景。
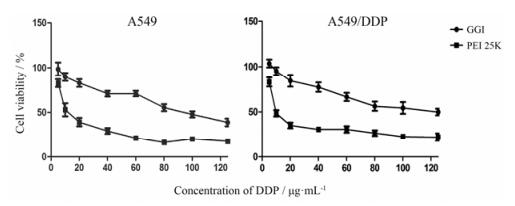
|
Figure 3 The cell cytotoxicity of GGI polymer to A549 and A549/DDP cells. PEI 25K as the positive control |
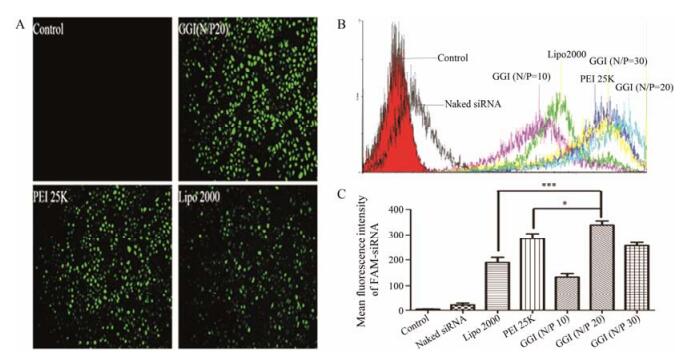
从荧光显微镜结果图和流式定量分析结果(图 4) 可以看出, 在转染相同浓度的FAM-siRNA的条件下, 未经任何处理的空白对照组无荧光; 其余3组的平均荧光强度(MFI) 顺序是GGI (339.3) > PEI (283.4) > Lipofectamine 2000 (189.6), 且GGI不同N/P比的平均荧光强度顺序为N/P=20 > N/P=30 > N/P=10, 说明N/P最优比例为20时GGI/siRNA复合物的转染能力强于PEI 25K和Lipofectamine 2000, 更容易内吞进入细胞。
|
Figure 4 Cellular uptake of various FAM-siRNA nanoparticle formulations. A: Fluorescent images; B: Flow cytometric histogram profiles; C: Its quantitative results. n=3, x±s. *P < 0.05, ***P < 0.001 |
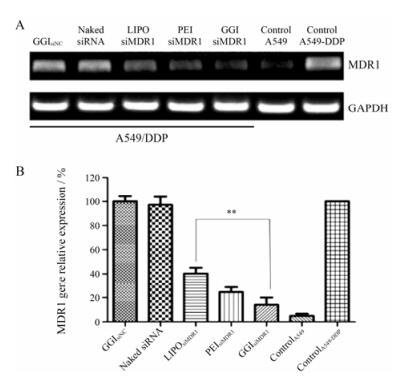
以GAPDH为内参, 采用RT-PCR法检测MDR1 mRNA的表达水平。在空白对照组中, A549/DDP细胞系中的MDR1 mRNA表达水平较A549细胞系更显著, 表明其耐药性与MDR1表达量的差异相关。GGIsiNC组与裸siRNA组的MDR1表达水平与空白对照相当, 而相对siMDR1转染的实验组, LiposiMDR1组、PEI 25KsiMDR1组MDR1 mRNA的相对表达量都有明显的降低, 分别为50%和25.4%, 而如图 5所示, GGIsiMDR1组MDR1 mRNA的相对表达量降低最为明显(14.1%), 表明裸siRNA并不能下调MDR1 mRNA水平, 而经过GGI复合的siMDR1则具有很强的抑制效果。
|
Figure 5 The relative quantity of MDR1 mRNA expression of A549 and A549/DDP cells. n=3, x±s. **P < 0.01 |
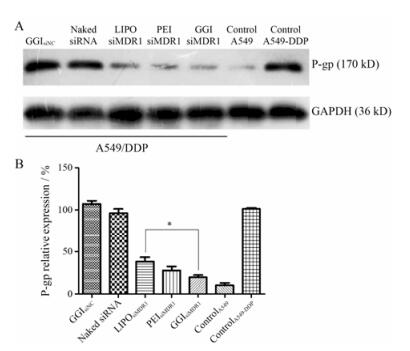
以Western blot法检测各组复合物经转染后对肺癌细胞P-gp蛋白表达的影响。由图 6可知, P-gp蛋白在A549/DDP细胞系的表达水平显著高于敏感株A549细胞系, 与mRNA表达结果一致, 表明P-gp高表达与肺癌细胞的耐药有关。同时, 相对于空白对照组, PEI 25K组、Lipo组和GGI组的P-gp表达水平顺序如下: GGI (19.54%) < PEI (27.6%) < Lipo (38%), 说明GGI/siMDR1复合物可以有效下调P-gp的表达。
|
Figure 6 Expression levels of P-gp proteinin A549 and A549/DDP cells treated with various formulations after 48 h. GAPDH as the control protein. A: Western bolt result; B: Its half-quantitative result. n=3, x±s. *P < 0.05 |
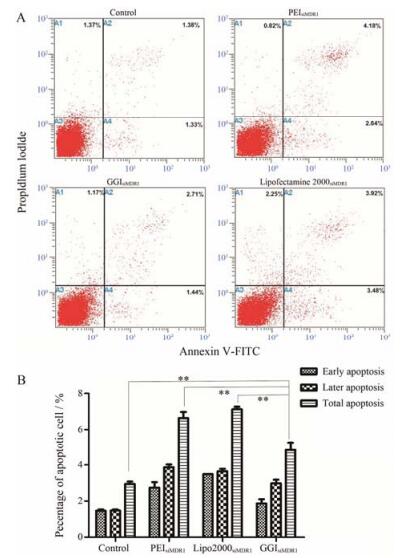
与PEI 25K (6.64%)、Lipofectamine 2000 (7.12%) 对照组相比, GGI诱导A549/DDP凋亡效果较弱, 凋亡率为4.83% (图 7), 说明GGI/MDR1 siRNA纳米粒不会产生显著的细胞凋亡。
|
Figure 7 Flow cytometry analysis (A) of cell apoptosis with polymer/MDR1 siRNA formulations and the percentage of different phase of apoptotic cells (B). n=3, x±s. **P < 0.01 |
根据顺铂处理及复合物转染后再用顺铂处理细胞的存活率计算各组的半数抑制率(IC50), 如图 8所示。对于A549细胞而言, 单独给予顺铂(IC50=13.25 μg·mL-1) 和经转染GGI/MDR1 siRNA组(IC50=9.74 μg·mL-1) 并没有明显差别, 而在A549/DDP细胞系, 经转染后给予顺铂药物组的细胞存活率大大降低, IC50为19.77 μg·mL-1, 较游离顺铂给药组(IC50=42.89 μg·mL-1) 敏感性增加, 证明在耐药株中经GGI/MDR1 siRNA复合物转染能有效抑制P-gp的表达, 从而在一定程度上增加顺铂在细胞内的积累, 提高对顺铂的敏感性。
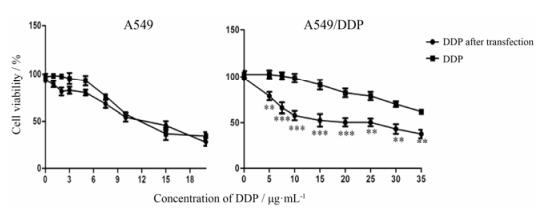
|
Figure 8 Cell viability of A549 and A549/DDP cells treated with DDP after transfection or without any treatment. n=3, x±s. **P < 0.01, ***P < 0.001 vs DDP |
经GGI/siNC(negative control siRNA) 转染组凋亡率与阴性对照组无明显差异, 说明在体外转染的最佳用量下, GGI对细胞并不会诱导细胞凋亡。同时, GGI/siMDR1转染后加顺铂处理组与游离顺铂给药处理组的细胞凋亡亦无显著差异, 分别为21.94%和25.16%, 说明转染后并不能增加A549细胞对顺铂的敏感性, 与MTT法检测结果一致。
8.2.2 耐药株A549/DDP细胞系的凋亡检测游离顺铂给药组细胞总凋亡率为23.97%, 转染GGI/siNC后加顺铂处理组为22.59%, 转染GGI/siMDR1加顺铂处理组则达到52.07%, 为单独顺铂给药组的2.17倍, 具有统计学差异(图 9), 说明在耐药株A549/DDP细胞系中, 由于siMDR1基因的干扰作用导致P-gp蛋白下调, 从而有效地增加了其对顺铂的敏感性。
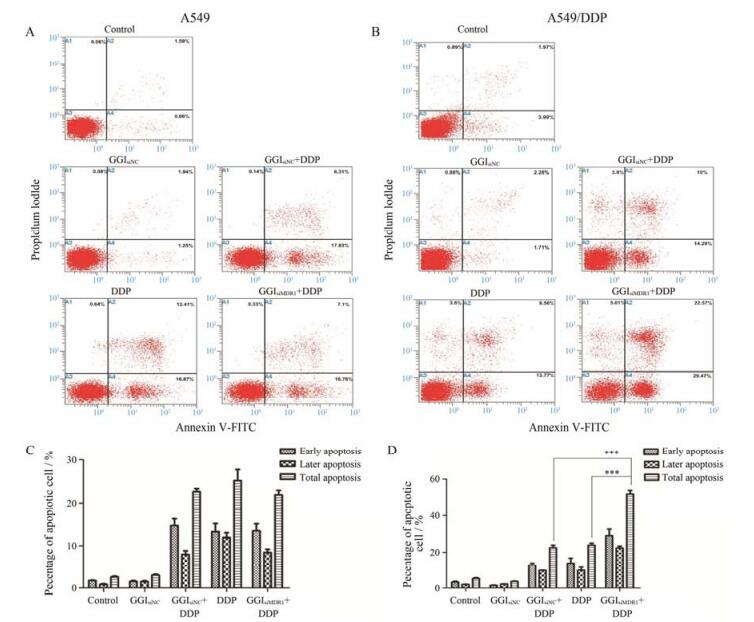
|
Figure 9 Flow cytometry analysis of cell apoptosis (A, B) and percentage of different phase of apoptotic cells with different formula tions of polymer/MDR1 siRNA polyplexes by Annexin V-FITC/PI methods. A, C: A549 cells; B, D: A549/DDP cells. n=3, x±s. ***P < 0.001 |
本研究创新构建并合成载体GGI (PEG-b-PLG-g-PEIs) 聚合物, 以聚谷氨酰胺为骨架, 并在侧链接枝低分子量的聚乙烯亚胺, 通过酯键及酰胺键聚合连接成稳定的高分子聚合物, 以期得到生物可降解的、低毒高效的基因传递载体, 使其有效地包裹siRNA, 形成稳定的GGI/siRNA复合物, 且证明GGI聚合物的细胞毒性显著低于PEI 25K (阳离子金标准), 实现低毒的目的。同时由GGI/siRNA复合物的细胞摄取及转染结果可知, GGI可高效地运载siRNA进入A549和A549/DDP细胞, 其转染效果远高于PEI和Lipofectamine 2000, 低分子量PEI的聚合可显著下调A549/DDP中MDR1 mRNA和P-gp的表达量, 并可增强其对顺铂的敏感性, 使得GGI有望成为一种前景良好的阳离子载体。
| [1] | Yuan Y, Cai T, Xia X, et al. Nanoparticle delivery of anticancer drugs overcomes multidrug resistance in breast cancer[J]. Drug Deliv, 2016, 23: 3350–3357. DOI:10.1080/10717544.2016.1178825 |
| [2] | Shen Y, Wang Q, Tian Y. Reversal effect of ouabain on multidrug resistance in esophageal carcinoma EC109/CDDP cells by inhibiting the translocation of Wnt/β-catenin into the nucleus[J]. Tumour Biol, 2016. DOI:10.1007/s13277-016-5437-8 |
| [3] | Hasanabady MH, Kalalinia F. ABCG2 inhibition as a therapeutic approach for overcoming multidrug resistance in cancer[J]. J Biosci, 2016, 41: 313–324. DOI:10.1007/s12038-016-9601-5 |
| [4] | Ahmad J, Akhter S, Khan MA, et al. Engineered nanoparticles against MDR in cancer:the state of the art and its prospective[J]. Curr Pharm Des, 2016, 22: 4360–4373. DOI:10.2174/1381612822666160617112111 |
| [5] | Yang X, Liu K. P-gp inhibition-based strategies for modulating pharmacokinetics of anticancer drugs:an update[J]. Curr Drug Metabol, 2016, 17: 806–826. DOI:10.2174/1389200217666160629112717 |
| [6] | Senarathna SM, Page-Sharp M, Crowe A. The interactions of P-glycoprotein with antimalarial drugs, including substrate affinity, inhibition and regulation[J]. PLoS One, 2016, 11: e0152677. DOI:10.1371/journal.pone.0152677 |
| [7] | Li W, Zhang H, Assaraf YG, et al. Overcoming ABC transporter-mediated multidrug resistance:molecular mechanisms and novel therapeutic drug strategies[J]. Drug Resist Updat, 2016, 27: 14–29. DOI:10.1016/j.drup.2016.05.001 |
| [8] | Chung FS, Santiago JS, Jesus MF, et al. Disrupting P-glycoprotein function in clinical settings:what can we learn from the fundamental aspects of this transporter?[J]. Am J Cancer Res, 2016, 6: 1583–1598. |
| [9] | Cantore M, Leopoldo M, Berardi F, et al. Design and synthesis of new selective P-gp substrates and inhibitors[J]. Curr Pharm Des, 2016. DOI:10.2174/1381612822666160810114008 |
| [10] | Tan YL, Yin JQ. Application of RNAi to cancer therapy[J]. Acta Pharm Sin (药学学报), 2005, 40: 193–198. |
| [11] | Dernburg AF, Karpen GH. A chromosome RNAissance[J]. Cell, 2002, 111: 159–162. DOI:10.1016/S0092-8674(02)01039-5 |
| [12] | Chery J. RNA therapeutics:RNAi and antisense mechanisms and clinical applications[J]. Postdoc J, 2016, 4: 35–50. |
| [13] | Borkhardt A. Blocking oncogenes in malignant cells by RNA interference--new hope for a highly specific cancer treatment[J]. Cancer Cell, 2002, 2: 167–168. DOI:10.1016/S1535-6108(02)00129-0 |
| [14] | Yang FF, Huang W, Li YF, et al. Current status of non-viral vectors for siRNA delivery[J]. Acta Pharm Sin (药学学报), 2011, 46: 1436–1443. |
| [15] | Gao Y, Liu XL, Li XR. Research progress on siRNA delivery with nonviral carriers[J]. Int J Nanomedicine, 2011, 6: 1017–1025. |
| [16] | Demeneix B, Behr JP. Polyethylenimine (PEI)[J]. Adv Genet, 2005, 53: 215–230. |
| [17] | Yu H, Tang Z, Li M, et al. Cisplatin loaded poly (L-glutamic acid)-g-methoxy poly (ethylene glycol) complex nanoparticles for potential cancer therapy:preparation, in vitro and in vivo evaluation[J]. J Biomed Nanotechnol, 2016, 12: 69–78. DOI:10.1166/jbn.2016.2152 |
| [18] | Peng KT, Hsieh MY, Lin CT, et al. Treatment of critically sized femoral defects with recombinant BMP-2 delivered by a modified mPEG-PLGA biodegradable thermosensitive hydrogel[J]. BMC Musculoskelet Disord, 2016, 17: 286. DOI:10.1186/s12891-016-1131-7 |
| [19] | Nag M, Gajbhiye V, Kesharwani P, et al. Transferrin functionalized chitosan-PEG nanoparticles for targeted delivery of paclitaxel to cancer cells[J]. Colloids Surf B Biointerfaces, 2016, 148: 363–370. DOI:10.1016/j.colsurfb.2016.08.059 |
| [20] | Dong K, Yan Y, Wang P, et al. Biodegradable mixed MPEGSS-2SA/TPGS micelles for triggered intracellular release of paclitaxel and reversing multidrug resistance[J]. Int J Nanomedicine, 2016, 11: 5109–5123. DOI:10.2147/IJN |
 2017, Vol. 52
2017, Vol. 52



