2. 中国药科大学 药剂教研室, 江苏 南京 210009
2. Department of Pharmaceutics, China Pharmaceutical University, Nanjing 210009, China
活性药物成分(API) 的固态相转变(如形成水合物、溶剂化物和无定形) 对其理化性质(如溶解度和溶出度等) 有重要的影响。当API处于无定形态或多晶型亚稳态时, 可快速溶出产生过饱和态, 提高药物的吸收和生物利用度[1]。然而这些亚稳态固体在体内易发生固相转变或过饱和溶液结晶, 形成低溶解性的稳态晶体而失去快速溶出的优势。有些晶体药物在溶出过程中亦会发生无水物向水合物或一水合物向多水合物的转变, 如茶碱[2]、呋喃妥因[3]和氨氯地平[4]等。水合物或多水合物的形成通常可导致药物溶解度的下降[5], 从而使固体制剂溶出速率减缓。为抑制亚稳态晶体向稳态晶体转变, 通常可在处方中加入聚合物作为结晶状态, 如聚乙烯吡咯烷酮、羟丙甲纤维素琥珀酸酯, 羟丙甲纤维素等加入可延缓非洛地平无定形在水中的转晶而维持较高的过饱和度[6]。
葛根素(puerarin, PUE) 为豆科植物葛根(Pue rarialobata (Willd.) Ohwi.) 的干燥根中提取的异黄酮类化合物, 化学名为8-β-D-葡萄吡喃糖-4', 7-二羟基异黄酮。研究发现葛根素具有抗炎、抗氧化及神经保护等药理活性, 可用于心脑血管疾病、高血糖症[7]、神经性损伤和帕金森[8]等疾病的预防与治疗, 临床上以静脉注射给药, 然而在其注射剂的制备中使用了大量的丙二醇用以提高葛根素的溶解度, 长期注射易引起过敏、溶血等不良反应[9], 因此对葛根素口服给药的研究一直是关注热点。目前认为葛根素水溶性差是导致其口服生物利用度低的原因, 并利用各种手段以提高其溶解度和口服生物利用度, 如制备纳晶[10, 11]、磷脂复合物[12]、自乳化系统[13]和脂质纳米粒[14]等, 但对葛根素的溶解过程及其水合物的研究一直处于空白。本文发现了市售的葛根素原料药为一水合物(puerarin monohydrate, PUEMH), 且在其过饱和溶出过程中形成溶解度更低的二水合物(pue rarin dihydrate, PUEDH)。另外, 还考察了高分子材料聚乙烯吡咯烷酮及其类型(PVPK12、PVPK30和PVPK90) 对延缓或抑制PUEMH向PUEDH转变过程的影响。
材料与方法药品和试剂 葛根素原料(纯度99.98%, 浙江震元制药有限公司。经固态表征表明其为一水合物PUEMH); 甲醇(色谱纯, Merck公司); PVPK12、PVPK30和PVPK90 (德国BASF公司); 实验用水(Milli-Q水纯化系统自制, 美国Millipore公司); 其他试剂均为分析纯。
葛根素二水合物的制备 取过量的葛根素原料药PUEMH (约4 g) 于烧杯中, 混悬于50 mL水中, 37 ℃下搅拌72 h, 过滤, 收集固体于25 ℃真空干燥箱中干燥, 过80目筛, 贮存于干燥器中, 备用。采用MettlerTolodo V20卡尔费休水分测定仪(瑞士MettlerTolodo International Inc.公司) 对样品水分进行确认, 考察了烘干时间对水分的影响。将PUEMH和PUEDH在25 ℃真空干燥箱中干燥24、48、72和96 h后测定样品中的水分含量。干燥48 h后含水量处于平稳状态, 表明游离水已经被除去。
固态表征
热重分析法(TGA) 采用TG209C热重分析仪(德国NETZSCH-Ger tebau GmbH公司)。样品置铝制样品池中, 升温速度为10 ℃·min-1, 升温范围为25~300 ℃。数据使用PerkinElmer Thermal Analysis软件进行处理。
粉末X射线衍射法(PXRD) 分别将样品过200目筛, 通过D8 Advance粉末X射线衍射仪(德国Bruker Scientific Inc.公司) 进行分析, 采用Cu-Kα靶, 波长为1.540 6 ,管电压、管电流分别为40 kV、40 mA, 步长为0.02°, 扫描速度为4°·min-1, 扫描范围为3~40°/2θ。
差示扫描量热分析(DSC) 采用Pyris 1 DSC (美国PerkinElmer公司) 对PUEMH和PUEDH进行分析。将样品置于一个敞口的铝制坩埚中, 在室温下对坩埚进行平衡, 升温速度为10 ℃·min-1, 所得到的数据使用NETZSCH-Proteus热分析软件(Version 4.2) 进行处理。
傅里叶变换红外光谱(FT-IR) 采用Nicolet Impact 410 FT-IR分光光度计(美国Thermo Fisher Scientific Inc.公司)。将样品与KBr压成薄片, 在400~4 000 cm-1内扫描。数据经Nicolet Omnic红外光谱软件(Version 8.0) 处理。
拉曼光谱(Raman) 将PURMH和PURDH分别用激光共聚焦拉曼光谱仪(日本LabRAM HR Evolution公司) 进行扫描。光谱范围500~2 000 cm-1, 光谱分辨率为1 cm-1, 激光激发波长为800 nm, 高速光栅尺步长为100 nm。
扫描电子显微镜(SEM) 用扫描电子显微镜(Sigma HD, 德国Zeiss公司) 分别观察葛根素两种固体形态的晶型。将PURMH和PURDH置于样品台上, 进行喷金镀膜处理(厚度≈15~20 nm), 置于扫描电镜下观察, 工作电压为0.800 kV。
两种水合物在水中的过饱和溶出 按照《中国药典》2015版四部通则0931第三法(小杯法) 装置, 在37 ℃条件下进行PUEMH过饱和溶出实验, 以200 mL水为溶出介质, 转速为100 r·min-1, 将过量的PUEMH和PUEDH (约2 g) 投入溶出介质中, 分别于0.167、0.5、1、2、4、6、8、12、24及48 h取样3 mL, 0.22 μm滤膜过滤, 续滤液经流动相适当稀释后通过以下高效液相色谱法(HPLC) 测定PUE浓度, 各组实验平行3次。采用Shimadzu LC-2010AHT HPLC系统(日本Shimadzu Corporation公司), 色谱柱为Inertsil ODS-SP C18柱(150 mm × 4.6 mm, 5 µm), 柱温设为30 ℃, 流动相为35%甲醇水溶液, 流速为1.0 mL·min-1, 检测波长设为250 nm。在该色谱条件下, PUE的保留时间为4.8 min, 在6~14 µg·mL-1浓度内与色谱峰面积呈良好的线性关系(r2=0.999 5), 日内日间精密度RSD小于3.7%, 准确度在98.5%~102.0%之间。
在37 ℃条件下重复进行PUEMH的过饱和溶出实验, 考察过饱和溶出过程中的晶型转变。分别于1、4、8和24 h抽取混悬液, 抽滤, 得到的固体糊状物置25 ℃真空干燥箱中, 所得干燥样品过80目筛后进行粉末X射线衍射、卡尔费休水分测定等分析。
聚合物对PUEMH过饱和溶出的影响 按照《中国药典》2015版四部通则0931第三法(小杯法) 装置, 在37 ℃条件下进行过饱和溶出实验。分别以PVPK12、PVPK30和PVPK90水溶液200 mL为溶出介质, 转速为100 r·min-1, 投入过量的PUEMH (约2 g), 分别于0.167、0.5、1、2、4、6、8和12 h取样考察3种聚合物对PUEMH过饱和溶出过程的影响。重复进行此实验, 分别于1、2、4、8和12 h抽取混悬液, 抽滤, 得到的固体糊状物置25 ℃真空干燥箱, 所得干燥样品用卡尔费休水分测定法分析。
结果与讨论 1 固态表征 1.1 葛根素原料和经水混悬干燥后固体的水分测定葛根素原料药和经水混悬干燥后固体进行TGA, 结果如图 1所示。葛根素原料药(图 1a) 从75至125 ℃发生第1次失重, 失重比例为4.20%;而经水混悬干燥后固体(图 1b) 从50至110 ℃发生第1次失重, 失重比例为7.87%。随着温度升高, 两者均在210 ℃左右发生第2次失重, 可能是由于降解引起。经卡尔费休法测定葛根素原料药和经水混悬干燥后固体的水分含量分别为4.37%和8.42%, 这与它们在TGA中第1次失重的比例基本一致, 根据比重计算水分子与药物摩尔比表明它们分别为葛根素一水合物与葛根素二水合物。与卡尔费休法测得的水分含量相比, TGA测得的水分失重略低, 吸附水失去。
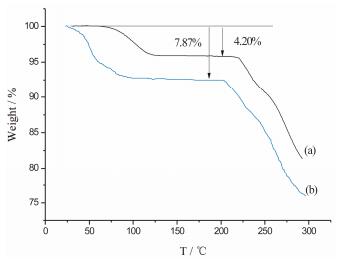
|
Figure 1 Thermal gravity analysis curves of puerarin monohydrate (a) and puerarin dihydrate (b) |
葛根素原料(PUEMH) 及制备得到的PUEDH的PXRD图谱如图 2所示。PUEMH (图 2a) 在2θ=6.73°、8.2°、9.0°、11.9°、13.5°、14.2°、16.2°、17.0°、18.4°、19.1°、19.9°、21.4°、23.4°、23.7°和24.0°处具有特征衍射峰, 表明其具有高度的结晶状态, 与文献所述一致[15, 16]。PURDH (图 2b) 的特征衍射峰为6.2°、8.1°、11.7°、12.5°、14.1°、14.9°、16.0°、17.0°、18.0°、18.5°、19.1°、20.6°、21.0°、21.9°、24.8°、25.3°。与PUEMH相比, PUEDH的PXRD中峰的数目、位置和强度均有明显不同, 最大的差别在于PURMH中强度为100%的特征衍射峰(23.7°) 消失。
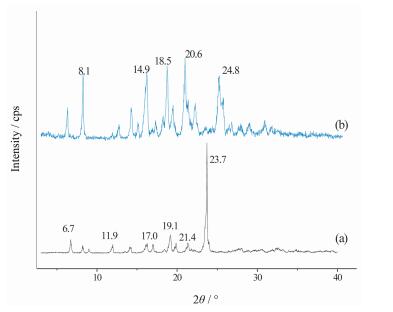
|
Figure 2 Powder X-ray diffraction patterns of puerarin monohydrate (a) and puerarin dihydrate (b) |
PUEMH及PUEDH的DSC图谱如图 3所示。由图可知, PURMH的DSC图谱(图 3a) 上有两个吸热峰, 其中, 115.2 ℃处宽的吸热峰为脱水峰, 这与TGA在75~125 ℃的第1次失重相符, 208.7 ℃处尖锐的吸热峰为PUEMH脱一分子水后形成PUE的熔点, 与文献所述一致[16]。PUEDH有两个脱水峰, 分别位于74.3 ℃和97.0 ℃, 与TGA在50~110 ℃的第1次失重相符, 209.2 ℃处吸热峰为PUEDH脱去两分子水后形成PUE的熔点。
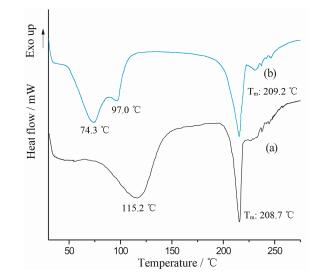
|
Figure 3 Differential scanning calorimetry thermograms of puerarin monohydrate (a) and puerarin dihydrate (b) |
PUEMH及PUEDH的FT-IR图谱如图 4所示。PUEMH的FT-IR图谱(图 4a) 中, 3 346.8和3 230.0 cm-1处为O-H的伸缩振动峰, 1 632.9 cm-1处为C=O的特征伸缩振动峰, 与文献报道一致[17, 18]。与PUEMH相比, PUEDH的FT-IR图(图 5b) 中, 仅有1个峰形更宽的吸收振动峰(3 344.7 cm-1), 可能是因为两个吸收峰发生重合或晶格中新加入的水分子造成的。与PURMH相比, 其余的伸缩振动峰(如C=O吸收峰在1 632.5 cm-1处, C伸缩振动峰在1 515.6 cm-1处, PURMH为1 515.2 cm-1) 位移较小, 仅峰形宽化, 这可能是由于PUEDH中氢键的作用方式不同于PUEMH。
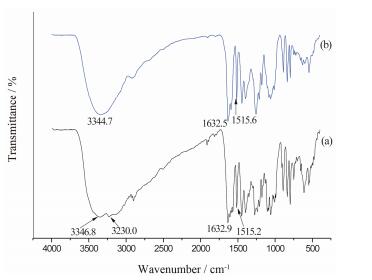
|
Figure 4 Fourier transform infrared spectroscopy spectra of puerarin monohydrate (a) and puerarin dihydrate (b) |
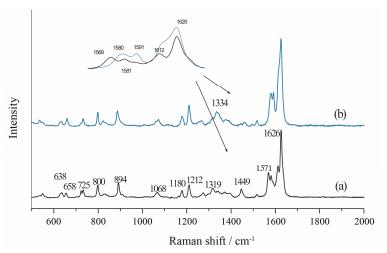
|
Figure 5 Raman spectra of puerarin monohydrate (a) and puerarin dihydrate (b) |
PUEMH和PUEDH两种水合物的Raman光谱如图 5所示, PUEMH强度最大的峰1 626 cm-1为苯环上C=Cring和C=O伸缩振动的混合峰, 1 571和1 449 cm-1为O-H弯曲振动峰, 1 300~1 400 cm-1区为C-H的伸缩振动, 1 068和1 319 cm-1区为C-O的伸缩振动, 894和800 cm-1苯环C-C的伸缩振动, 725 cm-1为C-H弯曲振动, 658和638 cm-1为O-H面外弯曲振动, 这与文献报道一致[19]。
与PUEMH相比, PURDH结构中的对称振动峰如苯环上C=Cring、C-C未见任何变化, 表明PUE的C-C骨架环境未发生变化; 而PURDH中非对称振动峰发生较大的位移, 如O-H弯曲振动峰蓝移至1 580和1 591 cm-1处, 1 612cm-1处的C=O伸缩振动亦发生蓝移而被C=Cring包含, 这可能是在PUEMH形成PUEDH的过程中由于水分子的介入与原有PUEMH中的氢键给予体(如-OH) /受体(如C=O) 之间发生氢键作用, 使药物分子内部极性基团的环境发生改变所致。
1.6 电子扫描电镜PURMH和PURDH两种水合物的SEM如图 6所示, PURMH (图 6a) 为板状晶体, 表面光滑; 而PURDH (图 6b) 为细条状, 呈簇排列。推测这可能是在混悬液法制备PUEDH过程中, PUEMH先溶解后再析出溶解度更小的PUEDH晶体, 而非在PUEMH晶体的晶格中直接插入水分子形成更大晶体的PUEDH。另外, 室温下将PUEMH置于高湿环境(92.5% RH, 饱和硝酸钾溶液) 中15天, 经PXRD及卡尔费休法测定表明PUEMH吸湿后并未形成结晶水转化成PUEDH, 这也从另一个侧面表明PUEDH是由于PUEMH先溶解再析出而形成。

|
Figure 6 Scanning electron microscopy images of puerarin monohydrate (a) and puerarin dihydrate (b) |
PUEMH及PUEDH在水中的溶出曲线如图 7所示, 在30 min时过量PUEMH溶出过程中达到第一个PUE浓度平台, 从2 h开始PUE的浓度呈显著下降趋势, 并在24 h后达到第二个浓度平台, 平衡质量浓度为2.56 mg·mL-1。而过量PUEDH在溶出过程中于1 h左右即达到PUE的最大浓度, 随后维持稳定, 且达到的平衡浓度与PUEMH的相近。PUEMH在溶出过程中PUE浓度先升高后降低至平衡的现象很可能是由于其转化成溶解度更低的PUEDH所引起。为验证这一假设, 在PUEMH溶出过程中取样并进行PXRD表征及卡尔费休水分测定。
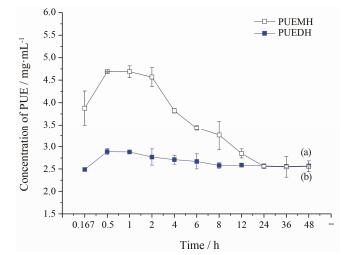
|
Figure 7 Dissolution profiles of puerarin (PUE) monohydrate (PUEMH, a) and puerarin dihydrate (PUEDH, b) in water (n=3) at 37 ℃ |
PUEMH在过饱和溶出的不同时间点取样真空干燥后PXRD结果如图 8所示。随着溶出时间的延长, PUEMH最强吸收的特征衍射峰(2θ=23.7°) 强度逐渐降低, 在24 h时完全消失; 此外, 在PUEMH溶出2 h时, 在2θ为24.8°与25.3°处出现了两个新的衍射峰, 且强度随着时间逐渐增强。在溶出24 h后的残留物经干燥后PXRD与PUEDH一致, 表明PUEMH在溶出过程中不断向二水合物PUEDH转变。

|
Figure 8 Powder X-ray diffraction (PXRD) patterns of puerarin monohydrate during its supersaturated dissolution. PXRD patterns showing, from bottom to top, (a) 0 h; (b)1 h; (c) 4 h; (d) 8 h; (e) 24 h; (f) puerarin dihydrte |
除PXRD表征外, 还对PUEMH过饱和溶出过程中的残留物采用卡尔费休法进行水分测定, 见表 1。结果表明, PUEMH晶体在溶出过程中的含水量不断增加, 在24 h时, 与PUEDH的结晶水含水量一致, 表明PUEMH在溶出过程中不断向PUEDH转化, 这与PXRD的结果吻合。
| Table 1 Water content of residues during supersaturated dissolution of PUEMH. n=3, x±s |
37 ℃条件下PUEMH在不同型号10 mg·mL-1PVP水溶液中的过饱和溶出曲线如图 9所示, 与PUEMH在纯水中先升高后降低的溶出曲线相比, 溶出介质中加入聚合物PVP后, PUEMH在1 h左右迅速达到平稳的溶出平台, 且随后PUE的浓度维持不变, 其中PVPK90为溶出介质的PUE平衡浓度达到最高, 为在水中的1.8倍。
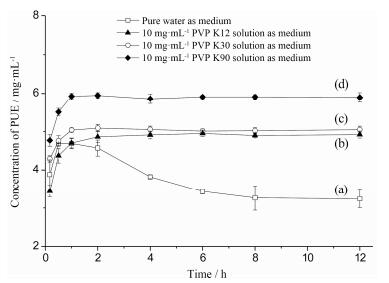
|
Figure 9 Dissolution profiles of puerarin monohydrate inpresence or absence of polyvinylpyrrolidone (PVPs). Medium: Pure water (a); 10 mg·mL-1 PVPK12 solution (b); 10 mg·mL-1 PVPK30 solution (c); 10mg·mL-1 PVPK90 solution (d) |
将PUEMH过饱和溶出过程中的残留固体真空干燥, 并采用卡尔费休法进行含水量测定, 见表 2。结果表明, 在含有聚合物PVP的溶出介质中, 残留固体的含水量在12 h溶出过程中未发生变化, 结晶水数目仍为1, 即PUEMH。因此, PVPK12、PVPK30和PVPK90可延缓或抑制PUEMH在溶出过程中向PUEDH转变。
| Table 2 Water content determination of puerarin hydraten in the presence of various PVP by Karl Fisher titration (KFT) after vacuum-dried at different times. n=3, x±s |
PUEMH在不同浓度PVPK90溶液中的溶出曲线如图 10所示。与PUEMH在纯水中(图 10a) 相比, 溶出介质中加入不同浓度的聚合物PVPK90后, PUEMH均在1 h左右迅速达到平稳的溶出平台, 且随后PUE的浓度维持不变, 其中20 mg·mL-1 PVPK90为溶出介质时PUE平衡浓度达到最高, 为纯水中的2.7倍。
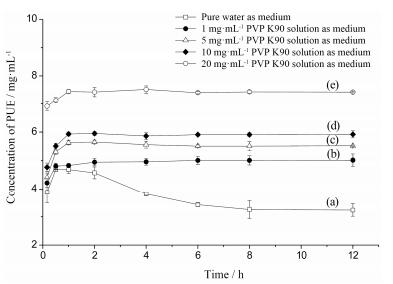
|
Figure 10 Dissolution profiles of puerarin monohydrate in presence or absence of PVPK90. Medium: Pure water (a); 1 mg·mL-1 PVPK90 solution (b); 5 mg·mL-1 PVPK90 solution (c); 10 mg·mL-1 PVPK90 solution (d); 20 mg·mL-1 PVPK90 solution |
在最初的过饱和溶出过程中, 少量的PUEMH晶体在水中溶解解离形成PUE分子, 随着PUEMH的不断溶解达到PUEMH晶体与热力学不稳定的PUE过饱和溶液共存的平衡体系, 当PUE分子与两分子水结合形成溶解度更低的PUEDH晶核, 不断长大析出PUEDH晶体, 上述共存平衡体系被打破, 溶解平衡向析出PUEDH晶体的方向移动, 在溶解PUEMH的同时不断析出溶解度更低的PUEDH, 直至PUEMH完全溶解。当溶出介质中加入聚合物PVPs后, 溶解的PUE分子可能与聚合物分子之间形成分子间作用力(如氢键)[20, 21], 占据了PUE与水形成氢键的位置, 从而不形成PUEDH晶核而保持PUEMH晶体与过饱和PUE溶液共存的体系, 使得最终残留固体为PUEMH晶体(图 11)。

|
Figure 11 Schematic illustration of potential mechanism for inhibition of the transformation from PUEMH to PUEDH by PVPs during dissolution |
本研究首次发现了葛根素原料为一水合物, 且在水中可向溶解度更低的二水合物转变。聚乙烯吡咯烷酮类聚合物的加入可有效抑制/延缓该转变, 为葛根素口服制剂的研究提供了重要的理论基础。
| [1] | Brouwers J, Brewster ME, Augustijns P. Super saturating drug delivery systems:the answer to solubility-limited oral bioavailability?[J]. J Pharm Sci, 2009, 98: 2549–2572. DOI:10.1002/jps.21650 |
| [2] | De Smidt JH, Fokkens JG, Grijseels H, et al. Dissolution of theophylline monohydrate and anhydrous theophylline in buffer solutions[J]. J Pharm Sci, 1986, 75: 497–501. DOI:10.1002/jps.2600750515 |
| [3] | Otsuka M, Teraoka R, Matsuda Y. Rotating-disk dissolution kinetics of nitrofurantoin anhydrate and monohydrate at various temperatures[J]. Pharm Res, 1992, 9: 307–311. DOI:10.1023/A:1015874415248 |
| [4] | Aaltonen J, Heinänen P, Peltonen L, et al. In situ measurement of solvent-mediated phase transformations during dissolution testing[J]. J Pharm Sci, 2006, 95: 2730–2737. DOI:10.1002/jps.20725 |
| [5] | Imaizumi H, Nambu N, Nagai T. Stability and several physical properties of amorphous and crystalline form of indomethacin[J]. Chem Pharm Bull, 1980, 28: 2565–2569. DOI:10.1248/cpb.28.2565 |
| [6] | Konno H, Taylor LS. Ability of different polymers to inhibit the crystallization of amorphous felodipine in the presence of moisture[J]. Pharm Res, 2008, 25: 969–978. DOI:10.1007/s11095-007-9331-3 |
| [7] | Shen ZF, Xie MZ. Hypoglycemic effect of the combined use of puerarin and aspirin in mice[J]. Acta Pharm Sin (药学学报), 1985, 20: 863–865. |
| [8] | Zhang B, Wei XB, Liu HQ, et al. Protective effects of hydroxyethylpuerarin against brain astrocytes injury induced by hydrogen peroxide[J]. Acta Pharm Sin (药学学报), 2006, 41: 171–174. |
| [9] | Zhou YX, Zhang H, Peng C. Puerarin:a review of pharmacological effects[J]. Phytother Res, 2014, 28: 961–975. DOI:10.1002/ptr.v28.7 |
| [10] | Tu L, Yi Y, Wu W, et al. Effects of particle size on the pharmacokinetics of puerarin nanocrystals and microcrystals after oral administration to rat[J]. Int J Pharm, 2013, 458: 135–140. DOI:10.1016/j.ijpharm.2013.10.001 |
| [11] | Li S, Yue J, Zhou W, et al. An investigation into the preparation, characterization and antioxidant activity of puerarin/cyclodextrin inclusion complexes[J]. Mol Recognit Chem, 2015, 82: 453–460. |
| [12] | Li Y, Pan WS, Chen SL, et al. Pharmacokinetic, tissue distribution, and excretion of puerarin and puerarin-phospholipid complex in rats[J]. Drug Dev Ind Pharm, 2006, 32: 413–422. DOI:10.1080/03639040600559123 |
| [13] | Luo CF, Yuan M, Chen MS, et al. Pharmacokinetics, tissue distribution and relative bioavailability of puerarin solid lipid nanoparticles following oral administration[J]. Int J Pharm, 2011, 410: 138–144. DOI:10.1016/j.ijpharm.2011.02.064 |
| [14] | Quan D, Xu G, Wu X. Studies on preparation and absolute bioavailability of a self-emulsifying system containing puerarin[J]. Chem Pharm Bull, 2007, 55: 800–803. DOI:10.1248/cpb.55.800 |
| [15] | Xie J, Yang F, Shi X, et al. Improvement in solubility and bioavailability of puerarin by mechanochemical preparation[J]. Drug Dev Ind Pharm, 2013, 39: 826–835. DOI:10.3109/03639045.2012.664147 |
| [16] | Li Y, Yang DJ, Chen SL, et al. Comparative physicochemical characterization of phospholipids complex of puerarin formulated by conventional and supercritical methods[J]. Pharm Res, 2008, 25: 563–577. DOI:10.1007/s11095-007-9418-x |
| [17] | Tao H, Meng Q, Li M, et al. HP-β-CD-PLGA nanoparticles improve the penetration and bioavailability of puerarin and enhance the therapeutic effects on brain ischemia-reperfusion injury in rats[J]. Naunyn Schmiedebergs Arch Pharmacol, 2013, 386: 61–70. DOI:10.1007/s00210-012-0804-5 |
| [18] | Chen AZ, Li Y, Chau FT, et al. Application of organic nonsolvent in the process of solution-enhanced dispersion by supercritical CO2 to prepare puerarin fine particles[J]. J Supercrit Fluids, 2009, 49: 394–402. DOI:10.1016/j.supflu.2009.02.004 |
| [19] | Wong KH, Razmovski-Naumovski V, Li KM, et al. The quality control of two Pueraria species using Raman spectroscopy coupled with partial least squares analysis[J]. J Raman Spectrosc, 2015, 46: 361–368. DOI:10.1002/jrs.v46.4 |
| [20] | Lovette MA, Browning AR, Griffin DW, et al. Crystal shape engineering[J]. Ind Eng Chem Res, 2008, 47: 9812–9833. DOI:10.1021/ie800900f |
| [21] | Raghavan SL, Trividic A, Davis AF, et al. Crystallization of hydrocortisone acetate:influence of polymers[J]. Int J Pharm, 2001, 212: 213–221. DOI:10.1016/S0378-5173(00)00610-4 |
 2017, Vol. 52
2017, Vol. 52


