2. 天津药物研究院释药技术与药代动力学国家重点实验室, 天津 300193
2. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
红景天系景天科景天属多年生草本或亚灌木植物, 主要生长在高海拔、高寒的藏、吉地区。我国应用红景天历史悠久, 在藏医《四部医典》和《本草纲目》中均有记载。现代药理研究表明, 红景天苷及其苷元酪醇为红景天的有效成分。大量研究证明红景天苷具有广泛的药理作用, 包括抗老化、抗缺氧、抗疲劳、抗抑郁、镇静催眠、抗辐射、增强机体免疫力、保护心脑血管、抗肾损害和抗肿瘤等[1, 2]。
目前, 国内外对红景天的研究多集中于药效, 对同时测定红景天苷和酪醇含量的分析方法研究报道较少, 且大多采用高效液相色谱(HPLC-UV) 法[3-6]。如Lin等[6]采用HPLC法同时测定灌胃给药红景天苷和酪醇后大鼠血浆中两种药物的浓度, 定量下限分别为2.83和53.9 μmol·L-1; Guo等[7]采用LC-MS/MS方法同时测定大鼠血浆中红景天苷和酪醇的浓度, 定量下限分别为0.167和0.145 μmol·L-1。以上两种方法对红景天苷的检测灵敏度均较低, 不能满足其体内药动学分析。此外, Wu等[8]应用LC-MS/MS法同时测定了大鼠血浆中的红景天苷和酪醇含量, 定量下限分别为0.167和0.036 μmol·L-1, 该方法的样品处理方式为固相萃取, 在批量处理样品时成本较高且步骤复杂, 并且红景天苷的检测灵敏度较低。
在LC-MS/MS分析过程中, 衍生化法可以增强化合物的离子化效率, 提高检测灵敏度, 并且能通过改变药物的极性而改善药物的色谱分离[9]。丹磺酰氯作为一种广泛应用的衍生化试剂, 主要应用于荧光检测以及优化酚类和胺类化合物的质谱响应等方面。通过与丹磺酰氯进行衍生化反应, 在化合物的结构中引入一个碱性含氮基团, 使其易于在酸性流动相中离子化, 从而增强待测物的质谱响应。酚类化合物与丹磺酰氯的反应过程[10]如图 1所示。本研究旨在通过红景天苷和酪醇与丹磺酰氯发生衍生化反应, 建立一种灵敏度更高、样品使用量更小、更经济可靠的检测方法, 为临床前药代动力学研究提供方法依据。
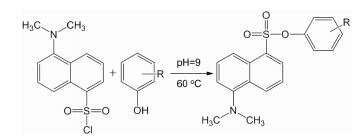
|
Figure 1 Derivative scheme of dansylation for compounds containing phenolic hydroxyl group |
药品与试剂 红景天苷供试品(批号: 14070203;纯度: 100.6%), 由福建省闽东力捷迅药业有限公司提供; 红景天苷对照品(批号: 110818-201517;纯度: 99.4%)、熊果苷标准品(批号: 111951-201301;纯度: 99.7%), 酪醇标准品(批号: 111676-200602;纯度: 100%), 中国食品药品检定研究院; 丹磺酰氯(批号: BCBPQ4057V;纯度: 99.8%), 美国Sigma公司; 色谱纯乙腈, Thermo Fisher公司; 分析纯甲基叔丁基醚, 天津漠德威化学科技有限公司; 分析纯无水甲酸、无水碳酸钠, 天津市光复精细化工研究所; 分析纯碳酸氢钠, 伊普赛诺科技(天津) 有限公司; 去离子水, 实验室自制。
动物 健康Beagle犬6只, 普通级, 体重(9.31±0.77) kg。购于北京玛斯生物技术有限公司, 动物质量合格证编号: 11400600001067 (雌), 11400600001065 (雄), 生产许可证: SCXK (京) 2011-0003。实验动物由天津药物研究院新药评价有限公司动物房饲养。动物使用方案已经获得天津药物研究院新药评价有限公司IACUC批准。
仪器 ACQUITY TQDTMUPLC/MS/MS型液质联用仪(包括在线脱气、二元梯度泵、自动进样器、柱温箱、ESI源、Masslynx 4.1数据处理软件等), 美国Waters公司; MS-100型恒温混匀仪, 杭州奥盛仪器有限公司; Sorvall Legend Micro 17R台式高速冷冻离心机, Thermo Fisher Scientific公司; Turbo Vap LV型样品浓缩仪, 美国Caliper公司; BM-40型纯水制备系统, 北京中盛茂源科技发展有限公司。
色谱条件 ACQUITY UPLC® BEH C18色谱柱(100 mm × 2.1 mm, ID, 1.7 μm), 柱温35 ℃; 乙腈(含0.1%甲酸) (A相)-水(含0.1%甲酸和10%乙腈) (B相) 流动相, 梯度洗脱(0~5 min, 50% A; 5~5.1 min, 50% A→90% A; 5.1~7.5 min, 90% A; 7.5~7.6 min, 90% A→50% A; 7.6~9 min, 50% A), 流速0.2 mL·min-1; 进样量5 μL。
质谱条件 电喷雾离子化源(ESI); 毛细管电压3 000 V; 锥孔电压30 V; 离子源温度110 ℃; 去溶剂气温度350 ℃, 去溶剂气流量650 L·h-1, 锥孔气流量50 L·h-1。正离子多反应监测模式(MRM); 用于定量分析的离子对分别为: m/z 534.2→372.0 (红景天苷衍生物), 碰撞能为20 V; m/z 372.0→171.0 (酪醇衍生物), 碰撞能为25 V; m/z506.0→171.0 (内标熊果苷衍生物), 碰撞能为35 V。
溶液配制
对照品溶液 精密称取红景天苷、酪醇对照品适量, 分别用乙腈配制为750和3 000 μmol·L-1的红景天苷和酪醇贮备液。随后用乙腈将红景天苷和酪醇贮备液稀释成0.02/0.1、0.05/0.2、0.2/0.5、1/1、5/2、10/5和20/10 μmol·L-1系列混合对照溶液。
质控溶液 精密量取上述红景天苷、酪醇对照贮备液适量, 用乙腈稀释配制0.05/0.2、1/1和16/8 μmol·L-1红景天苷和酪醇混合质控(QC) 工作液。
内标溶液 精密称取熊果苷对照品适量, 用乙腈配制成400 μg·mL-1内标贮备液, 再用乙腈稀释为500 ng·mL-1的内标溶液。
衍生化溶液 避光称取丹磺酰氯适量, 用乙腈配制0.5 mg·mL-1丹磺酰氯溶液, -20 ℃避光保存。
给药溶液 称取红景天苷适量, 配制成100 mg·mL-1的生理盐水溶液, 给药体积为1 mL·kg-1。
血浆样品处理 吸取犬血浆50 μL, 加入乙腈50 μL, 内标100 μL, 涡旋2 min, 4 ℃ 12 000 r·min-1离心10 min。取上清液100 μL至1.5 mL EP管, 加入碱溶液(100 mmol·L-1的Na2CO3水溶液-100 mmol·L-1 NaHCO3水溶液, 1:5, pH 9) 100 μL, 避光加入丹磺酰氯(0.5 mg·mL-1) 乙腈溶液100 μL, 涡旋2 min, 在60 ℃条件下孵育30 min。孵育后加入甲基叔丁基醚900 μL, 涡旋2 min后离心5 min, 取上清液800 μL用N2吹干, 加入复溶溶液(乙腈-水, 50:50) 120 μL, 涡旋离心后进样5 μL, 进行UHPLC-MS/MS定量分析。
线性关系 取空白犬血浆50 μL, 加入混合对照溶液50 μL, 配制成浓度为0.02/0.1~20/10 μmol·L-1的血浆样品, 进行UHPLC-MS/MS分析。以红景天苷衍生物或酪醇衍生物与内标熊果苷衍生物的色谱峰面积比(Y) 为纵坐标、血浆中待测物的浓度(X) 为横坐标, 用加权(W=1/X2) 最小二乘法进行直线回归。
批内、批间精密度与准确度 取空白犬血浆50 μL, 按标准曲线制备方法配制定量下限、低、中、高4个浓度(0.02/0.1、0.05/0.2、1/1和16/8 μmol·L-1) 红景天苷/酪醇QC样品, 每一浓度每天进行6样本分析, 连续测定3天, 根据当日标准曲线计算QC样品的浓度。
基质效应和回收率 样品A:取质控溶液(低、中、高浓度) 各50 μL, 按血浆样品处理过程(不加犬血浆, 以50 μL水代替; 50 μL质控溶液代替乙腈) 处理样品, 进样5 μL, 记录红景天苷衍生物、酪醇衍生物和内标衍生物的色谱峰面积A。样品B:取空白犬血浆50 μL, 加入乙腈150 μL, 涡旋后离心, 取上清液100 μL, N2吹干, 取A溶液100 μL复溶, 按血浆样品处理过程操作, 进样5 μL, 记录待测物衍生物和内标衍生物的色谱峰面积B。样品C:取质控溶液(低、中、高浓度) 各50 μL, 按血浆样品处理过程(以50 μL空白犬血浆代替血浆, 质控溶液代替50 μL乙腈) 处理样品, 进样5 μL, 记录待测物衍生物和内标衍生物的色谱峰面积C。峰面积比B/A×100%即为红景天苷, 酪醇和内标的基质效应; 峰面积比C/B×100%即为红景天苷, 酪醇和内标的提取回收率。
稳定性 考察低、高浓度的含药血浆样品(红景天苷/酪醇浓度为: 0.05/0.2和16/8 μmol·L-1) 室温放置2 h, -80 ℃冻融循环2次, -80 ℃长期冻存以及处理过的样品于自动进样器10 ℃放置24 h的稳定性。
稀释效应 犬空白血浆和适量的质控贮备液配制成红景天苷/酪醇浓度为800/400 μmol·L-1血浆样品, 用空白血浆稀释50倍后, 测定稀释后血浆中待测物的实际浓度, 测定结果与稀释因子相乘后的实际浓度和理论浓度进行对比。
药动学研究 5只健康Beagle犬, 灌胃给药(100 mg·kg-1) 红景天苷生理盐水溶液, 于给药前和给药后0.083 3、0.25、0.5、0.75、1、2、3、4、6、9、12和24 h采血0.5 mL, 离心分离血浆, -80 ℃保存待测。
数据处理 使用Masslynx 4.1数据处理软件, 对待测物及内标进行积分, 记录峰面积, 求得血浆校正曲线并且计算每只动物的红景天苷和酪醇浓度数据; 应用WinNonlin 6.3药代动力学软件, 选择非房室模型统计矩法计算药代参数tmax、t1/2、Cmax、AUC0-t和AUC0-∞。
结果 1 方法学验证 1.1 专属性犬空白血浆样品的色谱见图 2A; 将定量下限浓度的混合溶液和内标溶液加入空白犬血浆中, 依同法操作, 色谱图见图 2B, 红景天苷衍生物、酪醇衍生物和内标衍生物的保留时间分别为2.06、4.62和1.88 min; Beagle犬灌胃给药后3 h的血浆样品色谱图见图 2C。结果表明, 空白血样中内源性物质的响应低于LLOQ的1/5以及内标响应的1/20, 对待测物和内标的定量测定不会产生明显影响。
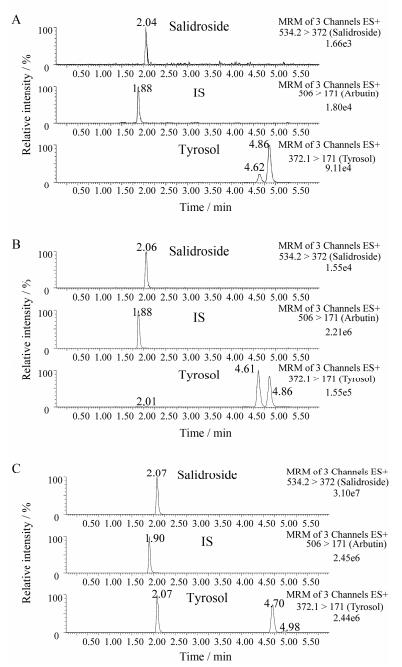
|
Figure 2 The chromatograms of the blank dog plasma (A), the blank dog plasma spiked with salidroside (0.02 μmol·L-1), tyrosol (0.1 μmol·L-1) and IS (500 ng·mL-1 arbutin) (B), the dog plasma sample collected at 3 h post dosing of 100 mg·kg-1 salidroside (C) |
红景天苷的回归方程为Y=0.328 X -0.000 055 0 (r=0.998 3), 酪醇的回归方程为Y=0.800 X + 0.020 5 (r=0.999 5)。结果表明红景天苷和酪醇在0.02/0.1~20/10 μmol·L-1内线性良好, 定量下限分别为0.02和0.1 μmol·L-1 (信噪比 > 10)。
1.3 批内、批间精密度与准确度结果表明, 红景天苷和酪醇在定量下限的批内、批间精密度(RSD) 均小于8.59%, 准确度(RE) 在±2.68%之间; 低、中、高3个浓度QC样品的批内、批间精密度(RSD) 均小于8.68%, 准确度(RE) 在±11.4%之间。
1.4 基质效应和回收率结果表明, 红景天苷在3个浓度水平的基质效应分别为101±0.042 0%、89.4±0.024 8%、94.1±0.073 7%;回收率分别为96.5±2.76%、100.0±2.27%、105±1.97%;酪醇的基质效应分别为96.6±0.025 2%、88.5±0.018 6%、92.7±0.066 9%;回收率分别为105±1.97%、107±2.92%、102±1.57%;内标的基质效应为99.6±0.046 6%;回收率为93.8±4.31%。
1.5 稳定性结果表明, 红景天苷/酪醇的含药血浆在以上贮存条件下和处理后于10 ℃放置24 h的测定浓度分别为0.052 5±0.001 35/15.7±0.582、0.057 2±0.002 20/16.3±0.353、0.056 4±0.002 84/16.5±0.507、0.052 7±0.001 91/15.3±0.180; 0.224±0.005 94/7.98±0.149、0.218±0.008 09/7.78±0.185、0.211±0.010 1/ 7.79±0.237、0.201±0.006 43/7.70±0.079 3 μmol·L-1。RSD均小于5.03%; RE均在±14.3%范围内, RSD和RE均小于15%, 稳定性良好。
1.6 稀释效应结果表明, 红景天苷的准确度在88.8%~108%之间, 精密度为7.25%;酪醇的准确度在90.9%~112%之间, 精密度为7.32%。
2 Beagle犬灌胃给药后的药动学研究Beagle犬灌胃给药后, 红景天苷和酪醇的平均药时曲线图见图 3, 相应的药动学参数见表 1。结果表明, 红景天苷在Beagle犬体内吸收迅速, 血药浓度于1 h左右达峰, 随后逐渐下降, 其在体内脱去葡萄糖分子生成其苷元酪醇, 于给药后0.5 h在血浆中检测到酪醇的浓度, 与原形药物红景天苷相比略有延迟, 其血药浓度于2 h左右达峰, 峰浓度约为原形药物的1%, 随后血药浓度逐渐下降。
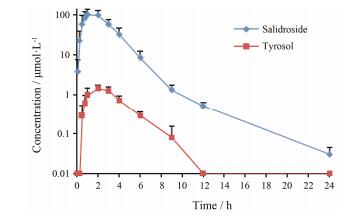
|
Figure 3 Mean plasma concentration-time profile of salidroside and tyrosol by UHPLC-MS/MS after oral administration of salidroside (100 mg·kg-1) to Beagle dogs. n=5, x±s |
| Table 1 Pharmacokinetic parameters of salidroside and tyrosol after oral administration of salidroside (100 mg·kg-1) to Beagle dogs. n=5, x±s |
在本研究的预实验过程中发现酪醇的质谱响应较低, 且在低浓度时响应波动较大, 难以满足药代动力学研究的需求。分析造成该现象的原因与酚羟基的结构有关。文献[10, 11]报道针对酚羟基结构的液质检测常有采用衍生化来提高质谱响应灵敏度。通过与丹磺酰氯进行衍生化反应, 可将含氮基团引入到酚类化合物结构中, 形成在ESI条件下正离子方式检测时易离子化结构。丹磺酰氯衍生化产物通常会产生m/z 171.0特征子离子[10, 11], 如酪醇衍生物。但也有例外, Gong等[12]报道的淫羊藿苷衍生物这类分子量较大的苷类化合物会产生脱糖的子离子。红景天苷衍生物的质谱断裂方式与文献中淫羊藿苷衍生物的断裂方式一致, 均为脱去糖分子, 因此产物离子为m/z 372.0。
衍生化反应的效率受多个因素影响。本文参考文献[10, 11]报道的丹磺酰氯衍生化条件, 考察了4种因素对衍生化反应的影响。首先是衍生化反应时间(5、15、30、45和60 min) 对质谱响应值的影响。如衍生化反应时间较短, 不同样品衍生化速度会有差异, 使得结果重现性较差。反应时间达30 min后质谱响应无明显变化, 所以选择30 min作为反应时间。其次, 考察了反应温度(30~80 ℃) 对待测衍生物质谱响应值的影响, 结果表明在60 ℃条件下, 待测衍生物的响应值最高。再次, 考察了反应pH值(pH=8、9、10.5、11、12.5) 对待测衍生物质谱响应值的影响, 结果表明, 在pH=9时待测衍生物的响应值最高。最后, 考察了丹磺酰氯浓度对待测衍生物质谱响应值的影响, 结果表明, 在0.5 mg·mL-1丹磺酰氯浓度条件下, 衍生化反应达到饱和。因此, 本文最终确定的衍生化反应条件如下:在60 ℃条件下, 待测物、内标与0.5 mg·mL-1丹磺酰氯在pH=9碱性环境中反应30 min。
在色谱分离方面, 本文对比了ACQUITY UPLC® BEHC18、ACQUITY UPLC® HSS和ACQUITY UPLC®BEHShield RP18等色谱柱对衍生物分离的影响。研究发现ACQUITY UPLC® BEHC18色谱柱的保留时间理想, 且峰形较好。此外, 在流动相中加入0.1%甲酸有助于改善峰形、提高正离子条件下的ESI效率。在选择内标时, 要考虑其结构要与红景天苷类似, 并且要含有酚羟基或氨基等能与丹磺酰氯进行衍生化反应的基团。熊果苷结构与红景天苷相近, 峰形较好且保留时间与红景天苷接近, 适合作为本测定方法的内标。
本实验也考察了非衍生化血浆样品处理方法。由于红景天苷极性大, 直接采用蛋白沉淀方式有很强的基质效应, 而采用液液萃取方式提取回收率又太低。因此, 在衍生化之前首先要进行蛋白沉淀; 衍生化之后, 由于衍生化反应物的极性降低, 采用甲基叔丁基醚对待测物和内标进行萃取, 提取回收率高且稳定。另外, 甲基叔丁基醚还能将反应体系中的碱去除, 避免了样品中含有碱而导致的基质效应。
本实验首次通过衍生化反应对红景天苷、酪醇和内标结构进行修饰, 在提高检测灵敏度的同时降低了实验成本、减少了样品使用量。对比未衍生化处理样品, 此法对红景天苷和酪醇的分析灵敏度均有较大提高, 定量下限为0.02/0.1 μmol·L-1 (S/N > 10), 酪醇的定量下限0.1 μmol·L-1满足实验要求。本方法极大提高了待测物的分析水平, 为红景天苷和酪醇的临床前药动学研究提供了方法学基础, 并且为含有酚羟基或氨基的苷类化合物的体内浓度测定以及药代动力学研究提供了新方法。
| [1] | Li FL. Research progress in pharmacological effects of salidroside from Rhodiola[J]. Mod Food Sci Technol (现代食品科技), 2013, 29: 916–922. |
| [2] | Li Y, Zhang HF, Li XG. Research advance on pharmacological action of salidroside[J]. J Jilin Med Coll (吉林医药学院学报), 2007, 28: 175–177. |
| [3] | Song W, Shi XF, Zhang RT, et al. Content determination of rhodioloside and tryosol in compound Rhodiola buccal tablets by HPLC[J]. China Pharm (中国药房), 2011, 22: 621–622. |
| [4] | Yi ZB, Lai XP, Xu DJ. Simultaneous determination of salidroside and tyrosol in Rhodiolarosea by HPLC[J]. Chin Tradit Herb Drugs (中草药), 2009, 40: 1827–1829. |
| [5] | Yang XY, Lu QQ, Lou DJ, et al. Simultaneous determination of salidroside, tyrosol and gallate in Rhodiola rosea by HPLC[J]. Chin J Anal Lab (分析试验室), 2009, 28: 57–60. |
| [6] | Lin JZ, Zhang DK, Zou L, et al. Research on pharmacokinetics of salidroside and tyrosol in rats[J]. Chin Tradit Pat Med (中成药), 2014, 36: 1845–1849. |
| [7] | Guo N, Hu ZW, Fan XX, et al. Simultaneous determination of salidroside and its aglycone metabolite p-tyrosol in rat plasma by liquid chromatography-tandem mass spectrometry[J]. Molecules, 2012, 17: 4733–4754. DOI:10.3390/molecules17044733 |
| [8] | Wu QF, Li G, Fu Y. Simultaneous determination of salidroside and tyrosol in rat plasma by LC-MS/MS and application to their pharmacokinetic study[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2013, 24: 169–172. |
| [9] | Liu HY, Li D, Yong Y, et al. Comparison of three derivatization reagents for the simultaneous determination of highly hydrophilic pyrimidine antitumor agents in human plasma by LC-MS/MS[J]. J Chromatogr B, 2012, 893-874: 49–56. |
| [10] | Pernica M, Poloucká P, Seifertová M, et al. Determination of alkylphenols in water samples using liquid chromatographytandem mass spectrometry after pre-column derivatization with dansyl chloride[J]. J Chromatogr A, 2015, 1417: 49–56. DOI:10.1016/j.chroma.2015.09.030 |
| [11] | Zhuang XY, Zhong Y, Mei Y, et al. Pre-column derivatization combined with UHPLC-MS/MS for rapid and sensitive quantification of bakuchiol in rat plasma[J]. J Pharm Biomed Anal, 2013, 75: 18–24. DOI:10.1016/j.jpba.2012.11.001 |
| [12] | Gong Y, Yip SC, Thamarai SK, et al. Trace analysis of icariin in human serum with dansyl chloride derivatization after oral administration of epimedium decoction by liquid chromatography tandem mass spectrometry[J]. J Chromatogr B, 2007, 860: 166–172. DOI:10.1016/j.jchromb.2007.10.045 |
 2017, Vol. 52
2017, Vol. 52


