2. 大连医科大学附属第二医院, 辽宁 大连 116027;
3. 中国科学院大学, 北京 100049
2. Second Affiliated Hospital of Dalian Medical University, Dalian 116027, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
瑞香素(又称祖师麻甲素) 是我国传统中药祖师麻主要活性成分和质量控制指标成分[1]。瑞香素在我国20世纪80年代即被开发为治疗闭塞性脉管炎、关节炎等疾病的辅助药物, 以瑞香素为主要活性成分的多种瑞香属类植物在土耳其被用于治疗腰痛和发热等的传统草药[2]。
药物代谢是药物代谢动力学的核心研究内容, 直接关系药物的安全性和有效性[3]。然而, 从动物实验获取的药代、药效数据向人体进行放大和推导, 可能因种属差异获得错误的药理学数据[3]。大鼠是以往研究瑞香素代谢、药效机制使用最普遍的模式动物[1, 4-7]。瑞香素在大鼠体内药物代谢动力学表现为半衰期短(约15 min), 但机制仍不清楚[5]。作者[8, 9]曾研究比较瑞香素在大鼠和人肝微粒体中葡萄糖醛酸代谢通路差异; 鉴定了在人肝S9 (HLS9) 中瑞香素代谢产物结构, 测定了不同代谢通路动力学行为[8, 9]。然而, 瑞香素在大鼠和人体中代谢轮廓及清除速率是否存在差异尚不清楚。因此, 本研究利用大鼠肝S9 (RLS9) 考察瑞香素代谢轮廓及动力学行为。
材料与方法实验材料 瑞香素(97%), 丙甲菌素, Brij 58, 氯化镁, D-葡萄糖二酸1, 4-内酯(DSL), β-D-葡糖醛酸结合物水解酶, 尿苷酰二磷酸葡糖醛酸钠(UDPGA), S-腺苷基甲硫氨酸(SAM), 二硫苏糖醇(DTT), 3'-磷酸腺苷-5'-磷酰硫酸(PAPS), D-葡萄糖-6-磷酸盐, 葡萄糖-6-磷酸脱氢酶, NADP+购自Sigma-Aldrich。瑞香素代谢产物, 包括瑞香素-7-葡糖醛酸苷、瑞香素-8-葡糖醛酸苷、瑞香素-7-硫酸酯、瑞香素-8-硫酸酯、8-甲基-瑞香素和7-硫酸酯-8-甲基-瑞香素使用文献[8, 9]报道方法分离、纯化获得。RLS9购自瑞德肝脏疾病研究(上海) 有限公司。
孵育体系 使用Ⅰ相和Ⅱ相代谢酶体外研究体系考察瑞香素代谢特征。细胞色素P450酶(CYP) 孵育体系(总体积200 μL), 包括磷酸钾缓冲液(pH 7.4, 100 mmol·L-1)、NADPH-产生体系(1 mmol·L-1 NADP+、10 mmol·L-1葡萄糖-6-磷酸、1 U·mL-1葡萄糖-6-磷酸脱氢酶、4 mmol·L-1 MgCl2)、0.5 mg·mL-1 RLS9和瑞香素。Ⅱ相酶孵育体系(总体积200 μL), 包括Tris-HCl缓冲液(pH 7.4, 50 mmol·L-1)、5 mmol·L-1 MgCl2、0.5 mg·mL-1 RLS9、辅因子(5 mmol·L-1 UDPGA、4 mmol·L-1 PAPS、1 mmol·L-1 SAM) 和瑞香素。所有反应在37 ℃条件下预孵3 min, 加入辅因子(NADP+、UDPGA、PAPS或SAM) 启始反应。37 ℃条件下孵育60 min后, 加入甲醇200 μL终止反应。充分涡旋, 在4 ℃下20 000 ×g离心10 min去除蛋白, 取上清液进行HPLC-DAD-MS分析。
分析条件 使用岛津LC-MS-2010EV系统用于瑞香素及其代谢产物的分析和鉴定, 包括控制器CBM-20A, 两个LC-20AD泵, 自动进样器SIL-20ACHT, DAD检测器, 电喷射离子化(ESI) 质谱检测器。分析柱为Shim-pack XR-ODS C18色谱柱(100.0 mm × 2.0 mm, 2.2 μm), 柱温箱温度设为40 ℃。流动相A为乙腈, B为水(含0.2%甲酸), 流速为0.3 mL·min-1。梯度洗脱条件为: 0~2.0 min, 92%~90% B; 2.0~9.0 min, 90%~70% B; 9.0~11 min, 10% B; 11~16 min, 平衡到92% B。检测波长设定为320 nm。使用合成后的瑞香素代谢产物制作标准曲线。代谢产物M-5在0.04~8 μmol·L-1浓度内线性良好, 其余代谢产物M-1、M-2、M-3、M-4和M-6在0.2~30 μmol·L-1浓度内线性良好, 相关系数大于0.99。样品测定的准确度和精密度RSD值 < 15%。使用ESI质谱检测器在正负离子模式下检测瑞香素代谢产物。扫描m/z范围从100~1 000。检测器电压设定为±1.5 kV, CDL和加热器的温度均设在250 ℃, CDL电压设定为40 V。其他检测条件如下:接口电压为4.5 kV, 氮气流速1.5 L·min-1, 干燥气(N2) 压力0.06 MPa。通过LC-MS Solution工作站(3.4.1版) 进行数据处理。
动力学分析 葡糖醛酸化孵育体系(200 μL), 包括Tris-HCl缓冲液(pH 7.4, 50 mmol·L-1)、10 mmol·L-1 MgCl2、10 mmol·L-1 DSL、25 μg·mL-1丙甲菌素、0.3 mg·mL-1 RLS9、5 mmol·L-1 UDPGA和1~600 μmol·L-1瑞香素, 孵育条件为37 ℃下10 min。磺酸化孵育体系(200 μL), 包括Tris-HCl缓冲液(pH 7.4, 50 mmol·L-1)、5 mmol·L-1 MgCl2、2 mmol·L-1 DTT、0.3 mg·mL-1 RLS9、4 mmol·L-1 PAPS和1~200 μmol·L-1瑞香素, 孵育条件为37 ℃下20 min。甲基化孵育体系(200 μL), 包括Tris-HCl缓冲液(pH 7.4, 50 mmol·L-1)、5 mmol·L-1 MgCl2、2 mmol·L-1 DTT、0.3 mg·mL-1 RLS9、1 mmol·L-1 SAM和1~100 μmol·L-1瑞香素, 孵育条件为37 ℃下10 min。以上反应中瑞香素代谢比例不超过20%, 以确保符合酶动力学理论假设。
采用Graphpad 6.0软件中的米氏动力学(公式1)、底物抑制动力学(公式2) 和双位点动力学(公式3) 对实验数据进行非线性拟合, 得到表观动力学常数Vmax和Km。
| $ V=\frac{{{V}_{\max }}\times \left[S \right]}{{{K}_{\text{m}}}+\left[S \right]} $ | (1) |
| $ V=\frac{{{V}_{\max }}\times \left[S \right]}{{{K}_{\text{m}}}+\left[S \right]+{{\left[S \right]}^{2}}/{{K}_{\text{s}}}} $ | (2) |
| $ V=\frac{{{V}_{\max 1}}\times \left[S \right]}{{{K}_{\text{m1}}}+\left[S \right]}+\frac{{{V}_{\max 2}}\times \left[S \right]}{{{K}_{\text{m2}}}+\left[S \right]} $ | (3) |
其中Km是米氏常数, Vmax是最大反应速率, Ks是底物抑制常数, [S]是底物浓度, V是反应速率。结果以均值±拟合S.E.的形式给出。
预测体内肝清除率 将3条代谢路径体外固有清除率(Vmax/Km) 相加获得体外固有清除率, 并通过公式4推导瑞香素在肝脏中体内固有清除率(CL'int, liver)。通过充分搅拌模型(公式5) 将肝脏体内固有清除率CL'int, liver放大至肝脏清除率(CLH)。
| $ \text{C}{{{\text{L}'}}_{\text{int, liver}}}=\frac{{{V}_{\max }}}{{{K}_{\text{m}}}}\times \frac{\text{S9含量}\left( \text{mg} \right)}{\text{肝组织}\left( \text{g} \right)}\times \text{肝组织含量}\left( \text{g}\cdot \text{k}{{\text{g}}^{-1}} \right) $ | (4) |
| $ \text{C}{{\text{L}}_{\text{H}}}=\frac{{{Q}_{\text{H}}}+{{f}_{\text{u, b}}}\times \text{C}{{{\text{L}'}}_{\text{int, liver}}}}{{{Q}_{\text{H}}}+{{f}_{\text{u, b}}}\times \text{C}{{{\text{L}'}}_{\text{int, liver}}}} $ | (5) |
其中Km是米氏常数, Vmax是最大反应速率。大鼠肝脏(97.9 mg·g-1, 47 g·kg-1) 放大因子参考先前报道获得[8]。其中fu, b是瑞香素在大鼠血液中的游离分数, 在本研究中视其与人血浆中游离分数值(0.8) 相同[9]。QH是大鼠肝脏血流速率(55.2 mL·min-1·kg-1)。
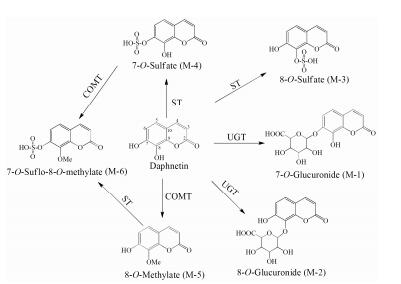
结果 1 瑞香素代谢产物结构鉴定通过HPLC-DAD-MS检查发现, 瑞香素、RLS9和Ⅱ酶辅因子(SAM、PAPS、UDPGA) 孵育后产生6个代谢产物(图 1)。质谱分析结果显示, 代谢产物M-1、M-2、M-3、M-4和M-6在负离子模式质谱信号分别为m/z 353、m/z 353、m/z 256、m/z 256、m/z 271。代谢产物M-5在正离子模式质谱信号为m/z 193。经过与对照品比对保留时间、DAD吸收光谱, M-1、M-2、M-3、M-4、M-5和M-6被鉴定为7-葡糖醛酸代谢物、8-葡糖醛酸代谢物、8-硫酸酯代谢物、7-硫酸酯代谢物、8-甲基化代谢物、7-硫酸酯-8-甲基代谢物。瑞香素在NAPDH孵育体系反应60 min后, 既未检测到底物瑞香素的减少, 也未检测到新的代谢产物色谱峰, 提示CYP酶不参与瑞香素代谢。此外, 为考察代谢产物M-6是否能由M-4经COMT代谢生成, 或由M-5经SULT代谢生成, 代谢产物M-4和M-5分别与提供SAM和PAPS的RLS9进行孵育。结果显示, M-4和M-5均可继续代谢为M-6。因此, 瑞香素在大鼠肝脏中代谢轮廓可总结为图 2。

|
Figure 1 Representative HPLC-DAD profile of daphnetin and its metabolites in RLS9 with (a) or without (b) cofactors. M-1: 7-Glucuronide; M-2: 8-Glucuronide; M-3: 8-Sulfate; M-4: 7-Sulfate; M-5: 8-Methylate; M-6: 7-Suflo-8-methylate |
|
Figure 2 Proposed metabolic pathways of daphnetin in rat liver. COMT: Catechol-O-methyltransferase; ST: Sulfotransferase; UGT: UDP-glucuronosyltransferase |
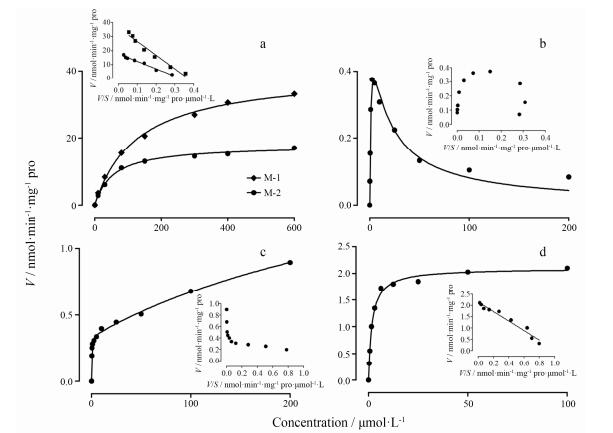
RLS9中, 瑞香素的葡糖醛酸化反应和甲基化反应符合米氏动力学行为, 而8-硫酸酯和7-硫酸酯反应分别符合底物抑制动力学行为和双位点动力学行为(图 3)。所有动力学反应非线性拟合的R2值大于0.99。RLS9中3条代谢通路的清除率(Vmax/Km) 符合以下规律:磺酸化反应(2 213 μL·min-1·mg-1) > 甲基化反应(1 167 μL·min-1·mg-1) > 葡糖醛酸化反应(634 μL·min-1·mg-1)。瑞香素在RLS9中的代谢动力学参数见表 1。
|
Figure 3 Enzyme kinetics of glucuronidation (a), sulfation (b: M-3 formation; c: M-4 formation), and methylation (d) of daphnetin by RLS9. Eadie-Hofstee plots (V/S-V) are displayed as insets |
| Table 1 Kinetic parameters of glucuronidation, sulfation and methylation for daphnetin by RLS9. aData were fit into the Michaelis-Menten model. bData were fit into the substrate inhibition model. cData were fit into the two-site model. n.a.: Not applicable |
通过体外数据向体内放大, 获得瑞香素在大鼠肝脏的体内内在清除率为18 470 mL·min-1·kg-1。基于充分搅拌模型公式, 进一步获得大鼠肝脏清除率(54.9 mL·min-1·kg-1)。最后, 根据瑞香素的大鼠肝脏清除率和大鼠肝脏血流的比值, 计算出瑞香素在大鼠肝脏中摄取率为0.99。
讨论瑞香素在口服给药后大鼠体内药代行为表现为半衰期短(15 min)、生物利用度低(25%)[5]。Shan等[5]使用LC-MS/MS分析了瑞香素给药后大鼠血液、尿液、粪便中代谢产物, 并根据代谢产物质谱信息推测瑞香素主要经过甲基化、葡糖醛酸化、磺酸化代谢清除。但代谢产物结构未得到确认。本研究通过与标准产物比对, 证实瑞香素在大鼠和HLS9中的代谢轮廓相同[8]。
瑞香素C-7和C-8位羟基均能发生葡糖醛酸化和磺酸化反应, 但C-8位羟基是甲基化反应选择性位点。这与作者[8]使用HLS9体系发现的情况一致。据报道, 大鼠和人甲基转移酶(COMT) 催化位点有高达81%的同源性, 两者参与催化的氨基酸序列高度一致[10]。大鼠和人COMT对瑞香素C-8羟基选择性代谢的机制可能相同。
在HLS9中, 瑞香素磺酸化反应符合底物抑制动力学行为。这与报道的大多数磺酸转移酶(ST) 底物催化反应特征一致。但在RLS9中, 瑞香素7-O-磺酸化反应符合双位点动力学行为。该发现表明, RLS9和HLS9中的参与瑞香素7-O-磺酸化反应的ST酶催化机制可能存在差异。该发现对研究大鼠ST酶-配体相互作用具有重要意义。
作者[8]前期研究发现, 甲基化反应是瑞香素在HLS9中清除率最高路径。同时, 8-O-甲基瑞香素被发现具有与瑞香素相近的体外抗炎活性。在本研究中, 磺酸化取代甲基化成为瑞香素在大鼠肝S9中清除率最高的代谢路径。由于8-O-甲基瑞香素具有抗炎活性, 而甲基化代谢通路在大鼠和人中贡献不同, 这可能导致两个种属间数据推导存在问题。但需要指出的是, COMTs、STs、葡糖醛酸转移酶(UGTs) 除在肝脏中表达外, 也在肠道、肾脏中分布[11-13]。因此, 大鼠和人的种属差异程度需要通过体内实验进行确认。
肝脏是药物代谢的主要器官。许多药物的肝脏清除接近体内总清除率。本研究使用体外代谢清除率数据推导出了瑞香素在大鼠肝脏中的清除率(54.9 mL·min-1·kg-1)。该值与瑞香素在大鼠体内实际测定值(58.5 mL·min-1·kg-1) 接近[5]。体外-体内肝脏清除率预测以往多用于考察经细胞色素P450酶等Ⅰ相代谢酶催化的化合物[12]。本研究结果证明该方法对经Ⅱ相代谢酶催化的化合物同样适用。
结论本研究证明磺酸化、甲基化、葡糖醛酸化是瑞香素在大鼠肝脏中的主要代谢路径。虽然瑞香素在大鼠和人肝脏中具有相同的代谢轮廓, 但各代谢通路的贡献可能存在差异。该结果应在瑞香素种间放大研究中加以重视。
| [1] | Gao Q, Shan J, Di L, et al. Therapeutic effects of daphnetin on adjuvant-induced arthritic rats[J]. J Ethnopharmacol, 2008, 120: 259–263. DOI:10.1016/j.jep.2008.08.031 |
| [2] | Yang EB, Zhao YN, Zhang K, et al. Daphnetin, one of coumarin derivatives, is a protein kinase inhibitor[J]. Biochem Biophys Res Commun, 1999, 260: 682–685. DOI:10.1006/bbrc.1999.0958 |
| [3] | Lin JH, Lu AY. Role of pharmacokinetics and metabolism in drug discovery and development[J]. Pharmacol Rev, 1997, 49: 403–409. |
| [4] | Qu SY, Wu YJ, Wang YH, et al. Metabolism and pharmacokinetics of daphnetin[J]. Acta Pharm Sin (药学学报), 1983, 18: 496–500. |
| [5] | Shan JJ. Studies on Oral Absorption and Metabolism of the Main Active Constituents of Zushima (祖师麻主要活性成分的口服吸收及代谢研究)[D]. Nanjing:Nanjing University of Chinese Medicine, 2009. |
| [6] | Yao R, Fu Y, Li S, et al. Regulatory effect of daphnetin, a coumarin extracted from Daphne odora, on the balance of Treg and Th17 in collagen-induced arthritis[J]. Eur J Pharmacol, 2011, 670: 286–294. DOI:10.1016/j.ejphar.2011.08.019 |
| [7] | Behera D, Damre A, Varghese A, et al. in vitro evaluation of hepatic and extra-hepatic metabolism of coumarins using rat subcellular fractions:correlation of in vitro clearance with in vivo data[J]. Drug Metabol Drug Interact, 2008, 23: 329–350. |
| [8] | Liang SC, Xia YL, Hou J, et al. Methylation, glucuronidation, and sulfonation of daphnetin in human hepatic preparations in vitro:metabolic profiling, pathway comparison, and bioactivity analysis[J]. J Pharm Sci, 2016, 105: 808–816. DOI:10.1016/j.xphs.2015.10.010 |
| [9] | Liang SC, Ge GB, Liu HX, et al. Identification and characterization of human UDP-glucuronosyltransferases responsible for the in vitro glucuronidation of daphnetin[J]. Drug Metab Dispos, 2010, 38: 973–980. DOI:10.1124/dmd.109.030734 |
| [10] | Männistö PT, Kaakkola S. Catechol-O-methyltransferase (COMT):biochemistry, molecular biology, pharmacology, and clinical efficacy of the new selective COMT inhibitors[J]. Pharmacol Rev, 1999, 51: 593–628. |
| [11] | Riches Z, Stanley EL, Bloomer JC, et al. Quantitative evaluation of the expression and activity of five major sulfotransferases (SULTs) in human tissues:the SULT "pie"[J]. Drug Metab Dispos, 2009, 37: 2255–2261. DOI:10.1124/dmd.109.028399 |
| [12] | Tukey RH, Strassburg CP. Human UDP-lucuronosyltransferases:metabolism, expression, and disease[J]. Annu Rev Pharmacol Toxicol, 2000, 40: 581–616. DOI:10.1146/annurev.pharmtox.40.1.581 |
| [13] | Obach RS, Baxter JG, Liston TE, et al. The prediction of human pharmacokinetic parameters from preclinical and in vitro metabolism data[J]. J Pharmacol Exp Ther, 1997, 283: 46–58. |
 2017, Vol. 52
2017, Vol. 52


