2. 山西大学 化工学院, 山西 太原 030006;
3. 山西中医学院中药学院, 山西 太原 030619;
4. 山西大学大型科学仪器中心, 山西 太原 030006
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. College of Chinese Materia Medicine, Shanxi University of Traditional Chinese Medicine, Taiyuan 030619, China;
4. Scientific Instrument Center, Shanxi University, Taiyuan 030006, China
酸枣仁为鼠李科枣属植物酸枣(Ziziphus jujuba Mill. var. spinosa(Bunge) Hu ex H.F.Chou) 的干燥成熟种子, 味甘、性平、有养心补肝、宁心安神、敛汗、生津之功效。现代药理研究表明, 酸枣仁具有镇静催眠、抗心律失常、抗氧化、免疫增强等作用。酸枣仁用于治疗失眠已有悠久的历史[1]。在治疗失眠的中药制剂中, 使用频率高达67.3%, 远超其他常用安神类中药[2]。
目前从酸枣仁中分离鉴定出的化合物约有百余种, 按结构分类以达玛烷型四环三萜皂苷、五环三萜、黄酮碳苷、生物碱和脂肪油为主, 其本底化学成分基本清晰。但现有酸枣仁效应物质研究多局限于个别或孤立几个成分的跟踪研究。亦或是研究酸枣仁乙醇提取物、总黄酮提取物及单体化合物灌胃给予大鼠后血浆、尿液和粪便中化学成分[3-8]。以上工作初步阐明了酸枣仁催眠作用的部分效应物质。然而这种追踪酸枣仁中一种或几种效应物质的研究模式, 难以从整体上揭示其效应物质的全貌, 缺乏对其体内药效物质与体内处置特征的整体认识。沟通体外化学成分群与体内化学成分群的关系, 是从整体上把握中药效应物质的关键。
酸枣仁临床用于治疗失眠以口服水煎液为主要给药形式, 其体内(吸收、分布、代谢、排泄, 即ADME) 过程是其发挥药理作用、产生疗效的基础。由于血浆中药物及其代谢产物的含量较少且处于动态变化中, 在收集过程中可能会造成某些成分的丢失。而通常尿液中的代谢产物与血浆中的基本一致, 且易富集。如果能在尿液中检测到这些产物, 证明其能够被吸收, 可逆向鉴定被吸收的化学成分[9]。本文以UHPLC Q Exactive HR-MS为技术手段, 全面分析酸枣仁水提取物化学成分及体内成分, 并对体内成分镇静催眠作用相关文献进行挖掘, 初步遴选潜在效应物质。为后期效应物质的进一步确证提供实验依据; 为多组分协同作用及药动学研究提供实验基础。
材料与方法仪器 Thermo fisher U3000超高效液相色谱仪, 配置在线脱气机、四元梯度泵、柱温箱、自动进样器(美国Thermo Fisher Scientific公司), Thermo Scien tificTM Q ExactiveTM组合型四极杆Orbitrap质谱仪(Germany); Xcailibar软件; 十万分之一天平(德国赛得利斯集团)。SPE C18固相萃取小柱(江苏, 汉邦)。
药品与试剂 酸枣仁皂苷A (批号: A0274)、酸枣仁皂苷B (批号: A0275)、斯皮诺素(批号: 131217), 均购自中国食品药品检定研究院。当药黄素(批号: 140516)、6ʹʹʹ-阿魏酰斯皮诺素(批号: 140215)、白桦脂酸(批号: 150913), 纯度≥98%, 均购买于四川省维克奇生物科技有限公司。酸枣仁药材购自山西振东道地药材有限责任公司, 经山西中医学院中药鉴定教研室裴香萍副教授鉴定为鼠李科植物酸枣[Ziziphus jujuba Mill. var. spinosa(Bunge) Hu ex H.F.Chou]的干燥成熟种子。乙腈(色谱纯, 迪马科技有限公司); 水为娃哈哈纯净水, 其余试剂均为分析纯。
动物 SPF级雄性Sprague-Dawley (SD) 大鼠, 体重(180~200 g), 由北京维通利华实验动物技术有限公司提供, 合格证号: SCXK (京) 2014-0001。
色谱条件 色谱柱: Agilent Poroshell 120 mm (3.0 mm × 100 mm, 2.7 µm); 流动相:乙腈(A), 0.1%甲酸水溶液(B)。梯度洗脱: 0~10 min, 2%~17% A; 10~12 min, 17% A; 12~14 min, 17%~19% A; 14~25 min, 19%~33% A; 25~30 min, 33%~100% A; 30~35 min, 100% A; 流速: 0.3 mL·min-1; 柱温: 25 ℃; DAD检测器扫描范围为190~400 nm, 检测波长为210、254和335 nm; 进样量3 µL。
质谱条件 离子源:电喷雾离子源(ESI); 扫描方式:正负离子同时扫描; 喷雾电压: 3.5 kV; 鞘气流速为35 psi (1 psi ≈ 6.9 kPa); 辅助气流速为10 psi; 毛细管温度: 320 ℃; 探头加温器温度: 300 ℃; 最大喷雾电流: 100 A; S-Lens分辨率: 55;扫描范围: m/z 100~1 500;质量分辨率: 70 000。
对照品溶液的制备 取对照品适量, 精密称定, 分别加甲醇制备成1 220 µg·mL-1斯皮诺素、1 240 µg·mL-1酸枣仁皂苷A、1 260 µg·mL-1酸枣仁皂苷B、1 130 µg·mL-1当药黄素、1 260 µg·mL-1 6ʹʹʹ-阿魏酰斯皮诺素和1 270 µg·mL-1白桦脂酸的对照品储备液, 各取适量, 制成混合对照品溶液。
供试品溶液的制备 取酸枣仁药材粉碎, 称取500 g, 加8倍量水, 加热回流提取1 h, 滤过, 残渣加8倍量水, 回流提取1 h, 滤过, 合并两次滤液, 浓缩, 60 ℃水浴蒸干得浸膏(得率为28.12%)。
SPE小柱活化及上样:甲醇活化固相萃取小柱, 蒸馏水洗脱至无醇味。称取酸枣仁水提物1 g (相当于生药3.6 g) 于锥形瓶中, 加水20 mL, 超声溶解, 于活化后的固相萃取小柱上样, 先用蒸馏水20 mL洗脱, 然后用甲醇20 mL洗脱, 收集甲醇洗脱液, 浓缩至干, 加甲醇定容至5 mL。
给药与样本采集 取实验环境下适应一周后的SD大鼠12只, 随机选6只作为酸枣仁水提物组, 按30 g·kg-1生药量给大鼠灌胃(15 mL·kg-1), 连续给药4天; 另取6只作为空白组, 给予等剂量的生理盐水。末次给药前禁食12 h, 自由饮水, 于代谢笼中收集给药后6、12和24 h的尿液, 离心15 min (5 000 r·min-1), 取上清液, -80 ℃冷冻备用。
大鼠尿液样品的预处理 取1.8 mL尿液上样于活化后的SPE C18固相萃取小柱。水15 mL洗脱除杂, 70%甲醇15 mL洗脱, 收集70%甲醇洗脱液, =浓缩至干, 加甲醇定容至5 mL, 取上清液1 µL, 供UHPLC分析。
结果 1 酸枣仁水提取物化学成分鉴定采用Q Exactive Orbitrap-HRMS鉴别酸枣仁水提取物中的化学成分。首先对已知对照品化合物的保留时间、紫外吸收光谱图和质谱图进行分析; 对于未知化合物, 通过质谱与光谱数据, 并参考文献, 推断结构。在此条件下, 共鉴定了25个化合物, 其中12个黄酮、8个三萜皂苷、2个脂肪酸和3个生物碱(图 1, 表 1)。

|
Figure 1 The base peak ion (BPI) chromatograms of extract from Semen Ziziphi Spinosae (SZR). A: UHPLC chromatogram (335 nm); B: Positive scan; C: Negative scan. The peaks from 1 to 25 are corresponding to Table 1 |
| Table 1 Identification of chemical constituents and metabolites by UHPLC Q Exatractive HR-MS. *Compared with reference substance. M: metabolites |
酸枣仁中含有丰富的三萜皂苷化合物, 分别为四环三萜类达玛烷型和五环三萜羽扇豆烷型。这些化合物紫外吸收较弱, 为末端吸收。首先将对照品酸枣仁皂苷A和B的裂解行为进行解析。在负离子模式下, 酸枣仁皂苷A产生m/z 1 251 [M-H+HCOO]-峰和1 205 [M-H]-准分子离子峰, 依次脱掉木糖(Xyl)、葡萄糖(Glu)、鼠李糖(Rha) 和阿拉伯糖(Ara), 分别产生碎片离子m/z 1 073、911、749、603和苷元离子m/z 471 [M-H-Xyl-Rha-Ara-2glu]-。酸枣仁皂苷B产生m/z 1 089 [M-H+HCOO]-峰和1 043 [M-H]-准分子离子峰, 依次脱掉Xyl、Glu、Rha和Ara, 分别产生碎片离子m/z 911、749、603和苷元离子471 [M-H-Xyl-Rha-Ara-Glu]-。
在负离子模式下, 化合物20产生m/z 1 281 [M-H+HCOO]-峰和1 235 [M-H]-准分子离子峰, 依次脱去3个Glu和1个Rha, 产生m/z 1 073、911、749和603碎片离子。参考文献[10], 推测为酸枣仁皂苷C。化合物17产生m/z 1 269 [M-H+HCOO]-峰和1 223 [M-H]-分子离子峰, 并产生碎片m/z 1 091 [M-H-Xyl]-, 929 [M-H-Xyl-Glu]-, 767 [M-H-Xyl-2Glu]-, 621 [M-H-Xyl-2Glu-Rha]-或[M-H-Xyl-2Glu-Fuc]-。参考文献[10], 推测其为原酸枣仁皂苷B或者B1。另推测化合物16和18分别为酸枣仁皂苷G和H[10]。由此可见, 这类化合物均产生较强的[M-H+HCOO]-峰。
白桦脂酸是酸枣仁中代表性的五环三萜皂苷类化合物。在负离子模式下, 给出m/z 455 [M-H]-的准分子离子峰。同时推测化合物22为美洲茶酸[11]。
1.2 黄酮类黄酮类化合物是酸枣仁中含量较高的一类化合物。首先对斯皮诺素、当药黄素和6ʹʹʹ-阿魏酰斯皮诺素对照品进行分析, 在270 nm (带Ⅱ) 和335 nm (带Ⅰ) 有较强的紫外吸收。在正离子模式下, 斯皮诺素产生m/z 609 [M+H]+分子离子峰, 脱掉1个Glu产生m/z 447, 该碎片丢失一分子Glu生成m/z 285;丢失C4H8O4(120 Da) 产生主要特征碎片m/z 327;丢失一分子H2O生成碎片离子m/z 429。m/z 429丢失中性碎片C2H6O3、CH4O2、H2O、2H2O和C5H8O4, 分别产生一系列的碎片离子m/z 351、381、411、393和297。当药黄素产生m/z 447 [M+H]+准分子离子峰、碎片峰m/z 429 [M+H-H2O]+, 并产生同斯皮诺素相同的一系列碎片m/z 351、411、393、381和297。6ʹʹʹ-阿魏酰斯皮诺素产生m/z 785 [M+H]+的准分子离子峰, 脱掉C4H8O4而产生碎片离子m/z 665;脱掉阿魏酰基产生碎片离子m/z 609, 并依次产生碎片离子m/z 447、429、393、351、327、297和285。以上结果表明, 黄酮碳糖(C糖) 的裂解途径主要发生在糖链部分[12]。
在正离子模式下, 化合物10、12和13都产生m/z 429、381、351、327、297的碎片离子, 显示出与斯皮诺素类似的质谱行为和紫外光谱吸收(表 1)。参考文献[13], 推断其分别为6ʹʹʹ-对羟基苯甲酰斯皮诺素、6ʹʹʹ-芥子酰斯皮诺素和6ʹʹʹ-对香豆酰基斯皮诺素。化合物6产生m/z 433分子离子峰, 并依次产生碎片离子m/z 415 [M+H-H2O]+、397 [M+H-2H2O]+、367 [M+H-2H2O-CH2O]+、337 [M+H-2H2O-2CH2O]+、313 [M+H-H2O-C4H6O3]+和283 [M+H-H2O-C4H6O3-CH2O]+, 以上碎片为黄酮C糖的特征碎片, 推断其为异牡芹素[13]。在正离子模式下, 化合物2、4和9均产生m/z 595[M+H]+分子离子峰。其中化合物2产生m/z 433 [M+H-Glu]+和313 [M+H-Glu-120Da]+碎片峰, 推断为文赛宁-2[13]; 化合物4产生碎片m/z 433 [M+H-Glu]+, 并依次产生m/z 415、397、379、337、313和283碎片, 推测为异牡芹素-2ʹʹ-O-β-D-葡萄糖[13]; 而化合物9产生m/z 449 [M+H-Rha]+和287 [M+H-Rha-Glu]+碎片, 推断为山柰酚-3-O-芸香糖[11]。在正离子模式下, 化合物11产生m/z 771的分子离子峰, 丢失碎片C11H10O4, 产生m/z 433, 并依次碎裂为m/z 415 [M+H-C11H10O4-H2O]+、379 [M+H-C11H10O4-3H2O]+和337 [M+H-C11H10O4-2H2O-C2H4O2]+, 推断其为nervilifordin J[14]。另外, 尝试推断化合物15为7-O-(6ʹʹʹ-O-阿魏酰葡萄糖)-异金雀黄花素或4-O-(6ʹʹʹ-O-阿魏酰葡萄糖)-当药黄素[13]。
1.3 生物碱类化合物由于缺乏对照品, 根据紫外光谱图和质谱信息, 并参考文献, 推断了化合物1、3和7。在正离子模式下, 化合物1产生m/z 286 [M+H]+分子离子峰, 依次产生碎片m/z 270 [M-CH3]+、237 [M-CH3O-H2O]+和219 [M-CH3O-2H2O]+, 推断其为乌药碱[14]。化合物3产生m/z 342 [M+H]+分子离子峰, 并产生碎片离子m/z 297 [M-3CH3]+、m/z 282 [M-4CH3]+和m/z 265 [M-3CH3-CH3O]+, 推测其为酸李碱[14]。化合物7产生m/z 268 [M+H]+的准分子离子峰, 二级碎片分别为m/z 252 [M-CH3]+和218 [M-CH3O-H2O]+, 推断其为山矾碱[15]。
1.4 脂肪酸类结合质谱数据, 化合物24和25分别推断为棕榈酸和油酸[16]。
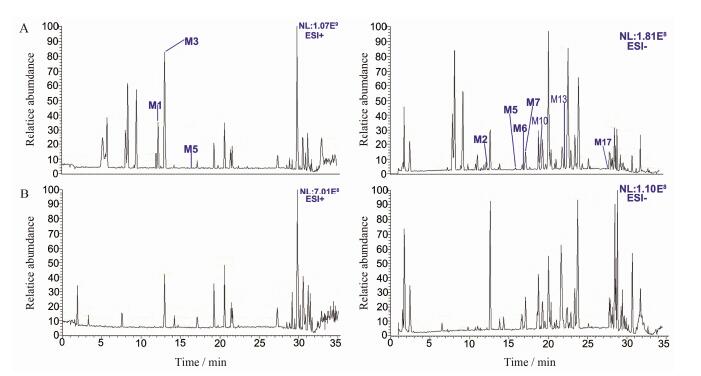
2 酸枣仁口服给予大鼠后尿液中代谢产物的鉴定上述结果表明酸枣仁水提物中化学成分复杂, 采用已建立的液质联用分析方法, 进一步将其生物体内的复杂动态物质组与体外物质组进行关联分析研究。结合酸枣仁水提物中化学成分的质谱裂解规律, 鉴定尿液中的原形成分, 并推断和解释代谢物。通过比较给药后尿液和空白尿液色谱图, 扣除内源性成分, 并采用提取离子流(EIC) 方法, 以5 ppm为准, 在正常大鼠给药后6、12和24 h的尿液中共检测到20个代谢物(表 1, 图 2)。
|
Figure 2 The BPI chromatographs of urine samples. A: Urine after oral admistration of SZR; B: Blank urine. M1-3, M5-7, M10, M13 and M17 are corresponding to Table 1 |
尿液中16个原形化合物包括2个生物碱、8个黄酮和6个三萜皂苷。其中文赛宁、异牡芹素-2ʹʹ-O-β-D-葡萄糖、斯皮诺素和当药黄素在3个时间点均被检测到。6ʹʹʹ-对羟基苯甲酰斯皮诺素、6ʹʹʹ-对香豆酰斯皮诺素和6ʹʹʹ-阿魏酰斯皮诺素在6和24 h被检测到, 推断三者可能发生了肝胆循环。而山柰酚-3-O-芸香糖苷仅在6 h尿液中被检测到, 说明氧糖苷容易发生水解反应被代谢。在3个时间点均检测到乌药碱和酸李碱。
另外, 采用EIC法, 共检测到6个三萜皂苷, 分别为酸枣仁皂苷A、B、C、G、H和原酸枣仁皂苷B或B1。其中酸枣仁皂苷H、原酸枣仁皂苷B或B1仅存在于6 h尿液中。
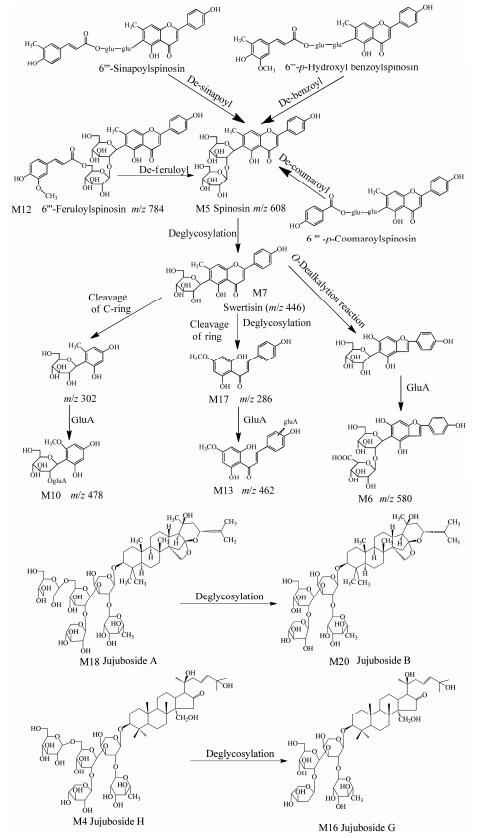
2.2 相关代谢产物的鉴定本文尝试推断了4个新的代谢产物, 分别为M6、M10、M13和M17。详细的代谢途径见图 3。在负离子模式下, M6产生m/z 579 [M-H]-分子离子峰及碎片离子m/z 403 [M-H-glucuronic acid (gluA)]-和385 [M-H-gluA-H2O]-, 推断为代谢产物swertisin-furane-glycoside-gluA[17]。M10产生m/z 477 [M-H]-分子离子峰及碎片离子m/z 301 [M-H-gluA]-, 推断其为phenolic-glycoside-gluA。其代谢途径可能是当药黄素在肠道菌群的作用下发生了环裂解反应, 进而在肝脏发生了Ⅱ相结合反应[18]。M13产生m/z 461 [M-H]-分子离子峰及碎片离子m/z 285 [M-H-gluA]-和267 [M-H-gluA-H2O]-, 推断为代谢物methylapigenin-gluA。其代谢途径可能是当药黄素在肠道菌群的作用下发生脱糖和环裂解反应。M17产生m/z 285 [M-H]-的分子离子峰和碎片离子m/z 267 [M-H-H2O]-, 推断为代谢物methylapigenin。综上, 黄酮类化合物在体内的代谢反应主要为肠道水解反应和环裂解反应, 并在肝脏发生Ⅰ相氧化反应、脱烷烃及Ⅱ相葡糖醛酸结合反应。
|
Figure 3 Structural skeleton of flavonoids and triterpenoids and their potential metabolic pathways |
在以往的酸枣仁化学成分定性分析研究中, 多针对酸枣仁醇提物、总黄酮和总皂苷, 未见水提取物中化学成分的研究报道。然而, 酸枣仁日常保健和临床用药, 多为水煎液。因此以酸枣仁水提取物中化学成分为研究对象更贴近中医临床应用。
以口服给予酸枣仁水提物后大鼠尿液为研究对象, 将体内复杂动态物质组与体外物质组进行关联分析。黄酮类化合物及代谢产物是大鼠口服酸枣仁水提物后尿液中的一类重要成分。以斯皮诺素为母核的系列化合物, 6ʹʹʹ-阿魏酰斯皮诺素、6ʹʹʹ-对羟基苯甲酰斯皮诺素、6ʹʹʹ-芥子酰斯皮诺素和6ʹʹʹ-对香豆酰斯皮诺素在体内发生了脱阿魏酰基、对羟基苯甲酰基、芥子酰基和香豆酰基反应, 生成斯皮诺素, 并在肠道菌的作用下发生脱糖反应生成当药黄素(图 3)。研究表明, 斯皮诺素能够协同戊巴比妥钠小鼠睡眠, 缩短睡眠潜伏期, 延长睡眠时间, 其作用机制与突出后5-HT1A受体相关[19]。当药黄素也具有镇静催眠作用[20]。因此, 斯皮诺素和当药黄素应为酸枣仁发挥镇静催眠作用的潜在效应物质。
以酸枣仁皂苷A和B为代表的四环三萜皂苷在体内的代谢反应主要为肠道糖苷键水解反应。谢军波课题组[21, 22]对酸枣仁皂苷A的体外肠道菌代谢研究表明, 其可以在4~6 h内迅速脱掉一个Glu后代谢成酸枣仁皂苷B。与之类似, 本实验中酸枣仁皂苷H仅在6 h尿液中被检测到。而化学结构与酸枣仁皂苷H相差一个Glu的酸枣仁皂苷G在3个时间点内均被检测到, 可能是酸枣仁皂苷H在肠道内脱糖基后生成了酸枣仁皂苷G。而本实验中酸枣仁皂苷A和B在3个时间点均被检测到。由此可见, 酸枣仁皂苷类化合物在肠道内的水解是不完全的, 其原形及其代谢产物均可进入体循环发挥其生物学作用, 并可经尿液排泄。文献[23]报道, 含酸枣仁皂苷A 4.3%和B 5.0%为主的总皂苷具有镇静催眠作用, 酸枣仁皂苷A和B应该是其发挥镇静催眠作用的潜在效应物质。另外, 在尿液中推断出了两个原形化合物乌药碱和酸李碱, 分别属于苄基异喹啉类和阿朴菲类。研究表明[24, 25]酸枣仁环肽类生物碱具有镇静催眠作用, 而乌药碱和酸李碱不具有镇静催眠活性, 且对环肽类生物碱镇静催眠作用不具有协同效应。
综上, 本文以体内、体外相结合为前提, 以化学成分转移和转变为基础, 以明确酸枣仁体内潜在效应物质为目的, 采用UHPLC Q Exactive轨道离子阱高分辨质谱首先表征了酸枣仁水提取物中丰富的化学成分; 其次, 通过体内-体外物质组关联分析了体内化学成分; 并进行体内成分镇静催眠作用文献挖掘, 初步遴选斯皮诺素、当药黄素、酸枣仁皂苷A和B为其发挥镇静催眠作用的潜在效应物质。本研究仅揭示了酸枣仁水提物在体内复杂代谢过程的冰山一角, 尿液中检测的其他原形成分和代谢产物是否也具有镇静催眠作用?酸枣仁水提物中三萜皂苷、黄酮和生物碱类在体内是如何整体协调吸收, 进而发挥作用的?这些问题尚待深入研究。
| [1] | Zhang ZJ. Jin Kui Yao Lue (金匮要略)[M]. Beijing: China Braille Press, 2013. |
| [2] | Zhu HX, Hu XJ. Study of modern using medicine regulation in the treatment of insomnia with TCM[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2008, 26: 775–776. |
| [3] | Cao JX, Zhang QY, Cui SY, et al. Hypnotic effect of jujubosides from Semen Ziziphi Spinosae[J]. J Ethnopharmacol, 2010, 130: 163–166. DOI:10.1016/j.jep.2010.03.023 |
| [4] | Chen J, Maiwulanjiang M, Lam KYC, et al. A standardized extract of the fruit of Ziziphus jujuba (jujube) induces neuronal differentiation of cultured PC12 cells:a signaling mediated by protein kinase A[J]. J Agric Food Chem, 2014, 62: 1890–1897. DOI:10.1021/jf405093f |
| [5] | Guo SM, Fan XW, He JW. Hypnotic effect of flavnoids from Semen Ziziphi Spinosae[J]. J Chin Med Mater (中药材), 1998, 21: 578–579. |
| [6] | Jiang JG, Huang XJ, Chen J, et al. Comparison of the sedative and hypnotic effects of flavonoids, saponins, and polysaccharides extracted from Semen Ziziphus jujube[J]. Nat Prod Res, 2007, 21: 310–320. DOI:10.1080/14786410701192827 |
| [7] | Ma Y, Han H, Nam SY, et al. Cyclopeptide alkaloid fraction from Zizyphi Spinosi Semen enhances pentobarbital-induced sleeping behaviors[J]. J Ethnopharmacol, 2008, 117: 318–324. DOI:10.1016/j.jep.2008.02.006 |
| [8] | Qiao W. Study on the Sedative and Hypnosis Active Component from Zizyphus vulgaris var Spinosus (酸枣仁镇静催眠有效成分的研究)[D]. Tianjin:Tianjin Medical University, 2002. |
| [9] | Chen L X, Yang LG, Xia GY, et al. Traditional Chinese medicine preparation method of the chemical constituents of the body metabolites[J]. Int J Pharm Res (国际药学研究杂志), 2013, 40: 711–719. |
| [10] | Ma JJ, Kang LP, Zhou WB, et al. Identification and characterization of saponins in extract of Ziziphi spinosae Semen (ZSS) by ultra-performance liquid chromatographyelectrospray ionization-quadrupole time-of-flight tandem mass spectrometry (UPLC-ESI-QTOF-MSE)[J]. J Med Plants Res, 2011, 5: 6152–6159. |
| [11] | Yang B, Yang HS, Chen F, et al. Phytochemical analyses of Ziziphus jujuba Mill. var. spinosa seed by ultrahigh performance liquid chromatography-tandem mass spectrometry and gas chromatography-mass spectrometry[J]. Analyst, 2013, 138: 6881–6888. DOI:10.1039/c3an01478a |
| [12] | Ren Y, Wang PY, Wu CS, et al. Identification of the metabolites after oral administration of extract of Ziziphi Spinosae Semen to rats or dogs by high-performance liquid chromatography/linear ion trap FTICR hybrid mass spectrometry[J]. Biomed Chromatogr, 2013, 27: 17–26. DOI:10.1002/bmc.v27.1 |
| [13] | Niu CY, Wu CS, Sheng YX, et al. Identification and characterization of flavonoids from Semen Zizyphi Spinosae by highperformance liquid chromatography/linear ion trap FTICR hybrid mass spectrometry[J]. J Asian Nat Prod Res, 2010, 12: 300–312. DOI:10.1080/10286021003752284 |
| [14] | Sun S, Liu H, Xu S, et al. Quality analysis of commercial samples of Ziziphi spinosae semen (suanzaoren) by means of chromatographic fingerprinting assisted by principal component analysis[J]. J Pharm Anal, 2014, 4: 217–222. DOI:10.1016/j.jpha.2014.01.003 |
| [15] | Man KP, Park JH, Shin YG, et al. Analysis of alkaloids in the seeds of Zizyphus jujuba, by high performance liquid chromatography[J]. Arch Pharm Res, 1991, 14: 99–102. DOI:10.1007/BF02892010 |
| [16] | Guo S, Duan JA, Tang YP, et al. UHPLC-TOFMS coupled with chemometric method as a powerful technique for rapid exploring of differentiating components between two Ziziphus species[J]. J Sep Sci, 2011, 34: 659–666. DOI:10.1002/jssc.v34.6 |
| [17] | Bao KD, Li P, Qi LW, et al. Characterization of flavonoid metabolites in rat plasma, urine, and feces after oral administration of Semen Zizyphi Spinosae extract by HPLC-diodearray detection (DAD) and ion-trap mass spectrometry (MSn)[J]. Chem Pharm Bull, 2009, 57: 144–148. DOI:10.1248/cpb.57.144 |
| [18] | Liu B. The Study and Analysis on the in vivo Metabolism of the Components in Traditional Chinese Medicine (中药成分体内代谢与分析研究)[M]. Beijing: China Press of Traditional Chinese Medicine, 2011. |
| [19] | Wang LE, Cui XY, Cui SY, et al. Potentiating effect of spinosin, a C-glycoside flavonoid of Semen Ziziphi spinosae, on pentobarbital-induced sleep may be related to postsynaptic 5-HT1A receptors[J]. Phytomedicine, 2010, 17: 404–409. DOI:10.1016/j.phymed.2010.01.014 |
| [20] | Cheng G, Bai YJ, Zhao YY, et al. Flavonoids from Ziziphus jujuba Mill var. spinosa[J]. Tetrahedron, 2000, 56: 8915–8920. DOI:10.1016/S0040-4020(00)00842-5 |
| [21] | Zhang Y, Xie JB, Zhang YQ, et al. Degradation kinetics of jujuboside A by rat intestinal flora and identification of the metabolites by HPLC-MS/MS[J]. Int J Food Prop, 2014, 17: 1841–1849. DOI:10.1080/10942912.2012.749410 |
| [22] | Zhang YQ, Zhang Y, Zhang KS, et al. Degradation kinetics of jujuboside B by rat intestinal flora in vitro with an RRLCMS-MS method[J]. J Chromatogr Sci, 2014, 52: 691–696. DOI:10.1093/chromsci/bmt100 |
| [23] | Cao JX, Zhang QY, Cui SY, et al. Hypnotic effect of jujubosides from Semen Ziziphi Spinosae[J]. J Ethnopharmacol, 2010, 130: 163–166. DOI:10.1016/j.jep.2010.03.023 |
| [24] | Li L, Liu GY, Liu JS, et al. Optimized compatibility of sedative-hypnotic components in Ziziphi Spinosae Semen by uniform design[J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 1374–1377. |
| [25] | Han BH, Park MH. Alkaloids are the sedative principles of the seeds of Zizyphus vulgaris var. spinosus[J]. Arch Pharm Res, 1987, 10: 203–207. DOI:10.1007/BF02857740 |
 2017, Vol. 52
2017, Vol. 52


