2. 江苏省食品药品监督检验研究院, 江苏 南京 210008
2. Jiangsu Institute for Food and Drug Control, Nanjing 210008, China
抑郁症是一种常见的精神疾病, 约有30%的抑郁症患者使用抗抑郁化学药物治疗无效或疗效不佳[1], CYP450酶活性的个体差异是导致药物治疗失败的重要因素[2]。因此研究抑郁状态下CYP450酶活性变化, 对于探索抑郁症的发病机制及临床合理用药有重要价值。
研究表明, 抑郁症和肾阳虚模型动物体内CYP450酶的活性或蛋白表达异常。通过慢性不可预见性温和刺激(CUMS)诱导抑郁模型可引起机体CYP450酶活性及蛋白表达上调或下调[3-5], 如小鼠抑郁模型CYP2A4表达下调, SD抑郁大鼠CYP450酶活性增加, GK抑郁大鼠CYP3A4和CYP2D6活性增加, CYP1A2活性降低。贯叶连翘治疗抑郁症的机制可能是其中某些成分通过抑制人CYP450酶活性, 尤其是CYP1A2、CYP2C9、CYP2C19、CYP2D6及CYP3A4, 达到抗抑郁效果[6]。辛热药仙茅治疗肾阳虚的作用机制可能涉及纠正异常的CYP3A4酶活性和蛋白表达[7]。
糖皮质激素诱导的动物模型在行为学和代谢组学方面均成功地模拟了肾阳虚抑郁症的生理状态[8-10], 尚未见肾阳虚抑郁症CYP450酶活性变化的报道。本实验采用“cocktail”法探究氢化可的松诱导的大鼠肾阳虚抑郁状态下CYP450酶活性变化, 并结合前期实验结果[11], 比较不同抑郁症模型动物CYP450酶活性变化的异同, 为临床分型论治抑郁症合理用药提供理论指导和实验依据。
材料与方法药品和试剂 注射用氢化可的松琥珀酸钠粉针剂(021509017, 天津生物化学制药有限公司), 奥美拉唑肠溶胶囊(2015112, 常州四药), 咪达唑仑注射液(20151104, 江苏恩华药业股份有限公司), 甲苯磺丁脲(tolbutamide, 017K1025), 氯唑沙宗(chlorzoxazone, 017K1385), 茶碱(theophylline, T1633)和右美沙芬(dextromethorphan, 097K11348), 均购自Sigma公司; 咪达唑仑(midazolam, 171250-200401), 奥美拉唑(omeprazole, 100367-201104), 内标吡罗昔康(piroxicam, 100336-200402), 内标替硝唑(tinisazole, 100336-200402), 均购自中国食品药品检定研究院。
仪器 Waters Quattro Micro液质联用仪, Mass lynx4.1色谱工作站, Labconco梅特勒-托利多AE240型电子天平, Biofuge PrinmoR型冷冻高速离心机, Labconco离心浓缩仪, 游泳缸, 自制敞箱和-20 ℃海尔冰箱。
给药方法 雄性SD大鼠16只, 体重(150±20) g, 由南通大学提供, 合格证号: (苏) 2014-0001SPF级。采用体重区间分组法, 将大鼠分为空白组(8只)和模型组(8只), 4只/笼饲养, 正常饮食、饮水。适养1周后, 开始实验。模型组大鼠每天臀部肌肉注射氢化可的松25 mg·kg-1 [12], 对照组大鼠给予等体积的生理盐水, 连续21天并确认造模成功后, 两组大鼠均灌胃给予混合探针药物10 mL·kg-1, 于5、10、20、40 min和1、1.5、2、2.5、3、5、8、12和24 h从眼底静脉丛采血约250 μL, 置于肝素钠浸泡过的EP管中。全血4 000 r·min-1离心10 min后, 吸取上层血浆于-20 ℃保存待用。整个实验过程尽量避光。
体重变化 分别于造模前、造模21天后测定其体重。
糖水偏好[12] 实验前一天, 将大鼠单笼适应24 h。d1:给予每只大鼠两瓶1%蔗糖水; d2:给予每只大鼠一瓶1%蔗糖水, 一瓶纯净水; d3:所有大鼠均禁食禁水23 h; d4:给予每只大鼠事先定量的2瓶水:一瓶1%蔗糖水, 一瓶纯净水, 1 h后交换两瓶位置, 计算大鼠在2 h内的糖水消耗量, 糖水偏好(%)=糖水消耗量/ (糖水消耗量+纯净水消耗量) × 100。
旷敞实验[12] 将大鼠放入高40 cm, 长、宽均为80 cm, 内壁涂黑, 底面平均分为25个16 cm × 16 cm的小方格的箱内底面中心, 同时进行摄像和计时, 以5 min内大鼠穿越箱底面的方格数为水平得分(三爪以上跨入), 穿越一格得1分; 以双前肢抬起次数为垂直得分(两前肢离地1 cm以上), 双前肢离地一次得1分。
强迫游泳实验 [12]将大鼠放入直径40 cm、水深35 cm的水桶内, 水温25 ℃, 适应2 min, 累计后4 min内大鼠的不动时间。
混合探针的配制 称取甲苯磺丁脲75 mg、氯唑沙宗100 mg、茶碱100 mg、右美沙芬50 mg, 固体用0.5% CMC-Na研磨混匀后, 全部转移至50 mL棕色量瓶中, 加入咪达唑仑注射液15 mL (含咪达唑仑75 mg), 奥美拉唑肠溶胶囊883 mg (含奥美拉唑75 mg), 生理盐水定容, 临用前配制。
混合对照品系列溶液 精密称取茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑各对照品适量, 分别溶于10 mL棕色量瓶中, 加甲醇定溶, 摇匀, 得各对照品储备液。精密移取各储备液适量, 加甲醇逐级稀释成8个不同浓度的单一系列溶液HB1~8, 将对应标号的6个探针药物等体积混合, 得混合对照品系列溶液, 浓度见表 1。于4 ℃冷藏备用。
| Table 1 Concentration of six probe drugs in mixed standard solutions (μg·mL-1). HB1-8: Eight different concentrations of reference substances |
混合内标溶液配制 精密称取替硝唑和吡罗昔康适量, 分别溶于10 mL量瓶中, 甲醇定容、摇匀, 得各内标储备液。另精密吸取各储备液适量于同一10 mL量瓶中, 甲醇定容、摇匀, 得质量浓度分别为3.213 μg·mL-1替硝唑、42.87 μg·mL-1吡罗昔康的混合内标溶液, 于4 ℃冷藏备用。
血样处理 取血浆100 μL, 加入混合内标10 μL, 涡旋30 s, 加入乙酸乙酯800 μL, 涡旋5 min, 12 000 r·min-1离心5 min, 取上清液700 μL, 40 ℃氮气吹干, 75%乙腈100 μL复溶, 涡旋5 min, 12 000 r·min-1离心5 min, 进样5 μL分析。
液相色谱-串联质谱方法[13]
标准曲线及LLOQ 取空白血浆100 μL, 加入配制好的混合对照品系列溶液10 μL, 混合内标溶液20 μL, 按“血样处理”项方法处理, 分别计算各化合物的峰面积(Ai)与相应内标的峰面积(As)的比值为Y, 以比值Y对各探针药物的浓度X进行线性回归, 得回归方程。
基质效应与提取回收率 取EP管数支, 分别加入10 μL低、中、高3个浓度质控溶液(茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑的质控溶液: 0.038、0.003、0.093、0.003、0.001、0.001 mg·L-1; 0.987、0.332、3.406、0.018、0.022、0.08 mg·L-1; 19.733、6.636、68.11、0.356、0.375、1.6 mg·L-1), 加入混合内标溶液10 μL, 复溶液80 μL, 涡旋3 min, 于12 000 r·min-1离心5 min, 取上清液进样分析, 记录峰面积(A1); 按“血样处理”项方法处理空白血浆数管, 40 ℃氮气吹干后, 同上操作, 记录峰面积(A2)。按标准曲线制备方法制备含药血浆质控样品, 记录峰面积A3。基质效应ME (%)=A2/A1×100%, 提取回收率R%=8/7×A3/A2×100%。
精密度及准确度 考察日内、日间精密度及准确度(3天)。按血浆标准曲线配制方法制备含6种探针药物的含药血浆质控样品, 按“血样处理”项下操作, 根据随行标线求得实测浓度。实测浓度的RSD即为精密度, 加入浓度和实测浓度的比值即为准确度。
稳定性 考察各对照品的甲醇溶液于4 ℃保存2个月以上稳定性; 血浆样品在室温(避光保存)12 h、-20 ℃冷冻保存10天、反复冻融3次稳定性; 血浆样品经预处理后在4 ℃进样器放置24 h稳定性。
统计学分析 实验结果均以x±s表示, 药动学参数采用DAS1.0软件计算, 应用SPSS16.0统计软件进行独立样本t检验, P < 0.05认为差异有统计学意义。
结果 1 模型确认实验前后正常组大鼠生活状态无明显变化; 与正常组相比, 模型组大鼠毛发枯燥, 精神萎靡, 对外来刺激反应迟钝, 喜扎堆, 表现出明显的肾阳虚抑郁状态, 体重显著低于正常组(P < 0.01);行为学测试结果显示, 与正常组相比, 模型组大鼠旷敞实验的自主活动能力显著下降, 水平得分、垂直得分均显著降低(P < 0.01), 糖水偏好程度显著降低(P < 0.01), 强迫游泳的不动时间显著延长(P < 0.01), 提示造模成功(图 1)。
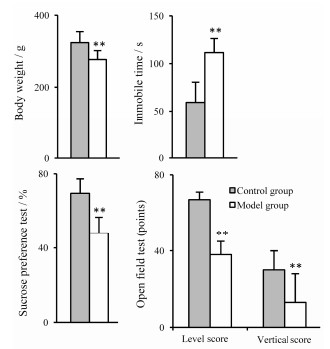
|
Figure 1 Effect of hydrocortisone on behavioral data from behavioral evaluation. n=8, x±s Data shows body weight, level score and vertical score in open field test, percentage of sucrose solution from the total liquid in 2 h in sucrose preference test, immobile time in forced swimming test. **P < 0.01 vs control group |
茶碱、氯唑沙宗、甲苯磺丁脲、咪达唑仑、右美沙芬、奥美拉唑和内标替硝唑、吡罗昔康的保留时间分别为1.99、2.35、2.46、3.33、3.22、2.25、2.08和2.63 min。6种探针药物与2种内标分离良好, 互不干扰, 且血浆中内源性杂质不影响分析物的测定, 基线平稳(图 2)。本方法具有良好的特异性和分离度, 能准确测定血浆中6个探针药物的浓度, 重现性好。

|
Figure 2 Representative MRM chromatograms of each analyte and IS in sample plasma. 1: Midazolam; 2: Omeprazole; 3: Dextromethorphan; 4: Tinisazole (IS); 5: Piroxicam (IS); 6: Tolbutamide; 7: Chlorzoxazone; 8: Theophylline |
6种探针药物的回归方程及LLOQ见表 2。
| Table 2 Standard curves and LLOQ of six probe drugs |
茶碱、氯唑沙宗、甲苯磺丁脲、咪达唑仑、右美沙芬、奥美拉唑和内标替硝唑、吡罗昔康的基质效应分别为99.91%~105.15%、93.31%~98.62%、90.58%~100.90%、91.51%~93.94%、95.75%~102.76%、94.63%~96.43%和92.47%、92.71%;提取回收率分别为89.65%~96.23%、97.31%~103.58%、99.13%~104.05%、91.51%~93.95%、95.75%~102.76%、94.63%~96.43%、88.47%、88.33%。
2.4 精密度及准确度茶碱、氯唑沙宗、甲苯磺丁脲、咪达唑仑、右美沙芬、奥美拉唑的日内精密度RSD分别小于等于4.23%、8.43%、7.42%、9.19%、11.16%、6.72%;日间精密度的RSD分别小于等于4.55%、9.34%、8.04%、8.77%、10.67%、6.23%。准确度均在85%~115%之间, 符合生物样品分析的要求, 提示该方法准确、可靠、重现性好。
2.5 稳定性各对照品的甲醇溶液在4 ℃冰箱保存2个月以上稳定; 血浆样品在室温(避光保存) 12 h、-20 ℃冷冻保存10天、反复冻融3次稳定; 血浆样品经预处理后在4 ℃进样器放置24 h稳定, RSD均小于11.12%。
3 探针药物的药代动力学 3.1 6种探针药物的血药浓度-时间曲线茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑的药时曲线见图 3。
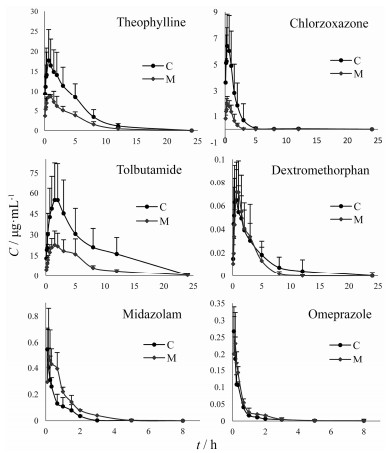
|
Figure 3 C-t curves of six kinds of probe drugs. n=8, x±s |
将正常组及模型组大鼠的药时数据分别经DAS1.0软件处理, 分别按一室、二室、三室模型以最小二乘法拟合, 结果表明:茶碱、甲苯磺丁脲符合一室模型(W=1/CC), 氯唑沙宗、咪达唑仑符合二室模型(W=1/CC), 奥美拉唑、右美沙芬符合二室模型(W=1), 药动学参数见表 3。与正常组相比, 模型组大鼠的主要药动学参数差异如下:茶碱Cmax、AUC0-t、AUC0-∞均极显著降低(P < 0.01), Cmax降低55.68%, AUC0-t降低55.35%;氯唑沙宗Cmax、AUC0-t、AUC0-∞均极显著降低(P < 0.01), Cmax降低67.34%, AUC0-t降低74.40%;甲苯磺丁脲的Cmax、AUC0-t、AUC0-∞均极显著降低(P < 0.01), Cmax降低55.39%, AUC0-t降低65.86%;奥美拉唑的MRT0-t、MRT0-∞显著降低(P < 0.05);右美沙芬、咪达唑仑代谢变化无显著差异。根据美国FDA对抑制剂和诱导剂的评价分类[14], 判断肾阳虚抑郁大鼠CYP2E1、CYP1A2和CYP2C6被诱导, 而CYP3A2、CYP2D1、CYP2D2活性无明显变化。
| Table 3 Pharmacokinetic parameters of six probe drugs in control-group and model-group rats. n=8, x±s. *P < 0.05, **P < 0.01 vs control group |
抑郁症是以持续心境低落为主要症状的情感障碍疾病, 抑郁症按西医分为迟滞型和激越型, 分别对应于中医的肝郁证和虚证[15]。CUMS抑郁模型属于迟滞型肝郁证[16], 而糖皮质激素诱导的抑郁模型为激越型肾阳虚证, 本课题组从CYP450酶活性变化角度分别对两种症型抑郁症进行研究。
本研究采用“cocktail”法考察肾阳虚抑郁状态下大鼠体内6种CYP450酶活性变化, 研究中排除6种探针药物在体内存在代谢相互作用的可能性, 研究设计基本符合cocktail探针药物法条件[17-19]。
结合课题组对CUMS抑郁大鼠模型研究结果[12], 发现两种抑郁模型CYP1A2和CYP2E1活性均增强, 而CYP2C6活性仅在肾阳虚抑郁模型中表现为增强。研究[20, 21]发现CUMS抑郁模型上调或下调CYP450酶活性的作用机制是通过改变内源性物质或激素水平实现, 例如肾上腺素、糖皮质激素等, 增强肝细胞CYP1A转录活性、CYP2E1活性及蛋白表达。Iber等[22]发现, 当小鼠体内皮质酮浓度低于正常范围时, CYP2C11 (对应大鼠CYP2C6)活性增强, 遭遇外界物理刺激或给予高浓度糖皮质激素后, CYP2C11活性降低, 并且该过程可能是由糖皮质激素受体介导的。肾阳虚抑郁模型大鼠血中皮质酮含量显著低于正常范围[9, 23], 故CYP2C6活性增强, 与本研究结果一致; 而慢性不可预见性温和刺激一定程度上会降低大鼠体内CYP2C6活性, 因此CUMS模型大鼠体内CYP2C6活性未见明显变化。
综合研究结果, 认为抑郁症不同症型, 推测CYP1A2、CYP2E1可能是抑郁症CYP450酶活性改变的共同亚型酶, CYP2C6可能是抑郁症肾阳虚型的特征亚型酶。临床治疗抑郁症应特别关注CYP1A2、CYP2E1参与代谢的药物疗效及不良反应。此外, 肾阳虚型抑郁症患者治疗时还应关注CYP2C6参与代谢的药物的应用。
| [1] | Berlim MT, Fleck MP, Turecki G. Current trends in the assessment and somatic treatment of resistant/refractory major depression:an overview[J]. Ann Med, 2008, 40: 149–159. DOI:10.1080/07853890701769728 |
| [2] | Ji Y, Schaid DJ, Desta Z, et al. Citalopram and escitalopram plasma drug and metabolite concentrations:genome-wide associations[J]. Br J Clin Pharmacol, 2014, 78: 373–383. DOI:10.1111/bcp.2014.78.issue-2 |
| [3] | Wu Y, Tang JY, Zhou CJ, et al. Quantitative proteomics analysis of the liver reveals immune regulation and lipid metabolism dysregulation in a mouse model of depression[J]. Behav Brain Res, 2016, 311: 330–339. DOI:10.1016/j.bbr.2016.05.057 |
| [4] | Xia ZC, Wei HY, Duan JJ, et al. Chronic unpredicted mild stress-induced depression alter saxagliptin pharmacokinetics and CYP450 activity in GK rats[J]. Peer J, 2016, 4: e1611. DOI:10.7717/peerj.1611 |
| [5] | Duan JJ, Zhou T, Chen X, et al. Pharmacokinetics of 5-fluorouracil and cyclophosphamide in depression rats[J]. Eur Rev Med Pharmacol, 2012, 16: 427–436. |
| [6] | Obach RS. Inhibition of human cytochrome P450 enzymes by constituents of St. John's Wort, an herbal preparation used in the treatment of depression[J]. J Pharmacol Exp Ther, 2000, 294: 88–95. |
| [7] | Wang CM, Xu SY, Lai S, et al. Curculigo orchioides (Xian Mao) modifies the activity and protein expression of CYP3A in normal and Kidney-Yang deficiency model rats[J]. J Ethnopharmacol, 2012, 144: 33–38. DOI:10.1016/j.jep.2012.08.020 |
| [8] | Iijima M, Ito A, Kurosu S, et al. Pharmacological characterization of repeated corticosterone injection-induced depression model in rats[J]. Brain Res, 2010, 1359: 75–80. DOI:10.1016/j.brainres.2010.08.078 |
| [9] | Kott JM, Mooneyleber SM, Shoubah FA, et al. Effectiveness of different corticosterone administration methods to elevate corticosterone serum levels, induce depressive-like behavior, and affect neurogenesis levels in female rats[J]. Neuroscience, 2016, 312: 201–214. DOI:10.1016/j.neuroscience.2015.11.006 |
| [10] | Tao XM. Metabonomic Study on the Animal Model and Clinical Patients of Kidney Yang Deficiency ("肾阳虚"模型及证候的代谢组学研究)[D]. Shanghai:Shanghai Jiao Tong University, 2009. |
| [11] | Zang YX, Sun BT, Zhao WZ, et al. Study of change in activity of hepatic drug metabolism enzymes in rat model of chronic unpredictable mild stress[J]. Acta Pharm Sin (药学学报), 2015, 50: 319–325. |
| [12] | Sturm M, Becker A, Schroeder A, et al. Effect of chronic corticosterone application on depression-like behavior in C57BL/6N and C57BL/6J mice[J]. Genes Brain Behav, 2015, 14: 292–300. DOI:10.1111/gbb.2015.14.issue-3 |
| [13] | Sun BT, Zhang Q, Zong Y, et al. Influence of Baixiangdan Capsules on metabolic activities of cytochrome P450 enzymes in rats evaluated by a cocktail method[J]. Pharm Clin Res, 2016, 24: 6–10. |
| [14] | Kux L. Draft guidance for industry on drug interaction studies-study design, data analysis, implications for dosing, and labeling recommendations; availability[J]. Fed Reg, 2012, 77: 9946. |
| [15] | Xing XQ, Xie XN. Dialectical treatment of depression in Chinese medicine[J]. J Clin Res, 2003, 20: 541–542. |
| [16] | Xia OD. Research of Proteome Differential Expression of LC in Rat Model of Liver Depression Syndrome (肝郁证模型大鼠蓝斑蛋白质组差异表达研究)[D]. Guangzhou:Southern Medical University, 2013. |
| [17] | Chen WK, Ju WZ, Xu LJ, et al. Studies on pharmacokinetic interaction among CYP1A2, CYP2E1 and CYP3A4 probes in rats[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2009, 20: 435–438. |
| [18] | Lin FO, He Y, Zhang LK, et al. Assessment of the effect of ketamine on cytochrome P450 isoforms activity in rats by cocktail method[J]. Int J Clin Exp Med, 2015, 8: 4335–4341. |
| [19] | Wang SH, Wang ZZ, Chen DX, et al. Effect of acute paraquat poisoning on CYP450 isoforms activity in rats by cocktail method[J]. Int J Clin Exp Med, 2015, 8: 19100–19106. |
| [20] | Kot M, Sadakierska-Chudy A, Haduch A, et al. The role of the dorsal noradrenergic pathway of the brain (locus coeruleus) in the regulation of liver cytochrome P450 activity[J]. Eur J Pharmacol, 2015, 751: 34–41. DOI:10.1016/j.ejphar.2015.01.014 |
| [21] | Devaux A, Pesonen M, Monod G. Glucocorticoid-mediated potentiation of P450 induction in primary culture of rainbow trout hepatocytes[J]. Biochem Pharmacol, 1992, 43: 898–901. DOI:10.1016/0006-2952(92)90259-L |
| [22] | Iber H, Chen Q, Sewer M, et al. Regulation of hepatic cytochrome P4502C11 by glucocorticoids[J]. Arch Biochem Biophys, 1997, 345: 305–310. DOI:10.1006/abbi.1997.0292 |
| [23] | Rosa PB, Ribeiro CM, Bettio LEB, et al. Folic acid prevents depressive-like behavior induced by chronic corticosterone treatment in mice[J]. Pharmacol Biochem Behav, 2014, 127: 1–6. DOI:10.1016/j.pbb.2014.10.003 |
 2017, Vol. 52
2017, Vol. 52


