2. 山西大学 体育学院, 山西 太原 030006;
3. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. Physical Education Departments, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
抑郁症是一种常见的精神障碍, 以持续的情绪低落为主要特征。据世界卫生组织(WHO)统计有超过3.5亿的人群遭受过抑郁症[1]。抑郁症不仅会影响人的情绪与心理状态, 而且会导致人的认知功能损伤[2]。抑郁症的发生不仅显著降低了患者的生存质量, 而且给患者及其家庭、社会带来了巨大的经济压力[3]。
尽管抑郁症给人类带来了巨大的负担, 但其发病机制仍未完全阐明。疾病机制的研究离不开模型, 抑郁症动物模型已较为成熟[4], 而体外细胞模型尚不完善。本实验室前期已采用代谢组学技术从临床样本[5]、动物模型[6]、药物干预[7]等方面对抑郁症及抗抑郁中药进行了一系列研究, 为从多层次全面研究抑郁症, 本实验室拟对抑郁症细胞模型进行研究。
目前体外实验中常用于建立抑郁症模型的有PC12细胞[8]、SH-SHY5Y细胞[9]、原代培养的神经元细胞[10]等。PC12细胞来源于褐家鼠肾上腺髓质嗜铬瘤, 具有神经内分泌细胞的一般特征。由于PC12细胞具有操作简单、容易获得等特点, 使其在抑郁症研究中应用广泛[11]。建立PC12抑郁症细胞模型时常用的刺激包括谷氨酸(glutamate, Glu)[11]和皮质酮(corticosterone, CORT)[12]等。
Glu是主要的内源性兴奋性神经递质之一, 其在中枢神经系统中起重要作用。谷氨酸循环障碍与抑郁症的发生发展有密切关系[13]。Glu与胱氨酸(cystine, Cys)两者通过偶联转运, Cys在细胞内迅速被还原成半胱氨酸, 一部分参与细胞内重要自由基清除剂谷胱甘肽的合成, 另一部分则出胞氧化成Cys, 重新参与Glu-Cys系统循环。而Glu-Cys转运功能依赖于Glu及Cys跨膜浓度差高低, 高浓度的Glu可使得CYs摄取被阻滞, 造成自由基堆积, 广泛攻击细胞超微结构, 尤其是线粒体, 介导后续反应, 导致神经元细胞损伤乃至死亡。此外, 高浓度Glu过度刺激谷氨酸受体会导致Ca2+超载, 过量Ca2+沉积在线粒体, 干扰线粒体呼吸链功能, 氧自由基生成增多, 使得膜通透性增强, Ca2+过度也可激活细胞内信号传导系统导致细胞功能紊乱而发生损伤[14, 15]。
CORT是糖皮质激素(glucocorticoids, GC)的一种, 是HPA轴(hypothalamic-pituitary-gonadal, HPA)的终末产物, CORT浓度的显著增加可导致神经元损伤, 发生抑郁样行为[16]。已有研究表明多数抑郁症患者HPA轴功能过度激活, 而HPA轴的亢进与应激有重要关系, 长期应激状态下, HPA轴持续激活使得体内GC含量增加, 促使神经胶质细胞释放Glu, 从而引起神经元细胞损伤或凋亡。此外, GC与糖皮质激素受体(glucocorticoid receptor, GR)结合, 使其活化, 促使神经元生存的基因表达下调和促进神经元凋亡基因表达上调, 导致神经元细胞发生凋亡[17]。
由此可见, Glu与CORT诱导神经元细胞损伤的机制有相似之处也有不同之处, 已有研究中两种刺激方式均有使用, 但二者所致的抑郁症模型是否有差异、细胞内外代谢产物有何异同、哪一种与临床抑郁症疾病的发生发展更为接近, 目前尚不清楚。本研究旨在以PC12细胞为研究对象, 采用1H NMR代谢组学及代谢通路分析技术对Glu和CORT诱导所致的抑郁症细胞模型的差异代谢物进行比较分析, 探寻两种诱导方式所致抑郁症细胞模型的差异和特点, 为合理选择体外细胞模型提供依据。
材料与方法材料 PC12细胞购自中国科学院典型培养物保藏委员会细胞库(中国上海), RPMI 1640培养液、胎牛血清(Hyclone, Logan, USA), 胰蛋白酶(北京索莱宝科技有限公司), CORT (中国成都化夏化学试剂有限公司), Glu (中国上海生工生物工程有限公司), 重水(美国默克试剂), 2, 3, 3-三甲基甲硅烷基丙酸(TSP) (美国默克试剂), 0.1 mol·L-1磷酸缓冲液(PBS, pH 7.4)。
实验仪器 细胞培养箱(中国力申科学仪器有限公司), 低速离心机(安徽中科中佳科学仪器有限公司), SCIENTZ-12N真空冷冻干燥机和超声波细胞粉碎机UP-250 (宁波新芝生物科技股份有限公司), Bruker 600 MHz Avance Ⅲ NMR谱仪(德国布鲁克公司)。
细胞培养与收集 PC12细胞生长于含10%胎牛血清的RPMI 1640培养液中, 接种等量的细胞于175 cm2的培养瓶中培养。当细胞生长至60%时, 分别采用500 μmol·L-1 CORT和20 mmol·L-1 Glu刺激36 h (空白组除外)。细胞计数后, 分别收集6个培养瓶中的细胞和培养基。培养液置于50 mL离心管中, 1 000 r·min-1离心5 min, 收集上清液, 液氮中速冻, -80 ℃保存。0.25%的胰蛋白酶消化至细胞皱缩变圆后加入等量血清终止消化, 1 000 r·min-1离心5 min后, PBS洗涤沉淀2次, 离心后将细胞沉淀于液氮中速冻, -80 ℃保存。
细胞及培养液1H NMR分析 参考文献[18], 取出细胞和培养液置于4 ℃冰箱中, 使其融化。培养液提取方法为取2 mL培养液直接于5 mL EP管中冻干。细胞提取方法为:反复冻融细胞5次后, 加入甲醇-水(1:2) 1 mL, 于冰上超声破碎15 min (超声设置为运行5 s, 停顿9 s), 4 ℃ 13 000 r·min-1离心10 min, 收集上清后向沉淀中加入甲醇水溶液1 mL, 重复上述操作, 收集两次上清液于5 mL EP管中冻干。
细胞和培养液冻干后加入600 μL重水配制的0.1 mol·L-1 PBS (pH 7.4), 其中分别含有0.005%和0.02% TSP, 4 ℃ 13 000 r·min-1离心10 min, 取上清于5 mm NMR管中进行测试。所有样品均于Bruker 600 MHz Avance Ⅲ NMR谱仪上测试完成。采用NOSEY序列测试, 弛豫延迟320 ms, 谱宽12 019.12 Hz, 扫描次数为64次。
1H NMR图谱采用MestReNova (Mestrelab Research, Santiago de Compostella, Spain)软件进行处理。以TSP校准化学位移(TSP 0 ppm), 校准相位和基线后, 谱图中δ 4.76~4.82 ppm处切除残留水峰, 并以0.01 ppm对谱图δ 0.70~9.00 ppm进行分段积分, 以总峰面积进行归一化后生成Excel数据文件, 将其导入SIMCA-P (Version 13.0, Umetric, Sweden)软件中进行多元统计学分析, 根据P < 0.05和VIP > 1筛选出差异代谢物。
进一步将差异代谢产物峰面积采用皮尔森相关系数分析细胞内外代谢物的相关程度。为分析两种刺激方式对代谢通路的影响, 将差异代谢物导入MetaboAnalyst 3.0 (http://www.metaboanalyst.ca/MetaboAnalyst)中进行差异通路分析, 分析结果中每条通路的影响值(impact value, IV)用来评价和差异代谢物的相关性, IV > 0.1的通路被认为其与诱导损伤的相关性较高。
结果 1 图谱指认与分析图 1为细胞(A)及培养液(B)的1H NMR图谱, 参考文献并应用Chenomx NMR suit软件(Chenomx IncInc, Edmonton, AB, Canada, version 7.5)以及HMDB (http://www.hmdb.ca/)数据库对图谱中的主要化学成分进行指认, 结果见表 1。
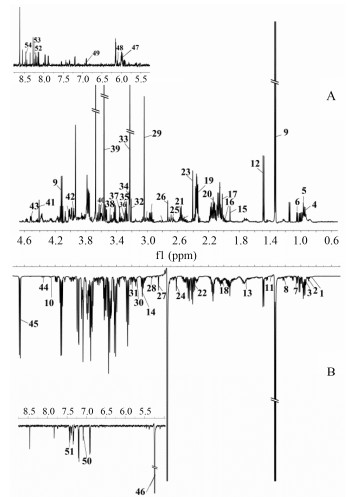
|
Figure 1 Typical 1H NMR spectrum of PC12 cells (A) and medium (B). The metabolites labeled with numbers are listed in Table 1 |
| Table 1 Chemical shift and multiplicity of identified metabolites from cells extracts (C) and medium extracts (M) |
运用SIMCA-P软件对积分数据进行处理, 采用有监督的PLS-DA对所有样本进行1H NMR代谢轮廓分析, 结果见图 2 (PLS-DA模型参数分别为a: R2X=0.698, R2Y=0.999, Q2Y=0.993; b: R2X=0.824, R2Y=0.996, Q2Y=0.993; c: R2X=0.668, R2Y=0.997, Q2Y=0.981; d: R2X=0.824, R2Y=0.996, Q2Y=0.567)。由图 2可知, 空白组和两种模型组的细胞与培养液均沿t[1]轴明显分开, 表明CORT和Glu刺激PC12细胞后, 对细胞的正常代谢均产生了比较显著的影响。进一步对PLS-DA进行模型验证, 累积200次的R2和Q2都低于原始值, Q2在纵轴上的截距为负值, 表明所建立的参数模型未发生过度拟合, 故PLS-DA散点图的模型验证成立, 结果可靠。
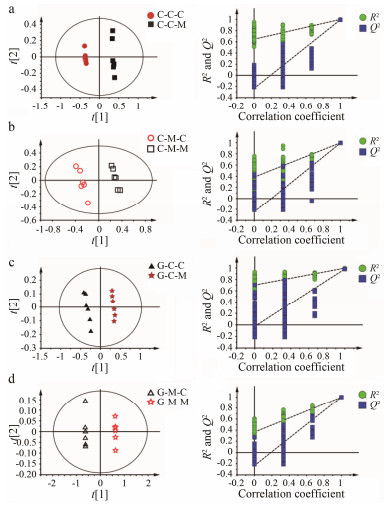
|
Figure 2 PLS-DA scores plot (left) and PLS-DA validation plot (right). a: CORT-induced PC12 cell vs control; b: CORT-induced PC12 cell medium vs control; c: Glu-induced PC12 cell vs control; d: Glu-induced PC12 cell medium vs control. C/G: CORT/Glu; C/M: cell/medium; C/M: control/model, eg. C-C-M: CORT-induced PC12 cell group |
为了进一步发现两种抑郁症模型的异同, 经过PLS-DA分析, 得到VIP值, 选出VIP > 1的代谢产物, 并将这些代谢产物的峰面积导入Excel软件进行t-test (P < 0.05)筛选出差异代谢物, 结果见表 2。
| Table 2 The different metabolites of CORT and Glu-induced PC12 cell. *P < 0.05, **P < 0.01 vs control |
由表 2可知, 在CORT刺激下, 细胞内发现15个差异代谢产物, 培养液中21个; 在Glu刺激下细胞中发现16个差异代谢产物, 培养液中26个。其中, 两种方式在细胞内外相同的差异代谢物分别为13个和19个。
3 相关性分析相关性分析结果如图 3所示。由图 3可知两种诱导方式导致细胞内外代谢产物相关性差异较大, 表明两种诱导方式可能对细胞内外物质交换的影响程度不同。进一步筛选相关性大于0.7的代谢产物进行分析, 发现在CORT刺激下, 2-氧基异亮氨酸(2-oxoisoleucine)和丝氨酸(serine)与多数差异代谢物有较强相关性, 而Glu刺激下谷胱甘肽(glutathione)和乳酸(lactate)与多数差异代谢物相关性较强。丝氨酸是一种非必需氨基酸, 在脂肪和脂肪酸的新陈代谢中发挥着作用, 此外丝氨酸在细胞膜的制造加工以及包围神经细胞的鞘的合成中都发挥着作用[19]。细胞可以从甘氨酸中合成丝氨酸, 并且还是合成嘌呤、胸腺嘧啶、胆碱的前体。研究表明丝氨酸对映异构体的合成与代谢异常可能在抑郁症的发生中发挥着重要作用[20]。谷胱甘肽是由谷氨酸、半胱氨酸及甘氨酸组成, 其具有抗氧化的能力[21], 其含量的显著降低与由Glu损伤PC12细胞的机制具有一致性。
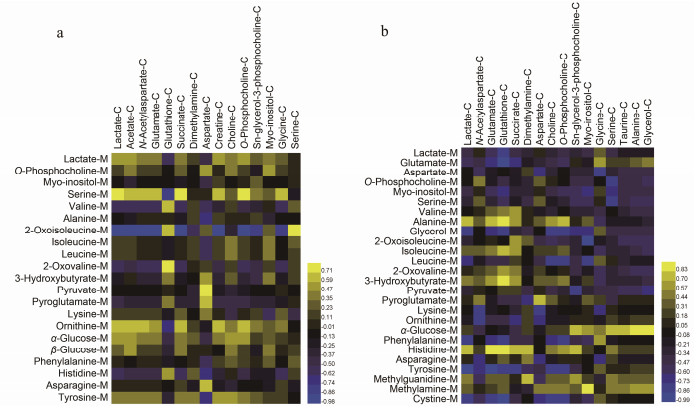
|
Figure 3 Correlation analysis about the different metabolites of cell (C) and medium (M). a: CORT-induced PC12 cell and medium; b: Glu-induced PC12 cell and medium |
对差异代谢物进行通路分析, 结果如图 4所示。结果表明CORT刺激后, 13条代谢通路发生显著变化, 包括氨酰转运RNA合成, 丙氨酸、天冬氨酸和谷氨酸代谢, 甘氨酸、丝氨酸和苏氨酸代谢, 谷胱甘肽代谢, 苯丙氨酸代谢, 精氨酸和脯氨酸代谢, 丙酮酸代谢, 丁酸甲酯代谢, TCA循环, 组氨酸代谢, 赖氨酸降解, 谷氨酸和谷氨酸盐代谢, 肌醇磷酸盐代谢。而Glu刺激后, 15条代谢通路表现出明显的变化, 除了与CORT刺激后相同的通路以外, 还包括牛磺酸与亚牛磺酸的代谢以及甘油脂代谢。这些代谢通路主要涉及能量代谢、氨基酸代谢等。
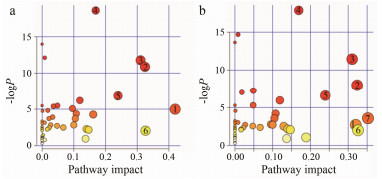
|
Figure 4 Summary diagram of pathway analysis. The greater values of the pathway impact and -logP, the higher correlation of different metabolites between groups, displayed with the larger circle in the picture. The P values from enrichment analysis, the pathway impact value calculated from pathway topology analysis. a: CORT-induced cell group pathway analysis; b: Glu-induced cell group pathway analysis. 1: Pyruvate metabolism; 2: Glycine, serine and threonine metabolism; 3: Alanine, aspartate and glutamate metabolism; 4: Aminoacy1-tRNA biosynthesis; 5: Glutathione metabolism; 6: D-Glutamine and D-glutamate metabolism; 7: Taurine and hypotaurine metabolism |
抑郁症已成为人类健康的主要负担之一, 研究抑郁症的发病机制对改善抑郁症现状具有重要意义, 而体外细胞模型的不完善是阐明抑郁症发生机制研究的主要障碍之一。通过对抑郁症细胞模型的深入分析研究, 对于深刻阐释抑郁症的发病机制及药物干预作用机制具有重要的指导意义。而代谢组学作为系统生物学的重要组成部分, 从代谢产物的整体轮廓分析评价疾病模型是重要的手段之一。
细胞在进行生命活动的过程中时刻都需要进行物质交换, 细胞从外环境中吸收营养物质等, 排出代谢产物等, 因而要全面分析细胞的状态, 必须从细胞内外整体分析。通过对细胞内外物质进行相关性分析对于研究细胞内外物质交换有一定意义, 另外相关性强的物质可能在代谢过程中相互涉及。而细胞物质交换的过程与能量代谢以及细胞膜的完整性有重要关系。
本研究从CORT和Glu刺激诱导的PC12细胞中发现其差异代谢产物, 并对差异代谢产物进一步进行相关性分析以及通路分析, 发现Glu诱导下, 谷胱甘肽以及乳酸与多数差异代谢产物具有相关性; CORT诱导下, 丝氨酸、2-氧基异亮氨酸与多数代谢差异物有显著相关; 而在通路分析中, CORT与Glu两种诱导方式, 无显著差别。其中在抑郁症患者和模型动物体内均发生了甘氨酸、丝氨酸、苏氨酸、组氨酸、精氨酸、脯氨酸、谷胱甘肽、丙酮酸和肌醇磷酸等代谢紊乱, 说明CORT和Glu刺激PC12细胞后发生的代谢变化与抑郁症患者及模型的代谢变化有一定吻合[22-24]。其差异代谢物引起的通路变化基本相同, 而相关分析的结果却不相同。在进行通路分析时, 考虑的是差异代谢物在代谢通路中的位置情况, 而进行相关分析时, 考虑的是细胞内外物质量的相关关系, 因此在进行分析时需要结合两者的结果。本研究中, 通路分析发现两种刺激方式导致的显著差异通路基本相同, 而相关分析进行筛选的结果却显示有所差异。CORT诱导产生的差异代谢物主要与培养基中丝氨酸和2-氧基异亮氨酸相关性较强, 在细胞中丝氨酸主要参与脂肪与脂肪酸的代谢, 并在细胞膜的制造加工中起重要作用。而丝氨酸与多数差异代谢物的相关说明丝氨酸在代谢过程中与这些差异代谢物可能通过脂肪和脂肪酸代谢等途径有所关联, 进一步推测CORT刺激下可能主要影响脂肪和脂肪酸的代谢。而Glu诱导下, 细胞内谷胱甘肽以及乳酸与多数物质相关, 根据谷胱甘肽的功能以及乳酸等的代谢途径, 推测Glu诱导的PC12细胞更倾向于影响糖酵解以及抗氧化过程, 同时有研究表明, 芍药苷可以通过抗氧化机制保护Glu诱导的PC12细胞[11]。然而有些不足的是, 这些结果仍然需要进一步验证。
Glu和CORT诱导PC12细胞所致抑郁症模型的方法是目前比较常用的方法。但PC12细胞有几种分化形式, 其不同的分化类型对细胞代谢产物可能会有影响, 因而在进行代谢组学研究中要控制好细胞的传代次数, 且要考虑是否为分化细胞及分化的类型。此外, 虽然Glu和CORT诱导是较为常用的方式, 但是仍存在其他方式, 如炎症诱导方式、单胺类神经递质再摄取等, 因此在今后的研究中应对这些因素诱导所致的模型给予关注。
| [1] | Heidi L. If depression were cancer[J]. Nature, 2014, 515: 182–184. DOI:10.1038/515182a |
| [2] | Wang D, Li L. The research progress of cognitive dysfunction in patients with depression[J]. Chin J Psychiatry (中华精神科杂志), 2015, 48: 115–122. |
| [3] | Peter S. Defeating the dementors[J]. Science, 2012, 338: 67. DOI:10.1126/science.338.6103.67 |
| [4] | Boldizsar C, Eberhard F, Ove W, et al. Animal models of major depression and their clinical implications[J]. Prog Neuro-psychoph, 2016, 64: 293–310. DOI:10.1016/j.pnpbp.2015.04.004 |
| [5] | Liu CC, Tian JS, Du GH, et al. Plasma metabolite biomarkers for the therapeutic response in depressed patients by the traditional Chinese medicine formula Xiaoyaosan:a 1H NMRbased metabolomics approach[J]. J Affect Disorders, 2015, 185: 156–163. DOI:10.1016/j.jad.2015.05.005 |
| [6] | Shi BY, Tian JS, Qin XM, et al. A 1H NMR plasma metabonomic study of acute and chronic stress models of depression in rats[J]. Behav Brain Res, 2013, 241: 86–91. DOI:10.1016/j.bbr.2012.11.036 |
| [7] | Tian JS, Peng GJ, Du GH, et al. Dynamic analysis of the endogenous metabolites in depressed patients treated with TCM formula Xiaoyaosan using urinary 1H NMR-based metabolomics[J]. J Ethnopharmacol, 2014, 158: 1–10. DOI:10.1016/j.jep.2014.10.005 |
| [8] | Jiang BP, Liu YM, Le L, et al. Cajaninstilbene acid prevents corticosterone-induced apoptosis in PC12 cells by inhibiting the mitochondrial apoptotic pathway[J]. Cell Physiol Biochem, 2014, 34: 1015–1026. DOI:10.1159/000366317 |
| [9] | Adeosun S, Albert P, Austin M, et al. 17β-Estradiol-induced regulation of the novel 5-HT1A-related transcription factors NUDR and Freud-1 in SH SY5Y cells[J]. Cell Mol Neurobiol, 2012, 32: 517–521. DOI:10.1007/s10571-012-9809-3 |
| [10] | Jonathan S, Wayne D, Robert D, et al. Putative neuroprotective and neurotoxic kynurenine pathway metabolites are associated with hippocampal and amygdalar volumes in subjects with major depressive disorder[J]. Neuropsychopharmacology, 2015, 40: 463–471. DOI:10.1038/npp.2014.194 |
| [11] | Mao QQ, Zhong XM, Feng CR, et al. Protective effects of paeoniflorin against glutamate-induced neurotoxicity in PC12 cells via antioxidant mechanisms and Ca2+ antagonism[J]. Cell Mol Neurobiol, 2010, 30: 1059–1066. DOI:10.1007/s10571-010-9537-5 |
| [12] | Zheng M, Liu C, Pan F, et al. Protective effects of flavonoid extract from Apocynum venetum leaves against corticosterone-induced neurotoxicity in PC12 cells[J]. Cell Mol Neurobiol, 2011, 31: 421–428. DOI:10.1007/s10571-010-9635-4 |
| [13] | Liu YM, Shen SN, Pan RL, et al. Cajaninstilbene acid protects corticosterone-induced injury in PC12 cells by inhibiting oxidative and endoplasmic reticulum stress-mediated apoptosis[J]. Neurochem Int, 2014, 78: 43–52. DOI:10.1016/j.neuint.2014.08.007 |
| [14] | Li XB, Huang JZ, Wang ZC. Role of glutamate receptor in depression[J]. Chin J New Drugs Clin Rem (中国新药与临床杂志), 2005, 24: 601–605. |
| [15] | Bleich S, Romer K, Wiltfang J, et al. Glutamate and the glutamate receptor system:a target for drug action[J]. Int J Geriatr Psych, 2003, 18: S33–S40. DOI:10.1002/(ISSN)1099-1166 |
| [16] | Monaghan DT, Bridges RJ, Cotman CW. The excitatoryamino acid receptors:their classes, pharmacology, and distinct properties in the function of the central nervous system[J]. Annu Rev Pharmacol, 2010, 29: 365–402. |
| [17] | Joanna W, Aarthi G, Liisa G, et al. Parity modifies the effects of fluoxetine and corticosterone on behavior, stress reactivity, and hippocampal neurogenesis[J]. Neuropharmacology, 2016, 105: 443–453. DOI:10.1016/j.neuropharm.2015.11.027 |
| [18] | Zhou XH. Role of P13K/Akt/Fox03a Pathway in the Protective of Venlafaxine Against Corticosterone Cell Death Induction in PC 12 Cells (PI3K/Akt/FoxO3a通路在文拉法辛保护皮质酮诱导PC12细胞的损伤中的作用)[D]. Guangzhou:Sun Yat-Sen University, 2010. |
| [19] | Li H, Zhu W, Zhang L, et al. The metabolic responses to hepatitis B virus infection shed new light on pathogenesis and targets for treatment[J]. Sci Rep, 2015, 5: 8421. DOI:10.1038/srep08421 |
| [20] | Meunier CN, Dallérac G, Le RN, et al. D-Serine and glycine differentially control neurotransmission during visual cortex critical period[J]. PLoS One, 2016, 11: e0151233. DOI:10.1371/journal.pone.0151233 |
| [21] | Liu ZQ, Gu XH, Yang YJ, et al. D-Serine in the nucleus accumbens region modulates behavioral sensitization and extinction of conditioned place preference[J]. Pharmacol Biochem Behav, 2016, 143: 44–56. DOI:10.1016/j.pbb.2016.02.002 |
| [22] | Leong PK, Wong HS, Chen J, et al. Differential action between schisandrin A and schisandrin B in eliciting an antiinflammatory action:the depletion of reduced glutathione and the induction of an antioxidant response[J]. PLoS One, 2016, 11: e0155879. DOI:10.1371/journal.pone.0155879 |
| [23] | Xia XT, Sun N, Tian JS, et al. Study on discovering potential biomarkers of depression and drug intervention of paroxetine based on 1H NMR metabolomics[J]. Acta Pharm Sin (药学学报), 2016, 51: 593–596. |
| [24] | Liu XJ, Li ZY, Li ZF, et al. Urinary metabonomic study using a CUMS rat model of depression[J]. Magn Reson Chem, 2012, 50: 187–192. DOI:10.1002/mrc.2865 |
 2017, Vol. 52
2017, Vol. 52


