2. 南京中医药大学, 平移系统生物学与神经科学中心/脑疾病综合生物医学实验室, 基础医学院, 江苏 南京 210023;
3. 江苏苏中药业集团制药有限公司, 江苏 姜堰 225500
2. Center for Translational Systems Biology and Neuroscience, Laboratory of Integrative Biomedicine of Brain Diseases, School of Basic Biomedical Science, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. SZYY Group Pharmaceutical Limited, Jiangyan 225500, China
重度抑郁症(MDD)是一种以持久的情绪低落和快感缺乏为特点的精神疾病, 它影响着人们的生活质量和身体健康, 甚至严重者导致自杀。世界卫生组织(WHO)指出, 在21世纪人类面临最大的疾病是精神疾病, 特别是抑郁症, 且在未来15到20年, 同其他疾病相比, 精神疾病的全球医疗费用将排名第二[1]。此外, 抑郁症的发病率呈上升趋势, 仅次于心血管疾病的发病率[2]。因此, 对于抑郁症的预防和治疗是目前研究的热点问题。
黄蜀葵花为锦葵科植物黄蜀葵(Abelmoschus manihot (L.) Medic.)的干燥花冠。始载于《嘉佑本草》, 后收录于《本草纲目》。其味甘、辛, 性凉。归心、肾、膀胱经。具有利尿通淋、活血、止血、消肿解毒的功效。现代研究表明, 黄蜀葵花具有显著的药理活性, 如抗炎、抗氧化、抗凝血、抗心肌缺血坏死和缺血性脑损伤的保护, 延缓肾小管损害和肾纤维化治疗慢性肾脏疾病, 降低血糖, 促进血管生成等[3-9]。据报道, 黄蜀葵花黄酮类成分对小鼠中风后抑郁症损伤具有明显保护作用[10, 11]。研究亦显示, 黄蜀葵花的乙醇提取物表现出显著抗抑郁活性, 灌胃给药后, 在大鼠脑中检测到异槲皮苷(IQT)、金丝桃苷(HY)、棉皮素-8-O-β-D-葡萄糖醛酸(G-8-G)、槲皮素-3'-葡糖苷(Q-3-G)和槲皮素(QT)[12-14]。然而, 黄蜀葵花中黄酮类化合物的抗抑郁作用机制尚未完全阐明。
本研究采用色谱分离方法分离、纯化和鉴定黄蜀葵花中主要黄酮类化合物; 采用悬尾实验(TST)和强迫游泳实验(FST)评价主要黄酮类化合物的抗抑郁活性; 采用Western blot技术评价化合物对小鼠海马组织中脑源性神经营养因子(BDNF)、海马酪氨酸受体激酶B (TrkB)和磷酸化的真核延伸因子2 (p-eEF2)的蛋白表达水平, 以期揭示黄蜀葵花抗抑郁的作用机制, 为其深入研究及开发利用提供科学依据。
材料与方法实验材料 ACQUITY UPLC系统(二元高压泵, 自动进样器, 柱温箱, 光电二极管阵列检测器, Empower 2色谱工作站, Waters公司); DHG-9023A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司); Sartorius BT125D电子分析天平(德国塞利多斯公司); EPED超纯水系统(南京易普达易科技发展有限公司); KQ-250E型超声波清洗器(昆山禾创超声仪器有限公司); AnkeGL-16 GⅡ型离心机(上海安亭科学仪器厂); Thermo Syncronis C18 (100 mm × 2.1 mm, 1.7 μm)色谱柱; Germany Bruker Avance AV-500/300 NMR光谱(TMS为内标); YRE-301旋转蒸发仪(巩义市, 予华仪器有限公司); Sephadex LH-2 (通用电气医疗集团生物科技); D101大孔树脂柱和聚酰胺柱(60~100目) (河北沧州宝精细化工有限公司)。
甲醇(南京化学试剂有限公司)为分析纯, 乙腈(美国TEDIA公司)及甲酸均为色谱纯(美国ACS公司), 超纯水由Milli-Q纯水机制备。槲皮素-3'-葡糖苷(纯度98%)、异槲皮苷(纯度98%)、杨梅素(纯度98%)、槲皮素(纯度98%)和金丝桃苷(纯度98%)购自南京春秋生物工程有限公司。氯胺酮(纯度99.9%) (中国古田制药); 黄蜀葵花80%乙醇提取物(14060703)由江苏苏中药业集团有限公司提供; 提取所用药材经南京中医药大学段金廒教授鉴定为锦葵科黄蜀葵[Abelmoschus manihot (L.) Medic.]植物的干燥花冠。
黄酮化合物的分离纯化与鉴定方法 干燥黄蜀葵花(20 kg)经80%乙醇(120 L×3)回流提取3次, 合并3次提取液, 浓缩得8 L浸膏, 依次用石油醚(18 L)和乙酸乙酯(18 L)分别萃取3次。萃取液5 L上D101大孔吸附树脂(0.25~0.84 mm)柱(15 cm×100 cm)分离, 依次采用纯水(50 L)、30%乙醇(55 L)、60%乙醇洗脱(30 L)及95%乙醇(20 L)进行洗脱。30%和60%的洗脱液分别浓缩到1.5 L和1 L, 30%乙醇浓缩液于聚酰胺树脂柱(15 cm×100 cm), 依次用纯水(40 L)、20%乙醇(20 L)、50%乙醇(20 L)(均含0.1%乙酸)洗脱。20%和50%的洗脱液均浓缩至500 mL, 分别吸取20%、50%、60%的浓缩液10 mL于Sephadex LH-20柱(3×200 cm)上分离, 用甲醇(1 L)洗脱, 每收集100 mL洗脱液后, 进样2 μL, 根据色谱及光谱特征, 合并相同馏分。经甲醇重结晶, 得到化合物1~8。流动相为0.1%甲酸水(A)-乙腈(B), 优化梯度为0~2 min: 14% B~17% B; 2~5 min: 17% B~18% B; 5~6 min: 18% B~19% B; 6~9 min: 19% B~35% B; 9~10 min: 35%~14% B; 10~11 min: 14% B。将纯化的化合物1~4溶于DMSO-d6通过1H NMR、13C NMR分析, 化合物5~8与对照品的保留时间及光谱特征进行比较。
动物和实验分组设计 清洁级雄性远交昆明小鼠136只, 年龄6~8周龄(18~22 g), 均由南京中医药大学实验动物中心提供(合格证号H35020148), 动物实验获得南京中医药大学的研究伦理委员会的批准, 所有实验程序都按照实验动物的护理和使用指南进行。小鼠适应性喂养1周, 自由进食进水, 自然光昼夜节律照射, 控制室内温度(25±1) ℃及湿度40%~60%。根据体重随机分为17组, 每组8只:空白对照组, 氯胺酮阳性药组, G-8-G低、中、高剂量组, Q-3-G低、中、高剂量组, IQT低、中、高剂量组, HY低、中、高剂量组, QT低、中、高剂量组。
动物给药 化合物G-8-G、Q-3-G、IQT、HY、QT (经UHPLC检测其纯度高于95%)分别分散于0.5% Tween 80溶液中, 配置成低、中、高浓度(1.5、3和6 mg·mL-1)。空白对照组灌胃0.5% Tween 80。氯胺酮溶解于生理盐水中, 配置成质量浓度为1 mg·mL-1的阳性对照药。按照10 mL·kg-1剂量灌胃小鼠, 24 h后进行行为测试。
悬尾实验 (tail suspension test, TST) 悬尾实验的操作步骤与文献[15]中报道的相似。此实验于微机化设备上进行, 允许4只小鼠在同一时间进行测试。动物的整个过程被录像。在小鼠尾巴尖1 cm处贴上粘合带, 将其悬浮于离地面50 cm处, 实验悬挂6 min, 适应2 min, 记录后4 min内小鼠累计不动时间。
强迫游泳实验(forced swimming test, FST) 小鼠放入水深15 cm、直径10 cm、高25 cm的玻璃缸中, 水温维持在(25±1) ℃, 小鼠后肢不触及缸底, 前肢不附于缸壁顶部。动物的整个过程被录像。实验共观察6 min, 适应2 min, 记录后4 min内小鼠累计漂浮不动时间。小鼠游泳结束后及时用吹风机处理干燥, 并严格控制水温, 每只小鼠实验前更换实验用水。
BDNF、TrkB和p-eEF2蛋白表达检测 取空白对照组、氯胺酮(10 mg·kg-1)、G-8-G (30 mg·kg-1)、Q-3-G (30 mg·kg-1)给药组给药24 h后小鼠整个腹侧和背侧的海马组织, 将其溶解于含有蛋白酶抑制剂和磷酸酶抑制剂缓冲液中。通过BCA测定法(Pierce, 罗克福德, IL, 美国)检测蛋白质浓度。蛋白裂解物用12%的SDS-PAGE电泳分离, 随后转移到聚乙二氟乙烯膜。5% BSA封闭1 h后, 4 ℃下与BDNF (圣克鲁斯生物技术, SC-546, 1:200)、TrkB (1:500)、p-eEF2 (细胞信号技术, 2332, 1:500)和β-tubulin (细胞信号技术, 1:200)抗体杂交过夜, 孵育二抗常温杂交1 h, 加入超级信号西方Pico化学发光底物(赛默飞世尔科技公司), 放入凝胶成像仪中曝光, 使用Gel-Pro analyzer 4.0软件对条带进行定量分析, 得出各条带积分吸光度IA, 以β-tubulin作为内参进行校正。所有实验重复3次。
蛋白表达量=(目的蛋白给药组IA/β-tubulin给药组IA)
蛋白相对表达量=(目的蛋白给药组IA/β-tubulin给药组IA)/(目的蛋白空白对照组IA/β-tubulin空白对照组IA)
统计学分析 实验数据用SPSS 16.0软件进行统计分析, 结果用平均值±标准方差表示, 多组数据的组间比较采用单因素方差分析Newman-Keuls多重检验, P < 0.05为有统计学意义。
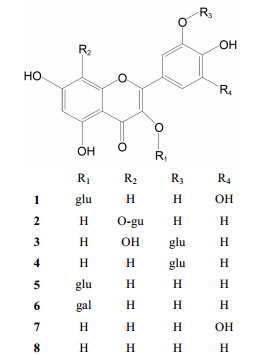
结果 1 黄酮类化合物的鉴定化合物1~8均为黄色粉末, 薄层色谱法点样后于紫外分光光度计254 nm波长下呈现黄色斑点, 盐酸-镁粉反应均显红色, 化合物1~6 Molish反应显红色, 化合物7、8无明显现象, 说明化合物1~6可能为黄酮苷类, 化合物7、8为黄酮苷元类。化合物5~8的化学位移Rf值和保留时间tR分别与IQT、HY、杨梅素和QT的对照品一致。因此, 化合物5鉴定为IQT, 6鉴定为HY, 7鉴定为杨梅素, 8鉴定为QT。化合物1~4的1H NMR和13C NMR数据详见表 1和表 2, 根据文献[16-18]比对, 分别鉴定为杨梅素-3-O-β-D-葡萄糖苷、G-8-G、棉皮素-3'-O-β-D-葡萄糖苷和Q-3-G。经UHPLC检测, 化合物1~8的纯度均高于95%, 其结构式如图 1所示。
| Table 1 1H NMR data (δ/ppm) for 1-4 measured in DMSO-d6. J in Hz |
| Table 2 13C NMR data (δ/ppm) for 1-4 measured in DMSO-d6 |
|
Figure 1 Chemical structures of compounds 1-8. gu: Glu curonide; glu: Glucose; gal: Galactose |
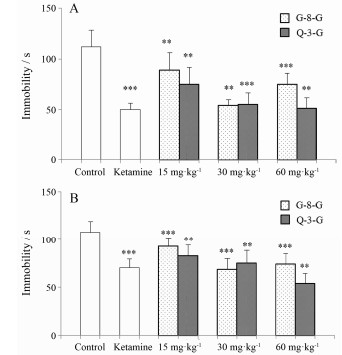
单次灌胃给药24 h后, 与空白对照组相比, 阳性药氯胺酮(10 mg·kg-1)给药组能显著缩短小鼠在悬尾实验和强迫游泳实验中的不动时间, 缩短率分别为55.06%和34.82% (P < 0.001)。化合物G-8-G和Q-3-G (15、30、60 mg·kg-1)干预后, 不动时间较空白对照组也明显缩短, G-8-G 15 mg·kg-1的缩短率分别为32.63% (P < 0.01)和25.58% (P < 0.001), 30 mg·kg-1的缩短率分别为50.33% (P < 0.01)和32.37% (P < 0.001), 60 mg·kg-1的缩短率分别为53.75% (P < 0.001)和51.66% (P < 0.001); Q-3-G 15 mg·kg-1的缩短率分别为20.37% (P < 0.01)和16.53% (P < 0.01), 30 mg·kg-1的缩短率分别为51.32% (P < 0.001)和38.35% (P < 0.01), 60 mg·kg-1的缩短率分别为32.98% (P < 0.01)和33.66% (P < 0.01), 如图 2所示。化合物IQT、HY、QT未见明显作用, 与空白组相比无统计学差异(P > 0.05)。
|
Figure 2 Effects of ketamine (10 mg·kg-1), G-8-G and Q-3-G (15, 30, 60 mg·kg-1) on the TST (A) and FST (B) carried out at 24 h after administration. Immobility time was measured for the last 4 min during the 6 min testing time. G-8-G: Gossypetin-8-O-β-D-glucuronide; Q-3-G: Quercetin-3'-O-β-D-glucoside; TST: Tail suspension test; FST: Forced swimming test. n=8, x±s. **P < 0.01, ***P < 0.001 vs control group |
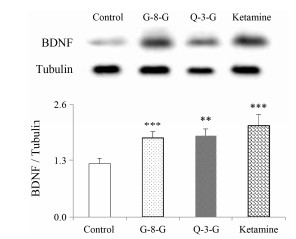
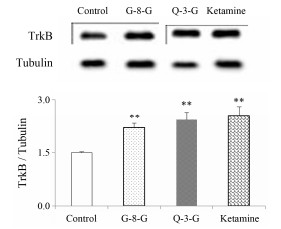
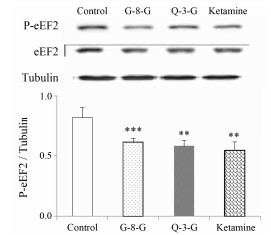
与空白对照组相比, 氯胺酮(10 mg·kg-1)、G-8-G (30 mg·kg-1)、Q-3-G (30 mg·kg-1)给药组的BDNF和TrkB蛋白表达量明显升高, p-eEF2蛋白表达量明显下降。氯胺酮组、G-8-G组、Q-3-G BDNF蛋白的相对表达量分别为1.71 (P < 0.001)、1.48 (P < 0.01)、1.52 (P < 0.001), 如图 3所示; TrkB蛋白的相对表达量分别为1.69、1.47、1.62 (P < 0.01), 如图 4所示; p-eEF2的相对表达量分别为0.66、0.75、0.71 (P < 0.01), 如图 5所示。
|
Figure 3 Brain-derived neurotrophic factor (BDNF) protein expression determined by Western blot at 24 h after an independent administration of ketamine (10 mg·kg-1), G-8-G (30 mg·kg-1) and Q-3-G (30 mg·kg-1). n=8, x±s. **P < 0.01, ***P < 0.001 vs control group |
|
Figure 4 Tyrosine receptor kinase B (TrkB) protein expression determined by Western blot at 24 h after an independent administration of ketamine (10 mg·kg-1), G-8-G (30 mg·kg-1) and Q-3-G (30 mg·kg-1). n=8, x±s. **P < 0.01, ***P < 0.001 vs control group |
|
Figure 5 Phosphorylation eukaryotic elongation factor 2 (p-eEF2) protein expression determined by Western blot at 24 h after an independent administration of ketamine (10 mg·kg-1), G-8-G (30 mg·kg-1) and Q-3-G (30 mg·kg-1). n=8, x±s. **P < 0.01 vs control group |
前期研究[14]表明, 黄蜀葵花的乙醇提取物具有显著的抗抑郁作用。本文研究结果进一步揭示了黄蜀葵花80%乙醇提取物中的HY、IQT、G-8-G、Q-3-G和QT 5个黄酮类化合物抗抑郁活性及其作用机制。其中, G-8-G和Q-3-G能显著降低小鼠在悬尾实验和强迫游泳实验中的不动时间, 与氯胺酮作用相似, 表现出显著的抗抑郁活性, 而HY、IQT和QT未见明显效应。而且Q-3-G和G-8-G在30 mg·kg-1剂量给药时, 小鼠悬尾实验和强迫游泳实验中不动时间的缩短率均高于15、60 mg·kg-1浓度, 且其作用强度与氯胺酮(10 mg·kg-1)相似。因此, 文中选择30 mg·kg-1作为评价G-8-G和Q-3-G的抗抑郁作用机制。
神经营养因子是生长因子, 在神经系统的发育和维持中起重要作用。BDNF是神经营养因子家族中继神经生长因子(NGF)之后的的第二个成员。BDNF结合TrkB后, 细胞内信号转导通路启动, 发挥相应的细胞保护、促进神经元的再生等生物活性[19-22]。最近研究报告指出, 特定的大脑区域, BDNF的表达增加和突触可塑性的增强与抗抑郁活性密切相关[23, 24]。eEF2激酶磷酸化抑制后能显著促进BDNF蛋白翻译, 增加BDNF蛋白的表达, 从而发挥抗抑郁作用。临床研究与动物实验研究表明, 氯胺酮的麻醉剂量(5 mg·kg-1)可以显著减少eEF2磷酸化, 提高BDNF的表达, 缓解抑郁症状, 并且这种作用在啮齿动物体内可持续多天[25-27]。研究[14]表明, 口服给药氯胺酮2 h和24 h后, BDNF和TrkB的表达均显著上升, 且在24 h时表达更高。
本文研究结果表明, 化合物G-8-G和Q-3-G的作用与氯胺酮相似, 单次给药24 h后均能显著增加TrkB的表达, 降低p-eEF2的表达, 与检测到的BDNF蛋白表达上调的结果一致。因此, G-8-G和Q-3-G能够通过调节BDNF/TrkB/p-eEF2信号通路缓解抑郁症。然而, 抑郁症发病机制复杂, 涉及许多靶蛋白和相应的信号传导途径, 如谷氨酸通路、下丘脑-垂体-肾上腺皮质轴(HPA)的激活等[17, 28]。因此, 黄蜀葵花中黄酮类化合物抗抑郁症的作用机制值得更加深入细致的研究, 为其开发用于治疗MDD的抗抑郁剂提供数据支撑。
| [1] | Adewuya AO, Ola BO, Aloba OO, et al. Impact of postnatal depression on infants growth in Nigeria[J]. J Affect Disord, 2008, 108: 191–193. DOI:10.1016/j.jad.2007.09.013 |
| [2] | Weich S, Lewis G. Poverty unemployment and common mental disorders:population based cohort study[J]. BMJ, 1998, 317: 115–119. DOI:10.1136/bmj.317.7151.115 |
| [3] | Fan L, Liu Q, Liao Y. Tacrolimus is an alternative therapy option for the treatment of adult steroid-resistant nephrotic syndrome:aprospective, multicenter clinical trial[J]. Int Urol Nephrol, 2013, 45: 459–468. DOI:10.1007/s11255-012-0205-1 |
| [4] | Liu KH, Wang L, Zhang Y. The clinical research of okra in treatment of diabetic nephropathy[J]. Jilin Med (吉林医学), 2005, 26: 1022–1024. |
| [5] | Li QL, Wang CY, Peng DY, et al. Protective effects of total flavone from the flowers of Ablemoschl manihot L. Medic on the myocardial ischemia/reperfusion injury[J]. Chin J Exp Tradit Med Form (中药实验方剂学杂志), 2006, 12: 39–42. |
| [6] | Wen JY, Chen ZW. Protective effect of pharmacological preconditioning of total flavones of Ablemoschl manihot L. Medic on cerebral ischemic reperfusion injury in rats[J]. Am J Chin Med, 2007, 35: 653–661. DOI:10.1142/S0192415X07005144 |
| [7] | Chen P, Wan YG, Wang CJ, et al. Mechanisms and effects of Abelmoschus manihot preparations in treating chronic kidney disease[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 2252–2256. |
| [8] | Chen G. Studies on the Chemical Constituents and Antihyperglycemic action of Ablemoschl manihot L. Medic (黄蜀葵花的化学成分和降糖活性研究)[D]. Beijing:Academy of Military Medical Sciences, 2006. |
| [9] | Pan W. Experimental Study on Angiogenic Effect and Its Mechalism of Total Flavone of Ablemoschl manihot (黄蜀葵花总黄酮促血管新生作用及机制的实验研究)[D]. Nanjing:Nanjing University of Chinese Medicine, 2010. |
| [10] | Jiang QH. Antidepressant Effects of Total Flavone of Abelmoschus manihot L. Medic on Post Stroke Depression on Model and Its Mechanisms (黄蜀葵总黄酮对脑卒中后抑郁小鼠模型的影响及机制研究)[D]. Anhui:Anhui Medical University, 2007. |
| [11] | Wen S, Zhang GQ, Wang YY, et al. Study progress on pharmacological activity of total flavone of Abelmoschus manihot[J]. World Chin Med (世界中医药), 2014, 9: 1105–1107. |
| [12] | Wang WX, Hu XY, Liu P, et al. Screening of antidepressant activities of ten natural flavonoids[J]. Chin Tradit Herb Drugs (中草药), 2007, 38: 900–902. |
| [13] | Zheng MZ, Liu CM, Pan FG, et al. Antidepressant-like effect of hyperoside isolated from Apocynum venetum leaves:possible cellular mechanisms[J]. Phytomedicine, 2012, 19: 145–149. DOI:10.1016/j.phymed.2011.06.029 |
| [14] | Guo JM, Xue CF, Duan JA, et al. Anticonvulsant, antidepressant-like activity of Abelmoschus manihot ethanol extract and its potential active components in vivo[J]. Phytomedicine, 2011, 18: 1250–1254. DOI:10.1016/j.phymed.2011.06.012 |
| [15] | Ren L, Tao WW, Zhang HL, et al. Two standardized fractions of Gardenia jasminoides Ellis with rapid antidepressant effects are differentially associated with BDNF up-regulation in the hippocampus[J]. J Ethnopharmacol, 2016, 187: 66–73. DOI:10.1016/j.jep.2016.04.023 |
| [16] | Li CM, An YT, Wang T, et al. Isolation and identification of chemical constituents from the flowers of Abelmoschus manihot (L.) Medic (Ⅲ)[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2011, 28: 520–524. |
| [17] | Li GC, Chen CX, Luo JL, et al. Chemical constituents in hypoglycemic active fraction in leaves of Myrica rubra[J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 863–865. |
| [18] | Li CM, Wang T, Zhang Y, et al. Isolation and identification of chemical constituents from the flowers of Abelmoschus manihot (L.) Medic (Ⅱ)[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2010, 27: 803–807. |
| [19] | Yan Q, Rosenfeld RD, Matheson CR, et al. Expression of brain derived neurotrophic factor protein in the adult rat central nervous system[J]. Neuroscience, 1997, 78: 431–448. DOI:10.1016/S0306-4522(96)00613-6 |
| [20] | Sugimoto T, Kuroda H, Horii Y, et al. Signal transduction pathways through TRK-A and TRK-B receptors in human neuroblastoma cells[J]. Jpn J Cancer Res, 2001, 92: 152–160. DOI:10.1111/cas.2001.92.issue-2 |
| [21] | Skup M, Dwornik A, Macias M, et al. Long-term locomotor training up regulates TrkB (FL) receptor-like proteins, brain derived neurotrophic factor, and neurotrophin 4 with different to pographies of expression in oligodendroglia and neurons in the spinal cord[J]. Exp Neurol, 2002, 176: 289–307. DOI:10.1006/exnr.2002.7943 |
| [22] | Monteggia LM, Gideons E, Kavalali ET. The role of eukaryotic elongation factor 2 kinase in rapid antidepressant action of ketamine[J]. Biol Psychiatry, 2013, 73: 1199–1203. DOI:10.1016/j.biopsych.2012.09.006 |
| [23] | Li N, Lee B, Liu RJ, et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists[J]. Science, 2010, 329: 959–964. DOI:10.1126/science.1190287 |
| [24] | Autry AE, Adachi M, Nosyrevaetal E. NMDA receptor blockade at rest triggers rapid behavioural antidepressant responses[J]. Nature, 2011, 475: 91–96. DOI:10.1038/nature10130 |
| [25] | ZarateJr CA, Singh JB, Carlsonetal PJ. A randomized trial of an N-methyl-D-aspartate antagonist in treatment-resistant major depression[J]. Arch Gen Psychiatry, 2006, 63: 856–864. DOI:10.1001/archpsyc.63.8.856 |
| [26] | Berman RM, Cappiello A, Anand A, et al. Antidepressant effects of ketamine in depressed patients[J]. Biol Psychiatry, 2000, 47: 351–354. DOI:10.1016/S0006-3223(99)00230-9 |
| [27] | Price RB, Nock MK, Charney DS, et al. Effects of intravenous ketamine on explicit and implicit measures of suicidality in treatment-resistant depression[J]. Biol Psychiatry, 2009, 66: 522–526. DOI:10.1016/j.biopsych.2009.04.029 |
| [28] | Kawabata K, Kawai Y, Terao J. Suppressive effect of quercetin on acute stress-induced hypothalamic-pituitary-adrenal axis response in Wistar rats[J]. J Nutr Biochem, 2010, 21: 374–380. DOI:10.1016/j.jnutbio.2009.01.008 |
 2017, Vol. 52
2017, Vol. 52


