2. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
近年来, 内生菌尤其是内生真菌与宿主植物的共生理论、机制以及应用研究获得快速发展[1], 内生菌作为植物生长发育和代谢过程中不可忽视的一部分, 其种群生物学功能对植物的生长发育、次生代谢、应对生物与生物胁迫等方面产生重要影响; 反过来, 宿主植物基因型和内环境也塑造着内生菌的群
落结构和组成特征。内生菌的研究, 增强了人们对植物品质影响因素的认识, 也解决了许多传统方法无法解决的问题, 多种内生菌已被商业化应用于植物的栽培和驯化, 极大的增强了人们对内生菌微生态功能的认识[2-4]。本文就近年来内生菌与植物的互作理论和作用机制、研究前沿、实际应用等进行综述, 并对内生菌在药材道地性形成中的作用进行探讨, 以加强人们对内生菌影响药用植物生长、发育、品质的认识提供参考。
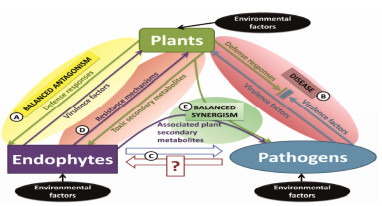
1 内生菌与植物的互作关系 1.1 互作理论和机制研究进展研究表明, 每株植物都是一个复杂的生态共同体, 而不是单一生命个体[5, 6]。植物诞生之初就伴随着内生菌的共生[7], 它们之间的互作可以追溯到400万年以前, 这对植物的营养、发育、抗逆性等产生巨大影响, 因此, “这必须作为一种普遍存在, 而不是看作例外”[8, 9]。近些年, 内生菌与宿主植物互作关系迅速发展, 存在“马赛克理论”(mosaic effect)[10, 11]、“获得性免疫系统”(acquired immune systems)[12]、“外源性化学兴奋效应”(xenohormesis)[13]等理论, 而占主流的、公认的是Schulz等[14]提出的“平衡对抗”(balanced antagonism)理论, 并随着代谢组学、分子科学的发展而逐步完善, 该理论认为内生菌和植物之间是一种内生菌毒力因子与宿主的防御和免疫系统之间的平衡对抗, 并长期共存、协同进化, 这不同于病原菌[15](图 1A); 如果微生物释放的毒力因子超过了宿主防御系统的抵抗力, 植物则表现出病症; 如果植物防御系统超过毒力因子, 微生物将被杀死(图 1B); 而内生菌作为潜在的病原菌, 其身份受到宿主生理状态和环境因子的影响, 如羊茅香柱菌(Epichloe festucae)促分裂原活化蛋白激酶基因(sakA)的表达对于该菌维持与宿主多年生黑麦草(Lolium perenne)之间的共生关系很重要, 它可以控制该菌不会变成病原菌(图 1C)[16]; 实际上, 二者平衡并不是简单的毒力因子和防御系统的对抗, 其维持机制远比毒力因子和防御系统平衡更复杂和精密(图 1D)。比如, 药用植物喜树(Camptotheca acuminata)产生的喜树碱能够通过绑定拓朴异构酶Ⅰ-DNA来抑制微生物拓朴异构酶Ⅰ复合体的活性[11, 17]。而分离自喜树树皮内的一株能产生喜树碱的腐皮镰孢霉(Fusarium solani)则能通过一种特有氨基酸残基结合在喜树碱与拓扑异构酶Ⅰ结合的活性结构域, 防止自己的拓扑异构酶Ⅰ失活, 进而免受自身或宿主产生的喜树碱的攻击[11]; 而另一种不产生喜树碱的内生真菌则是存在一种独特的编码拓朴异构酶Ⅰ的方式来抵抗宿主喜树碱的活性[11, 18]。因此, 侵入喜树的微生物转变为内生菌的首要条件是具有抵御喜树碱攻击的机制, 进而与宿主建立平衡的共生关系并协同进化。实际上, 内生菌与宿主之间互作关系远比想象的复杂。比如, 在体外条件下, 内生真菌F. solani产生喜树碱的生物能力逐渐减低, 甚至消失。研究表明, 该菌能够产生喜树碱的前体, 但是缺少来自宿主植物提供的异胡豆苷合成酶(stritosidine synthase), 而无法合成喜树碱。因此, 这不仅仅是二者之间横向基因转移的问题[11, 18]!这也是在体外培养条件下, 许多活性内生菌的活力不稳定, 甚至逐步消失, 一直无法实现大量生产的原因之一。因此, 阐明理论和机制, 是解决实际应用的前提。
|
Figure 1 Chemical-ecological schematic interpretation of plant-fungus cost-benefit interactions with emphasis on endo phytic fungi. (A) Balanced antagonism hypothesis is shown. (B) Plant disease caused by pathogenic fungi is presented. (C) Endophyte-pathogen reciprocity is demonstrated. The question mark indicates that this phenomenon might not be universal, and further research is necessary for verification. (D) Endophyte survival strategy is illustrated. (E) Balanced synergism is shown[11] |
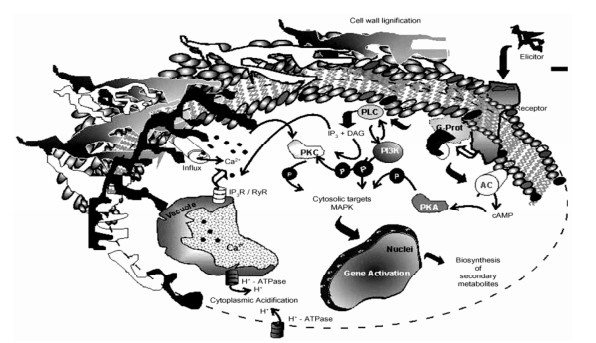
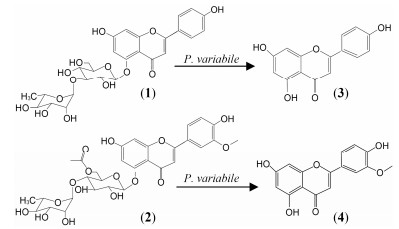
对于内生菌与宿主之间的互作机制, 其研究的难点主要是: ①植物同时与大量微生物相互作用; ②各内生菌之间也存在互作关系; ③体外很难模拟它们之间的真实互作关系。就目前研究发现来看, 内生菌影响植物代谢、生理、化学成分组成发生在分子和细胞水平的3个主要机制包括: ①通过产生多样化合物, 作为植物代谢物前体或直接成为其组成部分, 或被宿主吸收利用, 进而影响宿主生长发育和代谢。内生菌能通过直接产生各种代谢物, 还能产生植物激素, 如GA、ABA、SA、IAA等, 促进植物的发育[19]; 产生黄酮类物质(如isoflavonoids, flavones, flavonols类)作为抗氧化调节、信使物质、物质合成前体[20]; 产生植物抗毒素、抗生素、挥发性化合物等促进植物提高应对生物胁迫[21]。另外, 内生菌直接参与了与宿主的C、N、P等营养元素的循环, 帮助宿主更好的发育和生长[22, 23]; ②通过“诱导子”效应[24]或“横向基因转移”[25]等改变宿主基因表达和代谢途径。植物能够通过化学识别系统检测到内生菌释放分子的存在, 触发植物产生信号转导网络, 进而引起植物反应应答, 导致相关基因活性的变化, 导致某些次生代谢物的积累(图 2)[24]。另外, 植物-内生菌之间发生的横向基因交换也可能导致植物次生代谢产物的改变[26]; ③通过“生物转化”作用对宿主化合物产生影响[27]。许多研究表明, 某些内生菌能够对植物的代谢物进行“再加工”, 使之转化成了另外的化合物, 这造成了某些有毒化合物的降解或使植物具有另外功能, 对植物的代谢组成产生巨大影响[28]。研究人员在对柱冠粗榧Cephalotaxus harringtonia叶子中超过1 000个化合物观察中, 发现内生真菌变形盾壳霉Paraconiothyrium variabile能够专一性地将糖基黄酮类物质去糖苷化而转化作用成糖苷配体(合成路线图 1)[27]。当然, 内生菌在不同植物中可能存在各自不同的互作机制, 这需要进一步的深入研究。
|
Figure 2 Key signalling events triggered by the elicitation process[24] |
|
Scheme1 Biotransformations by P. variabile of the glycosy lated flavonoids (1, 2) and isolated from the crude extract of C. harringtonia and structures of the obtained aglycone moieties (3, 4) evidenced by metabolomics[27] |
现代研究从多个角度证明了内生菌与宿主植物生理状态和代谢的密切关系[29, 30]。内生菌与植物的生理状态和化学成分之间存在相关性已经在多种植物中证实。Azofeifa等[30]研究表明, 内生菌群落与海葡萄属植物Coccoloba cereifera叶片特性随着叶子年龄改变而动态变化, 内生菌数量与叶子含水量(r=0.30, P < 0.000 4)、多酚含量(r=0.40, P < 0.001)呈正相关关系, 与总叶绿体浓度具有低相关性(r=0.20, P < 0.05);另有报道称某些内生真菌能提高叶绿素含量, 促进光合速率[31, 32]。
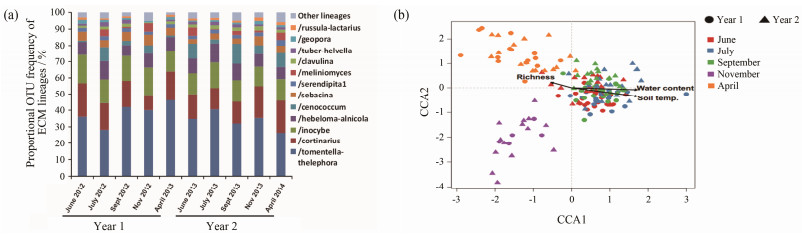
内生菌多样性和群落特征受到植物基因型、年龄、生理状态、季节、海拔、温度和湿度等环境因子的影响[33-35], 是宿主生理状态的评价标志之一。Bulgari等[33]发现葡萄内生菌群落组成与植物感染状态、生长月份之间都存在紧密相关性, 也发现植物病原菌感染过程能够减弱季节对植物内生菌生态动力学的影响, 伯克氏菌属Burkholderia、甲基杆菌属Methylobacterium和泛菌属Pantoea等的内生菌动态受到宿主植物病理状态和季节的影响。Mundra等[34]采用宏基因组技术研究了夏季和冬季, 以及对应环境因子(土壤pH值、N元素、C元素、有机质、水含量、温度等)条件下北极高纬度植物珠芽蓼Bistorta vivipara的ECM菌(隶属于丝膜菌属Cortinarius、Serendipita和蜡壳菌属Sebacina)生态分布存在规律性, 表明ECM真菌在冬天具有更高的丰富性, 群落结构主要受空间条件限制, 见图 3[35]。
|
Figure 3 Proportion of operational taxonomic units (OTUs) richness for different ectomycorrhizal fungal lineages for each sampling month (a) and effects on OTUs by spatial eigenvectors and sampling year (b)[35] |
内生菌能对植物代谢化学组成造成重大影响, 在植物各组织的分布不同, 对植物不同组织的影响也不同[36]。如内生菌链霉菌Streptomyces spp.能促进宿主植物桉树Eucalyptus spp.生长并调控其次生代谢产物, 前者产生idol-3-acetic acid, 改变后者酶活性, 改变酚类化合物和黄酮类水平[37]; 而波浪芽管孢属Undifilumspp.真菌专一共生于棘豆属Oxytropisspp.和黄芪属Astragalus spp.等多种植物[38, 39], 并以种子纵向传播方式繁殖, Undifilumspp.的存在及数量与宿主植物中苦马豆素(SW)化合物含量呈正相关关系:去掉这种菌, 宿主就很少或没有SW; Undifilum spp.菌种数量和SW浓度也是地上植物(茎、叶)组织高于地下组织(根); 种皮高于胚内[40]。Hartley等[41]将优势的毛壳属Chaetomium cochlioides成功接种于丝路蓟Cirsium arvense中, 叶子整体代谢组成分发生明显改变, 并产生新的氧脂素(oxylipin)代谢物, 如一种新拟南芥素和含有茉莉酮酸酯的半乳糖酯类化合物等, 内生菌对新叶片和老叶片的化学成分组成都产生了重要影响(图 4)。
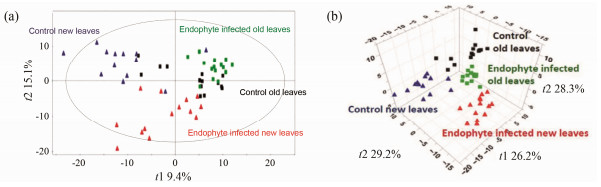
|
Figure 4 Effects of endophyte C. cochlioides on the metabolome profile of leaf biochemistry in C. arvense. Note: Principal compo nent analysis (a), partial least squares-discriminant analysis (b) and ultra high performance liquid chromatography-time-of-flight mass spectrometry in positive electrospray ionization mode were used on analysis of leaf extractions analysis[41] |
利用内生菌进行植物品质改良, 主要通过改造单个菌或重建内生菌群落来实现, 具有环保、绿色、可持续性强等诸多优点。目前, 已经有一些菌株得到大规模商业化应用, 比如, 长柄木霉Trichoderma harziamum、淡紫拟青霉Paecilomyces lilicinus、球孢白僵菌Beauveria bassiana、尖孢镰刀菌Fusarium oxysporum等菌应用于生防控制, 其优势是可以直接处理种子或幼苗, 避免处理大量的土壤和已经成年的植物[3, 4, 42], 具有可持续性好, 减少污染、降低成本等优点。在澳大利亚新近批准的商业化生产中, 内生真菌Neotyphodium lolii经过基因改造为新菌株AR1 (EAR1)和AR37 (EAR37), 接种于黑麦草Lolium perenne, 极大地改变后者代谢谱, 产生原本不存在的生物碱, 如麦角缬碱(ergovaline)、震颤素B (lolitrem B)和波胺(peramine)等, 使宿主具备无毒、产量高、抗逆性强等优良品质[2, 43]。然而, 采用重建内生菌微生态群落进而改良植物品质方面尚未有大的突破, 这也是该领域的难点, 需要更多的探索。
2 内生菌对药用植物生长发育的影响道地中药材是被传统医疗实践证明了的、生长于特定地域、具有良好治病疗效药材的代名词[44]。传统观点认为, 道地药材是植物基因型和环境相互作用的产物[45]。环境条件又分为外环境和内环境, 传统研究突出关注了植物外环境的作用, 对于内环境缺乏足够的认识[45]。而内生菌则是植物内环境的重要组成部分[46], 对药用植物品质的影响主要表现在以下几个方面。
2.1 促进种子萌发和生长发育内生菌对某些药用植物种子的萌发起着关键作用。野生条件下, 名贵中药天麻(Gastrodia elata Bl.)种子萌发率极低, Xu等[47, 48]发现分离自天然条件下天麻发芽种子中的紫萁小菇、兰小菇、石斛小菇等内生真菌, 能够极大的提高种子发芽率; 人们也发现蜜环菌能促进天麻幼苗健康而优质的生长发育[49], 这有效提高了天麻的育种品质和栽培难题。
内生菌促进药用植物生长发育, 发现了至少两个途径: ①产生赤霉素(GA)、吲哚乙酸(IAA)等植物生长激素[50]; ②参与宿主植物的C、N、P、K、Ca、Mo等元素的循环和吸收[22, 23]。内生菌Penicillium resedanum能产生赤霉素GA3, 促进川椒Capsicum annuum在盐、高温、干旱条件下根的生长、生物量和叶绿素的提高[51]。
2.2 促进宿主活性代谢物积累目前, 国内外学者在苍术、石斛、红豆杉、喜树、杜仲、银杏、白木香、龙血树等的药材中都进行了积极探索[1, 52], 它们活性成分的积累与内生菌种群功能有着密切的关系, 有些尤其密切。比如, 我国珍稀中药龙血竭, 是在真菌侵染条件下激活龙血树(Dracaena spp.)免疫系统产生的防御性产物。我国学者从龙血树产生天然血竭部位分离出优势内生真菌镰孢霉等真菌, 接入到健康的树木或者落叶上, 都能在较短的时间内产生高质量的血竭[53-55]; 目前, 在我国云南等地, 采用为植物“输液”的办法, 将真菌孢子输入龙血树体内, 大大提高了血竭质量和产量。
2.3 内生菌代谢产物影响植物生物活性内生菌自身产生的代谢产物, 包括与宿主相同的代谢产物[56]和新天然产物[57], 极大的影响药用植物的代谢组成。一株从香桃木Myrtus communis中分离的内生真菌Neofusicoccum australe能产生桃金娘科植物的活性成分香桃木酮系列化合物及其衍生物, 其粗提物具有抑制肿瘤增殖、抗炎等活性[57], 其代谢物分泌至植物中, 直接影响宿主植物的代谢物组成和生物活性。
2.4 提高药用植物的抗逆性内生菌能有效的促进药用植物对温度、pH值、盐、渗透压、紫外、虫及病害的胁迫作用。研究表明, 生长于美国黄石公园的二型花属植物Dichanthelium lanugunasum与优势内生真菌弯孢属Curvularia protuberata真菌共生才能适应38 ℃的地热高温, 而单独培养, 就会死亡[58]。优势真菌黄色镰孢霉Fusarium culmorum于宿主植物滨麦Leymus mollis共生能够抵抗高盐环境, 而从非海水中获得的F. culmorum则不具有这种功能[59]。
2.5 内生菌协助植物应对海拔、季节、气候等的变化不同基因型的植物在特有的环境中, 选择了特有的内生菌群, 而内生菌群对不同生境植物生理、化学和活性具有重要影响, 是植物的表观特征之一。本课题组研究了分布于我国青藏高原和东北长白山高海拔地区的大花红景天(Rhodiola crenulata)、长白红景天(R. angusta)和库页红景天(R. sachalinensis)的内生真菌生态和功能[60], 发现两个地方3个品种红景天存在着种属专一性和地区专一性。R. crenulata, R. angusta和R. sachalinensis各自专一性菌种分别为17, 7和15株; 研究也发现西藏R. crenulata中分离的球孢白僵菌Beauveria bassiana (Ophiocordyceps bassiana无性型)和僵尸菌属真菌Ophiocordycepssp.属于我国西南地区和尼泊尔的特有菌[61-62], 这不同于东北红景天内生菌。另外, 本课题组还分离出与宿主相同抗氧化功能活性的内生真菌[63], 将这些真菌与红景天共培养, 能够保证低海拔条件下红景天的正常发育并提高红景天苷和酪醇的产量[64]。
药用植物是以植物基因型为主, 环境因素作为催化剂促成的植物-内生菌协同进化体[42]。对于药材品质的评价研究, 还需注意:基因型和环境条件的不同, 内生菌在不同植物甚至不同组织中所起作用不同, 内生菌的研究需要根据传统药材的特性和存在的问题, “有的放矢”的进行; 研究要具有系统性, 要结合传统理念。互作药材研究不仅要研究其“活性成分”, 也要研究整体代谢组的变化; 还要进行道地产区和非道地产区的比较研究; 研究多年生的药材要连续跟踪足够的年份等。
3 结语内生菌贯穿于药用植物的各个发育阶段, 对药用植物的萌发、生长、代谢、应对胁迫、成熟与凋亡等阶段都产生重要影响, 对药用植物品质的评价, 是包括了内生菌在内的所有影响因子的评价。随着宏转录组学、蛋白质组学、宏基因组学、代谢组学等“组学”手段的联合应用, 人们对药用植物品质的评价和认识将更客观和全面。
| [1] | Jia M, Chen L, Xin HL, et al. A friendly relationship between endophytic fungi and medicinal plants:a systematic review[J]. Front Microbiol, 2016, 7: 906. |
| [2] | Woodfield DR, Easton HS. Advances in pasture plant breeding for animal productivity and health[J]. N Z Vet J, 2004, 52: 300–310. DOI:10.1080/00480169.2004.36446 |
| [3] | Mendoza AR, Sikora RA. Biological control of Radopholus similis by coapplication of the mutualistic endophyte Fusarium oxysporum strain 162, the egg pathogen Paecilomyces lilacinuss train 251 and the antagonistic bacteria Bacillus firmus[J]. Biocontrol, 2009, 54: 263–272. DOI:10.1007/s10526-008-9181-x |
| [4] | Sikora RA, ZumFelde A, Mendoza A, et al. In planta suppressiveness to nematodes and long-term root health stability through biological enhancement-do we need a cocktail[J]. Acta Hort, 2010, 879: 553–560. |
| [5] | Rodriguez RJ, White JF Jr, Arnold AE, et al. Fungal endophytes:diversity and functional roles[J]. New Phytol, 2009, 182: 314–330. DOI:10.1111/j.1469-8137.2009.02773.x |
| [6] | Rey T, Schornack S. Interactions of beneficial and detrimental root-colonizing filamentous microbes with plant hosts[J]. Genome Biol, 2013, 14: 121–127. DOI:10.1186/gb-2013-14-6-121 |
| [7] | Redecker D, Kodner R, Graham LE. Glomalean fungi from the Ordovician[J]. Science, 2000, 289: 1920–1921. DOI:10.1126/science.289.5486.1920 |
| [8] | Strobel G, Daisy B, Castillo U, et al. Natural products from endophytic microorganisms[J]. J Nat Prod, 2004, 67: 257–268. DOI:10.1021/np030397v |
| [9] | Partida-Martínez LP, Heil M. The microbe-free plant:fact or artifact[J]. Front Plant Sci, 2011, 2: 100. |
| [10] | Carroll GC. In Microbial Ecology of Leaves[M]. New York: Springer-Verlag, 1991: 358-375. |
| [11] | Kusari S, Hertweck C, Spiteller M. Chemical ecology of endophytic fungi:origins of secondary metabolites[J]. Chem Biol, 2012, 19: 792–798. DOI:10.1016/j.chembiol.2012.06.004 |
| [12] | Arnold AE, Mejía LC, Kyllo D, et al. Fungal endophytes limit pathogen damage in a tropical tree[J]. Proc Natl Acad Sci USA, 2003, 100: 15649–15654. DOI:10.1073/pnas.2533483100 |
| [13] | Howitz KT, Sinclair DA. Xenohormesis:sensing the chemical cues of other species[J]. Cell, 2008, 133: 387–391. DOI:10.1016/j.cell.2008.04.019 |
| [14] | Schulz B, Guske S, Dammann U, et al. Endophyte-host interactions. Ⅱ. Defining symbiosis of the endophyte-host interaction[J]. Symbiosis, 1998, 25: 213–227. |
| [15] | Parniske M. Arbuscular mycorrhiza:the mother of plant root endosymbioses[J]. Microbiology, 2008, 6: 763–775. |
| [16] | Eaton CJ, Cox MP, Scott B. What triggers grass endophytes to switch from mutualism to pathogenism[J]. Plant Sci, 2011, 180: 190–195. DOI:10.1016/j.plantsci.2010.10.002 |
| [17] | Sirikantaramas S, Yamazaki M, Saito K. A survival strategy:the coevolution of the camptothecin biosynthetic pathway and self-resistance mechanism[J]. Phytochemistry, 2009, 70: 1894–1898. DOI:10.1016/j.phytochem.2009.07.034 |
| [18] | Kusari S, Zühlke S, Spiteller M. Effect of artificial reconstitution of the interaction between the plant Camptotheca acuminata and the fungal endophyte Fusarium solani on camptothecin biosynthesis[J]. J Nat Prod, 2011, 74: 764–775. DOI:10.1021/np1008398 |
| [19] | Shen L, Li LY, Zhang XJ, et al. A new indole derivative from endophyte Myrothecium roridum IFB-E091 in Artemisia annua[J]. Acta Pharm Sin (药学学报), 2015, 50: 1305–1308. |
| [20] | Hassan S, Mathesius U. The role of falvonoids in rootrhizosphere signaling:opportunities and challenges for improving plant-microbe interactions[J]. J Exp Bot, 2012, 63: 3429–3444. DOI:10.1093/jxb/err430 |
| [21] | Estrada C, Wcislo WT, Bael SAV. Symbiotic fungi alter plant chemistry that discourages leaf-cutting ants[J]. New Phytol, 2013, 198: 241–251. DOI:10.1111/nph.12140 |
| [22] | Sessitsch A, Hardoim P, Döring J, et al. Functional characteristics of an endophyte community colonizing rice roots as revealed by metagenomic analysis[J]. Mol Plant Microbe Interact, 2012, 25: 28–36. DOI:10.1094/MPMI-08-11-0204 |
| [23] | Johri AK, Oelmüller R, Dua M, et al. Fungal association and utilization of phosphate by plants:success, limitations, and future prospects[J]. Front Microbiol, 2015, 6: 984–997. |
| [24] | Vasconsuelo A, Boland R. Molecular aspects of the early stages of elicitation of secondary metabolites in plants[J]. Plant Sci, 2007, 172: 861–875. DOI:10.1016/j.plantsci.2007.01.006 |
| [25] | Gluck-Thaler E, Slot JC. Dimensions of horizontal gene transfer in eukaryotic microbial pathogens[J]. PLoS Pathog, 2015, 11: e1005156. DOI:10.1371/journal.ppat.1005156 |
| [26] | Ambrose KV, Koppenhöfer AM, Belanger FC. Horizontal gene transfer of a bacterial insect toxin gene into the Epichloë fungal symbionts of grasses[J]. Sci Rep, 2014, 4: 5562. |
| [27] | Tian Y, Amand S, Buisson D, et al. The fungal leaf endophyte Paraconiothyrium variabile specifically metabolizes the hostplant metabolome for its own benefit[J]. Phytochemistry, 2014, 108: 95–101. DOI:10.1016/j.phytochem.2014.09.021 |
| [28] | Sun K, Liu J, Gao Y, et al. Isolation, plant colonization potential, and phenanthrene degradation performance of the endophytic bacterium Pseudomonas sp. Ph6-gfp[J]. Sci Rep, 2014, 4: 5462. |
| [29] | Rajala T, Sannakajsa MV, Vesala R, et al. The community of needle endophytes reflects the current physiological state of Norway spruce[J]. Fungal Biol, 2014, 118: 309–315. DOI:10.1016/j.funbio.2014.01.002 |
| [30] | Sanchez-Azofeifa A, Oki Y, Fernandes GW, et al. Relationships between endophyte diversity and leaf optical properties[J]. Trees, 2012, 26: 291–299. DOI:10.1007/s00468-011-0591-5 |
| [31] | Costa-Pinto L, Azevedo JL, Pereira JO, et al. Symptomless infection of banana and maize by endophytic fungi impairs photosynthetic efficiency[J]. New Phytol, 2000, 147: 609–615. DOI:10.1046/j.1469-8137.2000.00722.x |
| [32] | Hunt MG, Rasmussen S, Newton PCD, et al. Near-term impacts of elevated CO2, nitrogen and fungal endophyte-infection on Lolium perenne L. growth, chemical composition and alkaloid production[J]. Plant Cell Environ, 2005, 28: 1345–1354. DOI:10.1111/pce.2005.28.issue-11 |
| [33] | Bulgari D, Casati P, Quaglino F, et al. Endophytic bacterial community of grapevine leaves influenced by sampling date and phytoplasma infection process[J]. BMC Microbiol, 2014, 14: 198. DOI:10.1186/1471-2180-14-198 |
| [34] | Mundra S, Bahram M, Tedersoo L, et al. Temporal variation of Bistorta vivipara-associated ectomycorrhizal fungal communities in the High Arctic[J]. Mol Ecol, 2015, 24: 6289–6302. DOI:10.1111/mec.13458 |
| [35] | Vargas-Gastélum L, Romero-Olivares AL, Escalante AE, et al. Impact of seasonal changes on fungal diversity of a semiarid ecosystem revealed by 454 pyrosequencing[J]. FEMS Microbiol Ecol, 2015. DOI:10.1093/femsec/fiv044 |
| [36] | Saikkonen k, Gundel PE, Helander M. Chemical ecology mediated by fungal endophytes in grass[J]. J Chem Ecol, 2013, 39: 962–968. DOI:10.1007/s10886-013-0310-3 |
| [37] | Salla TD, Silva TRD, Astarita LV, et al. Streptomyces rhizobacteria modulate the secondary metabolism of Eucalyptus plants[J]. Plant Physiol Bioch, 2014, 85: 14–20. DOI:10.1016/j.plaphy.2014.10.008 |
| [38] | Oldrup E, McLain-Romero J, Padilla A, et al. Localization of endophytic Undifilum fungi in locoweed seed and influence of environmental parameters on a locoweed in vitro culture system[J]. Botany, 2010, 88: 512–521. DOI:10.1139/B10-026 |
| [39] | Grum DS, Cook D, Gardner DR, et al. Influence of seed endophyte amounts on swainsonine concentrations in Astragalus and Oxytropis locoweeds[J]. J Agric Food Chem, 2012, 60: 8083–8089. DOI:10.1021/jf3024062 |
| [40] | Cook D, Gardner DR, Pfister JA. Swainsonine-containing plants and their relationship to endophytic fungi[J]. J Agric Food Chem, 2014, 62: 7326–7334. DOI:10.1021/jf501674r |
| [41] | Hartley SE, Eschen R, Horwood JM, et al. Infection by a foliar endophyte elicits novel arabidopside-based plant defence reactions in its host, Cirsium arvense[J]. New Phytol, 2015, 205: 816–827. DOI:10.1111/nph.13067 |
| [42] | Wani ZA, Ashraf N, Mohiuddin T, et al. Plant-endophyte symbiosis, an ecological perspective[J]. Appl Microbiol Biotechnol, 2015, 99: 2955–2965. DOI:10.1007/s00253-015-6487-3 |
| [43] | Qawasmeh A, Obied HK, Raman A, et al. Influence of fungal endophyte infection on phenolic content and antioxidant activity in grasses:interaction between Lolium perenne and different strains of Neotyphodium lolii[J]. J Agric Food Chem, 2012, 60: 3381–3388. DOI:10.1021/jf204105k |
| [44] | Xiao XH, Chen SL, Huang LQ, et al. Survey of investigation on Daodi Chinese medicinal materials in China since 1980s[J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 519–523. |
| [45] | Chen ML, Huang LQ, Ouyang SH, et al. The role of endophytes in genuineness analysis of medicinal plant[J]. China J Inf Tradit Chin Med (中国中医药信息杂志), 2006, 13: 40–42. |
| [46] | Jiang S, Qian DW, Duan JA, et al. Research on correlation between plant endophytes and geoherbalism[J]. Chin Tradit Herb Drugs (中草药), 2008, 39: 1268–1272. |
| [47] | Xu JT, Guo SX. Nutrition for seed germination of Gastrodia elata by Mycena osmundicola[J]. Mycosystema (真菌学报), 1989, 8: 221–226. |
| [48] | Guo SX, Wang QY. Character and action of good strain from Mycena dendrobiion stimulating seed germination of Gastrodia elata[J]. Mycosystema (菌物学报), 2001, 20: 408–412. |
| [49] | Zhang WJ, Li BF. The relationship between Gastrodia elata and Armillaria mellea[J]. J Integr Plant Biol (植物学报), 1980, 22: 57–62. |
| [50] | Khan AL, Al-Harrasi A, Al-Rawahi A, et al. Endophytic fungi from frankincense tree improves host growth and produces extracellular enzymes and indole acetic acid[J]. PLoS One, 2016, 11: e0158207. DOI:10.1371/journal.pone.0158207 |
| [51] | Khan AL, Waqas M, Lee IJ. Resilience of Penicillium resedanum LK6 and exogenous gibberellin in improving Capsicum annuum growth under abiotic stresses[J]. J Plant Res, 2015, 128: 259–268. DOI:10.1007/s10265-014-0688-1 |
| [52] | Zhang DW, Zhao MM, Chen J, et al. Isolation, identification and anti-HIV-1 integrase activity of culturable endophytic fungi from Tibetan medicinal plant Phlomis younghusbandii Mukerjee[J]. Acta Pharm Sin (药学学报), 2013, 48: 780–789. |
| [53] | Cui JL, Wang CL, Guo SX, et al. Stimulation of dragon's blood accumulation in Dracaena cambodiana via fungal inoculation[J]. Fitoterapia, 2013, 87: 31–36. DOI:10.1016/j.fitote.2013.03.012 |
| [54] | Wang XH, Zhang C, Yang LL, et al. Production of dragon's blood in Dracaena cochinchinensis plants by inoculation of Fusarium proliferatum[J]. Plant Sci, 2011, 180: 292–299. DOI:10.1016/j.plantsci.2010.09.007 |
| [55] | Wang XH, Zhang CH, Wang Y, et al. Screen of microorganisms for inducing the production of dragon's blood by leaf of Dracaena cochinchinensis[J]. Lett Appl Microbiol, 2010, 51: 504–510. DOI:10.1111/lam.2010.51.issue-5 |
| [56] | Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew[J]. Science, 1993, 260: 214–216. DOI:10.1126/science.8097061 |
| [57] | Nicoletti R, Ferranti P, Caira S, et al. Myrtucommulone production by a strain of Neofusicoccum australe endophytic in myrtle (Myrtus communis)[J]. World J Microbiol Biotechnol, 2014, 30: 1047–1052. DOI:10.1007/s11274-013-1523-x |
| [58] | Redman RS, Sheehan KB, Stout TG, et al. Thermotolerance generated by plant/fungal symbiosis[J]. Science, 2002, 298: 1581. DOI:10.1126/science.1072191 |
| [59] | Rodriguez R, Redman R. More than 400 million years of evolution and some plants still can't make it on their own:plant stress tolerance via fungal symbiosis[J]. J Exp Bot, 2008, 59: 1109–1114. DOI:10.1093/jxb/erm342 |
| [60] | Cui JL, Guo TT, Ren ZX, et al. Diversity and antioxidant activity of culturable endophytic fungi from alpine plants of Rhodiola crenulata, R. angusta, and R. sachalinensis[J]. PLoS One, 2015, 10: e0118204. DOI:10.1371/journal.pone.0118204 |
| [61] | Sung GH, Hywel-Jones NL, Sung JM, et al. Phylogenetic classification of Cordyceps and the clavicipitaceous fungi[J]. Stud Mycol, 2007, 57: 5–59. DOI:10.3114/sim.2007.57.01 |
| [62] | Zheng P, Xia YL, Zhang SW, et al. Genetics of Cordyceps and related fungi[J]. Appl Microbiol Biotechnol, 2013, 97: 2797–2804. DOI:10.1007/s00253-013-4771-7 |
| [63] | Wang ML, Guo TT, Zhang NS, et al. Identification and fermentation optimization of two endophytic fungi from Rhodiola angusta[J]. Nat Prod Res Dev (天然产物研究与开发), 2015, 27: 667–673. |
| [64] | Cui JL, Guo TT, Chao JB, et al. Potential of the endophytic fungus Phialocephala fortinii Rac56 found in Rhodiola plants to produce salidroside and p-tyrosol[J]. Molecules, 2016, 21: 502. DOI:10.3390/molecules21040502 |
 2017, Vol. 52
2017, Vol. 52



