近年来, 肿瘤疾病越来越受到人们关注, 由于其高发病率、高死亡率的特点, 是人类健康的重大威胁, 是一直困扰世界、亟待解决的难题。与之同样广泛受到人们关注的疾病还有心脑血管疾病。心脑血管疾病居各种病因之首, 因其高患病率、高致残率及高死亡率的特点, 世界每年心脑血管疾病死亡人数上千万。
随着科学技术的发展, 越来越多的研究发现, 疾病具有不同于正常组织的微环境, 研究者针对疾病微环境探索出许多微环境特定响应型药物载体, 称为环境响应型载体, 又叫刺激响应性载体。在过去10年里, 刺激响应性载体取得了巨大的成功。在特定环境控制药物的释放中, 刺激响应性载体分为内源性刺激响应性载体和外源性刺激响应性载体[1]。内源性刺激主要是pH[2]和氧化还原物质(还原性谷胱甘肽[3]、ROS[4]); 外源性刺激主要是光[5]、超声[6]、磁场[7]和热[8]。
ROS主要包括过氧化氢(H2O2)[9]、单线态氧(1O2)[10]、羟基自由基(·OH)[11]和超氧化物[9], 在许多生理过程中如细胞信号[12]和先天免疫[9]起着关键性作用。然而, ROS的过度表达会破坏生物大分子, 引起疾病[9]。在很多疾病中都发现ROS过度表达、水平升高的现象。例如, 肿瘤组织的ROS水平明显比正常组织高, 正常组织的H2O2浓度严格控制在20 nmol·L-1左右, 而肿瘤组织由于过量H2O2的产生和累积, H2O2浓度达50~100 μmol·L-1[13]。ROS水平在肿瘤细胞的增殖和转移期间也会出现升高[14]。此外, ROS水平升高还出现在炎症[15]、心脑血管疾病(动脉粥样硬化[16]和高血压[17])、糖尿病[18]及神经退行性疾病(阿尔茨海默病[19])。
利用病变组织高水平ROS的环境, 研究者探索出许多ROS响应性药物载体。ROS响应性药物载体包括含硫多聚物ROS响应载体[14]、含硒多聚物ROS响应载体[20]、含碲多聚物ROS响应载体[21]和含不饱和脂质ROS响应载体[10]等(表 1)[14, 22-34]。
| Table 1 Reactive oxygen species (ROS)-responsive materials |
硫是非金属元素, 具有还原性, 能被氧化。含硫多聚物也具有还原性, 能在ROS的环境下被氧化, 如硫醚被H2O2氧化为亚砜后, 疏水性物质转变为亲水性物质, 水溶性显著性增强, 实现药物在H2O2环境的响应性释放; 酮缩硫醇(thioketal)在ROS环境下化学键断裂, 生成酮和硫醇, 实现药物释放[9]。
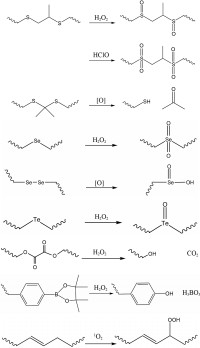
聚丙烯硫醚[poly (propylene sulfide), PPS]是具有硫醚结构的疏水性多聚物。PEG-PPS-PEG是PPS和PEG的三嵌段聚合物, 利用PEG-PPS-PEG[35] (图 1a)制备的囊泡在0.03% H2O2中被缓慢氧化, 但10天后未能完全氧化, 而在10% H2O2中10 h即被完全氧化。说明H2O2浓度越高, PEG-PPS-PEG被氧化速率越快。PEG-575EDT-PEG[22] (图 1b)是具有硫醚结构的三嵌段共聚物, 将其用于制备尼罗红纳米粒, 通过其荧光强度可以知道纳米粒的ROS响应情况, 在无H2O2的条件下, 纳米粒的荧光强度不变, 说明尼罗红纳米粒在无H2O2的环境下无ROS响应; 在50 mmol·L-1 H2O2中6 h纳米粒的荧光强度约下降80%;在200 mmol·L-1 H2O2中其荧光强度下降大于90%。因此, PEG-575EDT-PEG制备的纳米粒具有ROS响应特征。
|
Figure 1 Chemical structures of sulfur-based ROS responsive polymers based on ROS responsive motifs (the red). a: Poly (ethylene glycol)-poly (propylene sulfide)-poly (ethylene glycol), PEG-PPS-PEG; b: Poly (ethylene glycol)-1, 2-ethanedithiol-poly (ethylene glycol), PEG-575EDT-PEG; c: Poly-(1, 4-phenyleneacetone dimethylene thioketal), PPADT |
酮缩硫醇是ROS响应基团, 酮缩硫醇多聚物在炎症和肿瘤中应用较多。炎症和肿瘤具有高水平的ROS, 能够使酮缩硫醇化学键断裂, 实现药物释放。例如, 聚对苯丙酮乙烯酮缩硫醇[poly-(1, 4-phenyleneacetone dimethylene thioketal), PPADT][23] (图 1c)是具有ROS响应的酮缩硫醇基团的共聚物, PPADT在酸、碱和酶环境中稳定, 因此PPADT给药系统在胃肠道稳定, 口服给药后可以防止药物在非炎症组织释放。包载细胞内染料的PPADT纳米粒在巨噬细胞炎症环境下, 细胞内染料快速释放。PPADT纳米粒还可以包载siRNA, 口服给药后可实现siRNA在肠道炎症组织局部快速释放。其次, 聚氨基酮缩硫醇多聚物[poly (amino thioketal), PATK]是一种高效、安全的细胞内ROS响应基因载体。在体外实验中, PATK在100和200 mmol·L-1 H2O2溶液中降解的半衰期分别为20和11 h, PATK在100 mmol·L-1 H2O2中60 h约降解80%, 而在200 mmol·L-1 H2O2中50 h降解达到90%。包载DNA的PATK复合物在前列腺肿瘤细胞高水平ROS环境中快速释放DNA, 实现基因的高转染[14]。
1.2 含硒多聚物ROS响应载体硒与硫是同族元素, 具有与硫相似的性质, 也具有还原性。疏水性的单硒基团在ROS环境转变为亲水性的硒砜, 从而实现药物释放; 双硒基团在ROS环境下双硒键断裂, 被氧化为硒酸, 药物释放。
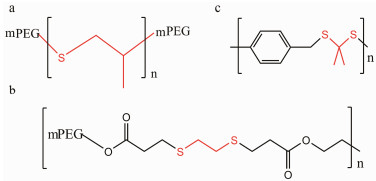
PEG-PUSe-PEG (图 2a)是含单硒三嵌段多聚物, 在水溶液中能自组装成胶束, PEG-PUSe-PEG胶束具有很好的ROS响应性质, 在微弱的ROS环境(0.1% H2O2)被氧化。与含硫三嵌段共聚物相比, PEG-PUSe-PEG对ROS响应更灵敏[20]。在药物释放实验中, PEG-PUSe-PEG多聚物胶束在0.1% H2O2中10 h后多柔比星(doxorubicin, DOX)的释放率达到70%。
|
Figure 2 Chemical structures of selenium-based ROS respon sive polymers based on ROS responsive motifs (the red). a: Poly (ethylene glycol)-polyurethane-Se-polyurethane-poly (ethylene glycol), PEG-PUSe-PEG; b: Side-chain selenium-containing amphiphilic poly (ethylene oxide-acrylic acid) block copolymers, PEO-PAA-Se; c: Poly (ethylene glycol)-polyurethane-Se-Se-polyurethane-poly (ethylene glycol), PEG-PUSeSe-PEG |
侧链含硒两亲性嵌段共聚物(side-chain selenium-containing amphiphilic poly (ethylene oxide-acrylic acid) block copolymers, PEO-PAA-Se) (图 2b)在0.1% H2O2微弱ROS环境下能转变成亲水的硒砜, 载尼罗红的PEO-PAA-Se聚合物胶束在0.1% H2O2下快速释放出尼罗红[24]。
含硒的超支化聚合物载体能实现药物在肿瘤细胞内的响应性释放。在肿瘤细胞高水平ROS环境下, 含硒的超支化聚合物纳米载体裂解, 触发药物在肿瘤细胞内快速释放。如含硒的超支化聚合物胶束在0.1 mmol·L-1 H2O2中快速裂解。载DOX的含硒超支化聚合物胶束能够实现DOX在HeLa细胞中响应释放[25]。
含双硒键多聚物易被ROS氧化为硒酸, 双硒键断裂, 药物释放。PEG-PUSeSe-PEG (图 2c)是含双硒键的两亲性三嵌段多聚物, 在水溶液中能自组装成胶束, 在0.01% H2O2环境中PEG-PUSeSe-PEG能被氧化为硒酸, 药物实现响应性释放[33]。
1.3 含碲多聚物ROS响应载体碲是氧族元素最后一个非金属元素, 具有强还原性。元素碲的还原性强于元素硒的还原性, 元素硒的还原性强于元素硫的还原性。采用循环伏安法证明含碲化合物的被氧化活性强于含硒化合物, 含硒化合物的被氧化活性强于含硫化合物[26]。含碲多聚物电负性比含硒多聚物的电负性低, 所以含碲多聚物对ROS有更高的灵敏性, 而且含碲多聚物具有比含硒多聚物更低的细胞毒性, 因此含碲多聚物是极具优势的ROS响应载体[27]。含碲多聚物在H2O2环境下被氧化(表 1), 从而实现药物释放。
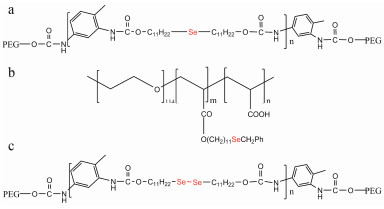
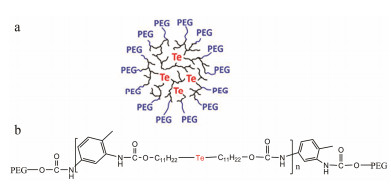
用超支化含碲多聚物(tellurium-containing hy perbranched polymers, HBPTe1900) (图 3a)制备的ROS响应胶束[27]在ROS响应实验中, 加入100 μmol·L-1 H2O2的胶束溶液24 h后粒径增大至原来的5倍, 未加入H2O2的胶束溶液粒径维持不变, 说明HBPTe1900对100 μmol·L-1 H2O2具有ROS响应[27]。文献[26]报道炎症组织的H2O2浓度在50~100 μmol·L-1, 因此, HBPTe1900是有潜力的ROS响应载体。
|
Figure 3 Chemical structures of tellurium-based ROS respon sive polymers based on ROS responsive motifs (the red). a: Tellurium-containing hyperbranched polymers (HBPTe1900); b: Poly (ethylene glycol)-polyurethane-Te-polyurethane-poly (ethylene glycol), PEG-PUTe-PEG |
用含碲多聚物(poly (ethylene glycol)-polyurethane-Te-polyurethane-poly (ethyleneglycol), PEG-PUTe-PEG) (图 3b)制备的ROS响应胶束[26]在100 μmol·L-1 H2O2中急速膨胀, 动态光散射方法测定氧化前胶束粒径35 nm左右, H2O2氧化后粒径达200 nm[26]。
1.4 草酸酯多聚物ROS响应载体草酸酯多聚物具有对ROS响应的性质, 草酸酯被H2O2氧化为醇和CO2, 化学键断裂, 药物释放。
将草酸酯多聚物A (oxalate ester-containing poly mers A, OEP A) (图 4a)制备成载荧光染料纳米粒[28], 在活体成像实验中, 将1和10 μmol·L-1 H2O2的载荧光染料纳米粒注射到小鼠体内, 测试小鼠活体成像荧光, 10 μmol·L-1 H2O2载荧光染料纳米粒释放出荧光染料, 使得活体成像荧光最清晰。在脂多糖炎症模型实验中, 给小鼠注射脂多糖引起小鼠炎症, 再注射载荧光染料纳米粒, 小鼠的活体成像荧光清晰。因此, OEP A载荧光染料纳米粒可用于活体成像。此外, OEP A制备的载荧光染料纳米粒可检测H2O2的最低浓度为250 nmol·L-1[36]。
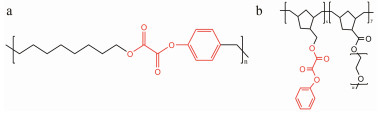
|
Figure 4 Chemical structures of aryl oxalate-containing ROS responsive polymers based on ROS responsive motifs (the red). a: Aryl oxalate-containing polymers A (OEP A); b: Aryl oxalate-containing polymers B (OEP B) |
将草酸酯多聚物B (oxalate ester-containing poly mers B, OEP B) (图 4b)制备成载入荧光染料胶束[29], 可用于细胞H2O2成像, 可以检测到细胞50 nmol·L-1 H2O2。相比于可检测250 nmol·L-1 H2O2 OEP A制备的包裹荧光染料的纳米粒, OEP B载荧光染料胶束具有更低的H2O2响应浓度。
1.5 苯硼酸酯多聚物ROS响应载体苯硼酸及其衍生物是构建有机化合物、功能聚合物的基团, 苯硼酸和苯硼酸酯被H2O2氧化为苯酚和硼酸, 化学键断裂, 从而药物释放[9]。
利用苯硼酸酯和葡聚糖合成氧化敏感的葡聚糖(oxidation-sensitive dextran, Oxi-DEX), 将其制备成微粒, Oxi-DEX微粒在1 mmol·L-1 H2O2环境中100 min约降解80%。载白蛋白(ovalbumin, OVA) Oxi-DEX微粒能加强MHC Ⅰ型的出现和CD8+T细胞的活性, 且载OVA Oxi-DEX微粒引起的MHC Ⅰ型的出现数量是非ROS响应微粒引起的27倍。在肿瘤治疗中, 通过加强MHC Ⅰ型的出现和CD8+T细胞的活性可以加强蛋白疫苗的功效[30]。
利用苯硼酸酯和β-环糊精(β-cyclodextrin, β-CD)合成氧化敏感的oxidatively responsive β-CD (Ox-bCD), 包载化疗药物多烯紫杉醇的Ox-bCD纳米粒在体外体内都能实现药物释放, 在1.0 mmol·L-1 H2O2中约4 h药物完全释放, 在无H2O2环境只释放约20%。RAW264.7细胞在Ox-bCD纳米粒质量浓度为1 mg·mL-1时存活率为70%, 当采用脂多糖诱导产生H2O2后, RAW264.7细胞在同样浓度Ox-bCD纳米粒下存活率为76%。昆明小鼠注射0、125、250、500和1 000 mg·kg-1 Ox-bCD纳米粒后都没有造成小鼠死亡。空白Ox-bCD纳米粒、游离多烯紫杉醇和包载多烯紫杉醇的Ox-bCD纳米粒的B16F10细胞凋亡率分别为4.5%、20.2%和69.0%。包载多烯紫杉醇的Ox-bCD纳米粒比pH响应β-环糊精纳米粒(a pH-responsive β-CD material, Ac-bCD)、PLGA纳米粒具有更强的抑制小鼠肿瘤生长的作用[31]。
以苯硼酸酯多聚物F4 (phenylboronic ester-containing polymers F4, PBEP F4) (图 5a)制备成载尼罗红的胶束, 将其置于H2O2溶液, 通过检测尼罗红的荧光强度变化判断胶束的降解情况。结果发现载尼罗红的胶束在200 μmol·L-1 H2O2环境降解, 说明PBEP F4载体在200 μmol·L-1 H2O2被氧化[32]。将苯硼酸酯多聚物P5 (phenylboronic ester-containing polymers P5, PBEP P5) (图 5b)制备成尼罗红纳米粒[37], 观察尼罗红的荧光强度变化判断纳米粒的裂解情况, 纳米粒在50 μmol·L-1 H2O2被氧化裂解。因此, PBEP P5纳米粒具有更强的ROS响应活性, 而50 μmol·L-1 H2O2与肿瘤环境的H2O2浓度相近, 所以PBEP P5纳米粒在肿瘤的治疗上具有巨大的潜力。

|
Figure 5 Chemical structures of phenylboronic ester-containing ROS responsive polymers based on ROS responsive motifs (the red). a: Phenylboronic ester-containing polymers F4 (PBEP F4); b: Phenylboronic ester-containing polymers P5 (PBEP P5) |
联合光敏剂ROS响应载体在特定波长照射后产生1O2。光敏剂产生1O2的原理是: O2分子具有基态和激发态。基态是稳定态, 也叫三线态; 激发态是不稳定的, 又叫单线态。当O2分子接受能量后, O2分子由基态转变为激发态, 即三线态氧转变为1O2。光敏剂是一类只吸收光子并将能量转移给不能吸收光子的分子, 促进其发生反应而本身不反应的物质, 在O2分子的环境下, 光敏剂吸收光子后将能量转移给三线态氧, 三线态氧吸收能量转变为1O2。
联合光敏剂ROS响应给药载体给药后进入血液循环, 在研究者对病变组织进行特定波长照射时, 联合光敏剂ROS响应给药载体由于光敏剂产生1O2而被氧化或裂解, 触发药物释放。而且1O2具有光动力治疗作用。
1O2是一种特殊的ROS, 既可以由细胞产生, 又可以由光敏剂产生。对1O2响应的物质主要有含双硒聚合物、不饱和脂质。
含双硒聚合物[1, 4-bis (2-hydroxyethyl) piperazine diselenide-containing polymer, PDSe]多层薄膜是一种ROS响应载体, 载入可见光光敏剂卟啉衍生物(porphyrin derivatives, Por)和药物。在可见光照射下, Por产生1O2, 1O2使双硒键断裂, 膜载体破坏, 药物释放。实验表明5 h照射后药物释放80%, 即使50 mW·cm-2的能量下, 药物也能释放[34]。
PEG-PUSeSe-PEG (图 2c)是含双硒聚合物载体, 采用透析法制备载Por光敏剂的DOX胶束[33], 不载Por的DOX胶束在红光光照后DOX荧光逐渐减弱, 载Por光敏剂的DOX胶束在红光照射后DOX荧光维持不变, 结果表明, 红光照射时Por光敏剂产生1O2, 引起DOX释放。
不饱和脂质包括蛋黄卵磷脂[L-α-phosphatidyl choline (egg, chicken), Egg PC]、二油酰磷脂酰胆碱[1, 2-dioleoyl-sn-glycero-3-phosphocholine, DOPC]和二亚油酰磷脂酰胆碱[1, 2-dilinoleoyl-sn-glycero-3-phosphocholine, DLPC] (图 6a~c)。不饱和脂质含有毗邻双键的亚甲基, 当处于1O2环境下, 毗邻双键的亚甲基与1O2反应, 使得不饱和脂质变成脂质过氧化物(表 1), 增强不饱和脂质体的亲水性, 从而使得不饱和脂质制备的给药系统被破坏, 药物释放[10]。
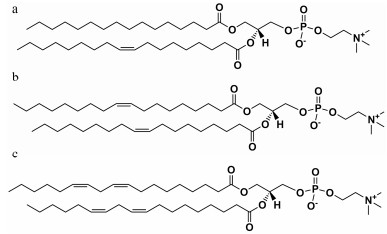
|
Figure 6 Chemical structures of unsaturated lipids. a: L-α-Phosphatidylcholine (egg, chicken, Egg PC); b: 1, 2-Dioleoyl-sn-glycero-3-phosphocholine (DOPC); c: 1, 2-Dilinoleoyl-sn-glycero-3-phosphocholine (DLPC) |
Egg PC是一种不饱和脂质, 将其制备成脂质体, 包载光敏剂二磺酸基酞菁氯化铝和药物, 用671 nm波长、以55 mW·cm-2照射200 s后, 在20 min内药物释放20%[38]。DOPC是含两个不饱和键的不饱和脂质, 而Egg PC是只有一个不饱和键的脂质, 然而DOPC制备的脂质体被1O2氧化的活性和Egg PC制备的脂质体对1O2反应的活性相似[38]。DLPC具有两个双键毗邻的亚甲基, 两个双键毗邻的亚甲基与1O2反应时比只有一个双键毗邻的亚甲基具有更高活性[10]。用DLPC制备了载八丁氧基酞菁钯的河豚毒素脂质体[10], 活性氧响应释放实验表明, 用730 nm的50 mW·cm-2光照射10 min, 每照射1次药物释放约10%, 不进行光照射则不释放。河豚毒素是强效的局部麻醉药, 具有极小的肌肉毒性和神经毒性, 能够实现神经阻滞。小鼠尾静脉注射DLPC脂质体后, 未包载河豚毒素的DLPC脂质体不管是否进行光照, 小鼠都未见神经阻滞; 而包载河豚毒素的DLPC脂质体进行光照后出现神经阻滞, 未光照则没有发现神经阻滞的现象。结果表明, 光照对包载河豚毒素的DLPC脂质体的药物释放影响巨大, 当光照时, 光敏剂产生1O2, 1O2氧化DLPC脂质体, 从而实现药物释放。
3 化学键合光敏剂脂质ROS响应载体含不饱和脂质ROS响应载体的应用需要具备3个条件: ①包载光敏剂; ②特定波长照射; ③光敏剂产生足够的1O2。然而光敏剂具有溶解性差、载药量低的特点, 限制了含不饱和脂质ROS响应载体的应用。化学键合光敏剂脂质的出现解决了光敏剂载药量低的难题, 脂质溶解性好, 以化学键合的方法将光敏剂接到脂质中, 可以提高光敏剂的溶解性, 提高光敏剂的载药量[39]。化学键合光敏剂脂质活性氧响应载体, 即将光敏剂以化学键结合到脂质上, 再将其制备成脂质体。光照射脂质体时, 药物释放, 然而其作用机制还未知[39]。
HPPH-lipid (图 7a)是光敏剂己氧基焦脱镁叶绿酸衍生物键合到1-棕榈酰-2-羟基-3-磷脂酰胆碱的脂质, 用HPPH-lipid制备了钙黄绿素及DOX活性氧自由基响应脂质体[39], 用658 nm近红外光、以120 mW·cm-2照射3 min后, 钙黄绿素释放100%。在抗肿瘤实验中, 生理盐水组小鼠不到50天就全部死亡, 死亡率100%, 而DOX活性氧自由基响应脂质体光照后100天小鼠存活率还维持在75%。实验表明, DOX活性氧自由基响应脂质体治疗效果显著。
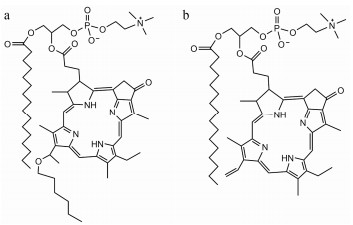
|
Figure 7 Chemical structures of porphyrin-phospholipid. a: 2-[1-Hexyloxyethyl]-2-devinyl pyropheophorbide-a-phospholipid, HPPH-lipid; b: sn-1-Palmitoyl sn-2-pyropheophorbide phosphta-tidylcholine, Pyro-lipid |
用Pyro-lipid (图 7b)制备了DOX活性氧自由基响应脂质体[40], 对小鼠的药代动力学实验表明, 与不含Pyro-lipid的DOX脂质体相比, 含Pyro-lipid的DOX脂质体血药浓度相似。抗肿瘤实验中, 游离DOX给药17天肿瘤体积达400 mm3, 5 mg·kg-1剂量的DOX活性氧自由基响应脂质体光照组40天时肿瘤体积不超过200 mm3, 7 mg·kg-1剂量的DOX活性氧自由基响应脂质体光照组肿瘤体积自给药后降低, 7天后肿瘤体积消失, 40天时肿瘤体积依然未见。此外, 7 mg·kg-1剂量的DOX活性氧自由基响应脂质体光照组小鼠50天的存活率为100%。实验表明, DOX活性氧响应脂质体明显抑制肿瘤的生长, 提高小鼠的存活率。
4 ROS响应与其他响应联用的多重响应在ROS-pH双重响应给药系统中, pH响应基团通过改变给药系统形态促进药物的释放。肿瘤、炎症病理微环境具有高水平ROS、酸性pH的特点。利用这一特点, 研究者探索出一种ROS-pH双重响应给药系统, 它由聚己酸内脂通过硫醚键键合PEG, 聚己酸内酯含有遇酸不稳定的β-酰胺。该给药系统在pH 6.0的10 mmol·L-1 H2O2溶液中药物释放显著强于pH 6.0和7.4的10 mmol·L-1 H2O2溶液, 表明该给药系统在H2O2中响应释放。在肿瘤组织中pH约为6.8, 该给药系统在HepG2细胞的摄取强于在pH 7.4的摄取, 表明该给药系统在pH 6.8时具有更好的细胞摄取[41]。
ROS-温度双重响应给药系统利用肿瘤组织温度比正常组织稍高、ROS水平更高的微环境实现药物的释放。ROS-温度双重响应三嵌段聚合物poly [(propylenesulfide)-block-(N, N-dimethylacrylamide)-block-(N-isopropylacrylamide)](PPS-b-PDMA-b-PNIPAAM)从室温增加到体内温度时形成水凝胶, 与ROS相应共同作用实现药物释放。当温度为25 ℃时, PPS-b-PDMA-b-PNIPAAM自组装成胶束; 37 ℃时, 温度超过了PNIPAAM的低临界溶解温度, 胶束溶液快速转变成水凝胶。PPS-b-PDMA-b-PNIPAAM水凝胶具有保护细胞及ROS响应释放药物的作用。载尼罗红PPS-b-PDMA-b-PNIPAAM水凝胶在500 mmol·L-1 H2O2中64 h未释放完全, 在100 mmol·L-1 H2O2中释放未达到75%。载荧光染料PPS-b-PDMA-b-PNIPAAM水凝胶能使荧光染料在小鼠体内维持14天[42]。
ROS-酶双重响应给药系统在肿瘤和炎症中具有较好的响应效果。例如, ROS-酶双重响应的两亲性嵌段多聚物亲油端组成胶束内核, 包括H2O2响应的前体药物(prodrug, PD), PD是以苯硼酸酯化学键键合金属蛋白酶(matrix metallop-roteinases, MMP)抑制剂。多聚物亲水端由MMP肽底物(GPLGLAG GERDG)组成。在炎症和肿瘤环境中, 过度产生的MMP肽使亲水端断裂, 同时, ROS响应的苯硼酸酯键断裂, 释放MMP抑制剂。从而使MMP抑制剂作用于炎症或肿瘤[43]。
ROS-还原双重响应给药系统具有氧化响应和还原响应的特征。例如, 含双硒聚合物具有ROS-还原双重响应性。0.01% H2O2能使含双硒聚合物氧化为硒酸, 0.01%谷胱甘肽(GSH)能使含双硒聚合物还原为硒醇[33]。因此, 载罗丹明B的PEG-PUSeSe-PEG胶束在低浓度的H2O2和GSH环境下都能快速释放药物。
双重ROS响应载体含双硒聚合物具有对H2O2、1O2的双重ROS响应特性。在0.01% H2O2环境下PEG-PUSeSe-PEG (图 2c)胶束能被氧化为硒酸, 药物释放。将PEG-PUSeSe-PEG制备成载Por光敏剂的DOX胶束, 红光照射时Por光敏剂可引起DOX释放[33]。
5 问题与展望在许多疾病中都存在ROS过度表达、ROS水平过高的现象。因此, ROS响应载体在许多疾病中是具有潜力的载体。ROS响应载体已应用于胃肠道炎症[23]、坐骨神经阻滞[10]和肿瘤[40]。有些ROS载体(如芳基草酸酯多聚物ROS响应载体、苯硼酸酯多聚物ROS响应载体和含碲聚合物ROS响应载体)还停留在初步研究阶段。
含双硒多聚物ROS响应载体不仅具有双重ROS响应, 还具有氧化-还原双重刺激响应性。因此, 含双硒多聚物ROS响应载体是具有潜力的ROS响应载体。
含不饱和脂质ROS响应载体对1O2响应, 光敏剂产生1O2使载体氧化裂解, 触发药物释放。然而, 不饱和脂质在空气中易被氧化, 因此, 含不饱和脂质ROS响应载体应避免与空气长时间接触。光敏剂的最大吸收波长在组织渗透中起着至关重要的作用, 最大吸收波长为近红外光时, 组织渗透能力强, 而且波长越长的近红外光组织渗透能力越强[10]。但是照射具有局限性, 只能照射皮肤表面, 对于体内病变组织, 特定波长的光无法渗透。
ROS响应给药系统在许多疾病的诊断和治疗中具有巨大的优势, 在氧化应激相关的疾病中优势更为显著。因此, 对ROS响应给药系统的进一步研究很有必要。鉴于许多ROS响应给药系统在临床医学的应用相对较少, ROS响应给药系统的未来研究将集中在临床医学应用方面。
| [1] | Mura S, Nicolas J, Couvreur P. Stimuli-responsive nanocarriers for drug delivery[J]. Nat Mater, 2013, 12: 991–1003. DOI:10.1038/nmat3776 |
| [2] | Lee ES, Na K, Bae YH. Doxorubicin loaded pH-sensitive polymeric micelles for reversal of resistant MCF-7 tumor[J]. J Control Release, 2005, 103: 405–418. DOI:10.1016/j.jconrel.2004.12.018 |
| [3] | Li J, Yin T, Wang L, et al. Biological evaluation of redoxsensitive micelles based on hyaluronic acid-deoxycholic acid conjugates for tumor-specific delivery of paclitaxel[J]. Int J Pharm, 2015, 483: 38–48. DOI:10.1016/j.ijpharm.2015.02.002 |
| [4] | Poole KM, Nelson CE, Joshi RV, et al. ROS-responsive microspheres for on demand antioxidant therapy in a model of diabetic peripheral arterial disease[J]. Biomaterials, 2015, 41: 166–175. DOI:10.1016/j.biomaterials.2014.11.016 |
| [5] | Timko BP, Arruebo M, Shankarappa SA, et al. Near-infraredactuated devices for remotely controlled drug delivery[J]. Proc Natl Acad Sci U S A, 2014, 111: 1349–1354. DOI:10.1073/pnas.1322651111 |
| [6] | Epstein-Barash H, Orbey G, Polat BE, et al. A microcomposite hydrogel for repeated on-demand ultrasound-triggered drug delivery[J]. Biomaterials, 2010, 31: 5208–5217. DOI:10.1016/j.biomaterials.2010.03.008 |
| [7] | Hoare T, Timko BP, Santamaria J, et al. Magnetically triggered nanocomposite membranes:a versatile platform for triggered drug release[J]. Nano Lett, 2011, 11: 1395–1400. DOI:10.1021/nl200494t |
| [8] | Landon CD, Park JY, Needham D, et al. Nanoscale drug delivery and hyperthermia:the materials design and preclinical and clinical testing of low temperature-sensitive liposomes used in combination with mild hyperthermia in the treatment of local cancer[J]. Open Nanomed J, 2011, 3: 38–64. |
| [9] | Song CC, Du FS, Li ZC. Oxidation-responsive polymers for biomedical applications[J]. J Mater Chem B, 2014, 2: 3413–3426. DOI:10.1039/c3tb21725f |
| [10] | Rwei AY, Lee JJ, Zhan C, et al. Repeatable and adjustable on-demand sciatic nerve block with phototriggerable liposomes[J]. Proc Natl Acad Sci U S A, 2015, 112: 15719–15724. |
| [11] | Lee SH, Gupta MK, Bang JB, et al. Current progress in reactive oxygen species (ROS)-responsive materials for biomedical applications[J]. Adv Healthc Mater, 2013, 2: 908–915. DOI:10.1002/adhm.v2.6 |
| [12] | Yang XL, Chen YJ, Hu GY, et al. Research progress of NADPH oxidases and their inhibitors[J]. Acta Pharm Sin (药学学报), 2016, 51: 499–506. |
| [13] | de Gracia Lux C, Joshi-Barr S, Nguyen T, et al. Biocompatible polymeric nanoparticles degrade and release cargo in response to biologically relevant levels of hydrogen peroxide[J]. J Am Chem Soc, 2012, 134: 15758–15764. DOI:10.1021/ja303372u |
| [14] | Shim MS, Xia Y. A reactive oxygen species (ROS)-responsive polymer for safe, efficient, and targeted gene delivery in cancer cells[J]. Angew Chem Int Ed Engl, 2013, 52: 6926–6929. DOI:10.1002/anie.201209633 |
| [15] | Choudhury S, Ghosh S, Gupta P, et al. Inflammation-induced ROS generation causes pancreatic cell death through modulation of Nrf2/NF-κB and SAPK/JNK pathway[J]. Free Radic Res, 2015, 49: 1371–1383. DOI:10.3109/10715762.2015.1075016 |
| [16] | Salvayre R, Negre-Salvayre A, Camaré C. Oxidative theory of atherosclerosis and antioxidants[J]. Biochimie, 2016, 125: 281–296. DOI:10.1016/j.biochi.2015.12.014 |
| [17] | Chen F, Li X, Aquadro E, et al. Inhibition of histone deacetylase reduces transcription of NADPH oxidases and ROS production and ameliorates pulmonary arterial hypertension[J]. Free Radic Biol Med, 2016, 99: 167–178. DOI:10.1016/j.freeradbiomed.2016.08.003 |
| [18] | Dong K, Ni H, Wu M, et al. ROS-mediated glucose metabolic reprogram induces insulin resistance in type 2 diabetes[J]. Biochem Biophys Res Commun, 2016, 476: 204–211. DOI:10.1016/j.bbrc.2016.05.087 |
| [19] | Dumont M, Beal MF. Neuroprotective strategies involving ROS in Alzheimer disease[J]. Free Radic Biol Med, 2011, 51: 1014–1026. DOI:10.1016/j.freeradbiomed.2010.11.026 |
| [20] | Ma N, Li Y, Ren H, et al. Selenium-containing block copolymers and their oxidation-responsive aggregates[J]. Polym Chem, 2010, 1: 1609–1614. DOI:10.1039/c0py00144a |
| [21] | Cao W, Gu Y, Li T, et al. Ultra-sensitive ROS-responsive tellurium-containing polymers[J]. Chem Commun, 2015, 51: 7069–7071. DOI:10.1039/C5CC01779C |
| [22] | Xiao C, Ding J, Ma L, et al. Synthesis of thermal and oxidation dual responsive polymers for reactive oxygen species (ROS)-triggered drug release[J]. Polym Chem, 2015, 6: 738–747. DOI:10.1039/C4PY01156B |
| [23] | Wilson DS, Dalmasso G, Wang L, et al. Orally delivered thioketal nanoparticles loaded with TNF-α-siRNA target inflammation and inhibit gene expression in the intestines[J]. Nat Mater, 2010, 9: 923–928. DOI:10.1038/nmat2859 |
| [24] | Ren H, Wu Y, Ma N, et al. Side-chain selenium-containing amphiphilic block copolymers:redox-controlled self-assembly and disassembly[J]. Soft Matter, 2012, 8: 1460–1466. DOI:10.1039/C1SM06673K |
| [25] | Liu J, Pang Y, Zhu Z, et al. Therapeutic nanocarriers with hydrogen peroxide-triggered drug release for cancer treatment[J]. Biomacromolecules, 2013, 14: 1627–1636. DOI:10.1021/bm4002574 |
| [26] | Cao W, Gu Y, Li T, et al. Ultra-sensitive ROS-responsive tellurium-containing polymers[J]. Chem Commun, 2015, 51: 7069–7071. DOI:10.1039/C5CC01779C |
| [27] | Fang R, Xu H, Cao W, et al. Reactive oxygen species (ROS)-responsive tellurium-containing hyperbranched polymer[J]. Polym Chem, 2015, 6: 2817–2821. DOI:10.1039/C5PY00050E |
| [28] | Lee D, Khaja S, Velasquez-Castano JC, et al. In vivo imaging of hydrogen peroxide with chemiluminescent nanoparticles[J]. Nat Mater, 2007, 6: 765–769. DOI:10.1038/nmat1983 |
| [29] | Lee D, Erigala VR, Dasari M, et al. Detection of hydrogen peroxide with chemiluminescent micelles[J]. Int J Nanomedicine, 2008, 3: 471–476. DOI:10.2217/17435889.3.4.471 |
| [30] | Broaders KE, Grandhe S, Fréchet JM. A biocompatible oxidation-triggered carrier polymer with potential in therapeutics[J]. J Am Chem Soc, 2010, 133: 756–758. |
| [31] | Zhang D, Wei Y, Chen K, et al. Biocompatible reactive oxygen species (ROS)-responsive nanoparticles as superior drug delivery vehicles[J]. Adv Healthc Mater, 2015, 4: 69–76. DOI:10.1002/adhm.v4.1 |
| [32] | Song CC, Ji R, Du FS, et al. Oxidation-accelerated hydrolysis of the ortho ester-containing acid-labile polymers[J]. ACS Macro Lett, 2013, 2: 273–277. DOI:10.1021/mz4000392 |
| [33] | Xu H, Cao W, Zhang X. Selenium-containing polymers:promising biomaterials for controlled release and enzyme mimics[J]. Acc Chem Res, 2013, 46: 1647–1658. DOI:10.1021/ar4000339 |
| [34] | Ren H, Wu Y, Li Y, et al. Visible-light induced disruption of diselenide-containing layer-by-layer films:toward combination of chemotherapy and photodynamic therapy[J]. Small, 2013, 9: 3981–3986. DOI:10.1002/smll.201300628 |
| [35] | Napoli A, Valentini M, Tirelli N, et al. Oxidation-responsive polymeric vesicles[J]. Nat Mater, 2004, 3: 183–189. DOI:10.1038/nmat1081 |
| [36] | Chen WT, Mahmood U, Weissleder R, et al. Arthritis imaging using a near-infrared fluorescence folate-targeted probe[J]. Arthritis Res Ther, 2005, 7: R310–R317. DOI:10.1186/ar1483 |
| [37] | Song CC, Ji R, Du FS, et al. Oxidation-responsive poly (amino ester) s containing arylboronic ester and self-immolative motif:synthesis and degradation study[J]. Macromolecules, 2013, 46: 8416–8425. DOI:10.1021/ma401656t |
| [38] | Pashkovskaya A, Kotova E, Zorlu Y, et al. Light-triggered liposomal release:membrane permeabilization by photodynamic action[J]. Langmuir, 2009, 26: 5726–5733. |
| [39] | Carter KA, Shao S, Hoopes MI, et al. Porphyrin-phospholipid liposomes permeabilized by near-infrared light[J]. Nat Commun, 2014, 5: 3546. |
| [40] | Luo D, Carter KA, Razi A, et al. Doxorubicin encapsulated in stealth liposomes conferred with light-triggered drug release[J]. Biomaterials, 2016, 75: 193–202. DOI:10.1016/j.biomaterials.2015.10.027 |
| [41] | Deng H, Zhao X, Liu J, et al. Reactive oxygen species (ROS) responsive PEG-PCL nanoparticles with pH-controlled negative-to-positive charge reversal for intracellular delivery of doxorubicin[J]. J Mater Chem B, 2015, 3: 9397–9408. DOI:10.1039/C5TB01939G |
| [42] | Gupta MK, Martin JR, Werfel TA, et al. Cell protective, ABC triblock polymer-based thermoresponsive hydrogels with ROS-triggered degradation and drug release[J]. J Am Chem Soc, 2014, 136: 14896–14902. DOI:10.1021/ja507626y |
| [43] | Daniel KB, Callmann CE, Gianneschi NC, et al. Dualresponsive nanoparticles release cargo upon exposure to matrix metalloproteinase and reactive oxygen species[J]. Chem Commun, 2016, 52: 2126–2128. DOI:10.1039/C5CC09164K |
 2017, Vol. 52
2017, Vol. 52