2. 河南医学高等专科学校药学系, 河南 郑州 451191
2. Department of Pharmacy, Henan Medical College, Zhengzhou 451191, China
生物活性成分的筛选和辨识是中药研究领域的重要内容。以酶、蛋白质、细胞膜(或仿生物膜)以及活性细胞等生物材料为靶标用于中药活性成分筛选研究具有效率高、灵敏度高以及特异性强等优势, 并且能够在一定程度上体现药物的作用机制[1]。然而, 将这些生物材料直接用于筛选存在一定的限制, 如游离状态的酶稳定性差、无法重复利用[2], 活细胞对环境耐受性差等。通过物理、化学或生物的手段将生物材料固定在一定区域内并保持其活性, 进而推动一系列相应的固定化技术的发展。生物材料经固定化后, 提高了其对环境的耐受能力, 可以最大限度地保持细胞膜的完整性以及酶或受体的活性, 也可以促进生物材料在疏水性溶液中的分散[3]。
固定化载体材料将直接决定酶或细胞膜等生物材料所处的环境, 是固定化技术中影响生物材料性能的重要因素。随着对固定化技术研究的不断深入, 在应用传统载体材料(如硅胶)的同时, 研究开发新型材料如磁性微球、中空纤维、表面等离子共振传感芯片和纳米管等已成为主要方向。本文从载体材料的角度对固定化技术在中药活性成分筛选中的应用进行了综述, 以期为研究中药活性成分的筛选方法提供参考。
1 固定化载体材料及方法简介 1.1 固定化载体材料目前, 固定化载体材料主要分为以下3类:传统的载体材料、复合载体材料和新型载体材料。传统无机载体材料如硅胶无毒且稳定性好, 但键合生物材料的能力较差, 而高分子材料生物相容性好, 结构易调控, 能够与其形成互补体系。因此有不少研究人员将二者组合制备性能更加优异的复合载体材料。例如, 用功能化纤维素纳米晶体(cellulose nanocrystals, CNCs)包埋金纳米粒子(AuNPs)与磁性纳米粒子复合物(Fe3O4NPs), 制备新型的复合材料CNC/Fe3O4NPs/AuNPs作为木瓜蛋白酶的固定化载体, 能显著提高蛋白的负载量[4]。
为了提高酶的载量、稳定性, 降低工业生物技术酶催化所带来的高额消耗, 一些新型的载体材料例如磁性纳米材料、介孔材料也逐渐被引入到固定化酶技术中[5]。此外, 固定化人工膜[6]、中空纤维以及纳米管[7]等具有良好的应用前景。Zhao等[8]将合成的超顺磁性Fe3O4@粘土纳米复合材料用于固定糖化酶, 固定后的糖化酶表现出优良的热稳定性和可重复性, 并且用戊二醛或Ca2+活化已失活的固定化酶可实现载体的再生。
1.2 固定化方法传统的固定化方法主要包括吸附法、共价结合法、包埋法以及交联法。
吸附法操作简单, 并且几乎不会破坏酶的活性, 适于固定酶等生物大分子, 也是固定细胞膜的一种常用手段。亲和吸附法是利用配体与配基间的生物特异性作用, 实现生物材料的固定化, 其最大的优势在于它能够选择酶固定在载体材料上的结合位点从而保留蛋白质的活性结构, 克服了一般固定化酶在多次使用后活性降低的缺点[9]。生物素-亲和素是亲和固定中常用的一种作用, 即生物素的脲基与亲和素上羰基氧和亚氨基通过氢键作用而稳定结合。Xu等[10]利用亲和素-生物素特异性作用实现了三螺旋DNA的固定化, 并将固定化后的DNA成功应用于天然植物中活性成分的筛选。
共价结合法利用生物材料与载体材料表面活性基团的共价键结合作用, 将活性材料固定化, 这种方法的优点是能够有效防止酶或细胞等从载体材料上解吸。近期Zhu等[11]以戊二醛为交联剂, 将脂肪酶共价结合在聚酰胺-胺树状高分子修饰后的磁性微球表面, 连续10次使用后, 其酶活力仍然是游离酶的90%, 证明该方法较为温和, 适于脂肪酶的固定化。
包埋法包埋细胞时, 条件温和, 且不易渗漏, 因此多用于细胞的固定化。而交联法常用于制备无载体固定化酶, 如交联酶晶体和交联酶聚集体[12]。
2 固定化载体材料在中药活性成分筛选中的应用 2.1 硅胶硅胶是固定化技术中最常用的载体材料。生物材料如细胞膜、脂质体、蛋白质以及DNA等常通过吸附法或共价结合法固定在硅胶表面。相比其他的固定化载体材料, 硅胶最大的优势在于可以作为色谱填料, 中药提取物直接在色谱柱内与固定后的细胞膜或生物大分子发生作用, 能够实现中药活性成分的在线筛选。
国内外许多研究人员将细胞膜固定在活化的硅胶表面建立了细胞膜色谱法[13-15], 用于筛选中药中的潜在活性成分。细胞膜色谱法作为一种亲和色谱技术, 发展迅速, 其所构建的多靶标-多组分模型与复杂的中药体系相适应[13, 16], 是一种简单、快速以及有效的分析方法。细胞膜色谱法的固定化原理是细胞膜的磷脂层与二氧化硅载体表面的硅醇基(Si-OH)发生不可逆吸附, 从而使其固定在二氧化硅上[17]。这种采用物理吸附的固定方式, 能够最大限度地保持细胞膜的完整性以及维持细胞膜表面受体的活性。正常细胞或受体高表达细胞是最常用的细胞模型, Liu等[15]将人牙周膜细胞膜与活化的硅胶在4 ℃下混合, 使细胞膜吸附到硅胶表面, 制备了人牙周膜细胞膜固定相, 并且结合HPLC-MS从黄连中筛选出了具有成骨活性的化合物黄连碱。相比于正常细胞, 理论上病理状态的组织或细胞能更好地模拟体内药物与受体相互作用情况。Chen等[13]同时制备了正常和病理两种状态下的心肌细胞膜色谱柱, 研究表明两种不同状态的CMC模型不仅能更准确有效地筛选复杂基质中的活性化合物, 还能确定在不同细胞状态时药物靶向的变化, 从而间接反映药物作用机制。
作为一种仿生物膜, 脂质体以非共价键吸附的方式附着在硅胶表面, 建立固定化脂质体色谱法(immobilized liposome chromatography, ILC)可以用于中药中具有生物膜渗透性的潜在活性成分筛选[18, 19]。Wang等[18]以ILC为第一维色谱柱, 以Chromolith整体柱为第二维色谱柱, 从中药五味子中辨识出14个潜在活性成分。而除了传统硅胶, 近几年发展起来的一种表面具有中孔和大孔结构的新型贯流硅胶, 具有比传统硅胶更大的表面积及更快的传质速率等优势[20], 将其作为固定化载体材料制备脂质体色谱柱, 可以在增大固定化脂质体容量的同时提高色谱柱分离效率。根据贯流硅胶的这种特性, Zhang等[19]将卵磷脂分别涂覆在贯流硅胶和传统硅胶表面制备ILC固定相(ILC-1和ILC-2), 对22种药物在ILC固定相上的保留行为进行对比后, 表明以贯流硅胶制备的ILC-1有更高的柱效。同时用ILC-1对中药甘草、苦参以及槐花中潜在活性成分进行筛选, 获得良好的效果。
不同于细胞膜或脂质体, 生物大分子如蛋白质或DNA在固定化技术中多以共价结合的方式固定在硅胶上。例如, 采用共价结合的方法将生物大分子如G蛋白偶联受体[21]、血清白蛋白[22]或DNA[23]固定在硅胶表面, 用于中药中与靶标特异性结合的活性物质的筛选。许多药物通过与肾上腺素受体作用而发挥药效, Wang等[21]采用羰基二咪唑法将β2肾上腺素受体固定在大孔硅胶上制备了色谱柱固定相。大孔硅胶首先与γ-氨丙基三乙氧基硅烷反应制备氨丙基硅胶, 然后用1, 1-羰基二咪唑对硅胶表面的氨基进行活化。活化后的硅胶与β2肾上腺素受体的羧基共价结合即制备得到固定化β2肾上腺素受体。该研究结合质谱分析从中药制剂活血胶囊中筛选出3个能够与β2肾上腺素受体发生特异性结合的潜在生物活性物质, 分别为阿魏酸、羟基红花黄色素A以及柚皮苷。Su等[23]以1-乙基-3-(3-二甲氨丙基)碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide, EDC]为交联剂将小牛胸腺DNA共价结合于氨丙基硅胶上制备键合了DNA的色谱柱, 用于筛选中药黄连和大黄中具有抗病毒作用的活性成分。
以硅胶为载体材料的亲和色谱法具有以下优点: ①样品无需提前分离和纯化; ②涂覆了蛋白质或细胞膜的固定相直接作为HPLC的固定相, 中药提取液中的潜在活性成分与其发生相互作用, 可以实现中药中活性成分的快速在线筛选; ③非共价键结合的固定化方式能较好地维持生物材料的活性。然而在药物筛选时, 由于细胞膜或蛋白质需要的生理环境与液相分离分析条件不兼容(如流动相的流速不能太大以及流动相中不能含有机溶剂等), 这使得蛋白质或细胞膜色谱柱的柱效低, 对于复杂成分不能实现良好分离, 从而大大降低系统的灵敏度。传统的“中心切割”二维色谱和全二维色谱技术是解决这一问题、实现活性成分的自动化分析并提高灵敏度的有力工具。例如, He等[14]以高表达表皮生长因子细胞膜固定相为第一维色谱, 经紫外检测后, 将保留的组分通过十位切通阀导入ODS柱中进行成分分析, 筛选出中药黄芩中作用于表皮生长因子受体的活性成分为汉黄芩素。
2.2 磁性材料铁的氧化物如Fe3O4和γ-Fe2O3是固定化技术中最常使用的磁性材料。然而这些磁性材料在使用过程中极易快速聚集成团, 因此常用二氧化硅、金、碳素材料和高分子聚合物(聚乙二醇、聚乙烯醇)等对其进行修饰[24]。由于磁性材料与反应体系利用磁场即可得到快速分离, 因此作为固定化载体材料可以实现简单有效的高通量筛选。近年来, 有诸多文献报道将蛋白质或酶固定在功能化磁性材料上用于中药活性成分筛选的研究[9, 11, 25-27]。
由于在活性成分筛选过程中, 结合了潜在活性成分的固定化酶与中药混合溶液需要在磁场的作用下分离, 这对于固定化蛋白的稳定性存在较高的要求, 而共价结合法能利用蛋白质表面天然存在的基团如羧基或氨基与磁性微球形成共价键, 这种方法可以制备稳定的固定化蛋白, 减少分离过程中蛋白的损失, 在以磁性材料固定化中应用较多, 而采用戊二醛作为交联剂将酶或蛋白质键合到磁珠上的方法又最为普遍, 其固定化流程如图 1A。基于这种原理, Zhang等[26]用3-氨丙基三乙氧基硅烷[(3-aminopropyl) triethoxysilane, APTES]对Fe3O4@SiO2磁性纳米粒子进行氨基化修饰后, 将人血清蛋白(human serum albumin, HSA)键合在合成的Fe3O4@SiO2磁性纳米粒子上, 结合2D-HPLC-DAD-MSn分离分析, 从黄芪中筛选出了34个异黄酮类和13个皂苷类物质。研究表明该Fe3O4@SiO2-HSA在10次连续循环使用后, HSA的活性仍高达96.2%。另外一种以EDC和N-羟基琥珀酰亚胺(N-hydroxy succinimide, NHS)作为交联剂的方法也是常用的共价结合固定化方法(图 1B)。Tao等[25]通过采用这种方法制备磁性微球固定化α-葡糖苷酶并结合HPLC/MS和NMR分析从中药桑叶中筛选出了两个α-葡糖苷酶抑制剂, 分别为异槲皮苷和黄芪苷。相比于以戊二醛作为交联剂的固定化方式, EDC和NHS都是水溶液性的化合物, 因此上述两步反应都可以在水溶液中进行。但是由于EDC和NHS活化酯键后形成的物质不稳定, 这使得所制备固定化酶负载率较戊二醛法低[28]。
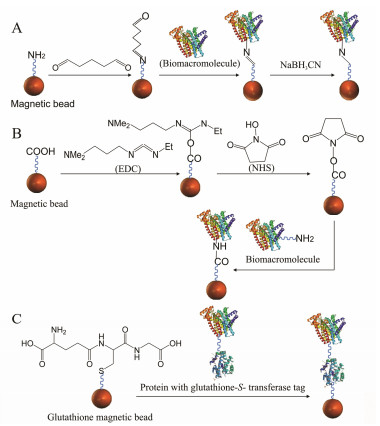
|
Figure 1 Methods of immobilization with biomacromolecule by magnetic materials. A: Covalent bonding, crosslinker:Glutaraldehyde; B: Covalent bonding, crosslinker: NHS and EDC; C: Affinity immobilization method |
在一般情况下, 酶经固定化后一级结构不会发生改变。但酶的空间构象有可能发生转变, 进而影响药物或配体与酶作用的活性位点。而亲和吸附法通过酶表面的标记物与磁性微球上修饰的相应配基发生特异性亲和作用(图 1C), 能够解决上述酶活性位点变化的问题。Li等[9]将糖原合成酶激酶-3β (glycogen synthase kinase-3β, GSK-3β)用谷胱甘肽转移酶标记, 利用谷胱甘肽转移酶与磁性微球表面修饰的谷胱甘肽间的特异性结合作用力制备磁性微球固定化GSK-3β, 从15种中药提取物中筛选出3种对GSK-3β具有强烈抑制活性的中药, 分别为常春卫矛、扁桃以及大叶藤黄。这也是首次采用亲和吸附法将GSK-3β固定在磁性微球上的研究。
对磁性材料进行化学修饰或生物标记后, 生物大分子极易通过共价结合或亲和相互作用吸附于其表面。以功能化磁性材料为载体制备的固定化酶稳定性好, 连续多次使用后仍保留较高的活性, 此外, 磁性材料的生物相容性好, 比表面积大, 酶载量高、易于修饰各种基团以及具有超顺磁性, 因此它是一种非常理想的固定生物大分子的载体材料。相比于其他载体材料, 在中药活性成分筛选过程中, 利用外加磁场可以使固定了生物分子的磁珠与中药提取液得到快速分离, 实现配体垂钓(ligand fishing), 筛选出中药中的潜在活性成分。
2.3 中空纤维中空纤维最早由Pedersen-Bjergaard和Rasmussen作为萃取溶剂的载体应用于液液微萃取中。中空纤维不仅内壁能吸附物质, 也能渗透小分子和拦截大分子, 目前广泛用于复杂混合物中目标分析物的萃取、富集、浓缩和纯化[29]。
中空纤维一般是通过物理吸附的方式固定酶、细胞、脂质体等生物材料用于筛选中药中的活性成分(图 2)[30-32]。中空纤维用于固定细胞能够使细胞均匀地分布在其内壁, 而不会出现堆积或者浓度梯度现象[30]。Tao等[31]首次将吸附在中空纤维内壁的细胞用于中药筛选研究, 建立了中空纤维细胞捕获结合HPLC法(hollow fiber cell fish-HPLC, HFCF-HPLC)。相比于细胞膜色谱法, 这种方法不仅使细胞的整体生物结构和特征在筛选过程中得以维持, 而且不需要繁琐的生物膜色谱柱的制备过程。Xue等[32]分别将含有胃癌细胞、巨噬细胞、神经母细胞瘤细胞的培养液直接注入中空纤维中, 在扫描电镜下可观察到细胞吸附在中空纤维的内壁。通过对比分别用固定细胞与未固定细胞的中空纤维筛选中药活性成分的洗脱液色谱图, 发现中药与中空纤维活性中心的非特异性作用较弱, 表明所筛选出的五味子木脂素、蛇床子和补骨脂香豆素成分为能够与细胞发生特异性结合的潜在活性成分。除细胞外, Tao等[31]采用聚丙烯中空纤维为载体材料, 通过物理吸附的方式使甘油三脂酶附着在中空纤维内壁, 构建了中空纤维吸附靶酶结合HPLC-MS分析的新方法, 筛选出荷叶总黄酮中对甘油三酯酶具有抑制作用的成分, 分别为槲皮素-3-O-β-D-吡喃阿拉伯糖基-(1→2)-β-D-吡喃半乳糖苷、槲皮素-3-O-β-D-葡萄糖醛酸和山柰酸-3-O-β-D-葡萄糖醛酸。
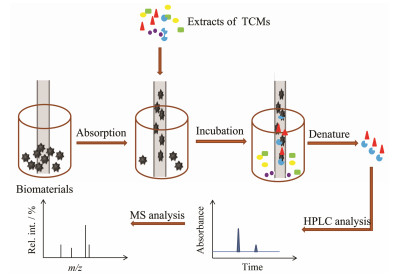
|
Figure 2 Schematic of screening bioactive compounds from TCMs by using hollow fibers |
以中空纤维作为载体材料制备固定化细胞或酶是一种简单易行的固定化方法, 但是, 中空纤维固定生物材料在中药活性成分筛选中的研究尚浅, 所筛选出的活性成分仍需通过体内或体外药理活性实验进一步验证。此外, 中药中一些成分的标准品常常难以获得, 而中空纤维细胞捕获结合HPLC法无法收集足够量的活性物质以进行药理实验或者对化合物的结构进行鉴定[32]。
2.4 表面等离子共振传感芯片表面等离子共振(surface plasmon resonance, SPR)传感芯片是SPR生物分析仪的核心元件, 包括耦合器件、金属膜和表面基质(如羧甲基葡聚糖、烷基硫醇或亲和素)三部分[33]。蛋白质、肽、酶以及DNA等生物大分子以一定的方式与SPR芯片上的表面基质作用, 从而固定在SPR传感芯片表面。目标分子流经其表面时与生物大分子发生特异性结合作用, 这使得SPR芯片表面的介质发生变化, 继而影响到SPR生物分析仪中传感器的输出信号, 根据传感器输出信号的变化可以对目标分子进行进一步的分析[33, 34]。SPR生物分析仪在药物研究如药物与蛋白的结合常数测定、高通量筛选等方面有着广泛的应用。
物理吸附法、共价结合法以及亲和素-生物素结合法是目前在SPR中较为常用的偶联方法[33]。Zhang等[35]利用羧甲基葡聚糖修饰的金膜作为固定化载体材料, 采用EDC和NHS将其活化, 从而与HAS表面的氨基共价键结合, 实现了HSA的固定化。该研究通过利用固定在SPR传感芯片上的HSA, 结合HPLC-MS/MS分析从中药黄芪中筛选出11个异黄酮类和9个黄酮皂苷类物质。Peng等[36]采用上述类似方法固定HSA, 对中药杜仲中的活性成分进行了高通量筛选。Zheng等[37]采用生物素化的脂质A, 利用亲和素-生物素之间的相互作用将其固定在SPR芯片表面, 从60种中药提取物中找到新的治疗脓毒症的先导化合物京尼平苷。除了单靶标的固定, Liu等[38]建立了一种基于固定化细菌脂多糖和细菌DNA双靶点的SPR生物传感器用于抗脓血症药物的筛选, 脂多糖直接通过物理吸附作用固定在SPR芯片上, 而细菌DNA则通过生物素-亲和素作用固定在SPR芯片上。该研究利用构建的双靶标SPR芯片对114种中药提取物进行了筛选, 发现地骨皮的活性最高, 并结合色谱分离技术以及体内药理活性实验获得了一个新型的抗脓血症候选药物-地骨皮乙素。
采用SPR传感芯片固定生物大分子用于中药活性成分的筛选, 可以检测到中药中的低含量组分, 具有灵敏度高以及高通量的特点, 同时实现了在线和自动化的分析过程。但是SPR传感芯片必须用于SPR生物分析仪中, 而该仪器的使用在一定程度上增加了分析成本。并且由于传感器的原理限制, SPR生物分析仪无法识别出化合物的种类, 仍需要与HPLC-MS等结合使用。因此, SPR传感芯片在中药研究中更多地用于配体与靶点的结合分析, 在中药活性成分筛选的应用仍存在一定的局限性。
2.5 其他载体材料天然或者合成的有机高分子载体是固定化技术中重要的载体材料。壳聚糖是海产品加工业中产生的一种天然多糖类物质, 其来源方便、廉价且易于改性。Ye等[39]采用壳聚糖作为载体材料制备了乙酰胆碱酯酶色谱柱, 从中药厚朴醇提物中筛选得到两个抗菌活性成分。该研究分别采用了凝胶-溶胶交联法和溶胶-凝胶包埋法用于酶的固定化, 发现在溶胶-凝胶包埋法的过程中形成的泡状结构可以促进药物的渗透从而使底物更容易与酶直接接触。此外, 也有文献[10]报道将琼脂糖作为固定化载体用于中药活性成分筛选的研究。例如, Xu等[10]将三螺旋DNA固定在链酶亲和素修饰的琼脂糖表面, 从中药黄柏中筛选出了两个活性组分小檗碱和非洲防己碱。甲基丙烯酸酯是一种高分子合成化合物, 对其改性后可以形成机械强度更高的复合微球, 作为液相色谱的填料可以应用于中药活性成分的筛选。Li等[40]通过原子转移自由基聚合反应将精氨酸-甘氨酸-天冬氨酸肽(RGD多肽)涂覆在聚[(寡聚乙二醇)甲基丙烯酸酯]修饰的氨基微球表面作为载体材料固定血管内皮细胞, 血管内皮细胞上的整合素以特异性亲和作用与氨基微球表面的RGD肽发生特异性吸附。该研究从中药川芎中筛选出了3个作用于血管内皮细胞的活性成分并鉴定出其中两个化合物, 分别为3-丁基-1(3H)异苯并呋喃酮和川芎嗪。
除了上述有机高分子载体外, 纳米材料如碳纳米管以及纳米粒子也是固定化酶技术中的研究热点。埃洛石纳米管是一种由高岭土片层卷曲而成的天然纳米管, Wang等[41]首次将埃洛石纳米管应用于固定化技术中, 筛选出厚朴中对脂肪酶具有抑制作用的活性成分, 分别为magnotriol A和magnaldehyde B。研究结果表明埃洛石纳米管在90 min能够吸附85%的脂肪酶, 并且固定后酶的催化活性明显高于游离脂肪酶。此外, 金纳米粒子与蛋白质间存在着多种作用方式, 包括静电吸附作用、共价键结合等。Zhang等[42]利用α-葡糖苷酶表面氨基和巯基与金纳米粒子之间的相互作用力, 制备固定化酶微反应器, 结合毛细管电泳技术从11种中药中筛选出一系列α-葡糖苷酶抑制剂。
3 结论与展望以生物材料为靶标筛选中药活性成分的方法在中药药效物质研究中发挥着越来越重要的作用。固定化技术将生物材料限定在一定的空间区域内, 在中药活性成分筛选领域显示出独特的优势。例如, 通过将生物材料固定在硅胶上制备亲和色谱柱而发展的在线筛选方法, 可同时实现成分筛选、结构鉴定以及活性确认; 相比之下, 基于磁性材料的固定化技术的主要优势则在于简单快速的材料与中药混合溶液分离, 省去了离心等操作步骤, 在实现快速分离的同时对生物材料也具有一定的保护作用; 而中空纤维由于操作简便、成本低廉、可重复利用等优势也逐渐成为一种常用的固定化材料; SPR芯片固定酶或细胞后用于中药研究表现出的高灵敏度、强专属性以及高通量等优势, 可以解决中药中某些成分含量低以及成分复杂等问题。
前期本课题组已应用血小板萃取技术对中药延胡索中的潜在抗血小板聚集活性成分进行了筛选[43], 计划进一步采用不同的载体材料对血小板或其他细胞进行固定, 用于天然产物中的药效物质研究。固定化技术应用于活性成分筛选的过程中仍然存在一些问题, 例如, 硅胶作为固定化载体材料, 存在固定过程繁琐、生物材料固定后寿命短的问题, 尤其是细胞膜色谱柱, 一般有效使用寿命只有3~5天, 这限制了硅胶在固定化技术中的应用。在后续研究中, 可以尝试对常用的硅胶和磁性材料通过表面修饰的方法进行性质和功能改造, 例如在磁性材料表面键和一层稳定性优良的材料使其更容易分散等。而中空纤维固定生物材料依赖物理吸附作用, 没有选择性, 可以尝试同时固定多种酶或细胞, 适应中药作用多靶点的特性, 更全面地反应中药作用的真实情况。另外, 如果能将SPR生物分析仪与其他分析技术, 如拉曼光谱、原子力显微镜等联用, 也有望建立一种新的低检测限中药活性成分筛选方法, 适用于中药中低含量组分的研究。总之, 固定化技术的发展, 更多优良的有机无机材料的出现, 以及更高分辨率仪器及技术的革新都为基于固定化技术的中药活性成分筛选提供支撑。
| [1] | Li P, Qi LW, Liu EH, et al. Analysis of Chinese herbal medicines with holistic approaches and integrated evaluation models[J]. Trend Anal Chem, 2008, 27: 66–77. DOI:10.1016/j.trac.2007.11.005 |
| [2] | Hwang ET, Gu MB. Enzyme stabilization by nano/microsized hybrid materials[J]. Eng Life Sci, 2013, 13: 49–61. DOI:10.1002/elsc.v13.1 |
| [3] | Kan AA, Alzohairy MA. Recent advances and applications of immobilized enzyme technologies:a review[J]. Res J Biol Sci, 2010, 5: 565–575. DOI:10.3923/rjbsci.2010.565.575 |
| [4] | Mahmoud KA, Lam E, Hrapovic S, et al. Preparation of well-dispersed gold/magnetite nanoparticles embedded on cellulose nanocrystals for efficient immobilization of papain enzyme[J]. ACS Appl Mater Inter, 2013, 5: 4978–4985. DOI:10.1021/am4007534 |
| [5] | Ansari SA, Husain Q. Potential applications of enzymes immobilized on/in nano materials:a review[J]. Biotechnol Adv, 2012, 30: 512–523. DOI:10.1016/j.biotechadv.2011.09.005 |
| [6] | Habicht KL, Singh NS, Khadeer MA, et al. Characterization of a multiple endogenously expressed adenosine triphosphatebinding cassette transporters using nuclear and cellular membrane affinity chromatography columns[J]. J Chromatogr A, 2014, 1339: 80–85. DOI:10.1016/j.chroma.2014.02.076 |
| [7] | Rastian Z, Khodadadi AA, Vahabzadeh F, et al. Facile surface functionalization of multiwalled carbon nanotubes by soft dielectric barrier discharge plasma:generate compatible interface for lipase immobilization[J]. Biochem Eng J, 2014, 90: 16–26. DOI:10.1016/j.bej.2014.05.009 |
| [8] | Zhao GH, Wang JZ, Li YF, et al. Enzymes immobilized on superparamagnetic Fe3O4@Clays nanocomposites:preparation, characterization, and a new strategy for the regeneration of supports[J]. J Phys Chem C, 2011, 115: 6350–6359. DOI:10.1021/jp200156j |
| [9] | Li Y, Xu J, Chen Y, et al. Screening of inhibitors of glycogen synthase kinase-3β from traditional Chinese medicines using enzyme-immobilized magnetic beads combined with highperformance liquid chromatography[J]. J Chromatogr A, 2015, 1425: 8–16. DOI:10.1016/j.chroma.2015.10.062 |
| [10] | Xu N, Yang H, Cui M, et al. High-performance liquid chromatography-electrospray ionization-mass spectrometry ligand fishing assay:a method for screening triplex DNA binders from natural plant extracts[J]. Anal Chem, 2012, 84: 2562–2568. DOI:10.1021/ac202796v |
| [11] | Zhu W, Zhang Y, Hou C, et al. Covalent immobilization of lipases on monodisperse magnetic microspheres modified with PAMAM-dendrimer[J]. J Nanopart Res, 2016, 18: 32. DOI:10.1007/s11051-016-3337-x |
| [12] | Sheldon RA, Vanpelt S. Enzyme immobilisation in biocatalysis:why, what and how[J]. Chem Soc Rev, 2013, 42: 6223–6235. DOI:10.1039/C3CS60075K |
| [13] | Chen X, Cao Y, Zhang H, et al. Comparative normal/failing rat myocardium cell membrane chromatographic analysis system for screening specific components that counteract doxorubicin-induced heart failure from Acontium carmichaeli[J]. Anal Chem, 2014, 86: 4748–4757. DOI:10.1021/ac500287e |
| [14] | He H, Han S, Zhang T, et al. Screening active compounds acting on the epidermal growth factor receptor from Radix scutellariae via cell membrane chromatography online coupled with HPLC/MS[J]. J Pharm Biomed Anal, 2012, 62: 196–202. DOI:10.1016/j.jpba.2011.12.025 |
| [15] | Liu J, Yang J, Wang SC, et al. Combining human periodontal ligament cell membrane chromatography with online HPLC/MS for screening osteoplastic active compounds from Coptidis Rhizoma[J]. J Chromatogr B, 2012, 804: 115–120. |
| [16] | Hou XF, Wang SC, Zhang T, et al. Recent advances in cell membrane chromatography for traditional Chinese medicines analysis[J]. J Pharm Biomed Anal, 2014, 101: 141–150. DOI:10.1016/j.jpba.2014.05.021 |
| [17] | He LC, Wang SC, Geng XD. Coating and fusing cell membranes onto a silica surface and their chromatographic characteristics[J]. Chromatographia, 2001, 54: 71–76. DOI:10.1007/BF02491836 |
| [18] | Wang S, Wang C, Zhao X, et al. Comprehensive twodimensional high performance liquid chromatography system with immobilized liposome chromatography column and monolithic column for separation of the traditional Chinese medicine Schisandra chinensis[J]. Anal Chim Acta, 2012, 713: 121–129. DOI:10.1016/j.aca.2011.10.062 |
| [19] | Zhang C, Li J, Xu L, et al. Fast immobilized liposome chromatography based on penetrable silica microspheres for screening and analysis of permeable compounds[J]. J Chromatogr A, 2012, 1233: 78–84. DOI:10.1016/j.chroma.2012.02.013 |
| [20] | Wei JX, Shi ZG, Chen F, et al. Synthesis of penetrable macroporous silica spheres for high-performance liquid chromatography[J]. J Chromatogr A, 2009, 1216: 7388–7393. DOI:10.1016/j.chroma.2009.04.066 |
| [21] | Wang S, Zhao K, Zang W, et al. Highly selective screening of the bioactive compounds in Huoxue capsule using immobilized β2-adrenoceptor affinity chromatography[J]. Anal Biochem, 2014, 457: 1–7. DOI:10.1016/j.ab.2014.04.013 |
| [22] | Hu L, Li X, Feng S, et al. Comprehensive two-dimensional HPLC to study the interaction of multiple components in Rheum palmatum L. with HSA by coupling a silica-bonded HSA column to a silica monolithic ODS column[J]. J Sep Sci, 2006, 29: 881–888. DOI:10.1002/(ISSN)1615-9314 |
| [23] | Su X, Hu L, Kong L, et al. Affinity chromatography with immobilized DNA stationary phase for biological fingerprinting analysis of traditional Chinese medicines[J]. J Chromatogr A, 2007, 1154: 132–137. DOI:10.1016/j.chroma.2007.03.050 |
| [24] | Laurent S, Forge D, Port M, et al. Magnetic iron oxide nanoparticles:synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications[J]. Chem Rev, 2008, 108: 2064–2110. DOI:10.1021/cr068445e |
| [25] | Tao Y, Zhang Y, Cheng Y, et al. Rapid screening and identification of α-glucosidase inhibitors from mulberry leaves using enzyme-immobilized magnetic beads coupled with HPLC/MS and NMR[J]. Biomed Chromatogr, 2013, 27: 148–155. DOI:10.1002/bmc.v27.2 |
| [26] | Zhang Y, Nie M, Shi S, et al. Integration of magnetic solid phase fishing and off-line two-dimensional high-performance liquid chromatography-diode array detector-mass spectrometry for screening and identification of human serum albumin binders from Radix astragali[J]. Food Chem, 2014, 146: 56–64. DOI:10.1016/j.foodchem.2013.09.030 |
| [27] | Wan LH, Jiang XL, Liu YM, et al. Screening of lipase inhibitors from Scutellaria baicalensis extract using lipase immobilized on magnetic nanoparticles and study on the inhibitory mechanism[J]. Anal Bioanal Chem, 2016, 408: 2275–2283. DOI:10.1007/s00216-016-9320-7 |
| [28] | Wong LS, Khan F, Micklefield J. Selective covalent protein immobilization:strategies and applications[J]. Chem Rev, 2009, 109: 4025–4053. DOI:10.1021/cr8004668 |
| [29] | Yan Y, Chen X, Hu S, et al. Applications of liquid-phase microextraction techniques in natural product analysis:a review[J]. J Chromatogr A, 2014, 1368: 1–17. DOI:10.1016/j.chroma.2014.09.068 |
| [30] | Yan Y, Hao Y, Hu S, et al. Hollow fibre cell fishing with high performance liquid chromatography for screening bioactive anthraquinones from traditional Chinese medicines[J]. J Chromatogr A, 2013, 1322: 8–17. DOI:10.1016/j.chroma.2013.10.084 |
| [31] | Tao Y, Zhang Y, Wang Y, et al. Hollow fiber based affinity selection combined with high performance liquid chromatography-mass spectroscopy for rapid screening lipase inhibitors from lotus leaf[J]. Anal Chim Acta, 2013, 785: 75–81. DOI:10.1016/j.aca.2013.04.058 |
| [32] | Xue X, Li L, Chen X, et al. Hollow fiber cell fishing with high performance liquid chromatography for screening bioactive compounds from traditional Chinese medicines[J]. J Chromatogr A, 2013, 1280: 75–83. DOI:10.1016/j.chroma.2013.01.033 |
| [33] | Ou HC. Preparation and Application of the Biosensor Based on the Principle of SPR (基于SPR技术的传感芯片的研制及其应用)[D]. Beijing:Peking Union Medical College, 2009. |
| [34] | Wang XP, Hong XY, Zhan SY, et al. Surface plasmon resonance sensing technology and bioanalytical instrument[J]. Prog Chem (化学进展), 2014, 26: 1143–1159. |
| [35] | Zhang Y, Shi S, Guo J, et al. On-line surface plasmon resonance-high performance liquid chromatography-tandem mass spectrometry for analysis of human serum albumin binders from Radix astragali[J]. J Chromatogr A, 2013, 1293: 92–99. DOI:10.1016/j.chroma.2013.04.015 |
| [36] | Peng M, Zhang Y, Shi S, et al. Simultaneous ligand fishing and identification of human serum albumin binders from Eucommia ulmoides bark using surface plasmon resonancehigh performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2013, 940: 86–93. DOI:10.1016/j.jchromb.2013.09.032 |
| [37] | Zheng X, Yang D, Liu X, et al. Identification of a new anti-LPS agent, geniposide, from Gardenia jasminoides Ellis, and its ability of direct binding and neutralization of lipopolysaccharide in vitro and in vivo[J]. Int Immunopharmacol, 2010, 10: 1209–1219. DOI:10.1016/j.intimp.2010.07.001 |
| [38] | Liu X, Zheng X, Long Y, et al. Dual targets guided screening and isolation of kukoamine B as a novel natural anti-sepsis agent from traditional Chinese herb Cortex lycii[J]. Int Immunopharmacol, 2011, 11: 110–120. DOI:10.1016/j.intimp.2010.10.015 |
| [39] | Ye YH, Li C, Yang J, et al. Construction of an immobilised acetylcholinesterase column and its application in screening insecticidal constituents from Magnolia officinalis[J]. Pest Manag Sci, 2015, 71: 607–615. DOI:10.1002/ps.2015.71.issue-4 |
| [40] | Li Q, Wang J, Liu G, et al. Screening bioactive compounds from Ligusticum chuanxiong by high density immobilized human umbilical vein endothelial cells[J]. Anal Bioanal Chem, 2015, 407: 5783–5792. DOI:10.1007/s00216-015-8764-5 |
| [41] | Wang H, Zhao X, Wang S, et al. Fabrication of enzymeimmobilized halloysite nanotubes for affinity enrichment of lipase inhibitors from complex mixtures[J]. J Chromatogr A, 2015, 1392: 20–27. DOI:10.1016/j.chroma.2015.03.002 |
| [42] | Zhang A, Ye F, Lu J, et al. Screening α-glucosidase inhibitor from natural products by capillary electrophoresis with immobilised enzyme onto polymer monolith modified by gold nanoparticles[J]. Food Chem, 2013, 141: 1854–1859. DOI:10.1016/j.foodchem.2013.04.100 |
| [43] | Zhang Q, Chen C, Wang FQ, et al. Simultaneous screening and analysis of antiplatelet aggregation active alkaloids from Rhizoma Corydalis[J]. Pharm Biol, 2016, 54: 3113–3120. DOI:10.1080/13880209.2016.1211714 |
 2017, Vol. 52
2017, Vol. 52


