2. 北京市药品检验所, 北京 102206;
3. 北京中医药大学中药品质评价研究中心, 北京 100102
2. Beijing Institute for Drug Control, Beijing 102206, China;
3. Traditional Chinese Medicine Quality Evaluation Research Center, Beijing University of Chinese Medicine, Beijing 100102, China
中药柴胡 (Bupleuri Radix) 始载于《神农本草经》,在中国有着两千多年的药用历史,是最常用的大宗药材之一[1]。它在方剂配伍中常作为“君药”出现,用于治疗感冒发热、寒热往来、疟疾、肝郁气滞、胸肋胀痛、脱肛、子宫脱垂以及月经不调[2]。随着中药现代化的发展,柴胡中分离得到了诸如柴胡皂苷[3]、挥发油[4]、柴胡多糖[5]等多种活性成分,它们发 挥了抗炎[6]、抗肿瘤[7]、神经调节[8]、免疫调节[9]等多种药理活性,这使得柴胡在现代药物开发中占据了重要的地位。因此其市场需求逐年旺盛,年需求量已达上千吨[10]。
柴胡属包含约150种植物,我国分布有42种、17变种、7变型[11]。2015版《中国药典》规定,中药柴胡为伞形科柴胡属植物柴胡 (Bupleurum chinense DC.) 或狭叶柴胡 (Bupleurum scorzoneri folium Willd.) 的干燥根[2],其中柴胡俗称“北柴胡”。但由于地理分布以及地方用药习惯等因素的影响,柴胡属中有25种、8变种、3变型在不同地区和市场中作为柴胡使用[12]。事实上,一些《中国药典》规定基原以外的柴胡种类,在地方标准中被当做正品柴胡,如黑柴胡 (Bupleurum smithii Wolff) 和银州柴胡 (Bupleurum yinchowense Shan et Y. Li) 在《甘肃省中药材标准》[13]、锥叶柴胡 (Bupleurum bicaule Helm) 在《内蒙古中药材标准》[14]中均被列为地方用柴胡。然而,不同种柴胡的主要成分及药理活性不尽相同,如银州柴胡的总皂苷具有很好的神经调节作用[8],柴胡相比于狭叶柴胡具有更好的解热作用[15]。因此,各种柴胡的混用滥用会导致柴胡质量的不可控制以及相应的用药安全问题,对不同种柴胡属药用植物的鉴定就显得尤为重要。此外,在各中药材市场中,将柴胡药材通过传统方法进行鉴别的难度很大,因此建立一种快速准确的新鉴定方法迫在眉睫。
目前,DNA条形码鉴定技术在中药鉴定领域取得了良好的效果[16-18]。其中18S~26S核rRNA基因的内转录间隔区 (internal transcribed spacer,ITS) 因变异速度较快、变异位点丰富、长度较为稳定、便于测序分析等优点[19, 20],在解决植物界科、亚科、族属组内的系统发育和分类问题方面发挥了重要作用[21],已成为系统与进化植物学研究中的重要分子标记。因此,综合比较了不同DNA条形码在柴胡属药用植物鉴定中的鉴定效率[22-25],拟采用ITS序列作为鉴定柴胡属药用植物的DNA条形码。
本文采集了来自辽宁、河北、内蒙、北京、山西、宁夏、甘肃、青海、西藏9个省区共14个居群的柴胡属药用植物168株,建立了柴胡属药用植物ITS 鉴定方法。利用此方法对52份来自全国5个主要中药材市场的柴胡药材进行分子鉴定,从而对ITS鉴定方法的准确性进行验证,同时对市售柴胡药材的流通情况进行考察。由于柴胡皂苷是柴胡中最为重要的活性物质[26, 27],是柴胡质量评价的指标性成分[28, 29],因此本文进一步对52份柴胡药材中柴胡皂苷a (saikosaponin a,SSa)、柴胡皂苷c (saikosaponin c,SSc) 以及柴胡皂苷d (saikosaponin d,SSd) 进行了含量分析,以期为市售柴胡药材的质量评价提供依据。本文的结果对于常见柴胡属药用植物的有效鉴定具有重要价值,且对于掌握市售柴胡药材的流通现状以及质量评价具有指导意义。
材料与方法柴胡属药用植物材料 从全国9个省份的14个居群采集了168株柴胡属药用植物,由北京中医药大学刘春生教授对其进行形态鉴定,各样品详细信息见表 1。
| Table 1 Bupleurum medicinal plants for establishment of ITS identification method |
柴胡药材材料 52份柴胡药材样品收集自全国5个中药材市场,包括: 四川成都荷花池药材市场10份 (CD1~CD10) 、河北安国药材市场11份 (AG1~AG11) 、广东广州药材市场10份 (GZ1~GZ10) 、安徽亳州药材市场11份 (BZ1~BZ11) 、河南禹州药材市场10份 (YZ1~YZ10) 。
实验仪器 移液枪 (eppendorf); 1-13000型离心机 (SIGMA); TProfessional热循环分析仪 (Biometra); DYY-6C型电泳仪 (北京市六一仪器厂); BG-gds AUTO510型凝胶成像系统; Agilent 1100液相色谱仪; Phenomenexgemini 5 μm C18 (110A 4.6 mm×250 mm) 色谱柱。
实验试剂 广谱植物基因组DNA快速提取试剂盒、2×Taq PCR Master Mix酶、琼脂糖、Golden View染色剂、BM2000+DNA Marker购于北京博迈德科技发展有限公司; 对照品柴胡皂苷a (纯度: 98%,批号: 141128) 、柴胡皂苷d (纯度: 99.07%,批号: 141220) 购于成都普菲德生物技术有限公司,对照品柴胡皂苷c (纯度: 98.59%,批号: MUST-15102802) 购于成都曼思特生物技术有限公司; 甲醇 (分析纯,Merck); 乙腈 (色谱纯,Merck); 浓氨水 (分析纯,北京化工厂)。
ITS 序列扩增 取柴胡属植物材料干燥叶片置于研钵中,在液氮氛围下迅速研磨成粉末,取该粉末20 mg于1.5 mL离心管中,用广谱植物基因组DNA提取试剂盒逐步提取DNA。扩增ITS序列引物为P1: 5'-AGAAGTCGTAACAAGGTTTC-3'、P4: 5'-TCCTCC GCTTATTGATATGC-3'。30 μL PCR反应体系: 2×Taq PCR Master Mix 15.0 μL,上下游引物各1.0 μL (5 μmol·L-1),DNA模板3.0 μL,ddH2O 10.0 μL。PCR反应条件: 94 ℃ 5 min; 94 ℃ 1 min,55 ℃ 45 s,72 ℃ 1 min (35循环) ; 72 ℃ 10 min。1% 琼脂糖凝胶电泳检测,PCR扩增产物送上海生工生物工程有限公司测序,采用CodonCode Aligner V5.12 (CodonCode Co.,USA) 进行序列拼接及校对。
柴胡属药用植物分子鉴定方法的建立 对扩增获得的ITS序列进行基于GenBank的相似性搜索,以确定是否为目标序列。将全部ITS序列导入DNAMAN 6.0 (LynnonBiosoft Co.,LTD,USA) 中进行比对分析,统计ITS序列各类单倍型信息,并在GenBank中注册。利用MEGA 5.0 (molecular evoutionary genetics analysis) 进行种内及种间变异及K2P (Kimura 2-parameter) 遗传距离分析[30]。基于邻接 (neighbor joining,NJ) 法构建系统发育树,使用Bootstrap重复1 000次检验各分支的支持率。基于以上分析,确定物种与单倍型的对应关系,并验证分子鉴定方法的准确性。
市售柴胡药材的分子鉴定 提取52份柴胡药材的总DNA并扩增其ITS序列,利用已建立的ITS分子鉴定方法对其进行物种鉴定。
HPLC 法分析市售柴胡药材中SSa、SSc、SSd的含量 采用文献报道的HPLC方法测定柴胡药材中SSa、SSc及SSd的含量[31]。对照品储备液的制备方法为: 精密称取SSc 8.30 mg于25 mL量瓶中,加甲醇适量使溶解并稀释至刻度; 精密称取SSa 11.58 mg、SSd 12.31 mg到同一10 mL量瓶中,加SSc溶液溶解并稀释至刻度,摇匀,作为对照品溶液,分别进样1、2、5、10、20、30 μL作为线性溶液。供试品溶液的制备方法为: 精密称定柴胡药材粉末 (过四号筛) 0.50 g,置具塞锥形瓶中,加入含5% 浓氨水试液的甲醇溶液25 mL,密塞,30 ℃水温超声处理 (功率200 W,频率40 kHz) 30 min,抽滤,用甲醇20 mL分2次洗涤容器及药渣,洗液与滤液合并,旋转蒸发回收溶剂至干。残渣加甲醇溶解,转移至5 mL量瓶中,加甲醇至刻度,摇匀,过0.45 μm滤膜,取续滤液,即得。色谱条件: 色谱柱为Phenomenexgemini 5 μm C18 (110A 4.6 mm×250 mm); 流动相为乙腈-水溶液,梯度洗脱条件: 0~5 min 20%乙腈,5~10 min 20%~30%乙腈,10~22 min 30%乙腈,22~46 min 30%~45%乙腈,46~60 min 45%~48%乙腈,60~61 min 48%~20%乙腈,61~70 min 20%乙腈; 流速 1.0 mL·min-1; 检测波长210 nm; 柱温30 ℃; 进样量10 μL。
HPLC 数据分析 运用统计软件SAS 8.0 (SAS Institute Inc.,USA),对柴胡药材中3种皂苷的含量及相关性进行统计学分析。分别采取单因素方差分析方法ANOVA及LSD T检验方法对不同种柴胡进行显著性差异分析,从而对不同种柴胡质量进行评价。
结果 1 基于ITS序列的柴胡属药用植物的分子鉴定 1.1 ITS 序列变异位点及单倍型分析测序得到柴胡ITS序列长度为600~606 bp。通过DNAMAN比对全部柴胡植物材料ITS序列,共发现86个变异位点 (表 2),并确定了19种单倍型 (TH1~TH19) ,对应的GenBank注册号分别为KT984177~KT98493、GU570601、EU001336。其中北柴胡有5种单倍型; 狭叶柴胡有4种单倍型; 黑柴胡有6种单倍型; 银州柴胡、锥叶柴胡、窄竹叶柴胡 (Bupleurum marginatum Wall. ex DC. var.stenophyllum)、三岛柴胡 (Bupleurum falcatum L.) 各有1种单倍型; 不同种间无重复单倍型。TH1为银州柴胡特有单倍型,TH2~TH6为北柴胡特有单倍型,TH7~TH10为狭叶柴胡特有单倍型,TH11~TH16为黑柴胡特有单倍型,TH17为锥叶柴胡特有单倍型,TH18为窄竹叶柴胡特有单倍型,TH19为三岛柴胡特有单倍型。单倍型的地理分布如图 1所示。
| Table 2 Variable sites in the 19 ITS haplotypes. x: Deletion of base. An asterisk indicated that the character states were the same as TH1 |
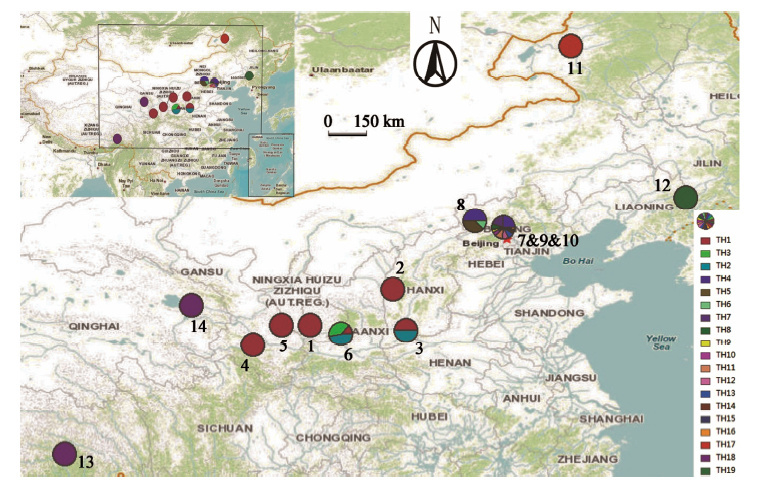
|
Figure 1 The distribution of 19 haplotypes. 1-14 represent different populations and pie charts show proportion of different haplotypes |
遗传距离反映了物种间的亲缘关系,其值越大亲缘关系越远,反之越近。当种内的遗传距离显著小于种间的遗传距离时,证明ITS序列对于不同种柴胡有着很好的鉴定效率。
19种单倍型的遗传距离范围是0~0.104 5; 北柴胡种内遗传距离范围是0~0.005 1; 狭叶柴胡种内遗传距离为0; 黑柴胡种内遗传距离范围是0~0.001 7; 银州柴胡、锥叶柴胡、窄竹叶柴胡、三岛柴胡种内遗传距离为0; 银州柴胡与北柴胡TH2种间遗传距离最小,是0.006 8; 银州柴胡与锥叶柴胡种间遗传距离最大,是0.104 5。种内种间遗传距离的分布情况如图 2所示,可明显看出种间遗传距离显著大于种内遗传距离,并且二者趋势线的峰图有着明显的分离,故以ITS序列鉴定常见柴胡属药用植物有着较高的效率。
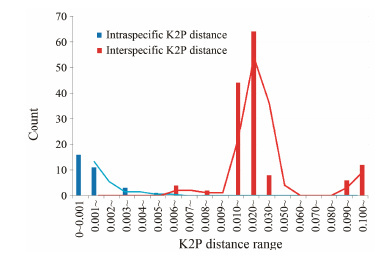
|
Figure 2 The distribution of K2P distance |
将168条扩增得到的ITS序列以及GenBank中已注册的银州柴胡序列HM114234、北柴胡序列JF718839、HM114232、狭叶柴胡序列JF718838、黑柴胡序列JF738140、锥叶柴胡序列HQ824723、窄竹叶柴胡序列HQ687952和三岛柴胡序列KP281271导入MEGA 5.0软件,以阿米芹族毒芹Cicutavirosa L. (AY524767) 为外类群构建NJ树(图 3),结果显示ITS序列可将7种柴胡属药用植物明确区分。其中窄竹叶柴胡最先与其他柴胡分开,其亲缘关系较其他种柴胡最远; 随后北柴胡与银 州柴胡聚为一大类,黑柴胡、三岛柴胡、锥叶柴胡、狭叶柴胡聚为一大类; 在进一步的分支中,各自独立聚为一支。GenBank中的序列亦各自聚到所属柴胡种的分支中。

|
Figure 3 NJ tree based on ITS sequences from 168 Bupleurum medicinal plants and 9 registered ITS sequences in GenBank. Bootstrap repeated 1 000 times and branch values lower than 50% were hided |
基于全部柴胡属药用植物材料的ITS序列单倍型信息及物种信息,建立了柴胡“物种-单倍型”信息表 (表 3),常见柴胡属药用植物的ITS序列可通过DNAMAN与此信息表中的序列进行比对,从而确定柴胡的物种。
| Table 3 “Species-Haplotypes” information of Bupleurum medicinal species |
按照已建立的柴胡分子鉴定方法,对52份柴胡药材进行鉴定,结果显示该方法能够成功鉴定全部的柴胡药材,并且未出现新的单倍型,从而进一步验证了本方法的可靠性,各柴胡药材单倍型及物种信息列于表 4。共鉴定出5种柴胡,其中北柴胡18份、银州柴胡23份、窄竹叶柴胡5份、锥叶柴胡5份、三岛柴胡1份。
| Table 4 Molecular identification results and saikosaponins contents of 52 Bupleuri Radix samples |
HPLC色谱图如图 4所示,SSa、SSc、SSd的保留时间分别为42.486、33.272、54.022 min; SSa的标准曲线为: Y= 285923X- 4.625 1 (R2 =0.999 9) ; SSc的标准曲线为: Y= 248 107.7887X+ 57.072 (R2 = 0.9912) ; SSd的标准曲线为: Y= 327 324.5403X+ 19.947 (R2 = 0.9999) ; 各柴胡药材中3种柴胡皂苷的百分含量列于表 4。
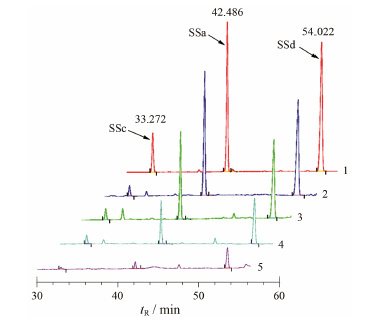
|
Figure 4 HPLC chromatograms of reference substance and samples. 1: HPLC chromatogram of reference substance; 2-5: HPLC chromatograms of B. marginatum var. stenophyllum,B. yinchowense,B. chinense,and B. bicaule,respectively |
以3种皂苷含量相加作为柴胡总皂苷含量,ANOVA和LSD T检验分析结果如表 5、6所示。4种柴胡 (三岛柴胡只有1份样品,无统计意义,故排除) 的总皂苷含量存在显著差异 (F= 38.04,P< 0.000 1) 。根据LSD T检验结果,4种柴胡的皂苷含量从高到低依次为窄竹叶柴胡、银州柴胡、北柴胡和锥叶柴胡。
| Table 5 The ANOVA results. d.f.: Degrees of freedom; SSD: Sum of squares |
| Table 6 LSD T test results. Means with the same letter are not significantly different |
为了进一步探讨SSa、SSc、SSd含量之间的相关性,对其进行了Spearman相关系数检验。SSa与SSc: 0.5 < rs = 0.671 5< 0.7 (P< 0.000 1) ,两者呈现弱相关性; SSa与SSd: 0.5 <rs = 0.834 4 <0.7 (P< 0.000 1) ,两者呈现较强相关性; SSc与SSd: 0.5 < rs = 0.671 2 < 0.7 (P< 0.000 1) ,两者呈现弱相关性。
讨论中药柴胡由于其药用物种的多样性和形态的相似性,使得柴胡药材鉴别十分困难。本课题组在前期预实验中,对市售柴胡药材样品进行了形态及显微鉴定分析,结果均不理想,难以实现柴胡药材的有效鉴定。ITS序列在植物的鉴定中有着较高的效率[32],本文采集各地药用柴胡植物材料,扩增其ITS序列,通过序列分析确定了19种ITS单倍型,并最终发现ITS序列能实现常见的7种柴胡属药用植物的高效鉴定。其中银州柴胡、窄竹叶柴胡、锥叶柴胡、三岛柴胡各只有1种单倍型,北柴胡有5种单倍型,狭叶柴胡有4种单倍型,黑柴胡有6种单倍型。此外,发现栽培品的柴胡样品,其种内ITS序列一致性良好,如: 三岛柴胡的TH19和北柴胡的TH2、TH3都只出现在栽培品中,因此提示这3种单倍型可作为北柴胡和三岛柴胡栽培品的分子标记。这其中的三岛柴胡原产于日本,在中国均为栽培品[33]。
本文建立的ITS鉴定方法在市售柴胡药材的鉴定中有着很高的效率,可实现全部柴胡药材的准确鉴定,进一步证明了该方法的可靠性。此外,发现各柴胡药材的ITS序列所属单倍型多为各柴胡栽培品所属单倍型,这也进一步说明市售柴胡药材以栽培柴胡为主。
《中国药典》中明确规定中药柴胡的检测指标为SSa及SSd,两者总含量应≥0.30%。因此,根据这一标准,市售柴胡样品的合格率为100%。通过测定52份柴胡药材中3种皂苷的含量,发现皂苷含量从高到低的顺序为窄竹叶柴胡、银州柴胡、北柴胡、锥叶柴胡,其中锥叶柴胡的皂苷含量最低。但在收集这些柴胡药材的过程中,发现锥叶柴胡在市场上被称为“海拉尔柴胡”,其价格最为昂贵,每公斤售价约为150元。因此,从皂苷含量的角度考虑,仅以价格为导向的质量评判标准是不科学的。此外,从3种柴胡皂苷含量的相关性来看,SSa和SSd是密切相关的,而SSc则与它们呈现一种弱相关性,因此推测SSa和SSd的生物合成途径更为接近,这也可以为研究柴胡皂苷的生物合成途径提供一些参考。
| [1] | Sen L. Shennong's Herbal (神农本草经)[M]. Shanghai: Shanghai Technology and Health Press, 1959: 35. |
| [2] | Chinese Pharmacopoeia Committee. Pharmacopoeia of People's Republic of China. Part 1(中华人民共和国药典一部)[S]. Beijing:China Medical Science Press, 2015:263. |
| [3] | Tao YW, Xu JS, Wei JH, et al. Expression analysis of glycosyltransferase BcUGT1 from Bupleurum chinense DC. and its expression in E. coli and the target protein purification[J]. Acta Pharm Sin (药学学报), 2013, 48: 1345–1352. |
| [4] | Ashour ML, El-Readi M, Youns M, et al. Chemical composition and biological activity of the essential oil obtained from Bupleurumm arginatum (Apiaceae)[J]. J Pharm Pharmacol, 2009, 61: 1079–1087. DOI:10.1211/jpp.61.08.0012 |
| [5] | Xie JY, Di HY, Li H, et al. Bupleurum chinense DC polysaccharides attenuates lipopolysaccharide-induced acute lung injury in mice[J]. Phytomedicine, 2012, 19: 130–137. DOI:10.1016/j.phymed.2011.08.057 |
| [6] | Zhu J, Luo C, Wang P, et al. Saikosaponin a mediates the inflammatory response by inhibiting the MAPK and NF-κB pathways in LPS-stimulated RAW 264.7 cells[J]. Exp Ther Med, 2013, 5: 1345–1350. |
| [7] | Wong VK, Li T, Law BY, et al. Saikosaponin d, a novel SERCA inhibitor, induces autophagic cell death in apoptosisdefective cells[J]. Cell Death Dis, 2013, 4: e720. DOI:10.1038/cddis.2013.217 |
| [8] | Li ZY, Guo Z, Liu YM, et al. Neuroprotective effects of total saikosaponins of Bupleurum yinchowense on corticosteroneinduced apoptosis in PC12 cells[J]. J Ethnopharmacol, 2013, 148: 794–803. DOI:10.1016/j.jep.2013.04.057 |
| [9] | Ying ZL, Li XJ, Dang H, et al. Saikosaponin d affects the differentiation, maturation and function of monocyte-derived dendritic cells[J]. Exp Ther Med, 2014, 7: 1354–1358. |
| [10] | Li X, Wang Y, Du G, et al. The 10th National Symposium on Natural Medicinal Material Resources Proceedings and Abstracts (全国第十届中药及天然药物资源学术研讨会论文集)[C]. Lanzhou:Lanzhou Chinese Pharmaceutical Association Press, 2012:159-164. |
| [11] | Pan SL. Bupleurum Species:Scientific Evaluation and Clinical Applications[M]. London: London Taylor & Francis Group, 2006: 7-22. |
| [12] | Yang ZY, Chao Z, Huo KK, et al. ITS sequence analysis used for molecular identification of the Bupleurum species from northwestern China[J]. Phytomedicine, 2007, 14: 416–423. DOI:10.1016/j.phymed.2007.04.009 |
| [13] | Food and Drug Administration of Gansu Province. Chinese Medicinal Materials Standard of Gansu province (甘肃省中药材标准)[S]. Lanzhou:Gansu Culture Press, 2008:388. |
| [14] | The Inner Mongolia Autonomous Region Health Department. Chinese Medicinal Materials Standard of Inner Mongolia Autonomous Region (内蒙古中药材标准)[S]. Hohhot:Inner Mongolia Medical Press, 1988:279. |
| [15] | Yan J, Wei YF, Gu R. Study on composition of essential oil in above-ground and root of Bupleurum malconense and root of B. chinense by AMDIS and retention index[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 1048–1053. |
| [16] | Chen S, Song J, Yao H, et al. Strategy and key technique of identification of Chinese herbal medicine using DNA barcoding[J]. Chin J Nat Med (中国天然药物杂志), 2009, 7: 322–327. |
| [17] | Feng S, Zheng SH, Li YK, et al. Identification of Radix et Rhizoma Clematidis and its adulterants using DNA barcoding[J]. Acta Pharm Sin (药学学报), 2014, 49: 260–266. |
| [18] | Chen N, Lai X. "Global System" for species identification:DNA barcode[J]. World Sci Technol/Mod Tradit Chin Med Mater Med) (世界科技:中药现代化), 2010, 12: 331–336. |
| [19] | Coutinho JP, Carvalho A, Lima-Brito J. Taxonomic and ecological discrimination of Fagaceae species based on internal transcribed spacer polymerase chain reaction-restriction fragment length polymorphism[J]. AoB Plants, 2014, 7(pii): plu79. |
| [20] | Coleman AW. Nuclear rRNA transcript processing versus internal transcribed spacer secondary structure[J]. Trends Genet, 2015, 31: 157–163. DOI:10.1016/j.tig.2015.01.002 |
| [21] | Alvarez I, Wendel JF. Ribosomal ITS sequences and plant phylogenetic inference[J]. Mol Phylogenet Evol, 2003, 29: 417–434. DOI:10.1016/S1055-7903(03)00208-2 |
| [22] | Wu Y, Liu CS, Liu YF, et al. ITS sequence identification of Radix Bupleuri[J]. China J Chin Mater Med (中国中药杂志), 2005, 30: 732–734. |
| [23] | Xie H, Huo KK, Chao Z, et al. Identification of crude drugs from Chinese medicinal plants of the genus Bupleurum using ribosomal DNA ITS sequences[J]. Planta Med, 2009, 75: 89–93. DOI:10.1055/s-0028-1088334 |
| [24] | Hollingsworth PM, Forrest LL, Spouge JL, et al. A DNA barcode for land plants[J]. Proc Natl Acad Sci USA, 2009, 106: 12794–12797. DOI:10.1073/pnas.0905845106 |
| [25] | Chao Z, Zeng W, Liao J, et al. DNA barcoding Chinese medicinal Bupleurum[J]. Phytomedicine, 2014, 21: 1767–1773. DOI:10.1016/j.phymed.2014.09.001 |
| [26] | Wang X, Wang Q, Burczynski FJ, et al. Saikosaponina of Bupleurum chinense (Chaihu) elevates bone morphogenetic protein 4(BMP-4) during hepatic stellate cell activation[J]. Phytomedicine, 2013, 20: 1330–1335. DOI:10.1016/j.phymed.2013.07.010 |
| [27] | Liu RY, Li JP. Saikosaponin d inhibits proliferation of human undifferentiated thyroid carcinoma cells through induction of apoptosis and cell cycle arrest[J]. Eur Rev Med Pharmacol Sci, 2014, 18: 2435–2443. |
| [28] | Huang W, Sun R. The chemistry, pharmacology and toxicology review of saikosaponins[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2010, 26: 71–74. |
| [29] | Xu L, Tian J, Song R, et al. LC-MS/MS determination and comparison of saikosaponin a, b 2, c, d in crude and processed Radix Bupleuri by vinegar[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2012, 43: 334–340. |
| [30] | Tamura K, Peterson D, Peterson N, et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Mol Biol Evol, 2011, 28: 2731–2739. DOI:10.1093/molbev/msr121 |
| [31] | Min YH, Wang JH, Fan MX, et al. Study on the variation of saikosaponins and the quality control of the decoction pieces of Radix Bupleuri[J]. Chin J Pharm Anal (药物分析杂志), 2014, 34: 836–843. |
| [32] | Han J, Song J, Yao H, et al. Comparison of DNA barcoders in identifying medicinal materials[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 1056–1061. |
| [33] | Ke SY, Shi LL, Ma YZ, et al. Evaluation of the genetic diversity of Bupleurum using amplified fragment length polymorphism analysis[J]. Genet Mol Res, 2015, 14: 2590–2599. DOI:10.4238/2015.March.30.18 |
 2017, Vol. 52
2017, Vol. 52


