2. 广东药科大学, 广东 广州 510006;
3. 中山大学附属第一医院, 广东 广州 510080
2. Guangdong Pharmaceutical University, Guangzhou 510006, China;
3. The First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China
近年来,基因治疗得到越来越广泛的关注,特别在那些临床上治疗不十分理想的相关疾病领域,如肿瘤、心血管及免疫缺陷疾病等[1, 2]。成功的基因治疗前提是要开发安全、有效的基因载体,包括病毒与非病毒载体[3, 4]。阳离子聚合物作为非病毒基因载体中一种,在基因治疗中被认为可以克服病毒型载体的免疫原性和潜在的基因重组的风险[5]。因此,阳离子聚合物被广泛而深入的研究[6, 7]。聚酰胺-胺 (polya midoamine,PAMAM) 是一类树状大分子具有高分枝的结构并含有众多的伯胺基团结构,这些基团可以与许多功能基团结合,如靶向基团[8, 9]和其他功能团[10, 11],以改善原载体的毒性或增加它的细胞穿透性,进而增加基因转染效率。基于此,它也可作为药物的优良载体[12, 13]。
PAMAM是树状阳离子聚合物,作为药物和基因载体虽有许多文献报道,但由于它的毒性大 (通常是4代及以上),在临床应用中受到很大限制[14, 15]。但低分子量的PAMAM (通常指0~3代) 存在低毒或几乎无毒,不过它很少单独作为基因载体,需与其他无毒母体聚合物偶联后,再作为基因载体[16, 17],以增强它与质粒DNA结合能力及与细胞膜的相互作用,改善其与基因结合的稳定性,降低对细胞的毒性及抗血清能力[18, 19]。
α-环糊精 (α-CD) 通常多用作疏水性药物的包合物,以达到提高难溶性药物溶解度和增强药物稳定性的目的。α-CD分子表面有多个羟基,这些羟基可以通过化学反应激活,为靶向配体、活性基因提供链接位点。许多文献已报道,应用该种方法对α-CD表面进行功能化修饰用于基因递送。α-CD分子修饰的许多母体聚合物,可明显降低其对细胞毒副作用,增加基因转染率[20, 21]。本课题组近几年对不同代数PAMAM进行了结构改造与修饰,得到一系列PAMAM衍生物,并对其毒性及转染能力进行探索[9-11, 16, 18, 19, 21]。本研究在此基础上,合成了α-CD与PAMAM接枝聚合物 (CyD-G1) ,并测试其理化性能,比较它们毒性、稳定性及其在有血清和无血清环境下的细胞转染率。
材料与方法材料 HKE-293A细胞株、Lipofectamine 2000 (美国Invitrogen公司); BEL-7402和COS-7细胞株 (中国科学院上海细胞库); DMEM培养基、胎牛血清(美国Gibico公司); TAE缓冲液、磷酸缓冲盐溶液 (PBS) 由国产分析纯试剂配制; MTT、DMSO、PEI-25K (美国Sigma公司); pEGFP-C1质粒 (广东药科大学生命科学院生物技术系提供); Endo Free Plasmid Kit (TIANGEN); α-cyclodextrin (α-CD,中国智源生物工程公司); PAMAM-G1 (中国南京和风精细化工有限公司); 羰基二咪唑 (CDI,阿拉丁试剂有限公司)。
仪器 LGJ-18型冷冻干燥机 (北京四环科学仪器厂); INOVA-500型核磁共振波谱仪 (美国Varian公司); Malvern ZEN 3600纳米粒度及电位分析仪 (英国Malvern公司); Olympus倒置相差显微镜 (日本Olympus公司); Bio-Rad酶联免疫检测仪、FACSCanto II流式细胞仪 (美国BD公司); LSM510激光共聚焦显微镜 (德国Zeiss公司); 5451D低速离心机 (德国Eppendorf公司)。
CyD-G1 的合成 将CDI (5.84 g) 置于500 mL烧瓶中,用无水DMSO (25 mL) 搅拌溶解,另将α-CD (0.39 g) 溶解于25 mL无水DMSO中。将含α-CD的无水DMSO溶液置于恒压漏斗中缓慢加入含有CDI的DMSO溶液,加毕,避光室温磁力搅拌 12 h,然后向反应液中加入乙醚-乙酸乙酯的混合溶剂 (Et2O 300 mL + EAc 600 mL),离心后得到白色黏稠沉淀,用10 mL乙酸乙酯洗涤2次后,用25 mL无水DMSO溶解待用。取PAMAM-G1 (10.3 g) 溶解于150 mL无水DMSO中,并缓慢将上述沉淀的DMSO溶液加入其中,加毕,避光室温磁力搅拌12 h。将此溶液加入到乙醚-乙酸乙酯的混合溶剂中 (Et2O 600 mL + EAc 1 200 mL) 得到终产物沉淀,离心过滤后将此产物置于截留分子质量为7 000的透析袋中,透析3天,冷冻干燥后得到产物CyD-G1。
CyD-G1/DNA 复合物的制备 按照不同的N/P比制备复合物,其中质粒DNA的质量为2 μg。CyD-G1用无菌水溶解配置成不同浓度的溶液,等体积与质粒DNA溶液混合,室温孵育30 min后即得CyD-G1/ DNA复合物。
凝胶电泳的阻滞实验 根据上述方法制备不同N/P比的复合物溶液12 μL,其中含有DNA的量为1.2 μg。室温孵育30 min后进行电泳实验,条件为: 0.9% (w/v) 琼脂糖凝胶,110 V电压,电泳45 min,溴化乙锭 (EB) 染色,通过凝胶成像系统观察DNA条带的迁移。
将上述已经配好的复合物溶液与等体积的DNaseⅠ核酸酶溶液混合,其中含有核酸酶1.2 μg。在37 ℃条件下孵育20 min,将此混合体系置于70 ℃,5 min终止降解反应,加入15 mg·mL-1肝素溶液置换并释放DNA,室温放置2 h后,按照上述条件进行凝胶电泳,分析DNA的降解情况。
复合物粒径和电位的测定 配制不同N/P比的复合物,使其最终体积为1 mL,采用马尔文激光粒度电位测定仪在室温条件下进行测定,每个样品经适当稀释后测定3次。
细胞毒性实验 实验前24 h将细胞消化接种于96孔板中,当细胞的融汇度达到80% 时,将事先用培养基配制好的不同浓度的聚合物溶液按照每孔150 μL,每4孔为一组进行加样,加毕后置于细胞培养箱培养4 h,再将溶液吸出,并加入150 μL新鲜含血清培养基,培养36~42 h后每孔加入MTT溶液 20 μL继续培养4 h。取出后,吸净孔中的培养基并加入DMSO 200 μL,置于摇床适当震荡,待完全溶解后在酶标仪上492 nm和620 nm双波长处测定吸光度 (A),取其平均值,按下式计算细胞的存活率。
| ${\rm{Cellviability( }}\% {\rm{ )}} = {{{A_{{\rm{492(sample)}}}}/{A_{620{\rm{(sample)}}}}} \over {{A_{{\rm{492(control)}}}}/{A_{{\rm{620(control)}}}}}} \times 100\% $ |
细胞转染实验 将细胞接种于24孔板,待融汇度达到80% 时进行实验。吸出孔中的培养基后,加入无血清或含血清的新鲜培养基550 μL,将事先配制好的150 μL不同N/P比的复合物溶液均匀加入到培养基中 (勿将细胞吹起) 培养4 h,然后用新鲜的含血清培养基1 mL替换,继续培养36~42 h,用于流式细胞仪的测定。
流式细胞仪的测定 将需要测定的细胞取出后,吸去培养基,并用冰PBS清洗2次,然后加入胰酶200 μL进行消化,显微镜观察到细胞收缩脱落后加入含血清培养基400 μL终止消化,适当吹打后1 000 r·min-1离心5 min,弃上清液,加入0.5% 多聚甲醛PBS 300 μL固化细胞后,进行流式细胞仪的测定。
结果与讨论 1 环糊精-PAMAM枝接物的合成与表征CyD-G1通过下面的路线 (合成路线1) 进行合成。在合成过程中,由于CDI良好的双端连接特性被用于活化羟基及枝接低分子量PAMAM。为了保证没有分子内及分子间的枝接现象出现,反应中CDI和PAMAM与α-CD的摩尔比分别为90∶1和50∶1。1H NMR结果(图 1) 表明,α-CD 具有独特而强烈的质子信号 (H1 5.05,H3、H5、H6 4.02~3.74,H2、H4 3.66~3.46) ,当环糊精枝接PAMAM后,由于大量伯氨基的存在,限制了其分子移动,使这些质子信号变得极其微弱甚至消失,而在图中只能观察到PAMAM-G1的亚甲基峰 (3.40~3.08,2.90~2.70,2.55~2.50,2.48~2.20) 。根据1H NMR结果推算出平均每个α-CD上枝接了6.4个PAMAM-G1分子,表明这种聚合物可以提供大量的伯氨基和正电荷密度,不但为DNA提供足够的结合位点,而且可以更好地压缩并保护DNA免于核酸酶的降解。
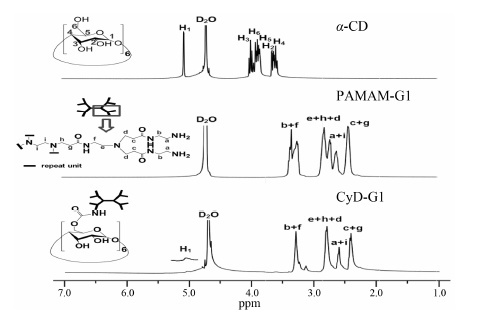
|
Figure 1 1H NMR spectra of α-CD,PAMAM-G1 and CyD-G1 |
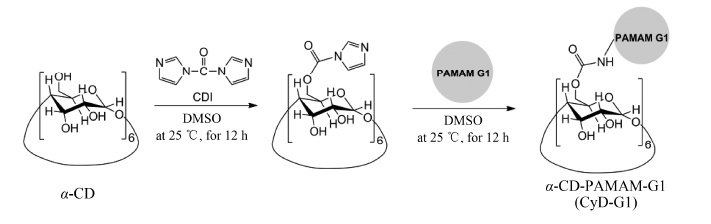
|
Scheme1 Synthesis route of CyD-G1. α-CD: α-Cyclodextrin; PAMAM: Polyamidoamine |
基因载体能否与DNA有效结合并保护DNA免受核酸酶的降解,是基因转染效率的首要条件。首先,考察CyD-G1与DNA的结合压缩特性。实验中配制了一系列不同N/P比的CyD-G1/DNA复合物,室温孵育30 min后进行凝胶电泳阻滞实验,并与PAMAM-G1和PEI-25K进行比较。结果表明,PAMAM-G1与DNA的结合能力较弱,在N/P比为80时,仍能看到模糊的DNA迁移条带。而PEI-25K在N/P比为4时就能够完全阻滞DNA的迁移。CyD-G1与DNA结合的能力稍弱于PEI-25K,在N/P比为4时可观察到少量的迁移条带,而在N/P比为8时,DNA迁移条带则完全没有出现。其次,为了考察CyD-G1对DNA的保护作用,采用核酸酶 (DNaseⅠ) 保护实验进行验证,结果表明: 当CyD-G1与DNA的N/P比小于8时,DNA被核酸酶完全降解,没有观察到任何DNA的条带出现; 当N/P≥8时,该阳离子聚合物可以有效保护DNA免于降解 (图 2)。

|
Figure 2 Agarose gel retardation assay: PAMAM-G1,PEI-25K,and CyD-G1 (a-c). Stability test against DNaseⅠ of CyD-G1 (d) |
图 3a为不同N/P比的CyD-G1/DNA复合物的粒径结果。如图可知,随着N/P比的不断增大,复合物的粒径呈现显著下降后略微上升趋势。其中,当N/P从0.5到10后,粒径由354.6 nm下降至140.8 nm; 在N/P比为20到60时,保持平均粒径为120.4 nm; 在N/P等于80时,略微上升到145 nm。这可能是由于阳离子聚合物在高浓度时自发产生聚集合并现象,导致过多的游离阳离子吸附在复合物表面使得粒子粒径变大。同时,对CyD-G1与DNA在含血清条件下不同N/P比的结合粒径也进行了考察。值得注意的是,在10% 血清存在的条件下,复合物粒径的变化趋势与无血清条件下基本一致,并没有出现粒子显著增大的情况,表明该复合物在血清条件下仍能保持粒子形态的完整性,提示其可能具有抗血清的作用。
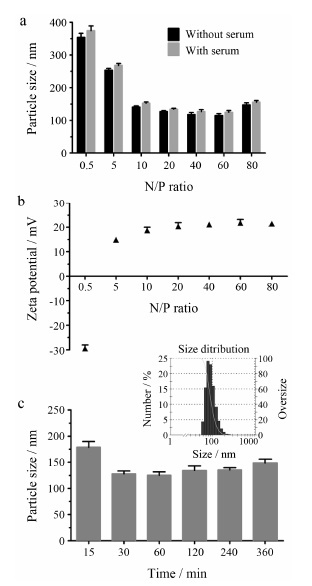
|
Figure 3 Particle size of CyD-G1/DNA polyplex (a). Zeta potential of CyD-G1/DNA polyplex (b). Stability test of CyD- G1/DNA polyplex (c,size distribution image represents the CyD- G1/DNA polyplex maintained 30 min with serum containing medium) |
图 3b为不同N/P比的CyD-G1/DNA复合物的zeta电位测定结果。由于复合物粒子是通过与细胞膜的静电引力相互作用被吞噬,粒子表面所带有的正电荷将显著影响体外基因的导入效果。结果表明,当 N/P比大于20后,复合物的zeta电位稳定在+21.2 mV左右,表明粒子表面携带足够的正电荷, 有利于细胞对复合物粒子的吸收。此外,还考察了复合物粒子在血清存在的条件下随时间的稳定性变化情况。所制备的复合物粒子分别在不同的时间点 (15~360 min) 测定粒径,如图 3c所示。复合物粒子在血清条件下,360 min内的平均粒径为134.6 nm,表明粒子完整性良好。而在临床应用时,这种特性将有助于对抗体血清的作用,对于达到预期的治疗效果尤为重要。
4 CyD-G1/DNA 的细胞毒性研究优异的基因载体应该具有良好的DNA结合传递能力和较低的细胞毒性,某些情况下,聚合物的低毒性是作为基因载体的先决条件。本实验中,采用传统的MTT法对不同浓度的CyD-G1聚合物溶液在一系列细胞中的毒性进行了研究,并以PEI-25K作为阳性对照进行对比,考察自制聚合物的细胞毒性水平。图 4a表示不同物质在HEK-293A细胞中的毒性。可以看出,在无血清的培养条件下,α-CD和PAMAM-G1均未表现出明显的细胞毒性,甚至当其质量浓度达到400 μg·mL-1时,细胞存活率仍能达到90% 以上。PEI-25K则表现出强烈的细胞毒性,当质量浓度为100 μg·mL-1时,细胞存活率急剧降低至19.8%; 在质量浓度为400 μg·mL-1时最终下降到6.8%。与PEI-25K相比,自制的CyD-G1阳离子聚合物表现出良好的细胞耐受性,在质量浓度为400 μg·mL-1 时,仍有70.3% 的细胞存活率。α-CD的外表面以亲水OH为主,表现出很好的细胞相容性,PAMAM-G1外表面虽有NH2,但分子质量很小,也未见明显毒性,而CyD-G1的分子质量远大于PAMAM-G1,外表面 -NH2分布更多,可能是造成毒性高于PAMAM-G1的原因。
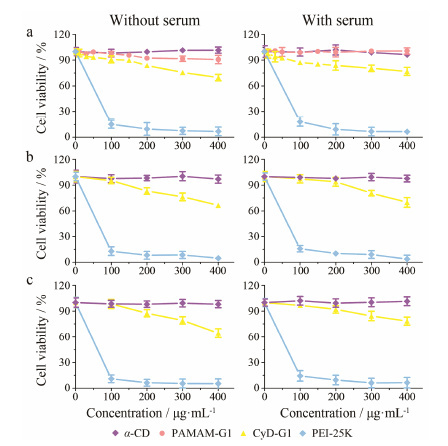
|
Figure 4 Cell viability of α-CD,PAMAM-G1,CyD-G1 and PEI-25K in serum-free and serum conditions for HEK-293A (a),BEL-7402 (b) and COS-7 (c) cells |
血清中的负电荷蛋白质会通过静电作用与阳离子聚合物结合,降低粒子表面的电性,避免其与细胞接触时产生的损伤导致细胞死亡。当使用含血清培养基培养时,细胞的存活率与无血清条件下相比均有不同程度的提高。当CyD-G1的质量浓度为400 μg·mL-1时,细胞的存活率提升至77.5%。但与PEI-25K共培养的细胞仍表现出极低的存活率,并没有因为血清的存在而产生变化。此外,BEL-7402细胞和COS-7细胞也被用于考察CyD-G1在不同细胞系中的毒性情况,见图 4b, c。结果表明,其毒性与HEK-293A细胞相似,高浓度情况下仍能保持较高的细胞存活率。上述MTT实验结果表明该阳离子聚合物体系在不同细胞系中使用是安全的。
5 体外细胞转染实验本实验以增强型绿色荧光蛋白 (EGFP-C1) 编码的质粒DNA作为报告基因,考察CyD-G1在不同细胞系的体外转染能力水平并与市售产品Lipofectamine 2000阳离子脂质体和PEI-25K进行对比,结果见图 5。图 5a表示不同N/P比的复合物在HEK-293A细胞中的转染效果。随着CyD-G1与质粒DNA的N/P比不断上升,转染率呈现先升高后降低的趋势,在N/P比等于80时达到了最佳的转染率。PEI-25K介导质粒的转染率为32.8%,明显低于CyD-G1的转染效果 (63.7%)。在无血清条件测定下,Lipofectamine 2000表现出最好的转染行为,转染率达到71.2%。当转染实验在血清存在的条件下进行时,不论是PEI-25K还是Lipofectamine 2000的转染率均大幅降低,其中,PEI-25K下降到原来的32.4%,而Lipofectamine 2000则下降到原来的4.1%。相反,CyD-G1在血清存在时没有发生转染率降低的现象,表明该聚合物在介导质粒转染时没有受到血清的影响,而且在某些N/P比的测定结果中,有血清的转染率要高于无血清的转染率 (N/P = 70、80、90) 。为了验证这种现象是否具有普遍性,BEL-7402细胞和COS-7细胞也同样被用于转染实验。结果 (图 5b, c) 表明,与HEK-293A细胞相比,虽然转染的绝对值有所降低,但仍能看出转染的趋势一致。在BEL-7402和COS-7细胞中,PEI-25K和Lipofectamine 2000在有血清情况下转染率却急剧降低,而CD-PG1则保持了有无血清转染的一致性。由于基因给药最终需要使目的基因在体内产生治疗效果,而体内血液会破坏基因的传递,这也是急待解决的问题。本实验中,CyD-G1表现出良好的血清对抗能力,这种抗血清的效果可能是由载体的结构特征所决定的,这种放射星状结构的载体是将几个PAMAM-G1结合至环糊精内核上,一方面提供了大量的伯氨基基团; 另一方面也显著提高了载体的缓冲能力。结合压缩DNA形成100 nm左右的纳米粒也有助于DNA的跨膜转运,提示该阳离子聚合物具有潜在体内应用的可能性。

|
Figure 5 Cell transfection efficiency of CyD-G1/pDNA polyplex with various N/P ratios in HEK-293A (a),BEL-7402 (b) and COS-7 (c) cells. PEI (N/P = 10) and Lipofectamine 2000 (Lipo,w/w = 2) were used as positive controls. Blue bar and red bar represent the transfection efficiency treated with serum-free and serum-containing medium respectively |
为了准确描述复合物在转染过程中的细胞摄入行为,在不同的时间点对细胞摄入复合物的情况进行了考察。一方面将复合物与转染细胞孵育特定时间后通过流式细胞仪测定其阳性转染率; 另一方面在转染发生的不同时间点采用激光共聚焦显微镜进行直观观察。流式细胞仪测定结果显示,复合物在细胞中共孵育1、2、4 h,细胞的转染率分别为24.7%、44.3% 和63.7%,而对应的PEI-25K的转染率分别为9.7%、16.9% 和32.8%。表明CyD-G1可以有效介导质粒DNA进入细胞内部进行表达。
激光共聚焦的结果如图 6所示,其中红色表示罗丹明标记的质粒DNA,蓝色表示DAPI染色的细胞核。如图可见,当转染时间为1 h时,只能在细胞核内偶尔发现红色的质粒DNA,表明DNA进入细胞内部但仍然没有转运进入细胞核。而根据明场的细胞轮廓可发现大部分的质粒DNA环绕在细胞膜上,提示仍有大量的质粒会被摄入细胞内; 当转染2 h时,质粒DNA在细胞表面的沉积增加,在细胞核内观察到红色DNA亮点明显增多; 当转染达到4 h时,质粒DNA进入细胞核中,在激光共聚焦图片上显现出红蓝重叠的图像,说明DNA已充分进入细胞核内。
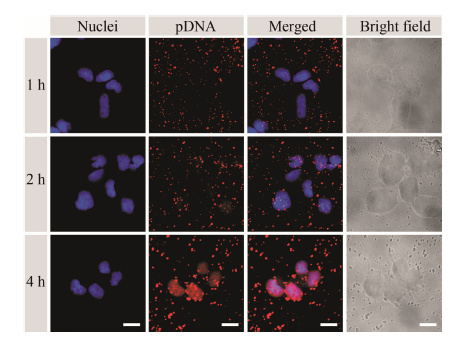
|
Figure 6 Confocal laser scanning microscope images of CD-PG1/rhodamine-labeled pDNA polyplex in HEK-293A cells after incubation for 1 h (a),2 h (b),4 h (c) |
本实验合成了一种由环糊精和聚酰胺-胺枝接形成的阳离子聚合物CyD-G1,凝胶阻滞实验表明该聚合物能够在较低N/P比的情况下有效结合DNA,并保护其免受核酸酶的降解作用。CyD-G1与DNA结合形成的纳米粒大小平均为120.4 nm,表面zeta电位为+21 mV,表明可以有效提供所需要的正电性,而且在6 h的稳定性测定中,粒子的粒径基本保持不变。与PEI-25K相比,CyD-G1具有较低的细胞毒性,在不同的细胞系中呈现出相似的结果。体外转染结果显示该载体作为基因传递系统的优异特性,与市售转染制剂在血清中转染率急剧降低不同的是,样品在不同N/P比测定时均没有发生显著的差异,而且不同细胞的转染率的趋势呈一致性。通过激光共聚焦可以看出不同转染时间下,聚合物进入细胞中的过程,表明该载体介导质粒DNA转染的有效性。这种抗血清的转染能力也提示该阳离子聚合物载体具有潜在的体内应用的可行性。
| [1] | Kurosaki T, Yamashita Y, Aki K, et al. Secure and effective gene vector of polyamidoamine dendrimer pharmaceutically modified with anionic polymer[J]. J Pharm Sci, 2011, 100: 4855–4863. DOI:10.1002/jps.22701 |
| [2] | Mintzer MA, Simanek EE. Nonviral vectors for gene delivery[J]. Chem Rev, 2009, 109: 259–302. DOI:10.1021/cr800409e |
| [3] | Al-Dosari MS, Gao X. Nonviral gene delivery:principle, limitations, and recent progress[J]. AAPS J, 2009, 11: 671–481. DOI:10.1208/s12248-009-9143-y |
| [4] | Kundu PP, Sharma V. Synthetic polymeric vectors in gene therapy[J]. Curr Opin Solid Sate Mater, 2008, 12: 89–102. DOI:10.1016/j.cossms.2009.01.005 |
| [5] | Thomas CE, Ehrhardt A, Kay MA. Progress and problems with the use of viral vectors for gene therapy[J]. Nat Rev Genet, 2003, 4: 346–358. DOI:10.1038/nrg1066 |
| [6] | Ping Y, Ma Q, Chen JH. Dextran-sperminepolycation as a vector for gene transfection in vitro[J]. Acta Pharm Sin (药学学报), 2007, 42: 669–674. |
| [7] | Chen JH. Application of cationic polymer vector for gene delivery systems[J]. Acta Pharm Sin (药学学报), 2003, 38: 316–320. |
| [8] | Shen M, Huang YZ, Ham LM, et al. Multifunctional drug delivery system for targeting tumor and its acidic microenvironment[J]. J Control Release, 2012, 161: 884–892. DOI:10.1016/j.jconrel.2012.05.013 |
| [9] | Cao DW, Chen JH, Feng M, et al. Nano-complexes from RGD-modified generation 1.0 polyamidoamine based copolymers used for intravascular gene release to prevent restenosis[J]. Nanomedicine, 2016, 11:335-375. |
| [10] | Zeng X, Pan SR, Li J, et al. A novel dendrimer based on poly (L-glutamic acid) derivatives as an efficient and biocompatible gene delivery vector[J]. Nanotechnology, 2011, 22: 375102. DOI:10.1088/0957-4484/22/37/375102 |
| [11] | Cao DW, Chen JH, Pan SR, et al. Divalent folate modification on PEG:an effective strategy for improving the cellular uptake and targetability of PEGylated polyamidomine-polyethylenimine copolymer[J]. Mol Pharm, 2015, 12: 240–252. DOI:10.1021/mp500572v |
| [12] | Kong SY, Tang GT, PEI YY, et al. PEGylated polyamidoamine dendrimer/methotrexate complex:pharmacokinetics and anti-tumor activity in normal and tumor-bearing rodents[J]. Acta Pharm Sin (药学学报), 2009, 44: 85–90. |
| [13] | Lu JJ, Wu ZH, Ping QN. The effect of polyamidoamine (PAMAM) dendrimers on the solubility and pharmacokinetics of breviscapine[J]. Acta Pharm Sin (药学学报), 2009, 44: 197–202. |
| [14] | Dufè C, Uchegbu IF, Schatzlein AG. Dendrimers in gene delivery[J]. Adv Drug Deliv Rev, 2005, 57: 2177–2202. DOI:10.1016/j.addr.2005.09.017 |
| [15] | Wu HM, Pan SR, Chen MW, et al. A serum-resistant polyamidoamine-based polypeptide dendrimer for gene transfection[J]. Biomaterials, 2011, 32: 1619–1634. DOI:10.1016/j.biomaterials.2010.09.045 |
| [16] | Cao DW, Qin LH, Chen JH, et al. Transfection activity and the mechanism of PDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8K[J]. Mol Biosyst, 2013, 9: 3175–3186. DOI:10.1039/c3mb70261h |
| [17] | Wen YT, Guo ZH, Du Z, et al. Serum tolerance and endosomal escape capacity of histidine-modified pDNA-loaded complexes based on polyamidoamine dendrimer derivatives[J]. Biomaterials, 2012, 33: 8111–8121. DOI:10.1016/j.biomaterials.2012.07.032 |
| [18] | Arima H, Yamashita S, Mori Y, et al. In vitro and in vivo gene delivery mediated by lactosylated dendrimer/a-cyclodextrin conjugates (G2) into hepatocytes[J]. J Control Release, 2010, 146: 106–117. DOI:10.1016/j.jconrel.2010.05.030 |
| [19] | Pan SR, Cao DW, Fang R, et al. Cellular uptake and transfection activity of DNA complexes based on poly(ethylene glycol)-poly(L-glutamine)copolymer with PAMAM G2[J]. J Mater Chem B, 2013, 1: 5114–5127. DOI:10.1039/c3tb20649a |
| [20] | Yang C, Li HZ, Goh SH, et al. Cationic star polymers consisting of α-cyclodextrin core and oligoethylenimine arms as nonviral gene delivery vectors[J]. Biomaterials, 2007, 28: 3245–3254. DOI:10.1016/j.biomaterials.2007.03.033 |
| [21] | Huang H, Cao DW, Qin LH, et al. Dilution-stable PAMAM G1-grafted polyrotaxane supermolecules deliver gene into cells through a caveolae-dependent pathway[J]. Mol Pharm, 2014, 11: 2323–2333. DOI:10.1021/mp5002608 |
 2017, Vol. 52
2017, Vol. 52



