2. 河北大学药物化学与分子诊断教育部重点实验室, 河北 保定 071002
2. Key Laboratory of Medicinal Chemistry and Molecular Diagnosis of the Ministry of Education, Hebei University, Baoding 071002, China
真菌是一类分布十分广泛的真核细胞生物,它们与人类关系密切,其中许多真菌对人类是有益的,然而还有些真菌可侵犯动植物及人类,引起各种真菌病。在过去20年中,由于大量病人进行器官移植和癌症化疗时造成潜在的宿主免疫功能不全,所以侵袭性真菌感染的发病率和死亡率已急剧增加[1]。在临床上,烟曲霉 (死亡率50%~90%)、新型隐球菌 (死亡率20%~70%) 和白色念珠菌 (死亡率20%~40%) 被认为是引发真菌感染的最重要的三大致病真菌[2-4]。目前高效和低毒的抗真菌药物是有限的,所以人们不断地对新型抗真菌药物进行探索研究,试图寻找具有高效性、专一性以及低毒性等特点的新型抗真菌药物。同时植物病原真菌在植物生长的不同时期侵染植物的根、叶柄、卷须、花穗和果实等器官,对植物的生长造成非常不利的影响。每年都有大量农作物因病原菌侵染而导致严重损伤、减产[5]。因此寻找能够有效抑制植物病原真菌活性的药物也非常重要。
1,3,4-噻二唑是一类含有两个N原子和一个S原子的五元杂环化合物,由于“氮碳硫”结构能作为活性中心螯合生物体中的某些金属离子,从而具有广谱的生物活性[6],如抗菌和抗真菌[7-9]、抗炎[10]、抗肿瘤[11]、抗病毒[12]等生物活性,一些含有1,3,4-噻二唑的化合物已开发成除草剂、杀菌剂、驱虫剂、植物生长调节剂等农药[13]。噻二唑类化合物因具有广泛的生物活性而倍受关注[14]。Matysiak等[7]合成了一系列5-取代的2-(2,4-二羟基苯基)-1,3,4-噻二唑衍生物 (图 1, 化合物1),并测定了其抗念珠菌活性,结果显示,当噻二唑C-2位取代基为甲基、苯基、4-乙氧基苯基和卤代苯基时,化合物显示出较高的抗真菌活性。Dogan等[15]的研究结果表明,含1,3,4-噻二唑环的化合物 (图 1,化合物2),不仅对金色葡萄球菌、大肠杆菌、绿脓杆菌有较好的抑制活性,同时它们对真菌白色念球菌也有很好的抑制活性。Tan等[16]报道1-(4-氯苯甲酰基)-3-[5-(4-吡啶基)-1,3,4-噻二唑-2-基]脲化合物 (图 1,化合物3),对棉花枯萎病菌、水稻纹枯病菌、黄瓜灰霉病菌、小麦赤霉病菌、苹果轮纹病菌均具有一定的抑制活性,尤其是对黄瓜灰霉病菌和苹果轮纹病菌的抑制效果较好,抑制率可达到80%以上,对水稻纹枯病菌的抑制率也接近80%。Che等[17]通过将吡啶、1,3,4-噻二唑和酰胺拼连到同一分子中,得到了2-氨基-5-(2-氯吡啶-4-基)-1,3,4-噻二唑衍生物,实验表明,该衍生物对葡萄白腐病菌有一定的抑制作用。
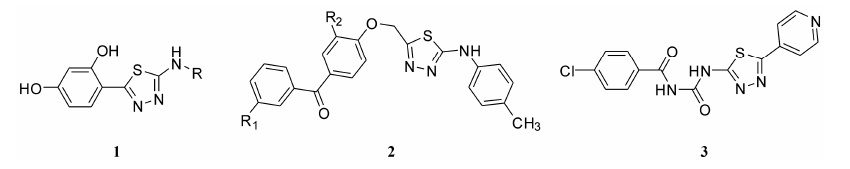
|
Figure 1 Some bioactive compounds containing 1,3,4-thiadiazole moiety |
硫色满酮是一类重要的含硫杂环化合物[18],具有抗炎、抗菌[19, 20]、抗癌[21]等多种生物活性。目前,人们对此类化合物的合成和生物活性已经做了大量研究,2003年,Yang等[22]合成了一系列硫色满酮季铵盐化合物,该类化合物水溶性较好,对浅部和深部真菌均表现出良好的抑制作用,尤其对白色念珠菌表现出较强的抑制活性 (MIC为6.25 μg·mL-1)。2004年,Qi等[23]合成了一系列3位Mannich碱化合物,其体外抗白色念珠菌活性与对照克霉唑相当。2007年,Das等[24]合成了一系列3-苄基-硫色满酮化合物,表现出了较好的体外抗白色念珠菌活性 (MIC为6 μg·mL-1)。2009年,Li等[25]合成了一系列2位烃硫基的硫色满酮衍生物,该类化合物具有较好的体外抗白色念珠菌活性,MIC可达2 μg·mL-1。Song等[26]设计在硫色满酮的2位引入吲哚环,体外抗真菌实验显示该类化合物对新生隐球菌和絮状表皮癣菌抑制的MIC值均达到4 μg·mL-1,并且这些化合物抑制浅部真菌的能力强于深部真菌; 当硫色满酮的苯环上具有吸电子基团如氟或氯时,抑制活性优于给电子基团的甲基。
鉴于1,3,4-噻二唑和硫色满酮杂环类化合物均具有良好生物活性,以此为基础,根据药物设计的生物活性基团拼接原理[27],本文以2-羧基-硫色满酮与2-氨基-1,3,4-噻二唑反应生成N-1,3,4-噻二唑-2-基硫色满-4-酮-2-甲酰胺衍生物,通过在硫色满酮的苯环上及1,3,4-噻二唑的2位引入电性不同的基团,采用微量稀释法评价其对活性的影响,得出初步构效关系,为新结构化合物的设计提供新思路。化合物的合成见合成路线1。
结果与讨论 1 化合物的合成及鉴定合成化合物的结构经1H NMR、13C NMR、HR-MS确证,理化数据见表 1、2。
| Table 1 Partial experimental results of compounds 3a-3n |
| Table 2 The spectral data of compounds 3a-3n |
以新生隐球菌 (Cryptococcus neoformans,C.n.)、白色念珠菌 (Canidia albicans,C.a.)、絮状表皮癣菌 (Epidermophyton floccosum,E.f.)、总状毛霉菌 (Mucor racemosus,M.r.) 和克柔念珠菌 (Candida krusei,C.k.) 为供试对象,对合成的目标化合物3a~3n的抑菌活性进行初步筛选,结果见表 3。从测试结果可以看出,目标化合物3a~3n对C.n.、C.a.和C.k.有较差的抗真菌活性,对E.f.和M.r.有较好的抗真菌活性。首先, 化合物3a和3c对E.f.的最小抑菌浓度均可达到8 μg·mL-1,优于阳性对照药物氟康唑; 化合物3g、3i、3k和3m对E.f.的抑菌活性仅次于3a和3c (MIC = 16 μg·mL-1)。其次,化合物3a、3c和3m对M.r.的抑制活性优于阳性对照药物氟康唑,最小抑菌浓度均为16 μg·mL-1; 3b、3e、3h、3j、3l和3n对M.r.的抑制活性与阳性对照药物氟康唑相当 (MIC = 32 μg·mL-1)。从初步构效关系分析发现,当硫色满酮的苯环上带有吸电子取代基时 (如氯),1,3,4-噻二唑的2位为供电子取代基时 (如甲基或乙基),化合物对E.f.和M.r. 表现出较好的抑制活性,这对进一步设计工作具有指导意义。
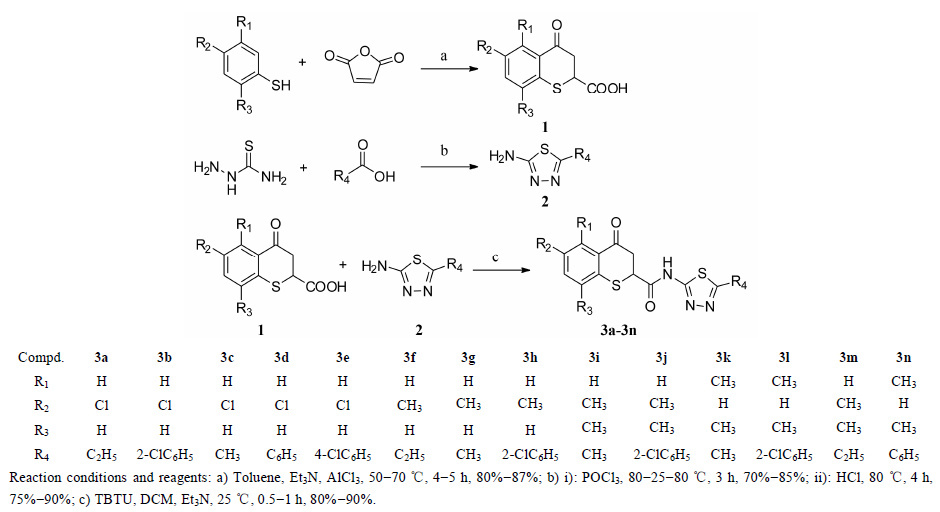
|
Scheme1 Synthesis of N-1,3,4-thiadiazol-2-yl-4-oxo-thiochroman-2-yl-formamide derivatives |
| Table 3 Minimum inhibitory concentrations (MIC/μg·mL-1) of target compounds 3a-3n. C.n.: Cryptococcus neoformans; C.a.: Canidia albicans; E.f.: Epidermophyton floccosum; M.r.: Mucor racemosus; C.k.: Candida krusei |
以玉米小斑病菌 (Helminthosporium maydis,H.m.)、油菜菌核病菌 (Sclerotinia sclerotiorum,S.s.)、花生冠腐病菌 (Aspergillusnigervan tiegh,A.t.)、番茄灰霉病菌 (Botrytis cinerea,B.c.)、尖孢镰刀病菌 (Fusarium oxysporum,F.o.)、苹果树腐烂病菌 (Valsa mali,V.m.)、辣椒炭疽病菌 (Colletotrichum gloeosporioides,C.g.)为供试对象,对合成的目标化合物3a~3n进行植物病原菌的抗真菌活性测试,结果见表 4。从测试结果可看出,化合物3b对H.m.的最小抑菌浓度达到16 μg·mL-1,优于阳性对照药物多菌灵; 化合物3h、3l对H.m.的抗菌活性和阳性对照药物多菌灵相当 (MIC = 32 μg·mL-1)。化合物3e对S.s.、H.m.和B.c.的抑制活性均优于阳性对照药物多菌灵。化合物3g、3h、3j对B.c.的抗菌活性和阳性对照药物多菌灵相当。此外,从构效关系看,当硫色满酮的苯环上取代基为氯时,1,3,4-噻二唑的2位为2-Cl苯基或4-Cl苯基时化合物对H.m.、S.s.和B.c.有良好的抑制活性。化合物3e对植物病原菌H.m.、S.s.和B.c.具有广谱的抗菌效果,所以可作为潜在的抗菌化合物开发利用。
| Table 4 Minimum inhibitory concentrations (MIC/μg·mL-1) of target compounds 3a-3n. H.m.: Helminthosporium maydis; S.s.: Sclerotinia sclerotiorum;A.t.: Aspergillusnigervan tiegh; B.c.: Botrytis cinerea; F.o.: Fusarium oxysporum; V.m.: Valsa mali; C.g.: Colletotrichum gloeosporioides |
本文以取代苯硫酚为原料,经3步反应,设计合成了14个未见文献报道的含1,3,4-噻二唑片段的硫色满酮衍生物。采用微量稀释法对目标化合物进行抗真菌活性的测试,首先化合物3a、3c对E.f.和M.r.的抗真菌活性效果明显,抑制活性优于阳性对照药物氟康唑。其次,化合物3e对H.m.、S.s.和B.c.的抑制活性均优于阳性对照药物多菌灵; 化合物3b对H.m.的抑制活性优于阳性对照药物多菌灵。因此,含1,3,4-噻二唑片段的硫色满酮衍生物对真菌的抑制作用具有进一步研究意义。
实验部分Bruker AVШ-600MHz型核磁共振波谱仪(Bruker公司),内标物TMS,溶剂为DMSO-d6; SGWX-4型显微熔点仪 (北京泰克公司); Bruker apex ultra 7.0 T傅里叶变换离子回旋质谱仪 (美国Bruker Daltonik); 旋转蒸发器 (RE 2000A) (上海亚荣仪器有限公司); 集热式恒温加热磁力搅拌器 (DF-101S) (巩义市予华科技有限公司)。所有试剂均为分析纯。
1 化合物合成 1.1 中间体1的合成 1.2 中间体2的合成方法一: 在100 mL烧瓶中加入10 mmol氨基硫脲、10 mmol芳基羧酸和15 mL三氯氧磷,80 ℃反应30 min后冷却至室温,在冰水浴条件下于30 min内缓缓滴加45 mL水,滴毕,80 ℃反应3 h后,经过TLC (石油醚/乙酸乙酯) 监测显示反应完全。反应液冷却至室温,倒入冰水中,搅拌下渐渐析出沉淀。冰水浴冷却下用1 mol·L-1氢氧化钠溶液调pH值到8~9,析出大量白色沉淀,抽滤得粗品,用混合溶剂 (DMF/H2O) 重结晶得中间体2,产率约为70%~85%。
方法二: 在100 mL烧瓶中加入10 mmol氨基硫脲和10 mmol烷基羧酸,搅拌下加入20 mL浓HCl,80 ℃反应4 h后,经过TLC (石油醚/乙酸乙酯) 监测显示反应完全。反应液冷却后倒入冰水中,搅拌出现沉淀。冰水浴冷却下用1 mol·L-1氢氧化钠溶液调pH值到8~9,析出大量白色沉淀,抽滤得粗品,用混合溶剂 (DMF/H2O) 重结晶得中间体2,产率约为75%~90%。
1.3 目标化合物3a~3n的合成在100 mL圆底烧瓶中,将10 mmol中间体1和10 mmol中间体2加入到溶有10 mmol TBTU和1 mL三乙胺的二氯甲烷溶剂中,反应0.5~1 h后有沉淀析出,经过TLC (石油醚/乙酸乙酯) 监测显示反应完全。抽滤得粗品,用混合溶剂 (乙酸乙酯/DMF) 重结晶得目标产物,产率约为80%~90%。
2 抗真菌活性测试 2.1 体外抗真菌活性本实验受试真菌均来自于中国医学科学院菌种保藏中心。阳性对照品氟康唑来自山东绿因药业有限公司,两性霉素B来自大连美仑生物技术有限公司。
本实验采用微量稀释法对5种受试真菌进行活性测试,14个目标化合物先用适量二甲基亚砜溶解,再用无菌蒸馏水稀释,然后加入到已灭过菌的1% 的葡萄糖蛋白胨琼脂培养基中,样品浓度分别为128、64、32、16、8、4、2 μg·mL-1。对照品氟康唑和两性霉素B的稀释方法同上。用血球计数法将受试菌的菌悬液浓度配成1×105 CFU·mL-1。之后接种供试菌 (每种菌同时作一空白对照),置恒温烘箱中培养2~7天。以无菌生长的最低浓度为最小抑菌浓度 (MIC值)。
2.2 植物病原菌的抗真菌活性本实验受试真菌目前保存于河北大学药物化学与分子诊断教育部重点实验室。阳性对照品多菌灵来自江苏泰仓农化有限公司。
本实验采用微量稀释法对7种受试植物病原真菌进行活性测试,将14个目标化合物分别用二甲基亚砜溶解,配置成样品储备液。采用倍比稀释法稀释样品,得到一系列浓度样品溶液分别是128、64、32、16、8、4、2 μg·mL-1。对照品多菌灵的稀释方法同上。用血球计数法将受试菌的菌悬液浓度配成1×106 CFU·mL-1。将100 μL样品溶液及100 μL菌悬液加到96孔板中 (每种菌同时作一空白对照),混匀后恒温28 ℃培养3~6天,以无菌生长的最低浓度为最小抑菌浓度 (MIC值)。
| [1] | Zhao C, Ma ST. Recent advances in the discovery of Nmyristoyltransferase inhibitors[J]. ChemMedChem, 2014, 9: 2425–2437. DOI:10.1002/cmdc.201402174 |
| [2] | Liu Y, Wang Y, Dong GQ, et al. Novel benzothiazole derivatives with a broad antifungal spectrum:design, synthesis and structure-activity relationships[J]. MedChemComm, 2013, 4: 1551–1561. DOI:10.1039/c3md00215b |
| [3] | Lai CC, Tan CK, Huang YT, et al. Current challenges in the management of invasive fungal infections[J]. J Infect Chemother, 2008, 14: 77–85. DOI:10.1007/s10156-007-0595-7 |
| [4] | Steenbergen JN, Casadevall A. Prevalence of Cryptococcus neoformans var. neoformans (Serotype D) and Cryptococcus neoformans var. grubii (Serotype A) isolates in New York City[J]. J Clin Microbiol, 2000, 38: 1974–1976. |
| [5] | Carvalho FP. Agriculture, pesticides, food security and food safety[J]. Environ Sci Policy, 2006, 9: 685–692. DOI:10.1016/j.envsci.2006.08.002 |
| [6] | Mou PP. Synthesis Structure Characterization and Biological Activity of Pyrazole Acylamides Containing 1,3,4-Thiadiazole (& Piperazine) (含1,3,4-噻二唑环(及哌嗪环)的吡唑甲酰胺类化合物的合成、结构表征及生物活性研究)[D]. Liaoning:Liaoning Normal University, 2009. |
| [7] | Matysiak J, Malinski Z. 2-(2,4-Dihydroxyphenyl)-1,3,4-thiadiazole analogues:antifungal activity in vitro against Candida species[J]. Russ J Bioorg Chem, 2007, 33: 594–601. DOI:10.1134/S1068162007060106 |
| [8] | Abdel-Wahab BF, Abdel-Aziz HA, Ahmed EM. Synthesis and antimicrobial evaluation of some 1,3-thiazole, 1,3,4-thiadiazole, 1,2,4-triazole, and 1,2,4-triazolo[3,4-b] [1,3,4] -thiadiazine derivatives including a 5-(benzofuran-2-yl)-1-phenylpyrazole moiety[J]. Monatsh Chem, 2008, 140: 601–605. |
| [9] | Verma S. Synthesis and antimicrobial activity of thiazolidine derivatives of thiazole[J]. Int J Pharm Res Dev, 2011, 2: 73–81. |
| [10] | Amir M, Kumar HS. Non-carboxylic analogues of naproxen:design, synthesis, and pharmacological evaluation of some 1,3,4-oxadiazole/thiadiazole and 1,2,4-triazole derivatives[J]. Arch Pharm, 2007, 340: 577–585. DOI:10.1002/(ISSN)1521-4184 |
| [11] | Rzeski W, Matysiak J, Kandefer-Szerszeń M. Anticancer, neuroprotective activities and computational studies of 2-amino-1,3,4-thiadiazole based compound[J]. Bioorg Med Chem, 2007, 15: 3201–3207. DOI:10.1016/j.bmc.2007.02.041 |
| [12] | Hamad NS, Al-Haidery NH, Al-Masoudi IA, et al. Amino acid derivatives, part 4:synthesis and anti-HIV activity of new naphthalene derivatives[J]. Arch Pharm, 2010, 343: 397–403. DOI:10.1002/ardp.v343:7 |
| [13] | Yin LH. Study on the Synthesis and Biological Activity of 1,3,4-Thiadiazole Derivatives (1,3,4-噻二唑类衍生物的合成及其生物活性研究)[D]. Nanjing:Nanjing University of Technology, 2008. |
| [14] | Ablajan K. Synthesis and biological activity of some novel hydrazones containing triazole and thiazole[J]. Chin J Org Chem (有机化学), 2011, 31: 724–727. |
| [15] | Dogan HN, Rollas S, Erdeniz H. ChemInform abstract:synthesis, structure elucidation, and antimicrobial activity of some 3-hydroxy-2-naphthoic acid hydrazide derivatives[J]. IL Farmaco, 1998, 53: 462–467. DOI:10.1016/S0014-827X(98)00049-4 |
| [16] | Tan XH, Sang QZ, Wang N, et al. Synthesis and fungicidal activity of 1-(4-chlorobenzoyl)-3-[5-(4-pyridyl)-1,3,4-thiadiazol-2-yl] urea[J]. J Hubei Inst Natl (Nat Sci Ed) (湖北民族学院学报,自然科学版), 2006, 24: 71–74. |
| [17] | Che C, Mao SF, Qin ZH. Synthesis and bioactivity of 2-amino-5[(2-chloropyrid)-4-yl]-1,3,4-thiadiazole derivatives[J]. Chin J Appl Chem (应用化学), 2002, 19: 795–797. |
| [18] | Zhou G, Liang GC, Zhong YF, et al. Ultrasound promoted synthesis of novel substituted spirooxindole compounds containing thiochroman moiety with antifungal activity[J]. Chin J Org Chem (有机化学), 2016, 36: 143–150. DOI:10.6023/cjoc201508007 |
| [19] | Li HY, Hu C. Survey on biological activities of 4-chromones and 4-chromanones[J]. Chin Pharm J (中国药学杂志), 2005, 40: 241–244. |
| [20] | Zheng W, Sun G, Sun BJ, et al. Study on synthesis and anti-inflammatory activity of chromanone derivatives[J]. Fine Chem Intermediates, 2009, 39: 30–33. |
| [21] | Bulzomi P, Bolli A, Galluzzo P, et al. Naringenin and 17beta-estradiol coadministration prevents hormone-induced human cancer cell growth[J]. Iubmb Life, 2010, 62: 51–60. |
| [22] | Yang GL, Zhou Y, Wang JM. Cycermanone quaternary antifungal compound:CN, 1394858A[P]. 2004-09-15. |
| [23] | Qi P, Jin YH, Guo C, et al. Synthesis and antifungal activities of the Mannich bases of thiochromanones[J]. Chin J Med Chem (中国药物化学杂志), 2003, 13: 134–137. |
| [24] | Das B, Chowdhury N, Damodar K, et al. A mild and efficient stereoselective synthesis of (Z)-and (E)-allyl sulfides and potent antifungal agent, (Z)-3-(4-methoxybenzylidene) thiochroman-4-one from Morita-Baylis-Hillman acetates[J]. Chem Pharm Bull, 2007, 55: 1274–1276. DOI:10.1248/cpb.55.1274 |
| [25] | Li Y, Xiao T, Liu DL, et al. Methyl 7-chloro-2-ethylsulfanyl-6-fluoro-4-oxo-4H-thiochromene-3-carboxylate[J]. Acta Crystallogr E, 2010, 66: 694. DOI:10.1107/S0108767310034471 |
| [26] | Song YL, Wu F, Zhang CC, et al. Ionic liquid catalyzed synthesis of 2-(indole-3-yl)-thiochroman-4-ones and their novel antifungal activities[J]. Bioorg Med Chem Lett, 2015, 25: 259–261. DOI:10.1016/j.bmcl.2014.11.056 |
| [27] | Cui XH, Tan J, Zhou M, et al. Design, virtual screening, synthesis and anti-hepatitis B virus of oxime derivaties[J]. Acta Pharm Sin (药学学报), 2016, 51: 1578–1583. |
| [28] | Okubo T, Yoshikawa R, Chaki S, et al. Design, synthesis, and structure-activity relationships of novel tetracyclic compounds as peripheral benzodiazepine receptor ligands[J]. Bioorg Med Chem, 2004, 12: 3569–3580. DOI:10.1016/j.bmc.2004.04.025 |
| [29] | Liang GC, Zhou G, Zhong YF, et al. Synthesis and antifungal activities of novel thiochromanone derivatives containing 1,3,4-thiadiazole[J]. Chin J Syn Chem (合成化学), 2015, 23: 1100–1105. |
 2017, Vol. 52
2017, Vol. 52



