2. 山西医科大学第一医院, 山西 太原 030001;
3. 山西大学体育学院, 山西 太原 030006
2. First Hospital of Shanxi Medical University, Taiyuan 030001, China;
3. Department of Physical Education, Shanxi University, Taiyuan 030006, China
百合地黄汤源自《金匮要略·百合狐惑阴阳毒病脉证治第三》,由百合和生地黄组成,为临床常用方剂。百合地黄汤及其加味用于治疗抑郁[1]、焦虑[2]、失眠[3]、甲状腺亢进[4]和更年期内分泌失调[5]等,动物实验也表明百合地黄汤具有较好的抗抑郁[6]、抗肿瘤[7]等作用。心理亚健康作为亚健康的一种分型,是处于心理健康和心理疾病之间的一个中间状态,其临床症状主要为精神不振、疲乏无力、反应迟钝、失眠多梦、抑郁寡欢、焦躁不安、急躁易怒、恐惧胆怯、记忆力下降、注意力不集中等。上述症状持续发作3个月以上,并且经系统检查排除可能导致上述表现的疾病者,目前可被判断为处于心理亚健康状态[8]。心理亚健康的核心症状为抑郁、焦虑、失眠[9]。因此,课题组前期使用百合地黄汤对心理亚健康人群进行干预,结果显示百合地黄汤能够显著地改善抑郁寡欢、精神不振、疲乏无力、焦躁不安、失眠多梦等症状,表明百合地黄汤对心理亚健康有较好的干预效果[10]。然而,由于中药复方化学成分的复杂性和功能主治的多样性,使得百合地黄汤干预心理亚健康的作用机制并不明确,因此借助网络药理学的方法挖掘百合地黄汤主要活性成分的作用靶点与其信号通路及疾病间的关联性,对于从系统生物学角度整体阐释百合地黄汤干预心理亚健康的作用机制具有重要意义。
网络药理学 (network pharmacology) 是以系统生物学和多向药理学为理论基础的药物设计新方法和新策略[11],通过构建药物-靶点-疾病之间的复杂网络来探讨药物的作用机制,具体包括活性分子筛选、靶点预测以及网络分析三部分。中药多为口服制剂,需通过吸收、分布、代谢、排泄 (ADME) 过程到达靶标器官、组织发挥作用。中药系统药理学技术平台 (TCMSP)[12]包含499味草药及其化学成分 (共计29 000余个),并提供了每个化合物的ADME性质数据,如血脑屏障 (BBB)、口服生物利用度 (OB)、Caco-2细胞渗透性 (Caco-2) 等,同时提供了潜在活性分子的靶点 (包括Drugbank数据库中6 511个药物分子和3 987个与已知化合物相互作用的蛋白质) 及其疾病信息,为从系统水平上研究中药作用机制提供了良好的平台。反向药效团匹配[13] (PharmMapper) 是一种基于配体特征靶点预测的方法,其中含有 7 000多个药效团模型并关联1 627个药物靶点信息,可自动寻找与查询分子构象最为匹配的药效团并进行打分。Ding等[14]通过挖掘TCMSP数据库,采用网络分析方法从化学成分、靶点、疾病三个层面对补阳还五汤防治气虚血瘀型疾病的作用机制进行研究。Gao等[15]采用网络药理学和反向药效团匹配方法发现逍遥散抗抑郁活性成分涉及25个作用靶点以及信号转导-内分泌-能量代谢等相关生物过程和代谢通路。以上研究表明,采用TCMSP数据库挖掘中药化学成分及靶点,并与PharmMapper靶点预测结果相结合的方法研究百合地黄汤干预心理亚健康的作用机制是可行的。
本文借助于网络药理学的方法,以百合地黄汤中活性成分为研究对象,通过构建活性成分-靶点-疾病的网络来探讨百合地黄汤干预心理亚健康的作用机制。
材料与方法活性成分的筛选 通过中药系统药理学技术平台 (TCMSP) (http://lsp.nwsuaf.edu.cn/index.php) 和文献检索收集百合地黄汤中两味药物百合、生地黄的化合物,通过ADME/T计算得出每一化合物的ADME性质,并对其口服生物利用度和类药性进行评估,确定活性成分。
靶点的预测及验证 挖掘TCMSP数据库中百合、生地黄中活性成分的潜在靶点,并登陆PharmMapper服务器 (http://59.78.96.61/pharmmapper/,Update in 2012-12-25) ,上传百合和生地黄主要活性成分mol2格式文件,得到虚拟筛选结果,将两部分数据进行整合。同时使用蛋白质数据库 (UniProt) 中UniProtKB搜索功能 (http://www.uniprot.org/,Update in 2014-04-10) ,通过输入靶点名称并限定物种为人,将检索得到的所有靶点校正为其官方名称 (official symbol),经上述数据库检索和转化操作,获取与活性成分相关的靶点信息。采用Jain等[16]提出的Sybyl软件中Surflex-dock模块对有三维结构的靶点进行分子对接分析验证,对接过程不考虑小分子和大分子的电荷,是基于结构相似性和形状相似性来进行匹配的,具有准确度高、真阳性率高、速度快的特点。
网络的构建及分析 根据上述预测结果,使用Cytoscape软件中的关联功能 (Merge) 将筛选出的活性成分、潜在靶点以及与靶点对应的疾病信息构建一个药物-靶点-疾病网络。在生成的网络中,节点代表化合物、蛋白质或疾病,边代表化合物-靶点以及靶点-疾病相互作用。通过ClueGO[17]插件中的分子功能 (molecular function) 分析和生物过程 (biological process) 分析对靶点的基因功能以及涉及的代谢通路进行分析。其中种属为人属,选择本体参考集 (ontologies reference set) ,Kappa评分(Kappa score) 设为0.4,其余采用默认参数。
结果 1 百合地黄汤的活性成分筛选通过TCMSP数据库以及文献检索[18, 19]中整理出百合地黄汤中的174个化合物,其中来自百合84个、生地黄90个。根据其ADME性质进行筛选。口服生物利用度和类药性是药物筛选、评价化合物成药性的重要的动力学参数,因此,根据OB≥30%、DL≥0.18对百合地黄汤中174个化合物进行筛选,找出满足条件的8个化合物。另外,生地黄中的梓醇、地黄苷A、毛蕊花糖苷以及水苏糖虽然有相对较低的OB值,但文献[20, 21]报道这4种化合物为生地黄中的活性成分且含量较高,因此共筛选出11个活性成分,如表 1所示。
| Table 1 Active compounds in Baihe Dihuang Tang with corresponding pharmacokinetics parameters. OB: Oral bioavail ability; DL: Drug-likeness; Compound 10: 26-O-β-D-Glu copyranosyl-3β,26-dihydroxy-choleslen-16,22-dioxo-3-O-α-L- rhamnopyranosyl-(1→2) -β- D-glucopyranoside_qt; Compound 11: 26-O-β-D-Glucopyranosyl-3β,26-dihydroxy-5-choleslen-16,22- dioxo-3-O-α-L-rhamnopyranosyl-(1→2) -β-D-glucopyranoside_qt |
在TCMSP数据库中整理出11种活性成分的潜在靶点共65个,将获得的靶点与PharmMapper返回的300个潜在作用靶点进行对比分析,归纳总结筛选出110个潜在靶点,根据医学主题词表 (MeSH) 的疾病分类,进一步筛选出与抑郁、焦虑、失眠相关的21个潜在作用靶点 (基因和蛋白),见表 2。
| Table 2 Information of potential targets from active ingredients of Baihe Dihuang Tang |
在PDB数据库中找出12个蛋白结构,采用Sybyl中的Surflex-dock模块对11个活性成分及12个靶点按默认参数进行分子对接,得出对接打分Score值。结合自由能越小,配体与受体结合越稳定,故Score值越大,配体与受体结合越稳定。一般Score 值在4.0以上认为是有一定的结合活性,大于5.0的说明分子与靶点有较好的结合活性,total score大于7.0则说明分子与靶点的结合构型具有高活性[22, 23],结果如表 3所示。
| Table 3 The docking scores of 11 active ingredients and its targets in Baihe Dihuang Tang |
从表 3中可以看出,在33个分子-靶标对接中,有高结合活性即打分在7.0之上有11个,有较好的结合活性即打分介于5.0~7.0之间有14个,打分介于4.0~5.0分之间以及打分低于4.0分的各有4个,其中低于4.0分的除易海松酸和ACHE的对接得分3.233 6较低外,多数接近4.0分。因此,百合地黄汤活性成分及其作用靶点的分子对接打分表明,活性成分及其靶标有着较好的相互作用,为后续的网络分析奠定基础。
3 网络构建及分析使用Cytoscape软件构建百合地黄汤活性成分-作用靶点-疾病的网络模型,如图 1所示。从图中可以看出,11个活性成分的21个潜在靶点对比到20个疾病上,β-谷甾醇、豆甾醇、地黄苷A、梓醇的作用靶点较多; 毛蕊花糖苷、水苏糖、去甲秋水仙碱等关联的作用靶点则较少,且不同的活性成分可作用于相同的靶点,也可作用于不同的靶点,每一个靶点至少与一种疾病相关,充分体现了百合地黄汤多成分、多靶点的作用机制。
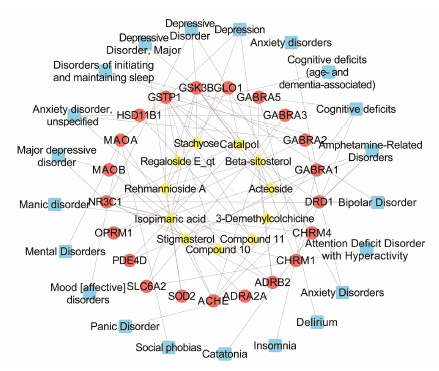
|
Figure 1 Components-targets network of major active ingre dients of Baihe Dihuang Tang main active ingredients (◆),targets (●),and diseases (■) |
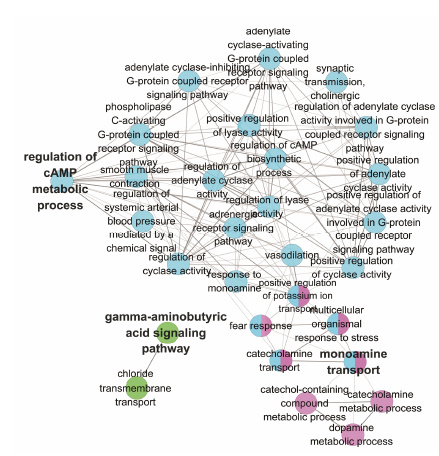
使用ClueGO插件对百合地黄汤靶标功能和代谢通路进行分析,如图 2和图 3所示。从图 2可以看出,百合地黄汤作用靶标的基因功能主要集中在G-蛋白偶联受体活性、铵离子结合活性、神经递质受体活性和苯二氮䓬类受体活性。GOBP分析(图 3) 展示了这些靶点参与调控γ-氨基丁酸信号通路、cAMP代谢调控过程以及单胺转运过程。

|
Figure 2 Functional grouped network for the targets of Baihe Dihuang Tang |
|
Figure 3 Pathway grouped network for the targets of Baihe Dihuang Tang |
由于心理亚健康是处于健康和疾病之间的一种中间状态,尚未收录于MeSH词表的疾病分类,而百合地黄汤对于抑郁、焦虑、失眠等症状有显著改善, 因此本实验通过分析百合地黄汤中与抑郁、焦虑、失眠相关的活性成分和靶点,从百合地黄汤干预心理亚健康的主要临床症状出发探讨其作用机制。百合具有镇静及抗应激损伤作用、免疫调节作用、抗氧化作用等[24]。其中抗抑郁、抗炎活性成分主要为甾体皂苷类[25],这与ADME筛选的结果一致。生地黄养阴生津,对中枢神经系统、免疫系统等有显著作用。其中环烯醚萜类成分发挥主要的抗抑郁作用[26],因此将梓醇、地黄苷A作为活性成分进行靶点预测。
由ClueGO靶点功能分析 (图 2) 结果可知,21个靶点主要与以下4类受体活性有关,分别是G-蛋白偶联受体活性、苯二氮䓬类受体活性、铵离子结合活性和神经递质受体活性。G-蛋白偶联受体可以调控神经再生[27],参与调节多种细胞功能。GABA作为脑内最重要的抑制性神经递质,分布于与情感和精神活动密切相关的大脑皮质各层与小脑皮质、纹状体等区域。而苯二氮䓬类受体活性与G-蛋白偶联受体家族成员相关联。有研究发现,情感障碍病人大脑皮质中GABA缺乏[28],未经治疗的抑郁病人皮质GABA水平明显低于健康组。Jiang等[29]发现内因性失眠症患者中枢重要的抑制性神经递质GABA显著降低,谷氨酸明显升高。因此,根据靶标功能分析推测百合地黄汤可能主要通过调控G-蛋白偶联受体活性对心理亚健康进行干预。除GABA外,单胺类神经递质 (5-HT、DA、NE) 也与抑郁、焦虑等情绪有关[30, 31]。Zhang等[32]发现百合地黄汤活性部位主要是通过调节脑内单胺类神经递质的表达来发挥抗抑郁作用。Zhang等[33]对创伤后应激障碍大鼠的海马进行研究,发现百合地黄汤能够显著上调大鼠海马中的5-HT水平,从而发挥干预作用。Imeri[34]、Asikainen[35]等发现5-HT能神经元对睡眠-觉醒周期具有双重调整作用。这说明百合地黄汤是通过调控单胺类神经递质活性改善抑郁、焦虑、失眠等心理亚健康症状。
靶点代谢通路分析 (图 3) 显示百合地黄汤活性成分相关的作用靶点主要参与了GABA信号转导、cAMP代谢调控以及单胺转运三个过程。cAMP通路是导致抑郁症的信号通路之一,在情绪调节中起重要作用。G-蛋白偶联受体与多种神经递质或神经肽结合,通过上调cAMP的表达水平激活蛋白激酶A,从而介导细胞对外界刺激的反应[36]。这表明百合地黄汤活性成分相关靶点是通过调控G-蛋白偶联受体活性进而影响GABA信号转导以及cAMP代谢调控过程。Guyton等[37]发现,百合与熟地黄配伍能够显著提高惊厥小鼠脑内的GABA和谷氨酸含量,达到延长睡眠时间、改善睡眠的作用。Dwivedi[38]、You[39]等的研究也表明抑郁症和失眠症的发病与cAMP信号通路表达有关。
除上述两条与G-蛋白偶联受体相关的代谢通路外,还有一条与单胺类神经递质受体活性有关的代谢通路,即单胺转运过程。单胺转运过程是通过单胺转运蛋白将释放到突触间隙的神经递质分别转运入突触前神经细胞,单胺神经递质突触传递功能异常会导致抑郁症、焦虑症等多种精神疾病[40]。以往研究表明[32, 33],百合地黄汤可以上调抑郁大鼠或应激障碍大鼠海马中的5-HT等神经递质的表达,这表明百合地黄汤可能改善异常的单胺转运过程。但是单胺神经递质突触传递功能的改善是由于提高了转运蛋白的亲和力还是抑制了神经递质的重吸收,目前尚不明确。
综上所述,百合地黄汤主要活性成分梓醇、地黄苷A、甾体皂苷以及甾醇等成分主要通过其潜在靶点GSK3B、NR3C1、GSTP1、MAOB等参与调控G-蛋白偶联受体活性和单胺类神经递质的表达活性进而影响GABA信号转导、cAMP代谢调控过程以及单胺转运过程,发挥对抑郁、焦虑以及失眠的改善作用,进而达到干预心理亚健康的效果。
本文通过构建百合地黄汤多成分-靶点-疾病网络,并对靶点基因功能和代谢通路进行分析,借助网络药理学的思路解释百合地黄汤干预心理亚健康的作用机制。文中预测的靶点与已知文献报道的药理作用相吻合,说明靶点预测的准确性,同时揭示了百合地黄汤多成分、多靶点、整合调节作用的特点。课题组前期初步建立了心理亚健康大鼠模型[41],同时发现百合地黄汤对心理亚健康模型大鼠的行为学指标有改善作用,但尚未进行作用机制研究。此外,课题组采用核磁共振代谢组学的方法对百合地黄汤干预后的心理亚健康人群血浆样本进行代谢轮廓分析,探讨百合地黄汤的干预作用效果及机制,该实验已经完成,结果正在整理中,该研究结果将与本研究结果进行比较,相互佐证。
| [1] | Yu JY, Tian JZ. Analysis the characteristics of depression on ancient TCM literature[J]. Tianjin J Tradit Chin Med (天津中医药), 2011, 28: 343–345. |
| [2] | Huang F. The Study on Rules of Applying Classical Prescriptions to Mental Sickness (经方治疗神志病证治规律研究)[D]. Wuhan:Hubei University of Chinese Medicine, 2010. |
| [3] | Huang ZQ. Research in Diagnosis and Treating Insomnia Theory of Zhong Jing and its Clinical Application (仲景辨治失眠理论及其临床应用研究)[D]. Nanjing:Nanjing University of Chinese Medicine, 2014. |
| [4] | Huang RB. A Study of Chinese Medical Treatment on Hyperthyroidism and Investigation on the Clinical Diagnosis of Professor Li Saimei (甲状腺机能亢进症中医辨治述略与李赛美临床经验探讨)[D]. Guangzhou:Guangzhou University of Chinese Medicine, 2013. |
| [5] | Zhou X, Li J, Wang ZQ, et al. Effect of estrogen combined with Baihedihuang Decoction on the reproductive endocrine and immune function of females with menopause syndrome[J]. Prog Mod Biomed (现代生物医学进展), 2015, 15: 4908–4911. |
| [6] | Guan JQ, Sun Y, Chen HW. Anti-depressive effect of Baihe Dihuang Decoction in mice model[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2013, 28: 1875–1877. |
| [7] | Huang JB, Zheng XW, Bao SZ. Anti-tumor metastasis action mechanism study of Baihe Dihuang Decoction with additives on mice with Lewis lung cancer[J]. Mod J Integr Tradit Chin Western Med (现代中西医结合杂志), 2006, 15: 3187–3189. |
| [8] | China Association of Chinese Medicine. Clinical Guidelines of Chinese Medicine on Sub health(亚健康中医临床指南)[S]. Beijing:China Press of Traditional Chinese Medicine, 2006. |
| [9] | Zhou W, Xu RY, Li Y, et al. Characteristics of mental sub-health state population[J]. Guangdong Med J (广东医学), 2011, 32: 1326–1329. |
| [10] | Wang X. The Treatment of Yin-Deficiency Type Of Psychological Health Groups with Baihe Dihumg Decoction (百合地黄汤对阴虚型心理亚健康人群的临床干预研究)[D]. Taiyuan:The First Clinical Hospital of Shanxi Medical University, 2014. |
| [11] | Xue XC, Hu JH. Research methods and applications in network pharmacology[J]. J Pharm Pract (药学实践杂志), 2015, 33: 401–405. |
| [12] | Zhang WJ, Wang YH. The theory and methods of systems pharmacology and its application in traditional Chinese medicine[J]. World Chin Med (世界中医药), 2015, 10: 280–286. |
| [13] | Liu XF, Ou YS, Yu B, et al. PharmMapper server:a web server for potential drug target identification using pharmacophore mapping approach[J]. Nucleic Acids Res, 2010, 38: W609–W614. DOI:10.1093/nar/gkq300 |
| [14] | Ding F, Zhang QR, Hu YJ, et al. Mechanism study on preventive and curative effects of Buyang Huanwu decoction in Qi deficiency and blood stasis diseases based on network analysis[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 4418–4425. |
| [15] | Gao Y, Gao L, Gao XX, et al. An exploration in the action targets for antidepressant bioactive components of Xiaoyaosan based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2015, 50: 1589–1595. |
| [16] | Jain AN. Surflex-Dock 2.1:robust performance from ligand energetic modeling, ring flexibility, and knowledge-based search[J]. J Comput Aided Mol Des, 2007, 21: 281–306. DOI:10.1007/s10822-007-9114-2 |
| [17] | Bindea G, et al. ClueGO:a cytoscape plug-in to decipher functionally grouped gene ontology and pathway annotation networks[J]. Bioinformatics, 2009, 25: 1091–1093. DOI:10.1093/bioinformatics/btp101 |
| [18] | Li M. Studies on Chemical Constituents of Rehmannia glutinosa (生地黄化学成分研究)[D]. Henan:Henan University of Traditional Chinese Medicine, 2014. |
| [19] | Li XN, Zhou MY, Shen PQ, et al. Chemical constituents from Rehmannia glutinosa[J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 3125–3129. |
| [20] | Li HW, Meng XL. Research progress on chemical constituents and pharmacological activities of Rehmannia glutinosa[J]. Drug Eval Res (药物评价研究), 2015, 38: 218–228. |
| [21] | Liu YF. The Study of Bioactivity Chemical Constituent in Rehmannia glutinosa (地黄活性物质与功能研究)[D]. Beijing:Chinese Acdemy of Medical Sciences & Union Medical College, 2013. |
| [22] | Wang FF, Pan JX, OuYang B. Molecular-dock based study on anti-inflammatory mechanism of Plantago asiatica L.[J]. Acta Chin Med Pharmacol (中医药学报), 2012, 40: 78–81. |
| [23] | Lin GY, Yao HC, Zheng XN, et al. Virtual screening for effective components in commonly used anti-diabetic traditional Chinese medicines based on molecular docking technology[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2015, 21: 202–206. |
| [24] | Li Y, Miao MS. Analysis of chemical, pharmacological and clinical application of lily[J]. China J Chin Med (中医学报), 2015, 30: 1021–1023. |
| [25] | Fu CY, Liu YH, Zeng L, et al. Research progress of antidepressant efficacy of lily[J]. Guid J Tradit Chin Med Pharm (中医药导报), 2015, 21: 83–86. |
| [26] | Wang JM, Feng WS, Cui Y, et al. Antidepressant-like effect of extracts from dried root of Rehmannia glutinosa (dihuang)[J]. Chin Pharm J (中国药学杂志), 2014, 49: 2073–2076. |
| [27] | Mei ZL, Hong H. G-Protein-coupled receptors in adult neurogenesis[J]. J North Pharm (北方药学), 2015, 12: 118–119. |
| [28] | Sanacora G, Mason GF, Rothman DL, et al. Reduced cortical γ-aminobutyric acid levels in depressed patients determined by proton magnetic resonance spectroscopy[J]. Arch Gen Psychiatry, 1999, 56: 1043–1047. DOI:10.1001/archpsyc.56.11.1043 |
| [29] | Jiang XJ, Xu ZQ, Liu J. The GABA changes of encephalofluetuograph in intrinsic insomniacs[J]. Chin J Clin Neurosci (中国临床神经学), 2005, 13: 236–238. |
| [30] | Coppen A, Shaw DM, Malleson A. Changes in 5-hydroxytryptophan metabolism in depression[J]. Br J Psychiatry, 1965, 111: 105–107. DOI:10.1192/bjp.111.470.105 |
| [31] | Bystritsky A, Kerwin L, Feusner J D, et al. A pilot controlled trial of bupropion XL versus escitalopram in generalized anxiety disorder[J]. Psychopharmacol Bull, 2008, 41: 46–51. |
| [32] | Zhang P, Zhao ZR, Wu YG, et al. Effects of active fraction of Bahe Dihuang Decoction on ethology and monoamine neurotransmitters in brain of depressive disorder rats[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2013, 31: 1759–1761. |
| [33] | Zhang YH, Hu LL. Effect of Baihe Dihuang Decoction on 5-HT in hippocampus of rats with post-traumatic stress disorder[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2013, 31: 2672–2673. |
| [34] | Imeri L, Clavenna A, Mancia M, et al. Changes in the serotonergic system during the sleep-wake cycle:simultaneous polygraphic and votammetric recordings in hypothalamus using a telemetry system[J]. Neuroscience, 1994, 58: 353–358. DOI:10.1016/0306-4522(94)90042-6 |
| [35] | Asikainen M, Toppila J, Alanko L, et al. Sleep deprivation increases brain serotonin turn over in the rat[J]. Neuroreport, 1997, 8: 1577–1582. DOI:10.1097/00001756-199705060-00006 |
| [36] | Anderson LE, Seybold VS. Calcitonin gene-related peptide regulates gene transcription in primary afferent neurons[J]. J Neurochem, 2004, 91: 1417. DOI:10.1111/j.1471-4159.2004.02833.x |
| [37] | Guyton AC, Hall JE. Textbook of Medical Physiology[M]. 11th Ed. America: Elsevier Saunders, 2006: 61-69. |
| [38] | Dwivedi Y, Mondal AC, Rizavi HS, et al. Differential and brain region-specific regulation of Rap-1 and Epac in depressed suicide victims[J]. Arch Gen Psychiatry, 2006, 63: 639. DOI:10.1001/archpsyc.63.6.639 |
| [39] | You QY, Wang P, Zhang SB, et al. Effects of Suanzaoren decoction on cAMP-PKA-CREB signaling pathway in hypothalamic paraventricular nuclear (PVN) mediated by GABAB1R in aged rat with REM sleep deprivation[J]. World J Sleep Med (世界睡眠医学杂志), 2014, 1: 129–134. |
| [40] | Lin ZC, Canales JJ, Thröstur Björgvinsson T, et al. Monoamine transporters:vulnerable and vital doorkeepers[J]. Prog Mol Biol Transl Sci, 2011, 98: 1–46. DOI:10.1016/B978-0-12-385506-0.00001-6 |
| [41] | Zhang X, Wu YF, Gao Y, et al. Establishment and evaluation of rat model with psychological sub-health[J]. Tradit Herb Drugs (中草药), 2016, 47: 610–616. |
 2017, Vol. 52
2017, Vol. 52


