中药前胡又称鸡脚前胡, 为伞形科植物白花前胡 (Peucedanum praeruptorum DUNN) 的干燥根, 具有宣散风热、降气化痰等功效, 临床多用于外感风热、肺热痰郁、胸膈满闷等症[1]。其主要活性成分包括白花前胡甲素 (praeruptorin A, PA)、白花前胡乙素 (praeruptorin B, PB)、白花前胡丙素 (praeruptorin C, PC)、白花前胡丁素 (praeruptorin D, PD)、白花前胡E素 (praeruptorin E, PE) 和8-甲氧基补骨脂素 (8-methoxypsoralen, 8-MOP) 等化合物[2]。
白花前胡丙素是一种角型二氢吡喃香豆素类化合物, 与白花前胡甲素组成一对外消旋体[3], 通过其钙离子拮抗作用机制, 表现出显著的降低血压和舒张冠状动脉血管的药理作用[4]。在肺损伤小鼠实验模型中, 白花前胡丁素及E素能显著抑制活性中性粒细胞的浸润, 并减少支气管肺泡灌洗液中肿瘤坏死因子-α (TNF-α) 和白细胞介素-6 (IL-6) 的水平, 从而表现出其应用在肺损伤治疗中的可能性[5]。
羧酸酯酶 (carboxylesterase, CES) 是一种重要的Ⅰ相代谢酶, 与多种药物、前体药物、环境毒物及内源性物质的解毒和代谢有关, 能有效催化羧酸酯类、氨甲酸酯类、酰胺类和硫酯类等物质的水解[6]。羧酸酯酶主要包括羧酸酯酶1 (carboxylesterase 1, CES1) 和羧酸酯酶2 (carboxylesterase 2, CES2) , 在组织分布及底物特异性方面存在着较大的差异。CES1主要在肝脏、单核巨噬细胞和肺上皮细胞表达, 在肠道表达极低, 偏向于水解含有较小乙醇基和较大乙酰基的底物, 如胆固醇、脂肪酸、可卡因和氯吡格雷等; CES2主要在肠道表达, 但在肝脏也有表达, 偏向于水解含有较大乙醇基和较小乙酰基的底物, 如阿司匹林、普鲁卡因和伊立替康等[7]。因此, 对羧酸酯酶的抑制作用将影响多种内源性物质以及药物在体内的代谢过程, 从而引起内源性代谢障碍以及药物-药物相互作用。
羧酸酯酶参与白花前胡素在体内的代谢过程, 白花前胡素经Ⅰ相代谢由羧酸酯酶水解生成代谢产物[8]。本课题组前期的研究表明, 白花前胡素对人体重要的Ⅱ相代谢酶尿苷二磷酸葡萄糖醛酸转移酶 (UDP-glucuronyltransferase, UGT) 有一定的抑制作用[9], 但对Ⅰ相代谢酶的抑制作用尚不清楚。因此, 本研究的目的是考察白花前胡丙素、丁素及E素对羧酸酯酶的抑制作用, 通过人肝微粒体 (human liver microsomes, HLM) 孵育特异性底物2-(2-苯甲酰基-3-甲氧基苯基) 苯并噻唑[2-(2-benzoyl-3-methoxy-phenyl) benzothiazole, BMBT]以及荧光素二乙酸酯 (fluorescein diacetate, FD) 水解反应, 并与羧酸酯酶经典阳性抑制剂新补骨脂异黄酮 (neobavaisoflavone, NB) 比较[10, 11], 体外检测白花前胡丙素、丁素及E素对羧酸酯酶1和2的代谢活性的抑制潜能, 以评估白花前胡丙素、丁素及E素通过抑制羧酸酯酶而引发内源性代谢疾病以及药物-药物相互作用的可能性。
材料与方法实验材料 二甲基亚砜DMSO、Tris-HCl、乙腈 (美国Sigma-Aldrich公司); 底物BMBT、FD (中国科学院大连化学物理研究所); 人肝微粒体HLM (美国BD公司); 白花前胡丙素、丁素、E素, 新补骨脂异黄酮 (中国成都普菲德公司); 高效液相色谱HPLC (美国Agilent公司); 恒温混匀仪 (中国杭州奥盛公司); ACCULAB型电子天平 (中国北京赛多利斯公司)。
高效液相色谱仪检测条件 高效液相系统: 含有一个SCL-10A系统控制器、两个LC-10AT泵、一个SIL-10A自动进样器、一个SPD-10AVP UV检测器。色谱分离条件: 色谱柱C18柱(4.6 mm × 250 mm)。流动相为含有0.5%甲酸的水溶液 (A) 和乙腈 (B)。洗脱方式: 0~12 min, 15% A, 85% B (羧酸酯酶1) ; 0~10 min, 30% A, 70% B (羧酸酯酶2) 。流速: 1 mL·min-1, UV检测器波长: 300 nm (羧酸酯酶1) ; 280 nm (羧酸酯酶2) 。水是超纯水。曲线计算: 由产物峰面积生成, 产物浓度0.1~100 mmol·L-1内曲线呈线性并且R2 > 0.99。每个浓度的准确度和精度达95% 以上。
体外孵育体系的组成和孵育后处理 评估白花前胡丙素、丁素及E素对羧酸酯酶抑制潜力的孵化系统 (总体积200 μL) 包含人肝微粒体, 50 mmol·L-1的Tris-HCl (pH 7.4) , 底物BMBT (羧酸酯酶1) , 底物FD (羧酸酯酶2) 以及不同浓度的白花前胡丙素、丁素、E素及新补骨脂异黄酮。为确保反应速率在线性范围内, 所使用的孵育时间和人肝微粒体浓度是事先确定的, 见表 1。37 ℃预温育5 min后在混合物中加入人肝微粒体10 μL启动反应。反应特定时间后, 通过加入乙腈200 μL来终止反应。然后将混合物在12 000 r·min-1条件下离心10 min, 取上清液200 μL注射入自动进样瓶, 进行UPLC分析。
| Table 1 Different concentration of HLM, substrate and time in the incubation system. CES: Carboxylesterase; HLM: Human liver microsomes |
初步筛选白花前胡丙素、丁素及E素对羧酸酯酶的抑制作用 白花前胡丙素、丁素、E素及新补骨脂异黄酮分别用DMSO稀释至浓度为100 mol·L-1, 各取1 μL在设定好的孵育条件下分别与羧酸酯酶1以及羧酸酯酶2进行反应, 并观察其抑制情况。设不加抑制剂作为空白对照, 且每个样品各做两组平行实验。实验数据取测量值的均值。
半数抑制浓度 (IC50) 实验 通过初筛实验, 筛选出抑制率大于80%的实验组。用DMSO将抑制剂稀释至不同浓度 (0.5、1、5、10、20、40、60、80和100 mol·L-1), 进一步求出IC50。
抑制动力学参数检测和类型的判断 通过IC50实验, 确定抑制剂浓度梯度进行抑制动力学行为 (包括动力学类型和参数) 的测定。采用不同浓度的白花前胡素 (浓度跨越的IC50) 和羧酸酯酶底物。利用Lineweaver-Burk作图法求出白花前胡素对筛选出的羧酸酯酶的抑制类型, 抑制动力学参数 (Ki) 是通过抑制剂浓度与Lineweaver-Burk图的相关斜率计算而得。
白花前胡素对羧酸酯酶抑制率的计算 通过HPLC-UV检测到的底物的代谢产物峰面积确定产物的含量, 再按抑制率 = (1-E抑制剂 / E对照) × 100% 计算白花前胡素对羧酸酯酶抑制率, E抑制剂是加入抑制剂后的产物含量, E对照是不加抑制剂的产物含量。
抑制动力学评价和体外-体内外推 在体外-体内外推使用方程: AUCi / AUC = 1+ c抑制剂in vivoKi, 式中AUCi是白花前胡素存在的条件下人体内药物的血药浓度曲线下面积; AUC是白花前胡素不存在的条件下人体内药物的血药浓度曲线下面积; c抑制剂in vivo是人体内抑制剂的血药浓度。通过这个公式可以计算出AUC的变化, 判断产生药物相互作用的可能性: c抑制剂in vivo/Ki < 0.1, 无可能性; 0.1 < c抑制剂in vivo/Ki < 1, 有可能性; c抑制剂in vivo/Ki > 1, 高可能性。
统计学分析 实验数据结果用x± s表示, 组间比较用t检验。
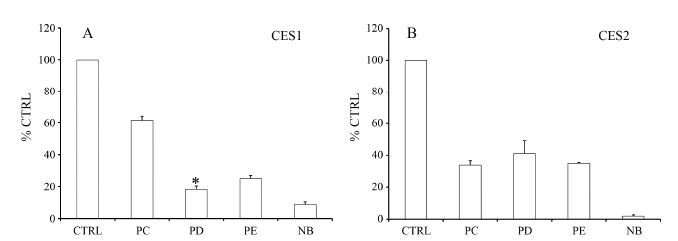
结果 1 白花前胡丙素、丁素及E素对羧酸酯酶活性的影响如图 1所示, 100 mol·L-1的白花前胡丙素、丁素及E素对羧酸酯酶2活性的抑制分别为65.9%、59.0% 和35.1%, 均小于80%; 白花前胡丙素、丁素及E素对羧酸酯酶1活性的抑制分别为38.6%、81.7% 和75.0%, 其中白花前胡丁素对羧酸酯酶1活性有较强的抑制作用 (P < 0.05) 。
|
Figure 1 Inhibition screening of praeruptorin C (PC), praeruptorin D (PD), praeruptorin E (PE) and neobavaisoflavone (NB) on the activity of CES1 and CES2. 100 mol·L-1 of PC, PD, PE and NB was used, and data were shown by using mean value plus SD. *P < 0.05 vs control group |
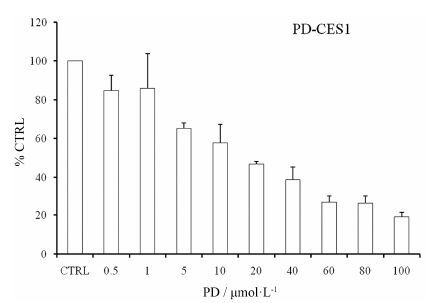
如图 2所示, 0.5、1、5、10、20、40、60、80和100 mol·L-1的白花前胡丁素对羧酸酯酶1活性的抑制分别为15.2%、14.1%、34.7%、42.2%、53.2%、61.2%、72.8%、73.1% 和80.9%。IC50约为20 mol·L-1。
|
Figure 2 IC50 of PD on the activity of CES1. Data were shown by using mean value plus SD |
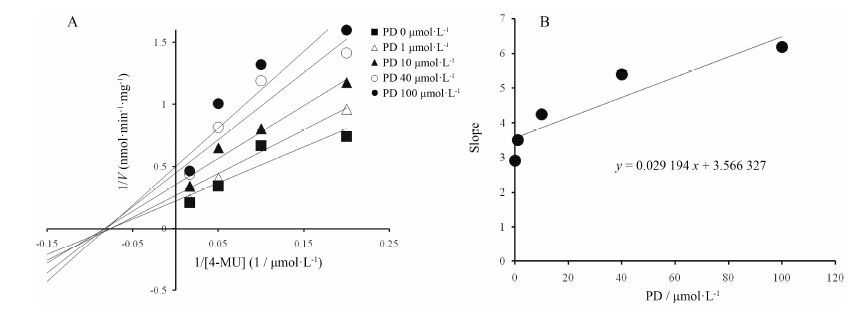
利用Lineweaver-Burk作图法求出白花前胡丁素对羧酸酯酶1的抑制类型, 如图 3所示, 本实验Lineweaver-Burk作图的拟合直线相交点位于x轴 (图 3A), 说明白花前胡丁素对羧酸酯酶1的抑制动力学类型属于非竞争性抑制。采用各条线的斜率对白花前胡丁素的浓度二次作图来计算Ki (图 3B), 白花前胡丁素对羧酸酯酶1催化BMBT的抑制的拟合方程为y = 0.029 194 x + 3.566 327。使用方程, 计算出白花前胡丁素对羧酸酯酶1的Ki为122.2 mol·L-1。
|
Figure 3 Inhibition kinetics of PD on CES1. (A) Lineweaver-Burk plot of the inhibition of PD on the activity of CES1. Each data point represents the mean value of duplicate experiments. (B) Determination of inhibition kinetic parameter (Ki) of PD onthe activity of CES1. The vertical axis represents the slopes of the lines from Lineweaver-Burk plot, and the horizontal axis represents the concen-trations of PD |
口服白花前胡丁素20 mg后, 大鼠体内最大血药浓度可达到15 μg·mL-1 (35 mol·L-1) [12]。假设白花前胡丁素达到相同的血浆浓度, 将白花前胡丁素的体内血药浓度 (c抑制剂) 代入公式, 计算白花前胡丁素的c抑制剂/Ki值为0.29, 表示由于抑制羧酸酯酶1所造成的药物AUC比未服用白花前胡丁素时增大了0.29倍。可以判定在正常剂量下, 有可能导致药物-药物相互作用的产生。
讨论白花前胡丙素、丁素及E素是从中药白花前胡中提取的有效成分, 具有广泛的生化以及药理活性[13]。药物在体内的代谢过程要经历Ⅰ相代谢反应和Ⅱ相代谢反应, 白花前胡丙素、丁素及E素的代谢过程与Ⅰ相代谢密切相关。白花前胡丙素以及丁素通过对核受体的控制, 上调Ⅰ相代谢酶的表达[14, 15]; 白花前胡E素在体外人肝微粒体孵育体系中, 产生多种Ⅰ相代谢产物[16]。因此, 提示白花前胡丙素、丁素及E素可能与重要的Ⅰ相代谢酶羧酸酯酶产生相互作用。本研究用人肝微粒体分别催化羧酸酯酶1及羧酸酯酶2的特异性底物BMBT及FD反应, 考察白花前胡丙素、丁素及E素对羧酸酯酶活性的抑制作用, 以提示白花前胡丙素、丁素及E素产生内源性代谢疾病以及药物-药物相互作用的可能性。白花前胡丁素对羧酸酯酶1表现出最显著的影响, 酶活性抑制达80% 以上。羧酸酯酶1是一个重要的Ⅰ相代谢酶, 主要分布在肝脏中[17], 除了在肝脏外源物质解毒方面发挥重要作用外, 还能参与人体内胆固醇酯和游离脂肪酸的运输和代谢过程[18]。因此, 白花前胡丁素可能扰乱这些内源性物质的代谢, 从而引起内源性代谢疾病如高胆固醇血症等。
药物可以通过对代谢酶的诱导或抑制作用影响其他药物的代谢, 从而改变其他药物在该作用靶点部位的有效浓度, 最终产生不良的药物反应。羧酸酯酶1是一种很重要的药物代谢酶, 能有效水解含有酯键、酰胺键、硫酯键的多种外源性药物或前体药物, 包括替莫普利、奥司他韦、哌替啶等临床常用药物[19]。考虑到白花前胡丁素对羧酸酯酶1活性的抑制可能导致不良反应, 本实验研究白花前胡丁素对羧酸酯酶1的抑制动力学进一步考察体外抑制能力是否可以被转换成体内抑制能力。结果显示, 白花前胡丁素强烈地抑制羧酸酯酶1, 且属于非竞争性抑制。非竞争性抑制的特点是抑制剂与酶活性部位以外部结合而改变活性部位的结构, 使酶活性下降, 导致酶催化这种底物的反应速率下降。进一步通过抑制动力学评价和体外-体内外推揭示了白花前胡丁素可能通过抑制羧酸酯酶在体内产生药物-药物相互作用。
综上所述, 在体外37 ℃孵育体系中, 用HPLC-UV检测方法和人肝微粒体催化特异性底物反应, 来评估白花前胡丙素、丁素及E素对羧酸酯酶潜在的抑制作用。其中, 白花前胡丁素对羧酸酯酶1活性的抑制作用最为显著, 而且体外抑制潜力也可很好转化成体内抑制能力, 预测白花前胡丁素很可能通过抑制羧酸酯酶1在体内引起内源性代谢障碍以及药物-药物相互作用。因此, 对羧酸酯酶1有抑制或诱导作用的药物与白花前胡丁素联合应用时, 应注意药物-药物相互作用的影响, 对指导临床用药及新药开发具有指导意义。
| [1] | Xu Z, Wang X, Dai Y, et al. (±)-Praeruptorin A enantiomers exert distinct relaxant effects on isolated rat aorta rings dependent on endothelium and nitric oxide synthesis[J]. Chem Biol Interact, 2010, 186: 239–246. DOI:10.1016/j.cbi.2010.04.024 |
| [2] | Song Y, Jing W, Yan R, et al. Research progress of the studies on the roots of Peucedanum praeruptorum Dunn (Peucedani Radix)[J]. Pak J Pharm Sci, 2015, 28: 71–81. |
| [3] | Wu JYC, Fong WF, Zhang JX, et al. Reversal of multidrug resistance in cancer cells by pyranocoumarins isolated from Radix Peucedani[J]. Eur J Pharmacol, 2003, 473: 9–17. DOI:10.1016/S0014-2999(03)01946-0 |
| [4] | Wu X, Shi CZ, Wu XD. Effects of praeruptorin-C on cytosolic free calcium in cultured rat heart cells[J]. Acta Pharm Sin (药学学报), 1992, 28: 728–731. |
| [5] | Yu PJ, Li JR, Zhu ZG, et al. Praeruptorin D and E attenuate lipopolysaccharide/hydrochloric acid induced acute lung injury in mice[J]. Eur J Pharmacol, 2013, 710: 39–48. DOI:10.1016/j.ejphar.2013.03.050 |
| [6] | Hatfield MJ, Umans RA, Hyatt JL, et al. Carboxylesterases:general detoxifying enzymes[J]. Chem Biol Interact, 2016, 259: 327–331. DOI:10.1016/j.cbi.2016.02.011 |
| [7] | Xu Y, Zhang C, He W, et al. Regulations of xenobiotics and endobiotics on carboxylesterases:a comprehensive review[J]. Eur J Drug Metab Pharmacokinet, 2016, 41: 321–330. DOI:10.1007/s13318-016-0326-5 |
| [8] | Jing WH, Song YL, Yan R, et al. Transport and metabolism of (±)-praeruptorin A in Caco-2 cell monolayers[J]. Xenobiotica, 2011, 41: 71–81. DOI:10.3109/00498254.2010.526653 |
| [9] | Liu X, Chen DW, Wu X, et al. The inhibition of UDPglucuronosyltransferase (UGT) isoforms by praeruptorin A and B[J]. Phytother Res, 2016, 30: 1872–1878. DOI:10.1002/ptr.v30.11 |
| [10] | Sun DX, Ge GB, Dong PP, et al. Inhibition behavior of Fructus Psoraleae's ingredients towards human carboxylesterase 1(hCES1)[J]. Xenobiotica, 2016, 46: 503–510. DOI:10.3109/00498254.2015.1091521 |
| [11] | Li YG, Hou J, Li SY, et al. Fructus Psoraleae contains natural compounds with potent inhibitory effects towards human carboxylesterase 2[J]. Fitoterapia, 2015, 101: 99–106. DOI:10.1016/j.fitote.2015.01.004 |
| [12] | Liang T, Yue W, Du X, et al. Pharmacokinetics and tissue distribution study of praeruptorin D from radix peucedani in rats by high-performance liquid chromatography (HPLC)[J]. Int J Mol Sci, 2012, 13: 9129–9141. DOI:10.3390/ijms13079129 |
| [13] | Tang W, Eisenbrand G. Peucedanum praeruptorum Dunn[M]. Berlin Heidelberg: Springer, 1992: 753-757. |
| [14] | Huang L, Bi HC, Liu YH, et al. CAR-mediated up-regulation of CYP3A4 expression in LS174T cells by Chinese herbal compounds[J]. Drug Metab Pharmacokinet, 2011, 26: 331–340. DOI:10.2133/dmpk.DMPK-10-RG-115 |
| [15] | Huang L, Huang M, Li YH, et al. Up-regulation of CYP3A expression through pregnant X receptor by praeruptorin D isolated from Peucedanum praeruptorum Dunn[J]. J Ethnopharmacol, 2013, 148: 596–602. DOI:10.1016/j.jep.2013.05.008 |
| [16] | Song YL, Yan R, Jing WH, et al. Characterization of metabolism of (+)-praeruptorin B and (+)-praeruptorin E in human and rat liver microsomes by liquid chromatography coupled with ion trap mass spectrometry and time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom, 2011, 25: 719–730. DOI:10.1002/rcm.v25.6 |
| [17] | Ross MK, Crow JA. Human carboxylesterases and their role in xenobiotic and endobiotic metabolism[J]. J Biochem Mol Toxicol, 2007, 21: 187–196. DOI:10.1002/(ISSN)1099-0461 |
| [18] | Nagashima S, Yagyu H, Takahashi N, et al. Depot-specific expression of lipolytic genes in human adipose tissues[J]. J Atheroscler Thromb, 2011, 18: 190–199. DOI:10.5551/jat.6478 |
| [19] | Imai T. Carboxylesterase:from drug metabolism to drug discovery[J]. Nihon Yakurigaku Zasshi, 2009, 134: 281–284. DOI:10.1254/fpj.134.281 |
 2017, Vol. 52
2017, Vol. 52


