2. 中国科学院大连化学物理研究所, 辽宁 大连 116023;
3. 大连医科大学, 辽宁 大连 116011
2. Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China;
3. Dalian Medical University, Dalian 116011, China
羧酸酯酶 (carboxylesterase, CE, EC 3.1.1.1) 是丝氨酸水解酶超家族的重要成员, 其可有效催化羧酸酯、硫酯、氨基甲酸酯和酰胺等多种内源性和外源性化合物的水解[1, 2]。哺乳动物的hCEs依据其氨基酸序列的同源性可分为5个家族, 即hCE1、hCE2、hCE3、hCE5和hCE6, 其中在人体主要分布有hCE1和hCE2两大类羧酸酯酶[3]。hCE1和hCE2的组织分布和底物特异性存在显著差异。hCE1主要分布在人体肝脏和脂肪细胞中, 在其他组织 (如肠道中) 的表达量相对较低; 但hCE2则主要分布在人肠道中, 同时在肝脏中也有一定的分布[4-6]。底物偏好性上, hCE1偏好催化醇基较小和酰基较大底物的水解, 如胆固醇酯和氯吡格雷等; 而hCE2则偏好催化醇基较大和酰基较小底物的水解, 如抗肿瘤药物卡培他滨和伊立替康[7]。
作为人体分布的一种重要的水解代谢酶, hCE1在维持人体脂质代谢平衡、药物及毒物的代谢清除中发挥不可忽视的作用。hCE1参与了胆固醇酯和脂肪酸酯等内源性脂类的水解代谢, 是维持脂质代谢平衡的关键代谢酶[5, 8]。近年来有研究表明, 肥胖和糖尿病患者皮肤细胞中hCE1的表达和活性均显著提升, 而hCE1强效抑制剂可通过抑制皮肤细胞中hCE1的活性减少胆固醇酯的水解, 进而降低血中游离胆固醇和脂肪酸酯的水平并显著改善胰岛素的敏感度[9, 10]。因此, 研发用于复杂生物体系中hCE1抑制剂的高效筛选与评价方法对于以hCE1为靶标的新药研发意义重大。另一方面, hCE1还参与了多种酯类外源物的水解代谢, 如抗血栓药物氯吡格雷、血管紧张素转化酶抑制剂依那普利、血管紧张素受体抑制剂奥美沙坦、3-羟基-3甲基戊二酸单酰辅酶A还原酶抑制剂洛伐他汀、中枢神经系统激活剂哌醋甲酯、麻醉止痛剂哌替啶、抗病毒药物奥司他韦及免疫抑制剂霉酚酸酯等, 以及农用杀虫剂溴氰菊酯等[2]。临床多药联用以及中西药联合使用等可能通过竞争代谢酶引发潜在的药物-药物相互作用[11]。因此, 构建hCE1相关药-药相互作用的早期评价及预警体系对于指导酯类药物的临床合理用药具有重要意义。
目前, hCE1抑制剂的筛选与评价多使用氯吡格雷及奥司他韦等传统探针底物, 其检测灵敏度有限且筛选通量低[12]。荧光探针底物因其具有检测灵敏度高、操作简单、适于高通量实时检测等优势, 近年来备受生物医药研究领域的关注[13-16]。因此, 可基于hCE1的底物偏好性设计研发hCE1的高特异性荧光探针底物, 进而用于复杂生物体系中的hCE1活性检测和抑制剂高通量筛选等研究。值得注意的是, 大多数荧光团都具有大羟基的结构, 其成酯后也多为hCE2的底物[14, 16-19]。因此, 近年来国内外多个研究团队都成功研发了hCE2的特异性荧光探针底物。但与之相对的是, hCE1的特异性荧光探针研发极具挑战, 其不仅需要选择含有羧酸基团且体积较大的荧光母体, 还需要考虑羧酸成酯前后荧光属性产生较大的变化, 同时还需要避免人体其他丝氨酸水解酶的参与。
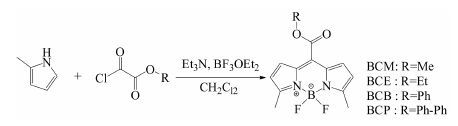
本研究以8-羧酸-氟硼二吡咯 (boron-dipyrro-methene, BODIPY)为荧光母体, 旨在设计研发一种新型的hCE1高特异性荧光探针底物, 进而为新药研发及生物医学相关领域提供强有力的工具分子。BODIPY作为一种常用的荧光母体, 其不仅具有量子产率高、摩尔消光系数高、光稳定性良好和pH不敏感等优点[20-22], 同时其8-位取代基的吸电子能力强弱能显著影响其紫外吸收和荧光发射波谱。8-羧酸-BODIPY的8-位羧酸基成酯后羧酸酯的吸电子能力增强进而引起荧光发射谱的红移, 而具有强吸电子能力的羧酸酯被酯酶水解后释放出吸电子能力相对较弱的8-羧酸-BODIPY后, 产物荧光发射谱会发生蓝移。因此, BODIPY-8-羧酸酯衍生物可作为理想的hCE1潜在底物。本研究以8-羧酸-BODIPY为荧光母体, 设计合成了4种羧酸酯衍生物 (合成路线1) , 借助抑制剂实验和代谢反应表型等实验评估了其特异性, 并从中发现了2个hCE1的特异性荧光探针底物。在此基础上, 细致开展了其代谢动力学和抑制剂高效筛选等研究。
|
Scheme1 The synthetic scheme of BODIPY-8-carboxylesters derivatives. BODIPY: Boron-dipyrromethene |
实验材料 人肝微粒体 (human liver microsomes, HLM)、羧酸酯酶1 (carboxylesterase1, CE1) 和羧酸酯酶2 (carboxylesterase2, CE2) 购自瑞德肝脏疾病研究有限公司 (上海, 中国), 对氧磷酶-1 (paraoxonase-1, PON1) 和对氧磷酶-2 (paraoxonase-2, PON-2) 购自巴傲得 (明尼苏达, 美国)。丁酰胆碱酯酶 (bu-tyrylcholinesterase, BChE) 和乙酰胆碱酯酶 (acetyl cholinesterase, AChE) 购自西格玛 (密苏里, 美国)。双 (对硝基苯基) 磷酸盐 (bis-p-nitrophenyl phosphate, BNPP) 和洛哌丁胺 (loperamide, LPA) 购自东京化成工业株式会社 (日本), 乙二胺四乙酸 (ethyl-enediaminetetraacetic acid, EDTA) 和加兰他敏 (gal-anthamine base, GA), 2-甲基吡咯, 三乙胺及草酰氯酯单甲酯购自百灵威 (北京, 中国)。3-O-β-羧丙酰基-乌苏酸[3β-O-(β-carboxypropionyl)-urs-12-en-28-oic acid, CUA]为实验室自制, 纯度98% 以上。色谱分析实验中所用试剂均为色谱纯。
仪器 全自动荧光酶标仪 (Synergy H1 Hybrid Multi-Mode Microplate Reader), 美国BioTek公司; 400 MHz核磁共振仪美国Bruker公司; SHIMADZU 超快速高效液相色谱仪 (UFLC) 配有LC-30AD高压泵、SPD-20A紫外/可见光检测器及荧光检测器 (FD), CBM-20A系统控制器、DGU-20A真空在线脱气机、SIL-30AC自动进样器、CTO-30A柱温箱及LabSolutions 5.81数据处理系统, 日本Shimadzu公司; 高分辨质谱仪LTQ Orbitrap XL, 美国Thermo公司; Milli-Q超纯水制备系统, 美国MILLIPORE公司。
BODIPY衍生物的合成 4种BODIPY衍生物的制备工艺参照Kim等[23]报道, 合成工艺如合成路线1所示。本研究以2-甲基吡咯和草酰氯酯单甲酯为起始原料制备BODIPY-8-羧酸甲酯 (BCM), 同时依照该合成方法制备了BODIPY-8-羧酸乙酯 (BCE)、BODIPY-8-羧酸苯酯 (BCB) 及BODIPY-8-羧酸联苯酯 (BCP)。所得产物的纯度经液相色谱-紫外检测仪分析均达到98%以上, 其结构经高分辨质谱及核磁鉴定。
单酶特异性筛选 在100 mmol·L-1的磷酸盐缓冲液 (PBS, pH 7.4) 中分别加入不同的BODIPY酯类衍生物 (底物终浓度为10 μmol·L-1), 在37 ℃下孵育3 min后分别加入不同的水解酶 (hCE1、hCE2、AChE、BChE、PON1和PON2) 起始反应, hCE1、hCE2、AChE、BChE、PON1和PON2的终浓度分别为5 g·mL-1、5 g·mL-1、5 g·mL-1、20 U·L-1、0.5 g·mL-1和0.5 g·mL-1。酶反应体系的总体积为200 L且DMSO的含量为1%。在37 ℃下孵育60 min后加入冰乙腈200 L终止反应, 随后取出反应液150 L在全自动荧光酶标仪上进行产物8-羧酸BODIPY的荧光信号检测, 产物检测条件如下: 激发波长为505 nm, 发射波长为560 nm。阴性对照组为未加入任何水解酶的PBS体系。
化学抑制实验 以HLM为酶源, 分别加入BNPP (羧酸酯酶的抑制剂)、LPA (CE2抑制剂)、GA (AChE和BChE抑制剂)、EDTA (PON1和PON2抑制剂) 和CUA[24] (hCE1特异性抑制剂) 测定抑制剂加入组和空白对照组 (PBS) 中8-羧酸BODIPY的荧光信号进而计算出残余酶活。实验步骤如下: 将适量的HLM加入到100 mmol·L-1的磷酸盐缓冲液 (PBS, pH 7.4) 中, 然后加入上述任意一种抑制剂的DMSO溶液使抑制剂的终浓度达到100 μmol·L-1, 在37 ℃下混匀后于金属孵育器上预孵15 min, 最后加入BODIPY酯类衍生物起始反应, 反应体系的总体积为200 L且DMSO的含量不超过1%。在37 ℃下孵育30 min后加入冰乙腈200 L终止反应, 随后取出反应液150 L直接在全自动荧光酶标仪上进行目标产物的荧光信号检测, 产物检测条件如下: 激发波长为505 nm, 发射波长为560 nm。
hCE1定量标准曲线绘制 在生理条件下 (pH 7.4、37 ℃) 测定了BCM和BCE两种荧光底物于不同hCE1质量浓度梯度 (0、0.5、1、2、4和6 μg·mL-1) 下孵育后产物8-羧酸BODIPY荧光信号的响应。实验操作及目标产物的检测流程可参照单酶特异性筛选部分, 酶反应体系的总体积为200 L且DMSO的含量为1%。
酶动力学实验 分别以HLM和hCE1为酶源, 在生理条件下 (pH 7.4、37 ℃) 测定BCM在不同浓度 (0、0.5、1、2.5、5、7.5、10、15和20 mol·L-1) 下水解产物的生成。酶动力学实验的孵育时间控制在30 min, 以确保底物的转化率低于10% 且产物的生成速率处于线性范围内。实验操作及目标产物的检测流程可参照单酶特异性筛选部分, 酶反应体系的总体积为200 L且DMSO的含量为1%。根据反应前后产物荧光值的变化, 通过产物8-羧酸BODIPY的标准曲线 (Y = 17 854 X + 2 365, R2 = 0.995, P < 0.000 1) 计算出产物的生成速率。以底物浓度S为x轴, 产物生成速率v为y轴, 借助Graphpad Prism 6 (GraphPad Software, USA) 软件利用如下公式1通过非线性回归绘制酶动力学曲线 (包括米氏动力学曲线和Eadie-Hofstee图) 并拟合相应的动力学参数Km和Vmax。
| $v=\frac{{{V}_{\text{max}}}\times [S]}{{{K}_{\text{m}}}+[S]}$ | (1) |
抑制剂的高效表征 以BCM为探针底物开展hCE1抑制剂的高效评价示范研究, 分别选用羧酸酯酶的广谱抑制剂BNPP和hCE1的高效抑制剂CUA, 并以HLM和hCE1为酶源测定了不同抑制剂浓度下hCE1的残余酶活力进而计算出相应的半数抑制剂量 (IC50值)。反应体系的总体积为200 L, DMSO的含量为1%。具体实验步骤如下: 首先, 将适量的HLM或hCE1加入到100 mmol·L-1的磷酸盐缓冲液 (PBS, pH 7.4) 中, 然后加入不同浓度的抑制剂, 在37 ℃下预孵育15 min后加入底物BCM起始反应, 继续在 37 ℃下孵育30 min后加入冰乙腈200 L终止反应, 随后取出反应液150 L直接在全自动荧光酶标仪上进行目标产物的荧光信号检测, 产物检测条件如下: 激发波长为505 nm, 发射波长为560 nm。通过对抑制剂浓度进行对数转换, 以抑制剂浓度的对数值LogC为x轴, hCE1的残余活力为y轴, 使用Graphpad Prism 6 (GraphPad Software, USA) 通过非线性回归绘制抑制动力学曲线并拟合IC50值。
结果 1 生理条件下底物的稳定性结果显示, 4种BODIPY-8-羧酸酯类衍生物在生理条件下 (pH 7.4, 37 ℃) 孵育2 h后均未见明显降解, 且无任何水解产物生成。但加入HLM及hCE1后, 4种BODIPY-8-羧酸酯类衍生物均可在生理条件下 (pH 7.4, 37 ℃) 水解并释放出荧光产物8-羧酸BODIPY, 且该水解过程可被有机溶剂 (如乙腈) 终止。以上研究提示4种BODIPY-8-羧酸酯类衍生物在生理条件下不会发生化学水解, 但其可被hCE1及含有hCE1的HLM水解。
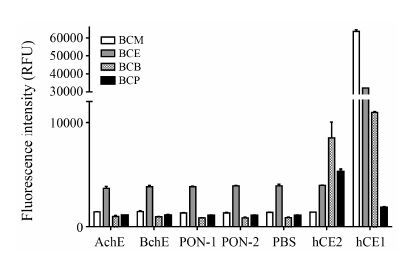
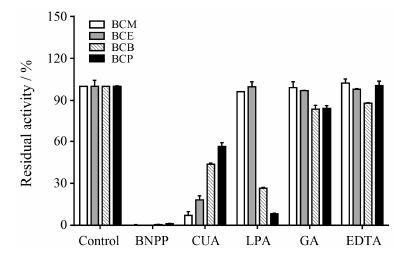
2 生理条件下底物的酶催化选择性为考察4种BODIPY-8-羧酸酯类衍生物的特异性, 首先利用人体分布的丝氨酸水解酶进行了代谢表型研究。如图 1及图 2所示, 4种BODIPY-8-羧酸酯类衍生物均可被hCE1水解, 但随着BODIPY-羧酸衍生物醇基部分的逐渐增大, hCE2开始参与酯类化合物的水解, BCB和BCP的hCE1特异性显著降低。其次, 以HLM为酶源, 借助5种酯酶特异性抑制 (BNPP、LPA、GA、EDTA和CUA) 对4种BODIPY-8-羧酸酯衍生物在HLM中的特异性进行了评价。结果表明, BCM和BCE在HLM中的水解过程仅被羧酸酯酶的特异性抑制剂BNPP和hCE1的特异性抑制剂CUA抑制, 而hCE2的特异性抑制剂LPA并不抑制BCM和BCE在HLM中的水解 (图 2) 。而BCB和BCP在HLM中的水解过程可被hCE2的特异性抑制剂LPA强烈抑制, 提示hCE2参与BCB和BCP的水解。结果显示, BCM和BCE可作为hCE1的特异性荧光探针底物。
|
Figure 1 Reaction phenotyping assays of four BODIPY-base fluorescent substrates (BCM: BODIPY-8-carboxylic acid methyl ester; BCE: BODIPY-8-carboxylic acid ethyl ester; BCB: BODIPY-8-carboxylic acid phenyl ester; BCP: BODIPY-8-carboxylic acid biphenyl ester) were incubated with different human serine hydrolase (AChE, BChE, PON1, PON2, hCE1, hCE2) for 60 min. AChE: Acetyl cholinesterase; BChE: Butyryl cholinesterase; PON1: Paraoxonase-1; PON2: Paraoxonase-2; hCE1: Human carboxylesterase 1; hCE2: Human carboxylesterase 2 |
|
Figure 2 Chemical inhibition assays of four BODIPY-base fluorescent substrates. Five selective inhibitors of various esterases (BNPP, LPA, GA, CUA and EDTA) were used. BNPP: bis-p-Nitrophenyl phosphate; CUA: 3β-O-(β-Carboxypropionyl)-urs-12-en-28-oic acid; LPA: Loperamide; GA: Galanthamine base; EDTA: Ethylenediaminetetraacetic acid |
如图 3所示, BCM和BCE在水解前后荧光发射波谱会产生显著变化。在生理条件下加入hCE1后, BCM和BCE可被hCE1快速水解并释放出产物8-羧酸-BODIPY, 后者在560 nm附近产生强烈的荧光信号。因此, BCM和BCE可作为hCE1的OFF-ON型探针用于该酶的活性检测。分别以BCM和BCE为hCE1的特异性荧光探针底物, 在生理条件下 (pH 7.4, 37 ℃) 测定了上述两种荧光底物对不同浓度hCE1的线性响应曲线。图 3C及3D显示, BCM和BCE分别与不同浓度hCE1孵育30 min后560 nm处的荧光信号变化, 从中可以看出BCM和BCE对hCE1均具有量好的线性响应 (R2 > 0.99) 。BCM和BCE检测hCE1的定量下限分别为0.18和0.37 μg·mL-1。上述研究为hCE1的活性检测提供了定量基础。

|
Figure 3 The changes in emission spectrum of BCM (A) and BCE (B) following incubation in human liver microsomes (HLM) for 30 min, and the calibration curves for hCE1 determination by BCM-based assay (C) and BCE-based assay (D) |
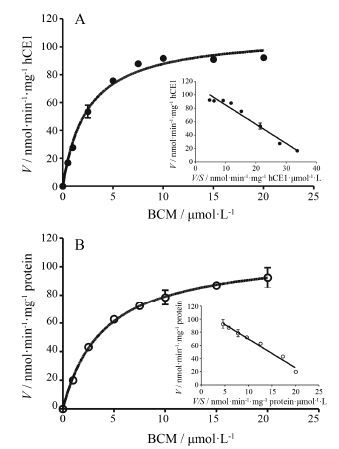
探针底物的酶动力学行为对于以酶活定量为基础的目标酶活性检测是十分重要的[25-28]。本研究细致考察了BCM在重组hCE1和HLM中的水解动力学行为。如图 4所示, BCM在重组hCE1和HLM的水解动力学均遵循经典的米氏动力学行为 (Eadie-Hofstee图呈线性)。BCM在上述两种酶源中的酶动力学参数如表 1所示, 从中可以看出, BCM对hCE1具有较高的亲和力 (Km值小于5 mol·L-1), 且BCM在重组hCE1中的Km值与其在HLM中的Km值非常接近, 提示hCE1是HLM中介导BCM水解的主要代谢酶。
|
Figure 4 Enzymatic kinetic plots of BCM in both recombinant hCE1 (A) and HLM (B). The corresponding Eadie-Hofstee plot was shown as an insert |
| Table 1 The kinetic parameters of BCM hydrolysis in both recombinant hCE1 and HLM |
结果表明, BCM在hCE1和人肝组织制备物中均有良好的特异性及检测灵敏度, 同时BCM水解前后的信号增益倍数可达50倍左右。因此, BCM可作为理想的hCE1特异性荧光探针底物, 且有望以HLM为酶源开展hCE1抑制剂的高效筛选及表征。为此, 本研究以BCM为探针底物, 在不同酶源孵育体系中表征了两种hCE1强效抑制剂 (BNPP和CUA) 对BCM水解反应的抑制能力。如图 5所示, BNPP和CUA可强效抑制对HLM及重组hCE1中的BCM水解, 其抑制行为均呈现剂量依赖型, 且BNPP和CUA在HLM中对BCM水解反应的抑制趋势与其在单酶中的趋势完全一致。BNPP和CUA在两种酶源中的半数抑制剂量IC50如表 2所示, 从中可以看出, BNPP和CUA均可强效抑制hCE1介导的BCM的水解, 其IC50值介于74~189 nmol·L-1之间, 且BNPP和CUA在HLM中的IC50值与其在重组单酶中的IC50值高度吻合。以上研究提示可借助BCM这一特异性荧光探针底物在组织微粒体层面开展hC E1抑制剂的高效筛选及表征。
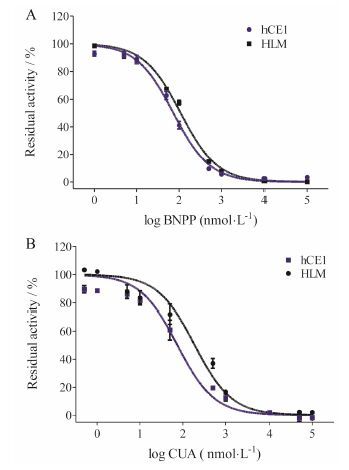
|
Figure 5 Rapid screening of hCE1 inhibitors in both HLM and recombinant hCE1 using BCM as the probe substrate; ① Dose-inhibition curves of BNPP on BCM hydrolysis in HLM and hCE1; ② Dose-inhibition curves of CUA on BCM hydrolysis in HLM and hCE1 |
| Table 2 The IC50 values of BNPP and CUA against BCM hydrolysis in different enzyme sources |
虽然目前国内外已有许多hCE1特异性底物被报道, 如氯吡格雷、依那普利、奥美沙坦、洛伐他汀、利多卡因和胆固醇酯等, 但上述底物及其水解产物的检测往往需要借助液相色谱-质谱联用技术。与传统的液质谱联用技术相比, 荧光检测具有检测灵敏度高, 操作简单, 适用于高通量检测等优势, 因而备受国内外研究者的关注。然而, hCE1特异性荧光探针的设计研发才刚刚起步, 前期仅有作者研究组报道了一种苯并噻唑母核的hCE1荧光探针, 但其发射波长低于500 nm, 易受生物基质的干扰[27, 29]。因此, 有必要研发属性优良的hCE1荧光探针用于复杂生物样本中目标酶活性的高效检测。
本研究结合hCE1偏好底物的结构特征 (偏好催化醇基较小和酰基较大底物发生水解反应), 以BODIPY-8羧酸为母核, 设计合成了4种羧酸酯衍生物。由于这些酯类衍生物都具有BODIPY-8羧酸这样的大酰基, 因此均可作为hCE1的潜在底物。而本研究也证实了上述4种酯类衍生物均可被hCE1催化发生水解反应。更为重要的是, 本研究相关结果表明hCE1可催化BODIPY羧酸酯发生水解反应, 且在BODIPY羧酸酯水解的前后荧光信号发生了显著变化, 可通过测量反应前后的荧光信号变化对hCE1进行定量。此外, 代谢表型实验和化学抑制实验证实了BCM和BCE对hCE1显示出良好的特异性, 但随着BODIPY-羧酸酯衍生物醇基部分体积的逐渐增大, hCE2开始参与酯类化合物的水解。因此, BCB和BCP对hCE1的特异性显著降低, 尤其是连接联苯基的羧酸酯衍生物BCP, 其主要代谢酶是hCE2。上述结果与相关文献报道的羧酸酯酶的底物谱规律一致[7]。虽然BCB和BCP对hCE1的特异性都很好, 但由于BCM的酯基较小因而其更易被hCE1水解, 导致其反应速率要高于BCE的水解速率。从反应速率来看, BCM在hCE1和HLM中的水解速率均高于BCE的水解速率 (高2倍左右), 提示在羧酸基团相同的条件下分子量较小的BODIPY-8-羧酸甲酯更易于被hCE1水解。上述结果表明BCM在hCE1活性的定量检测中显示出更高的灵敏度。
动力学实验证实BCM与hCE1具有很高亲和力, 且BCM在HLM中的动力学行为及参数与其在重组hCE1中的动力学行为及参数极其接近。结合图 2显示的酯酶特异性抑制剂的抑制实验结果, 可以看出BCM在HLM中的水解完全是hCE1催化的。上述结果提示可以BCM作为特异性探针底物, 在肝组织微粒体层面筛选hCE1的抑制剂。因此, 进一步在HLM层面开展了hCE1抑制剂的高效表征研究。研究发现两种酯酶抑制剂 (BNPP和CUA) 在HLM中对BCM水解的抑制趋势与其在单酶中的趋势完全一致, 且半数抑制剂量IC50值也非常接近。该结果提示, 未来可选用组织或细胞制备物开展hCE1抑制剂的高效筛选与评价。考虑到hCE1抑制剂可降低血中游离胆固醇和脂肪酸酯的水平并显著改善胰岛素的敏感度, 研发高效安全的hCE1抑制剂有望给肥胖和糖尿病患者带来福音。此外, 食品和中药中可能也存在hCE1抑制剂, 其与氯吡格雷、依那普利和奥美沙坦等hCE1代谢的临床药物共服时, 有可能通过抑制hCE1的活性改变上述药物的药代动力学行为进而影响其治疗效果。因此, 未来可借助hCE1特异性荧光探针底物开展hCE1相关的药-药相互作用快速评价及预警研究。
综上所述, 本研究基于hCE1偏好催化醇基较小和酰基较大底物发生水解反应这一特征, 以BODIPY-8羧酸为母核, 设计合成了4种羧酸酯衍生物。借助体外人源单酶筛选及化学抑制实验发现了两种hCE1特异性荧光探针底物BCM和BCE, 但hCE1对BCM具有更高的水解速率。进一步研究发现BCM具有良好的检测灵敏度和酶动力学行为, 可用于复杂组织微粒体样本中hCE1的活性检测, 以及hCE1抑制剂的高通量筛选与评价。此外, 本研究所发现的hCE1荧光探针底物BCM及其匹配的高通量检测方法还可用于hCE1相关的生物分析、药物发现、临床药理学及毒理学等研究。
| [1] | Teruko I, Masakiyo H. Prodrug approach using carboxylesterases activity:catalytic properties and gene regulation of carboxylesterase in mammalian tissue[J]. J Pestic Sci, 2010, 35: 229–239. DOI:10.1584/jpestics.R10-03 |
| [2] | laizure SC, herring V, witbrodt K, et al. The role of human carboxylesterases in drug metabolism:have we overlooked their importance[J]. Pharmacotherapy, 2013, 33: 210–222. DOI:10.1002/phar.2013.33.issue-2 |
| [3] | Homes RS, Wright MW, Laulede SJF, et al. Recommended nomenclature for five mammalian carboxylesterase gene families:human, mouse, and rat genes and proteins[J]. Mamm Genome, 2010, 21: 427–441. DOI:10.1007/s00335-010-9284-4 |
| [4] | Imai T, Taketani M, Shii M, et al. Substrate specificity of carboxylesterase isozymes and their contribution to hydrolase activity in human liver and small intestine[J]. Drug Metab Dispos, 2006, 34: 1734–1741. DOI:10.1124/dmd.106.009381 |
| [5] | Ross MK, Crow JA. Human carboxylesterases and their role in xenobiotic and endobiotic metabolism[J]. J Biochem Mol Toxicol, 2007, 21: 187–196. DOI:10.1002/(ISSN)1099-0461 |
| [6] | Zhang W, Xu G, McLeod HL. Comprehensive evaluation of carboxylesterase-2 expression in normal human tissues using tissue array analysis[J]. Appl Immunohistochem Mol Morphol, 2002, 10: 374–380. |
| [7] | Hosokawa M. Structure and catalytic properties of carboxylesterase isozymes involved in metabolic activation of prodrugs[J]. Molecules, 2008, 13: 412–431. DOI:10.3390/molecules13020412 |
| [8] | Wang DD, Jin Q, Zou LW, et al. A bioluminescent sensor for highly selective and sensitive detection of human carboxylesterase 1 in complex biological samples[J]. Chem Commun, 2016, 52: 3183–3186. DOI:10.1039/C5CC09874B |
| [9] | Dominguez E, Galmozzi A, Chang JW, et al. Integrated phenotypic and activity-based profiling links Ces3 to obesity and diabetes[J]. Nat Chem Biol, 2014, 10: 113–121. |
| [10] | Marrades MP, González-Muniesa P, Martínez JA, et al. A dysregulation in CES1, APOE and other lipid metabolismrelated genes is associated to cardiovascular risk factors linked to obesity[J]. Obes Facts, 2010, 3: 312–318. DOI:10.1159/000321451 |
| [11] | Satoh T, Hosokawa M. The mammalian carboxylesterases:from molecules to functions[J]. Annu Rev Pharmacol Toxicol, 1998, 38: 257–288. DOI:10.1146/annurev.pharmtox.38.1.257 |
| [12] | Zhu HJ, Wang XW, Gawronski BE, et al. Carboxylesterase 1 as a determinant of clopidogrel metabolism and activation[J]. J Pharmacol Exp Ther, 2013, 334: 665–673. |
| [13] | Qian XK, Wang P, Xia YL, et al. A highly selective fluorescent probe for sensing activities of catechol-O-methyltransferase in complex biological samples[J]. Sens Actuators B Chem, 2016, 231: 615–623. DOI:10.1016/j.snb.2016.03.074 |
| [14] | Jing Q, Feng L, Wang DD, et al. A two-photon ratiometric fluorescent probe for imaging carboxylesterase 2 in living cells and tissues[J]. ACS Appl Mater Interfaces, 2015, 7: 28474–28481. DOI:10.1021/acsami.5b09573 |
| [15] | Dai ZR, Ge GB, Feng L, et al. A highly selective ratiometric two-photon fluorescent probe for human cytochrome P4501A[J]. J Am Chem Soc, 2015, 137: 14488–14495. DOI:10.1021/jacs.5b09854 |
| [16] | Lv X, Ge GB, Feng L, et al. An optimized ratiometric fluorescent probe for sensing human UDP-glucuronosyltransferase 1A1 and its biological applications[J]. Biosens Bioelectron, 2015, 72: 261–267. DOI:10.1016/j.bios.2015.05.003 |
| [17] | Liu ZM, Feng L, Hou J, et al. A ratiometric fluorescent sensor for highly selective detection of human carboxylesterase 2 and its application in living cells[J]. Sens Actuators B Chem, 2014, 205: 151–157. DOI:10.1016/j.snb.2014.08.066 |
| [18] | Jin Q, Feng L, Wang DD, et al. A highly selective nearinfrared fluorescent probe for carboxylesterase 2 and its bioimaging applications in living cells and animals[J]. Biosens Bioelectron, 2016, 83: 193–199. DOI:10.1016/j.bios.2016.04.075 |
| [19] | Feng L, Liu ZM, Xu L, et al. A highly selective longwavelength fluorescent probe for the detection of human carboxylesterase 2 and its biomedical applications[J]. Chem Commun, 2014, 50: 14519–14522. DOI:10.1039/C4CC06642A |
| [20] | Loudet A, Burgess K. BODIPY dyes and their derivatives:syntheses and spectroscopic properties[J]. ChemRev, 2007, 107: 4891–4932. |
| [21] | Jiao LJ, Wu YY, Ding Y, et al. Conformationally restricted Aza-Dipyrromethene Boron Difluorides (Aza-BODIPYs) with high fluorescent quantum yields[J]. Chem-Asian J, 2014, 9: 805–810. DOI:10.1002/asia.v9.3 |
| [22] | Yang XD, Zhang XF, Lu XL, et al. Red fluorescent monobenzo-BODIPY dyes:solvent effects on spectra and efficient fluorescence quenching by quinones and phenols[J]. J Photochem Photobiol A Chem, 2015, 297: 39–44. DOI:10.1016/j.jphotochem.2014.10.013 |
| [23] | Kim SW, Kim HJ, Choi YD, et al. A new strategy for fluorogenic esterase probes displaying low levels of nonspecific hydrolysis[J]. Chem-Eur J, 2015, 21: 9645–9649. DOI:10.1002/chem.201501127 |
| [24] | Yang L, Ge GB, Zou LW, et al. the inhibitory effect of ursolic acid inhibitors in neutral cholesterol ester hydrolase and its application:CN, 201610866559.1[P]. 2016-9-30. |
| [25] | Aleksandra J, Lauren EJ, Kamilla M, et al. SERS-based monitoring of the intracellular pH in endothelial cells:the influence of the extracellular environment and tumour necrosis factor-α[J]. Analyst, 2014, 140: 2321–2329. |
| [26] | Feng L, Liu ZM, Hou J, et al. A highly selective fluorescent ESIPT probe for the detection of human carboxylesterase 2 and its biological applications[J]. Biosens Bioelectron, 2015, 65: 9–15. DOI:10.1016/j.bios.2014.10.002 |
| [27] | Liu ZM, Feng L, Ge GB, et al. A highly selective ratiometric fluorescent probe for in vitro monitoring and cellular imaging of human carboxylesterase 1[J]. Biosens Bioelectron, 2014, 57: 30–35. DOI:10.1016/j.bios.2014.01.049 |
| [28] | Ge GB, Ning J, Hu LH, et al. A highly selective probe for human cytochrome P4503A4:isoform selectivity, kinetic characterization and its applications[J]. Chem Commun, 2013, 49: 9779–9781. DOI:10.1039/c3cc45250f |
| [29] | Wang DD, Jin Q, Hou J, et al. Highly sensitive and selective detection of human carboxylesterase 1 activity by liquid chromatography with fluorescence detection[J]. J Chromatogr B, 2016, 1008: 212–218. DOI:10.1016/j.jchromb.2015.11.046 |
 2017, Vol. 52
2017, Vol. 52



