2. 中山大学药学院, 广东 广州 510006;
3. 海南医学院药学院, 海南 海口 571199
2. School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China;
3. School of Pharmaceutical Sciences, Hainan Medical University, Haikou 571199, China
P-糖蛋白 (P-gp) 是ABC (ATP binding cassette) 转运体家族重要成员, 也是药物在机体内转运的重要载体, 参与药物代谢动力学过程并介导了临床上许多药物相互作用。P-gp是在正常组织分布广泛的血浆膜结合药物外排转运蛋白, 存在于肠道上皮、肾小管、肝小管、血脑屏障和胎盘屏障。P-gp主要表达在上皮细胞内腔侧表面、顶端和黏膜侧, 它的功能主要是与其底物结合后, 将底物从细胞浆中排出细胞[1, 2]。近年来, 由于P-gp在药物转运和药物相互作用中发挥的重要作用, 对P-gp表达和功能的调控研究受到有关学者的广泛关注。
蛋白激酶C (protein kinase C, PKC) 是一类通过磷酸化蛋白质上的丝氨酸和苏氨酸残基进而调控其功能的蛋白激酶家族[3]。佛波醇二酯类的佛波酯 (phorbol 12-myristate 13-acetate, PMA) 是一种肿瘤促进剂, 在生物医学研究中常作为PKC激动剂, 用来激活PKC信号传导通路, 进而产生一系列细胞反应[4]。研究表明, PKC可以通过激活下游的细胞核因子kappa B (nuclear factor-kappa B, NF-κB) 途径进而调控下游靶基因转录[5]。NF-κB存在于多种组织细胞中, 具有广泛的生物学活性, 参与多种生理和病理过程的基因调控[6]。作为炎症过程中的关键性因子, NF-κB对药物代谢领域中的代谢酶和转运体的潜在影响逐渐受到关注。NF-κB已被报道在抑制细胞色素P450 3A (cytochrome P450 3A, CYP3A) 的基因表达中发挥重要作用, 其对CYP3A的抑制是基于与孕烷X受体 (pregnane X receptor, PXR)-维甲酸X受体 (retinoid X receptor, RXR) 复合物的相互作用[7]。配体依赖型转录因子PXR是人体对外源性异物产生适应性反应的主要的调节器, 其作用的发挥主要通过诱导药物代谢酶和转运体的基因表达实现。据报道, PXR也是调控P-gp基因表达的关键核受体[8, 9]。
截止目前, PKC信号途径在P-gp表达和功能调控中的作用尚不明确, 其潜在机制亦有待研究, 尤其是NF-κB和PXR是否在PKC对P-gp的表达调控中发挥作用尚不清楚。因此, 本研究通过细胞、分子水平考察PKC/NF-κB-PXR信号途径对P-糖蛋白基因表达的影响, 深入阐明P-gp基因表达调控的分子机制。
材料与方法实验材料 人结肠癌LS174T细胞购自中国科学院上海细胞库。
实验试剂 佛波酯 (PMA)、4α-佛波酯 (4α-PMA)、利福平购自美国Sigma公司; RT-PCR试剂盒和SYBR Premix Ex TaqTM试剂盒购自日本TaKaRa公司; GAPDH、P-gp、hPXR、RelA、NFKB1上下游引物购自日本TaKaRa公司; RPMI-1640培养基、非必需氨基酸、青霉素/链霉素溶液、BCA蛋白定量试剂盒购自美国Thermo Fisher Scientific有限公司; RIPA裂解液、细胞浆/核蛋白提取试剂盒、SDS-PAGE蛋白上样缓冲液 (5X)、SDS-PAGE凝胶配制试剂盒购自江苏碧云天生物技术研究所; 人GAPDH、RelA/p65、p-IκBα、IκBα、p-IKKα/β一抗、鼠二抗、兔二抗购自美国Cell Signaling Technology公司; Trizol试剂、胎牛血清、0.25% 胰蛋白酶-EDTA、LipofeetaminTM 2000脂质体购自美国Invitrogen公司。E. coli Competent Cells DH5α和PRL-TK质粒购自日本TaKaRa公司; TK-MDR1-luc报告质粒由美国匹兹堡大学谢文教授惠赠; pSG5-hPXR表达质粒由美国德克萨斯大学Dr. Steven A. Kliewer惠赠; 双荧光素酶报告基因检测试剂盒购自美国Promega公司; PKCα siRNA、hRelA siRNA、hPXR siRNA购自广州市锐博生物科技有限公司。
实验仪器 5417-R低温高速离心机、普通PCR仪、微量取样器购自德国Eppendorf公司; 多功能酶标仪购自美国Molecular Devices公司; 7500型实时荧光定量PCR仪购自美国Applied Biosystems (ABI) 公司; Mini-PROTEAN3电泳系统和Mini Trans-Blot转移系统购自美国Bio-Rad公司; ImageQuant LAS 4000曝光成像仪购自美国General Electric公司; 微量定量仪Nanodrop2000购自美国Thermofisher公司; 超灵敏管式发光仪购自广州云星科学仪器有限公司。
LS174T细胞的培养 LS174T细胞培养于含10% 胎牛血清、1% 青霉素/链霉素双抗溶液的RPMI-1640培养基中, 于37 ℃、5% CO2、90% 湿度的细胞培养箱中培养。
细胞转染与报告基因实验 选取处于对数生长期的LS174T细胞, 用含10% FBS的1640培养液制作成单细胞悬液, 以2×104/cm2的密度接种于96孔板中, 于培养箱中培养24 h。使用Lipofectamine 2000 进行质粒转染, 3种质粒转染细胞时每孔的量分别为tk-MDR1-luc: 80 ng, pSG5-hPXR: 80 ng, pRL-TK: 10 ng。pSG5-Empty空载体对照组中各质粒用量分别为tk-MDR1-luc: 80 ng, pSG5-empty vectors: 80 ng, pRL-TK: 10 ng。待质粒转染5 h后, 已转染质粒的细胞分别与10 μmol·L-1利福平 (rifampicin, Rif), PMA或4α-PMA (1 nmol·L-1、10 nmol·L-1、100 nmol·L-1) 及空白培养基孵育24 h。采用化学发光仪进行萤火虫荧光素酶和海肾荧光素酶荧光数值测定, 其中空白培养基作为空白对照, Rif组作为阳性对照。每孔的荧光素酶活性值用海肾荧光素酶的活性进行校正, 每个样品孔校正后的荧光素酶活性值 = 萤火虫荧光素酶的活性值 / 海肾荧光素酶的活性值。每一个剂量水平都有3个以上样品量, 空白对照组的荧光素酶活性值作为基础表达, 其他待测组的荧光素酶活性与空白组荧光素酶活性值相比, 以倍数表示荧光素酶表达量的高低。
实时荧光定量PCR实验 选取处于对数生长期的LS174T细胞, 用含10% FBS的RPMI-1640培养液制作成单细胞悬液, 以2×105/cm2的密度接种于 12孔板中, 于培养箱中培养24 h后。分别与PMA (1、10、100 nmol·L-1) 和4α-PMA (100 nmol·L-1) 及空白培养基 (含有1‰ DMSO) 孵育48 h, 按照操作说明书使用Trizol试剂提取总RNA并定量。采用PremeScript RT Reagent Kit试剂盒进行逆转录得到cDNA, 实时荧光定量PCR法检测细胞中P-gp的基因表达水平, 选取GAPDH作为内参对照。P-gp的上游引物: 5'-CCATAGCTCGTGCCCTTGTTAGA-3', P-gp的下游引物: 5'-CCATAGCTCGTGCCCTTGTTAGA-3'; GAPDH上游引物: 5'-GGAGCGAGATCCCTCCAAA AT-3', GAPDH下游引物: 5'-GGCTGTTGTCATACTT CTCATGG-3'。使用SYBR Premix Ex Taq Kit试剂盒按下列条件在PCR扩增仪上进行扩增: 94 ℃×1 min → 95 ℃×30 s, 58 ℃×30 s, 72 ℃×30 s (共45个循环) → 95 ℃×10 s → 65 ℃×45 s → 40 ℃×60 s。采用相对Ct值 (ΔCt) 的方法对P-gp基因的表达进行定量, 以GAPDH为内参, 药物处理细胞后P-gp基因的表达相对于对照组的变化倍数为: 2-ΔΔCt倍[10]。
Western blot检测实验 选取处于对数生长期的LS174T细胞, 用含10% FBS的RPMI-1640培养液制作成单细胞悬液, 以1×106/cm2的密度接种于6孔板中, 于培养箱中培养24 h后。分别与PMA (1、10、100 nmol·L-1) 和4α-PMA (100 nmol·L-1) 及空白培养基 (含有1‰ DMSO) 孵育48 h后, 裂解细胞 4 ℃、20 000 ×g离心30 min得蛋白溶液; NF-κB通路相关蛋白的提取按照细胞浆/核蛋白抽提试剂盒说明书进行。按照BCA Protein Assay Kit试剂盒操作说明书采用BCA法测定蛋白浓度。提取的蛋白溶液与上样缓冲液混合于沸水中煮沸变性10 min后冷却上样。蛋白溶液上样至8% 的SDS-聚丙烯酰胺凝胶, 经70 V电泳浓缩30 min、130 V电泳分离70 min后再经250 mA恒流90 min使蛋白电转至PVDF膜中。PVDF膜浸入含5% 脱脂奶粉的TBST封闭液中, 置于水平摇床上室温震摇孵育2 h。封闭好的PVDF膜与一抗溶液4 ℃孵育过夜后再与二抗溶液室温孵育 1 h。取出PVDF膜, 用1×TBST洗3次, 每次10 min; 蛋白印迹经Engreen ECL发光液显影后放置于ImageQuant LAS4000 mini曝光成像仪中分析[11]。以GAPDH为内参对照, 采用Image J 1.38软件分析定量蛋白印迹信号。
siRNA干扰实验 选取处于对数生长期的LS174T细胞, 用含10% FBS的RPMI-1640培养液制作成单细胞悬液, 以2×105/cm2的密度接种于12 孔板中。细胞在培养箱中培养24 h后, 参照本研究报告基因实验部分进行PKCα siRNA, RelA siRNA 或hPXR siRNA转染, 浓度为50 nmol·L-1, 转染5 h后, 分别与PMA (1、10、100 nmol·L-1) 和4α-PMA (100 nmol·L-1) 及空白培养基 (含有1‰ DMSO) 孵育48 h, 采用上述实时荧光定量PCR和Western blot检测实验的方法考察LS174T细胞中P-gp基因表达及NF-κB通路相关蛋白的表达, 其中空白培养基 (含有1‰ DMSO) 作为空白对照。
数据处理 各实验组数据均以Mean ± S.D.表示, 并根据资料性质分别进行方差分析, 采用SPSS 13.0 统计软件进行单因素方差分析, Dunnett’s两两比较法比较各组之间的统计学差异, P < 0.05表示具有统计学意义。
结果 1 PMA对PXR介导的P-gp转录作用的影响转染后的LS174T细胞与PXR的诱导阳性药物Rif共同孵育24 h后, Rif能显著增加MDR1荧光素酶表达约2.2倍, 证明PXR-MDR1报告基因检测体系成功建立。如图 1所示, 蛋白激酶C激动剂PMA能明显抑制LS174T细胞中PXR介导的MDR1荧光素酶活性; PMA (1~100 nmol·L-1) 与Rif共同给药至转染质粒的LS174T细胞孵育24 h后, 10和100 nmol·L-1 PMA能使LS174T细胞中的MDR1荧光素酶活性分别下降约29.7% 和55.9%。单独将PMA (1~100 nmol·L-1) 与转染质粒的LS174T细胞孵育24 h后, 10和100 nmol·L-1 PMA能使LS174T细胞中的MDR1荧光素酶活性分别下降约62.4% 和65.4%。而阴性对照4α-PMA对MDR1荧光素酶报告基因表达无影响, 提示PKC通路在其中发挥着重要作用。
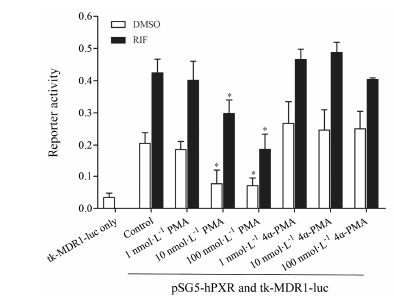
|
Figure 1 Activation of endogenous phorbol ester-dependent PKC signaling induces tk-MDR1-Luc reporter gene activity in LS174T cells. Five hour post-transfection, LS174T cells were treated with the indicated concentrations (nmol·L-1) of PMA (phorbol 12-myristate 13-acetate) or PKC-inactive 4α-PMA in the presence and absence of rifampicin (Rif, 10 μmol·L-1) for 24 h. The data presented are the mean ± S.D. of triplicates (n = 3) and are expressed as reporter gene activity; *P < 0.05 vs Control |
如图 2所示, 蛋白激酶C激动剂PMA能显著降低LS74T细胞中P-gp mRNA表达水平, 与对照组相比, 10与100 nmol·L-1分别可以使P-gp mRNA水平下降46.9% 和57.0% (图 2A); 同时Western blot结果显示PMA可以显著地下调LS74T细胞中P-gp的蛋白表达 (图 2B), 进一步确证了PMA对P-gp表达调控的下调作用。
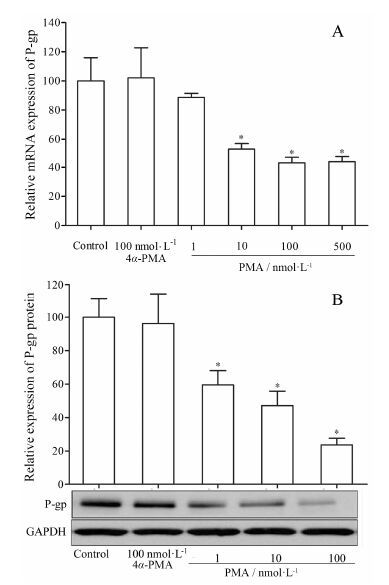
|
Figure 2 The effect of 4α-PMA and PMA on the mRNA expression (A) and protein expression (B) of P-gp in LS174T cell. The cells were treated with vehicle controls (0.1% DMSO); 100 nmol·L-1 4α-PMA; 1, 10, 100, 500 nmol·L-1 PMA for 48 h, respectively. Total RNA and proteins were harvested. P-gp mRNA levels were analyzed by real-time PCR. Proteins were analyzed by Western blot. Expression of tested genes was normalized against that of GAPDH. The effect of PMA on the P-gp expression levels is presented as percentage expression compared to the vehicle group. The data presented are the mean ± S.D. of triplicates (n = 3) ; *P < 0.05 vs Control |
本研究进一步探究PMA对LS174T细胞中NF-κB信号通路的影响。如图 3所示, LS174T细胞与蛋白激酶C激动剂PMA (1~500 nmol·L-1) 孵育48 h后, 能明显检测到p65 (RelA) 蛋白的核转位增加, 提示PMA可以激活NF-κB通路; 同时可以观察到胞浆中p-IκBα水平明显增加, 而IκBα水平剂量依赖性地下降; 实验进一步考察了PMA对NF-κB上游蛋白p-IKKα/β的影响, 结果显示PMA (1~500 nmol·L-1)可以增加胞浆中p-IKKα/β水平。
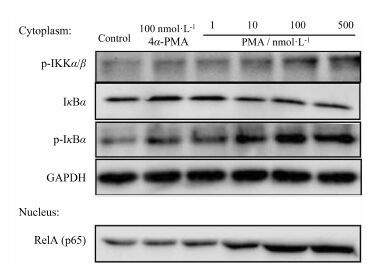
|
Figure 3 Effect of PMA on the NF-κB signaling pathway in LS174T cells. The cells were treated with vehicle control (0.1% DMSO) or PMA at concentrations of 1, 10, 100, 500 nmol·L-1 for 48 h. Cytoplasmic and nuclear extracts were prepared. The levels of NF-κB (p65/RelA) in the nucleus, the phosphorylation of IKKα/β, and the phosphorylation of IκBα and the cytosolic IκBα levels were determined by Western blot. Immunoreactive proteins were visualized using an ECL method. The data that are shown represented three independent experiments |
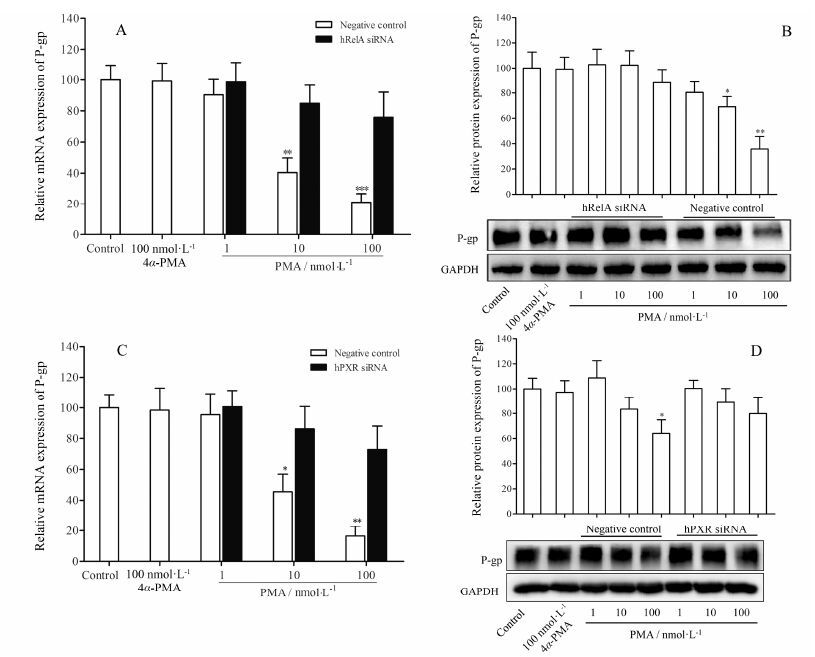
本研究考察干扰PKCα、RelA/p65或PXR后PMA对LS174T细胞中P-gp表达的影响。结果显示干扰PKCα可以消除PMA对P-gp蛋白的下调作用 (图 4A), 同时还发现PMA所致的NF-κB通路的激活作用消失 (图 4B, 4C); 干扰RelA后PMA对P-gp mRNA及蛋白表达的影响如图 5A和图 5B所示, 结果表明干扰RelA可以显著削弱PMA对P-gp mRNA及蛋白的下调作用; 进一步采取hPXR siRNA法确证hPXR在PMA对P-gp的表达调控中的作用, 如图 5C和图 5D所示, 干扰hPXR也可以显著削弱PMA对P-gp mRNA及蛋白的下调作用。
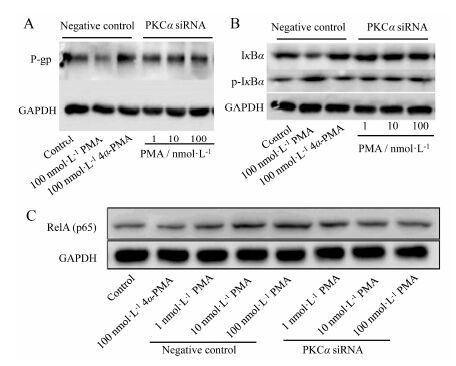
|
Figure 4 The role of PKCα in the regulation of P-gp (A) and NF-κB (B, C) due to activation of the PKC. LS174T cells were transfected with PKCα siRNA for 5 h. The cells were treated with vehicle control (0.1% DMSO); 100 nmol·L-1 4α-PMA; 1, 10 and 100 nmol·L-1 PMA for 48 h, respectively. Proteins were harvested and fractionated through 8% SDS-PAGE, transferred to PVDF filters, and incubated with primary antibodies. Immuno-reactive proteins were visualized using an ECL method |
|
Figure 5 The roles of RelA (A, B) and PXR (C, D) in the regulation of P-gp due to activation of the PKC. LS174T cells were transfected with RelA siRNA or PXR siRNA for 5 h. The cells were treated with vehicle control (0.1% DMSO); 100 nmol·L-1 4α-PMA; 1, 10 and 100 nmol·L-1 PMA for 48 h, respectively. Total RNA and proteins were harvested. P-gp mRNA levels were analyzed by real-time PCR. Proteins were analyzed by Western blot. Expression of tested genes was normalized against that of GAPDH. The effect of PMA on the P-gp expression levels is presented as percentage expression compared to control vehicle-treated cells. The data presented are the mean ± S.D. of triplicates (n = 3) ; *P < 0.05, **P < 0.01, ***P < 0.001 vs Control |
P-gp在药物吸收、药物相互作用和肿瘤的耐药方面扮演着重要角色, 国内关于P-gp调控的研究越来越多, 但这些文献报道均仅限于对P-gp蛋白表达及功能的影响[12-14], 尚未见对P-gp调控的确切分子机制的报道。目前PKC信号途径对P-gp表达、活性的影响及其机制尚不明确, 可能是PKC参与了细胞核内某些基因的表达调控, 其中PKC与核受体 (PXR、CAR等) 的相互作用可能发挥了重要作用。本研究考察PKC/NF-κB-PXR信号途径对LS174T 细胞中P-gp基因表达的调控作用。首先考察了蛋白激酶C激动剂PMA对PXR介导的P-gp转录调节作用, 结果表明PMA不论是否与PXR激动剂Rif共同给药均能显著抑制细胞中的P-gp荧光素酶报告基因表达, 提示PKC的激活可能会进一步影响下游通路从而干扰PXR-RXR异二聚体与P-gp基因序列的上游调节元件的结合, 最终下调P-gp的基因表达; 而阴性对照4α-PMA对P-gp荧光素酶报告基因表达无影响, 提示PKC信号通路在PMA对MDR1荧光素酶报告基因表达调控中发挥关键作用。PXR在P-gp表达调控中的作用的报道也开始见于国内外学者的研究中[15-19], 但尚未见PXR介导的P-gp表达调控在PKC途径对P-gp影响中发挥作用的报道。因此本研究结果为PKC途径对P-gp调控提供了新解释的可能。
基于报告基因实验结果, 本研究进一步考察PMA对LS174T细胞中P-gp mRNA和蛋白表达水平的影响, 结果显示PMA可以显著地下调LS174T细胞中P-gp的mRNA和蛋白表达, 上述结果与报告基因实验结果相一致同时也进一步确证了PMA对P-gp表达的下调作用。有研究表明, PKC可以磷酸化NF-κB的抑制因子IκBα, 随后激活NF-κB 通路, 增强p65的核转位[20, 21], 进而调控下游靶基因的表达。因此本研究继续考察了PMA对LS174T细胞中NF-κB通路的影响, 结果表明PMA能明显增加细胞中p65 (RelA) 蛋白的核转位, 同时观察到胞浆中p-IKKα/β和p-IκBα水平明显增加, 而IκBα水平剂量依赖性地下降, 上述结果提示PMA可以通过磷酸化IKKα/β和IκBα进而激活NF-κB通路; 结合PMA对PXR介导的MDR1荧光素酶报告基因和对细胞中P-gp表达的影响结果, 推测PMA激活PKC信号途径后, 随后激活NF-κB通路, 使得p65的核转位增加, 核内的p65结合至PXR与RXR形成的复合物上, 最终阻碍该复合物与调控序列结合进而下调P-gp的表达。
为深入阐明PKC/NF-κB-PXR信号途径对P-gp表达的调控作用, 本研究采取siRNA干扰法确证PKC、RelA/p65、hPXR在PMA对P-gp的表达调控中的作用。首先利用real-time qPCR和Western blot 技术对以上几种信号分子的siRNA干扰沉默效率进行了考察, 结果显示在将siRNA转染进入细胞的处理时间为5 h, 然后给药孵育48 h的条件下, PKC、RelA/p65、hPXR的干扰效率均非常理想 (结果未显示)。进一步的结果表明干扰PKCα、RelA/p65、hPXR均能显著削弱P MA对P-gp mRNA及蛋白的下调作用, 同时发现干扰PKCα后PMA对NF-κB通路的激活作用消失, 提示PKCα、RelA、hPXR在PMA对P-gp表达的下调作用中发挥至关重要的作用。
综上所述, 本研究证实PKC通路激活后可以进一步通过激活下游NF-κB信号通路下调PXR介导的P-gp基因及蛋白表达。本研究发现了一条调控P-gp基因表达新颖的潜在信号通路(PKC/NF-κB-PXR), 为阐明和完善P-gp基因表达的调控机制提供理论依据, 同时为药物经该途径调控P-gp功能提供科学解释, 进一步为研究P-gp介导的药物相互作用以及耐药性等提供新思路。
| [1] | Higgins CF. ABC transporters:from microorganisms to man[J]. Annu Rev Cell Biol, 1992, 8: 67–113. DOI:10.1146/annurev.cb.08.110192.000435 |
| [2] | Mizuno N, Niwa T, Yotsumoto Y, et al. Impact of drug transporter studies on drug discovery and development[J]. Pharmacol Rev, 2003, 55: 425–461. DOI:10.1124/pr.55.3.1 |
| [3] | Mellorand H, Parker PJ. The extended protein kinase C superfamily[J]. Biochem J, 1998, 332: 281–292. DOI:10.1042/bj3320281 |
| [4] | Li YH, Bi HC, Huang L, et al. Phorbol 12-myristate 13-acetate inhibits P-glycoprotein-mediated efflux of digoxin in MDCKII-MDR1 and Caco-2 cell monolayer models[J]. Acta Pharmacol Sin, 2014, 35: 283–291. DOI:10.1038/aps.2013.157 |
| [5] | Diaz-Meco MT, Moscat J. The atypical PKCs in inflammation:NF-κB and beyond[J]. Immunol Rev, 2012, 246: 154–167. DOI:10.1111/j.1600-065X.2012.01093.x |
| [6] | Meylan E, Dooley AL, Feldser DM, et al. Requirement for NF-κB signalling in a mouse model of lung adenocarcinoma[J]. Nature, 2009, 462: 104–107. DOI:10.1038/nature08462 |
| [7] | Gu X. Role of NF-κB in regulation of PXR-mediated gene expression:a mechanism for the suppression of cytochrome P-4503A4 by proinflammatory agents[J]. J Biol Chem, 2006, 281: 17882–17889. DOI:10.1074/jbc.M601302200 |
| [8] | Holmstock N, Gonzalez FJ, Baes M, et al. PXR/CYP3A4-humanized mice for studying drug-drug interactions involving intestinal P-glycoprotein[J]. Mol Pharm, 2013, 10: 1056–1062. DOI:10.1021/mp300512r |
| [9] | Lichti-Kaiser K, Staudinger JL. The traditional Chinese herbal remedy tian xian activates pregnane X receptor and induces CYP3A gene expression in hepatocytes[J]. Drug Metab Dispos, 2008, 36: 1538–1545. DOI:10.1124/dmd.108.021774 |
| [10] | Huang L, Bi HC, Liu YH, et al. CAR-mediated up-regulation of CYP3A4 expression in LS174T cells by Chinese herbal compounds[J]. Drug Metab Pharmacokinet, 2011, 26: 331–340. DOI:10.2133/dmpk.DMPK-10-RG-115 |
| [11] | Li YH, Bi HC, Zhong GP, et al. Effect of phorbol 12-myristate 13-acetate on function and gene expression of P-glycoprotein in adriamycin-resistant K562/ADM cells[J]. Pharmacology, 2013, 92: 121–130. DOI:10.1159/000353774 |
| [12] | Sun YB, Li GF, Tang ZH, et al. Modulation on the P-glycoprotein in the jejunum by combined use of Glycyrrhiza inflate and Kansui[J]. Acta Pharm Sin (药学学报), 2010, 45: 510–516. |
| [13] | Sun LR, Zhong JL, Cui SX, et al. Modulation of P-glycoprotein activity by the substituted quinoxalinone compound QA3 in adriamycin-resistant K562/A02 cells[J]. Pharmacol Rep, 2010, 62: 333–342. DOI:10.1016/S1734-1140(10)70273-5 |
| [14] | Ferreira MJ, Gyemant N, Madureira AM, et al. Inhibition of P-glycoprotein transport activity in a resistant mouse lymphoma cell line by diterpenic lactones[J]. Anticancer Res, 2005, 25: 3259–3262. |
| [15] | Zhang Y, Lu M, Sun X, et al. Expression and activity of p-glycoprotein elevated by dexamethasone in cultured retinal pigment epithelium involve glucocorticoid receptor and pregnane X receptor[J]. Invest Ophthalmol Vis Sci, 2012, 53: 3508–3515. DOI:10.1167/iovs.11-9337 |
| [16] | Qiang F, Kang KW, Han HK. Repeated dosing of piperine induced gene expression of P-glycoprotein via stimulated pregnane-X-receptor activity and altered pharmacokinetics of diltiazem in rats[J]. Biopharm Drug Dispos, 2012, 33: 446–454. DOI:10.1002/bdd.v33.8 |
| [17] | Rigalli JP, Ruiz ML, Perdomo VG, et al. Pregnane X receptor mediates the induction of P-glycoprotein by spironolactone in HepG2 cells[J]. Toxicology, 2011, 285: 18–24. DOI:10.1016/j.tox.2011.03.015 |
| [18] | Kota BP, Tran VH, Allen J, et al. Characterization of PXR mediated P-glycoprotein regulation in intestinal LS174T cells[J]. Pharmacol Res, 2010, 62: 426–431. DOI:10.1016/j.phrs.2010.07.001 |
| [19] | Harmsen S, Meijerman I, Febus CL, et al. PXR-mediated induction of P-glycoprotein by anticancer drugs in a human colon adenocarcinoma-derived cell line[J]. Cancer Chemother Pharmacol, 2010, 66: 765–771. DOI:10.1007/s00280-009-1221-4 |
| [20] | Ding X, Staudinger JL. Repression of PXR-mediated induction of hepatic CYP3A gene expression by protein kinase C[J]. Biochem Pharmacol, 2005, 69: 867–873. DOI:10.1016/j.bcp.2004.11.025 |
| [21] | Rochette-Egly C. Nuclear receptors:integration of multiple signaling pathways through phosphorylation[J]. Cell Signal, 2003, 15: 355–366. DOI:10.1016/S0898-6568(02)00115-8 |
 2017, Vol. 52
2017, Vol. 52


