2. 珠海澳大科技研究院, 广东 珠海 519080
2. UM Zhuhai Research Institute, Zhuhai 519080, China
阐明肠道菌群与宿主相互作用的方式、物质基础与信号机制是目前临床与基础医学、微生物学等领域共同关注的研究热点。已经知道, 肠道菌群是一个非常庞大、复杂、多样、持续动态变化的微生态系统。它与宿主通过底物的代谢交换与共代谢等方式相互作用, 深刻影响宿主代谢表型, 决定宿主的营养、健康和疾病状态[1]。但是直到最近, 肠道菌群对宿主代谢、处置药物的影响才逐渐被关注和研究。
一些与肠道菌群失调密切相关的疾病, 如糖尿病、肥胖症和炎症性肠病, 同时伴随着药物代谢酶和转运蛋白表达和/或功能的改变[2]。通过对无特定病原体 (SPF) 小鼠和无菌小鼠肝基因表达的对比分析, 发现了112个差异表达基因与药物代谢转运相关的核受体通路抑制功能相关[3]。比较出生1~90天的正常幼鼠及无菌幼鼠的肝脏信使RNA (messenger RNA, mRNA) 转录组, 发现无菌小鼠中异源物代谢相关的基因下调最为明显[4]。孕烷X受体 (pregnane X receptor, PXR) 是调控药物代谢酶及转运体表达和活性的一类重要的核受体。肠道菌产生的吲哚类成分是PXR的天然配体, 能够激活肠上皮细胞PXR, 通过toll样受体4 (toll like receptor 4, TLR4) 介导的信号通路, 调节靶基因表达, 增强肠屏障功能[5]。这些报道为肠道菌群介导宿主药物代谢及转运系统的病理变化提供了间接证据。
肠道药物代谢酶和转运蛋白是肠屏障功能的重要组成部分。细胞色素P450 3A (cytochrome P450 3A, CYP3A) 是一种重要的细胞色素P450酶亚型, 参与多种内源性和外源性物质的代谢, 在肠道和肝脏中含量丰富。CYP3A的活性高低影响许多药物的疗效以及患者对药物毒性的反应。有研究表明, 多种CYP亚型在无菌小鼠体内表达降低, 但定植细菌一段时间后, CYP亚型的表达不再降低, 有些亚型反而升高[6]; 另外, 细菌脂多糖 (lipopolysaccharide, LPS) 也可以下调小鼠肝脏CYP3A的表达[7]。作为肠道最主要的转运蛋白, P-糖蛋白 (P-glycoprotein, P-gp) 不仅影响许多药物的肠道吸收, 也参与体内多种有毒物质的外排, 保护肠上皮细胞免受毒物或代谢废物的损害, 维持细胞内环境的稳定。研究数据表明, 因肠道菌群失衡而产生的多种物质均可影响P-gp的表达, 如细菌诱导肝癌细胞产生的胆汁酸可以直接抑制肝癌细胞P-gp的过度表达与活性[8]; 细菌LPS下调大鼠P-gp活性与mRNA的表达[9]。另一方面, 益生菌嗜酸乳杆菌 (Lactobacilli acidophilus) 或鼠李糖乳酸杆菌 (L. rhamnosus) 的体外培养上清能升高人结肠腺癌细胞Caco-2的P-gp表达及活性[10]。由以上研究结果可以推测, 肠道菌群能够通过释放小分子、蛋白、肽类成分或其他成分调节CYP3A和P-gp的表达。但是, 肠道菌失调是否介导肠道CYP3A和P-gp的表达, 目前尚缺少直接证据, 其效应分子及具体作用机制也有待进一步研究。
溃疡性结肠炎 (ulcerative colitis, UC) 是以肠道菌群失衡和局部免疫失调为特征的慢性炎症性疾病。有研究证实, 革兰阴性菌的改变是引起结肠炎肠道菌群失衡的主要原因[11]。外膜囊泡 (outer-membrane vesicles, OMVs) 是革兰阴性菌分泌的、介导菌群内部通讯以及和宿主传递信号的重要生物活性结构, 包括DNA、RNA、细菌内毒素 (如LPS)、外毒素或细菌蛋白衍生物 (如肠菌抗原) 等, 可以作用于宿主肠道和免疫细胞, 引起肠道黏膜损伤及炎症[12]。研究表明, 绿脓杆菌 (Pseudomonas aeruginosa) 的OMVs可直接与TLR4靶向结合, 诱导肺上皮细胞释放白介素-6和白介素-1β, 激活炎症[13]; 脑膜炎球菌 (Meningococcus) 的OMVs可与TLR4结合, 触发树突状细胞的免疫应答[14]; 大肠埃希菌 (Escherichia coli) 的OMVs可通过TLR4激活核因子κB (nuclear factor-κB, NF-κB) 调控人微血管上皮细胞黏附因子的分泌[15]。由此推断, TLR4可能是OMVs产生生物学效应的主要靶点。
因此, 本研究以葡聚糖硫酸钠 (dextran sulfate sodium, DSS) 诱导大鼠UC, 造成肠道菌群紊乱, 并通过给正常动物同步饲喂正常或UC大鼠粪便, 观察菌群移植对肠CYP3A2和P-gp的影响; 进一步通过比较不同粪菌OMVs及TLR4通路阻断对肠上皮细胞Caco-2表达CYP3A4和P-gp mRNA的影响, 初步探讨肠道菌OMVs调控肠道CYP3A及P-gp的分子机制。
材料与方法主要实验试剂 葡聚糖硫酸钠 (Mr: 36 000~ 50 000) 购自美国MP Biomedicals。细菌DNA抽提试剂盒、SYBR Premix Ex Taq PCR试剂和引物均购自日本TaKaRa公司。Lipofectamine 2000、Trizol和逆转录试剂盒购自Thermo Fisher公司。甘油醛-3-磷酸脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、阴性对照和TLR4的沉默RNA (silence RNA, siRNA) 购自上海吉玛基因公司。瑞沙托维 (resatorvid, TAK-242) 购自美国APEXBIO公司。DMEM、胎牛血清和非必需氨基酸购自美国Gibco公司。
实验动物 24只Sprague-Dawley (SD) 雄性大鼠, SPF级, 体重250~300 g, 由澳门大学实验动物中心提供。在室温 (20 ± 2) ℃, 湿度(50± 5) %, 12 h/ 12 h昼夜交替条件下饲养。所有对动物的处理和操作均通过澳门大学动物伦理委员会的批准 (No.: UMAEC-2015-09) 。
造模方法和样品采集 SD大鼠按体重随机分为4组 (n = 6) 。正常组 (Nor) 大鼠给予去离子水7天, UC组大鼠给予5% DSS溶液7天。每天收集来自Nor和UC组大鼠的粪便, 并按照1 g粪便:10 mL生理盐水的比例分别制备成粪便混悬液, 灌胃 (每公斤体重1 g粪便) 给予正常动物 (粪菌定植NN组, NU组), 连续7天。DSS需每天新鲜配制。每天新鲜收集各组大鼠粪便样品, -80 ℃冻存, 用于菌组成检测。造模第8天, 动物颈椎脱臼处死, 收集十二指肠、空肠、回肠及结肠, 并清除肠道内容物, 用于后续检测。
细菌组成测定 取大鼠粪便样品组内等量混合, 按照文献所示方法[16]制备肠道菌悬液 (0.1 g·mL-1)。细菌总DNA的提取按照试剂盒说明书进行操作。所有DNA样品均设3个复孔, 使用ABI 7500 PCR基因扩增仪进行扩增。所测目标菌名称、相应引物及参考文献见表 1[17-22]。该PCR反应体系为50 μL, 包括: 1×SYBR Green Master Mix 26 μL, 引物各1 μL (终浓度为0.2 μmol·L-1), DNA 4 μL, 灭菌水18 μL。扩增及信号采集程序按照说明书进行设定, 并使用仪器自带软件按照2-△△Ct方法进行数据分析。
| Table 1 Primers for 16S rRNA genes of target bacteria |
细菌OMVs及不同组分的提取 按照上述方法处理第7天各组粪便样品, 获得粪便总菌, 并用Luria-Bertani肉汤培养基混悬菌体至2 mg·mL-1。37 ℃ 孵育24 h后, 6 000 ×g离心20 min收集上清。上清经0.45 m膜过滤后, 4 ℃及150 000 ×g条件下超高速离心3 h[23], 收集沉淀, 并测定蛋白浓度。
分别采用相对分子质量3 000、10 000、30 000、50 000的超滤膜, 参照超滤膜说明书所示的分离条件进行操作, 分离制备细菌OMVs不同组分。所得组分按照相对分子质量分为5组: 小于3 000 (F < 3) 、 3 000~10 000 (F3~10) 、10 000~30 000 (F10~30) 、30 000~50 000 (F30~50) 、大于 > 50 000 (F > 50) 。
Caco-2细胞培养及处理 Caco-2用含10% 胎牛血清、1% 非必需氨基酸、100 u·mL-1青霉素和链霉素的DMEM培养基于37 ℃、5% CO2条件下培养。
细胞于6孔板上长至融合时, 分别用来自4组大鼠的粪便菌OMVs (50 g·mL-1) 或OMVs的不同相对分子质量组分刺激细胞24 h, 或用TAK-242 (1 mol·mL-1) 预处理1 h后再加入来自正常和UC的OMVs (50 g·mL-1) 孵育24 h, 收集所有细胞用于基因扩增检测。
TLR4 siRNA 转染选择与哺乳动物无同源性的序列和GAPDH基因序列分别作为TLR4 siRNA 转染的阴性对照(negative control, NC) 及阳性对照 (positive control, PC)。Caco-2细胞培养至40% 融合后, 用Lipofectamine 2000试剂将5 nmol·mL-1 TLR4 siRNA、NC siRNA 及PC siRNA分别转染细胞并培养48 h。运用real-time quantitation PCR (QPCR) 方法检测siRNA转染前后阴性对照、GAPDH及TLR4相对表达量的变化, 评估方法的可靠性以及TLR4沉默效率。TLR4 siRNA转染序列分别如下: TLR4-770, 上游5'-GCUCACAAUCUUAUCCAAUTT-3', 下游5'-AUUGGAUAAGAUUGUGAGCTT-3'; TLR4-931, 上游5'-CCUGAACCCUAUGAACUUUTT-3', 下游5'-AA AGUUCAUAGGGUUCAGGTT-3'; TLR4-1240, 上游5'-CCUGGUGAGUGUGACUAUUTT-3', 下游5'-AAU AGUCACACUCACCAGGTT-3'; 阴性对照siRNA的转染序列为: 上游5'-UUCUCCGAACGUGUCACGU TT-3', 下游5'-ACGUGACACGUUCGGAGAATT-3'; 阳性对照GAPDH siRNA的转染序列为: 上游5'-UG ACCUCAACUACAUGGUUTT-3', 下游5'-AACCAU GUAGUUGAGGUCATT-3'。
经转染的Caco-2细胞用来自正常和UC大鼠粪便的OMVs (50 g·mL-1) 分别刺激24 h, 按上述方法收集所有细胞用于基因扩增检测。
CYP3A和P-gp在肠组织和细胞中的mRNA表达测定 将来自不同组大鼠的十二指肠、空肠、回肠、结肠或不同方法处理的Caco-2细胞用Trizol试剂裂解, 并按照说明书提取mRNA。根据逆转录试剂盒说明书操作得到互补DNA (complementary DNA, cDNA)。所有cDNA样品均设3个复孔, 使用ABI 7500 PCR基因扩增仪进行扩增。采用的引物及参考文献见表 2[24-27]。扩增及信号采集程序按照说明书进行设定, 并使用仪器自带软件按照2-△△Ct方法进行数据分析。
| Table 2 Primers for target genes in human Caco-2 cells and rats. CYP3A2: Cytochrome P450 3A2; CYP3A4: Cytochrome P450 3A4; P-gp: P-Glycoprotein |
数据统计处理 所有数据均以mean ± SD表示。结果的差异性分析通过GraphPad Prism 6软件及双侧t检验进行计算。P < 0.05时认为结果具有显著性差异。
结果 1 DSS诱导及粪便移植对大鼠粪便菌组成的影响如图 1所示, 实验期间, 正常组大鼠总菌量相对稳定, DSS诱导的UC组及定植正常及UC粪菌组的总菌量较正常组没有明显改变。UC组大鼠粪菌中双歧杆菌属 (Bifidobacterium)、乳杆菌属 (Lactobacillus)、柔嫩梭菌 (Clostridium leptum) 和球形梭菌 (Clos-tridium coccoides) 的相对比例均持续减少, 而肠杆菌科 (Enterobacteriacea) 和拟杆菌属 (Bacteroides) 的比例持续升高。定植正常大鼠的粪菌后, NN组双歧杆菌属和乳杆菌属显著减少, 肠杆菌科和拟杆菌属没有明显变化, 优势菌属梭菌属, 尤其是球形梭菌比例明显升高。而定植UC粪菌的NU组, 双歧杆菌属和乳杆菌属明显减少, 实验后期肠杆菌科和拟杆菌属的比例增加, 但变化程度弱于UC; 柔嫩梭菌和球形梭菌的变化趋势与NN组相似, 即两菌的比例均都接近或高于正常组。以上结果表明, DSS诱导大鼠UC, 引起肠道菌群失调, 定植正常及失调的粪菌后, 引起受体动物体内肠道菌群组成发生改变。
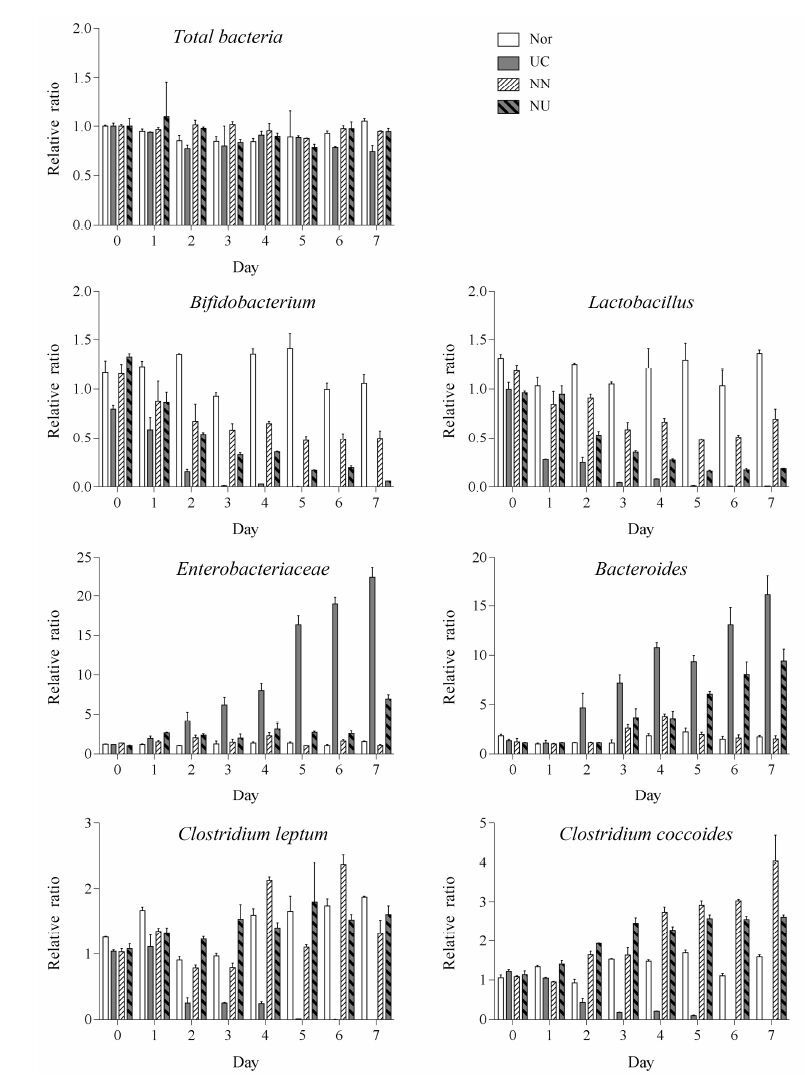
|
Figure 1 Alterations of total and six main bacteria in fecal samples from normal and ulcerative colitis (UC) rats, and rats receiving normal or UC rat feces. mRNA levels were measured by QPCR. Animals received water (Nor), 5% DSS (UC), feces from normal (NN) or ulcerative colitis rats (NU), respectively, for 7 days. Data were expressed as mean ± SD of triplicate determinations. The relative level of each bacterium at each time point was obtained by comparing with the level of the same group on day 0 |
如图 2所示, 在十二指肠、空肠、回肠和结肠中, CYP3A2和P-gp的表达呈现相同的变化趋势, 即UC组中的表达较正常组显著降低, 在定植来自正常组大鼠的粪菌后, 两者的表达均没有明显变化, 而定植来自UC组大鼠的粪菌后, CYP3A2和P-gp的表达显著降低, 与NN组相比有显著性差异, 但强度较UC组弱。以上结果表明, DSS诱导大鼠UC, 导致CYP3A2和P-gp变化, 而定植失调的菌群可以造成小肠和结肠中CYP3A2和P-gp的表达下调。

|
Figure 2 mRNA expression of CYP3A2 and P-gp in different intestinal segments of rats. mRNA expression was measured by QPCR. Data were expressed as mean ± SD (n = 6) . *P < 0.05 vs Nor; #P < 0.05 vs NN |
肠道菌OMVs对Caco-2细胞表达CYP3A4及P-gp mRNA的影响见图 3。正常组的粪菌OMVs与Caco-2细胞共孵能显著下调细胞中CYP3A4和P-gp的表达, 而UCOMVs处理组两者的表达变化较正常组均有显著性降低; 接受正常动物粪便组其肠道菌OMVs (NNOMVs) 对CYP3As和P-gp的下调作用程度与正常组类似, 而接受UC动物粪便组其肠道菌OMVs (NUOMVs) 的作用强于NNOMVs。以上结果表明, 肠道菌OMVs可降低肠CYP3A4和P-gp的表达, DSS诱导或移植失调的菌群能够进一步加强下调, 导致肠屏障降低。
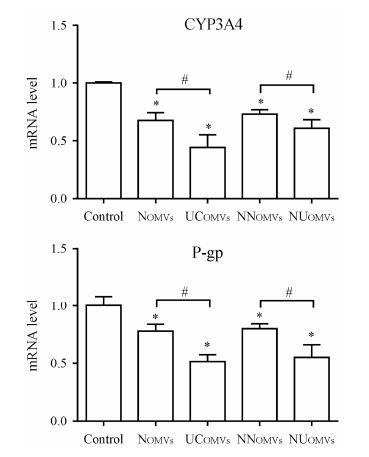
|
Figure 3 Effects of rat OMVs on mRNA expression of CYP3A4 and P-gp in Caco-2 cells. Cells were treated by OMVs from normal (NOMVs) and UC (UCOMVs) rats, and rats receiving normal (NNOMVs) or UC (NUOMVs) rat feces, respectively. mRNA expression was measured by QPCR. Data were expressed as mean ± SD of triplicate determination of one representative experiment. *P < 0.05 vs control; #P < 0.05 vs NOMVs or NNOMVs |
采用超滤法将正常及UC组大鼠肠道菌OMVs分成相对分子质量不同范围的5个组分 (F<3、F3~10、F10~30、F30~50和F>50) 。如图 4所示, 两组中小于相对分子质量3 000的组分对Caco-2细胞CYP3A4和P-gp mRNA的表达均无明显影响。与control相比, 正常粪菌OMVs的相对分子质量10 000~50 000组分(F10~30和F30~50) 均显著下调CYP3A4和P-gp的表达, 而大于相对分子质量50 000的组分对P-gp也有显著抑制; 而UC粪菌的OMVs中大于相对分子质量3 000的不同组分对CYP3A4和P-gp均有不同程度的显著抑制, 其中相对分子质量30 000~ 50 000的组分对CYP3A4的抑制作用最强; UC组OMVs各组分的作用强度均显著强于正常OMVs的相应组分。
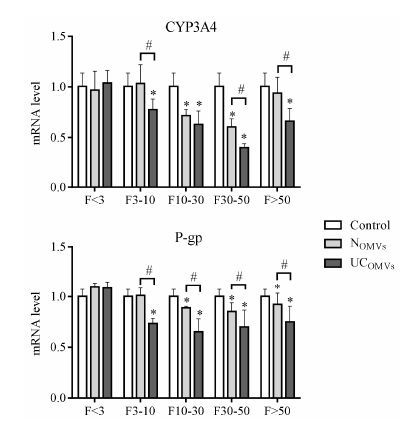
|
Figure 4 Effects of OMVs different fractions on mRNA expression of CYP3A4 and P-gp in Caco-2 cells. Cells were treated with or without different OMVs fractions from normal or UC rats. mRNA expression was measured by QPCR. Data were expressed as mean ± SD of triplicate determination of one representative experiment. *P < 0.05 vs control; #P < 0.05 vs NOMVs |
如图 5所示, 转染TLR4 siRNA或GAPDH siRNA (PC组) 后, Caco-2细胞内TLR4或GAPDH mRNA表达显著降低, 抑制效率可达98% 以上, 说明基因转染和转染后基因表达检测的方法是合理可靠的; NC 组与control相比无显著性差异, 表明实验中所使用的TLR4 siRNA序列可高效并特异性地抑制TLR4表达。

|
Figure 5 Effects of TLR4 siRNA transfection on TLR4 mRNA expression in Caco-2 cells. Cells were transfected with TLR4 siRNA for 48 h. Cells treated with negative siRNA (NC) or GAPDH siRNA (PC) were processed in parallel to serve as controls. mRNA expression was determined by QPCR. Data was expressed as mean ± SD of triplicate determination of one representative experiment. *P < 0.05 vs control, #P < 0.05 vs NC. TLR4: Toll like receptor 4; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
如图 6A所示, 用TLR4抑制剂TAK-242处理Caco-2细胞能阻断正常组及UC组OMVs对CYP3A4和P-gp mRNA的下调, 两者的表达恢复至control组水平。同样地, 用TLR4 siRNA沉默Caco-2细胞中TLR4基因, 能够抑制OMVs对CYP3A4和P-gp的下调, 使CYP3A4和P-gp的表达恢复到control组水平; 而阴性siRNA处理后CYP3A4和P-gp的表达与control相比无显著性差异, 表明CYP3A4和P-gp的改变不受非特异性因素的干扰 (图 6B)。以上结果表明, OMVs通过激活TLR4受体通路调控Caco-2细胞CYP3A4和P-gp的mRNA表达。
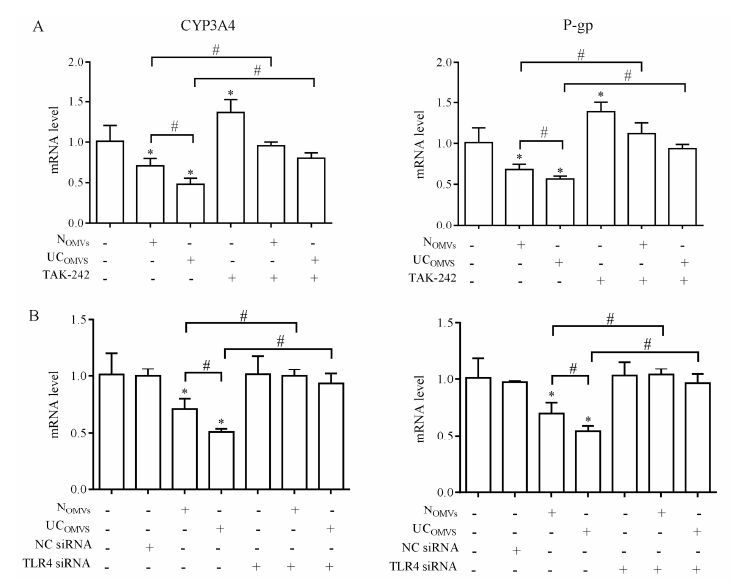
|
Figure 6 Effects of TLR4 inhibitor and siRNA transfection on mRNA expression of CYP3A4 and P-gp in Caco-2 cells. Cells were treated with TLR4 inhibitor (A), transfected with TLR4 or negative siRNA (NC) (B) followed by treatment of OMVs from normal or UC rats. mRNA expression was determined by QPCR. Data were expressed as mean ± SD of triplicate determination of one representative experiment. *P < 0.05 vs control; #P < 0.05 vs NOMVs or UCOMVs. TAK-242: Resatorvid |
随着人们对肠道菌群的深入了解, 其在宿主药物代谢和转运中的作用也受到越来越多的关注。本研究首次利用DSS诱导的大鼠溃疡性结肠炎模型结合粪便移植, 探讨肠道菌群失衡对肠道CYP3A以及P-糖蛋白的影响以及主要调节机制。研究发现: DSS诱导引起大鼠小肠和结肠中CYP3A和P-gp下调, 同时伴随肠道菌群组成的改变, UC粪菌移植至健康大鼠可引起相似的变化; 正常和结肠炎大鼠来源的粪菌OMVs均可下调Caco-2细胞CYP3A和P-gp的表达, 来自结肠炎大鼠的OMVs作用更为明显; 不同分子质量的粪菌OMVs组分可差异性地引起CYP3A和P-gp的改变; 抑制TLR4活化可以阻断OMVs对Caco-2细胞CYP3A和P-gp的下调。以上研究证实了肠道菌群失衡对肠道药物代谢和转运系统的影响, 揭示了部分调控机制。这对于调节肠道菌群的平衡以维持肠道屏障功能和提高药物疗效具有重要意义。
肠道菌群平衡对维持肠黏膜免疫屏障功能具有重要的作用。菌群失调可激活肠道免疫细胞, 释放大量炎性因子[28], 引起炎症, 影响宿主多种靶基因的转录和表达。溃疡性结肠炎是以肠道菌群失衡和局部免疫失调为特征的慢性炎症性疾病。大量研究证实, UC状态下可导致肠道菌群失衡, 细菌代谢网路发生改变。本研究选取文献报道的与UC病理紧密相关或显著变化的6个代表性肠道菌, 检测其在DSS诱导后的动态变化, 发现它们的变化与Rooks等[29]对炎症性肠病患者肠道菌群的研究结果相一致。
粪菌移植旨在通过将健康人粪便中的功能菌群移植到患者肠道内, 调节肠道菌群平衡, 重建正常的肠道微生态系统, 从而治疗或改善疾病。目前, 粪菌移植在临床治疗伪膜性肠炎、慢性便秘、炎症性肠病和肠易激综合征, 尤其是艰难梭菌感染方面已取得明显疗效[30]。此外, 粪菌移植技术是研究肠道菌群和疾病关系以及相关机制的有效手段, 在基础研究领域也有越来越多的应用[31]。本研究采用将对照组及UC组粪便同步饲喂正常动物的方式, 观察粪菌移植后是否会引起大鼠肠道菌群失调以及肠道CYP3A和P-gp表达的变化。结果表明, 移植UC粪菌后可引起受体动物产生类似UC的肠道菌组成的改变, 肠杆菌科和拟杆菌属增加, 乳杆菌属和双歧杆菌属减少, 这些变化与结肠炎临床研究的结果相吻合[32]。研究报道, 肠道优势菌柔嫩梭菌和球形梭菌在结肠炎患者中数量减少[33], 而在本研究中两者尤其是球形梭菌在接受正常菌及UC菌的动物肠道中呈增加的趋势。这可能是健康动物在接受异体菌移植后反馈性地通过调整优势菌的数量来维持自身的菌群平衡。
本研究中DSS诱导的UC大鼠小肠CYP3A2和P-gp的mRNA显著下调, 这与结肠炎小鼠小肠中两者的变化一致[2]; 还发现CYP3A2和P-gp在结肠下调更为显著, 这可能是由于肠道菌主要定植在结肠, 因而对结肠黏膜的损伤更为严重。移植正常动物的菌群对受体动物肠道CYP3A和P-gp的mRNA表达没有明显影响, 而UC粪菌移植造成肠道CYP3A2和P-gp的显著下调, 表明DSS诱导造成的菌群失衡是UC肠道CYP3A和P-gp下调的主要原因。
Vigsnaes等[11]通过比较结肠炎患者和健康人的粪便细菌组成, 发现二者最主要的差异为革兰阴性菌的数量。作者首次采用将革兰阴性菌OMVs与Caco-2细胞共孵的方法研究肠道菌对肠CYP3A和P-gp的调控, 发现正常及UC组粪菌OMVs对Caco-2细胞CYP3A4和P-gp均有下调作用, 这与体内研究中仅移植UC粪菌组能引起两者下调的结果不一致。此外, UC粪菌移植组OMVs的下调作用弱于UC组OMVs的作用。导致上述结果的可能原因如下: ① 体内有除肠道菌以外的其他因素参与肠道CYP3A和P-gp的调控; ② 粪菌移植后机体整体发生反馈性调节, 启动代偿机制。
有报道表明, LPS能够调节小鼠CYP3A和大鼠P-gp的表达和活性[7, 9], 细菌合成的石胆酸盐也可参与对小鼠CYP3A的调控[34]。本研究尝试通过比较正常和UC粪菌OMVs不同分子质量组分的作用寻 找调控肠道CYP3A4和P-gp的主要效应分子, 发现相对分子质量大于10 000和3 000的正常和UC粪菌OMVs组分分别下调CYP3A4和P-gp, 相对分子质量处于30 000~50 000之间的组分作用最为显著, 正常与UC组OMVs作用的差别也最为明显。这可能是DSS诱导UC引起肠道菌群中革兰阴性菌的组成及相对丰度变化所致。相应地, 在本研究中观察到DSS诱导的UC大鼠革兰阴性菌肠杆菌科和拟杆菌属的相对比例明显升高。这两种菌是否是介导OMVs调控肠CYP3A和P-gp的主要肠道菌还有待进一步研究。由于肠道菌群组成的复杂性以及分析技术的限制, 本研究未能对正常和UC粪菌OMVs的主要差异性成分作进一步分析。
CYP3A和P-gp的转录受核受体如PXR[35]的调控。TLRs是模式识别受体家族中一类重要的受体, 能够激活丝裂原活化蛋白激酶 (mitogen-activated protein kinase, MAPK) 等炎症相关的信号通路, 活化NF-kB, 调节PXR等表达[36]。作为革兰阴性细菌脂多糖的重要结合配体, TLR4可能介导了UC大鼠OMVs对肠CYP3A和P-gp的下调。本研究采用化学抑制和基因沉默两种方法抑制或阻断TLR4活化, 发现OMVs下调CYP3A和P-gp的作用被阻断, 证实了UC肠道菌群部分通过TLR4受体通路下调肠CYP3A和P-gp。
综上, 本研究通过体内菌群移植结合体外Caco-2细胞研究, 证实肠道菌可通过释放OMVs, 激活TLR4受体通路, 下调肠道CYP3A和P-gp的表达。本研究为阐明肠道菌平衡对维持肠屏障和药物治疗的重要性提供重要数据, 为发现肠道菌群失调相关疾病的治疗靶标及合理用药研究提供新思路。
| [1] | Marchesi JR, Adams DH, Fava F, et al. The gut microbiota and host health:a new clinical frontier[J]. Gut, 2016, 65: 330–339. DOI:10.1136/gutjnl-2015-309990 |
| [2] | Kawauchi S, Nakamura T, Miki I, et al. Downregulation of CYP3A and P-glycoprotein in the secondary inflammatory response of mice with dextran sulfate sodium-induced colitis and its contribution to cyclosporine A blood concentrations[J]. J Pharmacol Sci, 2014, 124: 180–191. DOI:10.1254/jphs.13141FP |
| [3] | Bjorkholm B, Bok CM, Lundin A, et al. Intestinal microbiota regulate xenobiotic metabolism in the liver[J]. PLoS One, 2009, 4: e6958. DOI:10.1371/journal.pone.0006958 |
| [4] | Selwyn FP, Cheng SL, Bammler TK, et al. Developmental regulation of drug-processing genes in livers of germ-free mice[J]. Toxicol Sci, 2015, 147: 84–103. DOI:10.1093/toxsci/kfv110 |
| [5] | Venkatesh M, Mukherjee S, Wang H, et al. Symbiotic bacterial metabolites regulate gastrointestinal barrier function via the xenobiotic sensor PXR and Toll-like receptor 4[J]. Immunity, 2014, 41: 296–310. DOI:10.1016/j.immuni.2014.06.014 |
| [6] | Claus SP, Ellero SL, Berger B, et al. Colonization-induced host-gut microbial metabolic interaction[J]. MBio, 2011, 2: e00271–10. |
| [7] | Gandhi AS, Guo T, Shah P, et al. CYP3A-dependent drug metabolism is reduced in bacterial inflammation in mice[J]. Br J Pharmacol, 2012, 166: 2176–2187. DOI:10.1111/j.1476-5381.2012.01933.x |
| [8] | Komori Y, Arisawa S, Takai M, et al. Ursodeoxycholic acid inhibits overexpression of P-glycoprotein induced by doxorubicin in HepG2 cells[J]. Eur J Pharmacol, 2014, 724: 161–167. DOI:10.1016/j.ejphar.2013.12.023 |
| [9] | Tomita M, Takizawa Y, Kanbayashi A, et al. Suppression of efflux transporters in the intestines of endotoxin-treated rats[J]. Int J Pharm, 2012, 428: 33–38. DOI:10.1016/j.ijpharm.2012.02.027 |
| [10] | Saksena S, Goyal S, Raheja G, et al. Upregulation of P-glycoprotein by probiotics in intestinal epithelial cells and in the dextran sulfate sodium model of colitis in mice[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 300: G1115–G1123. DOI:10.1152/ajpgi.00027.2011 |
| [11] | Vigsnaes LK, Brynskov J, Steenholdt C, et al. Gram-negative bacteria account for main differences between faecal microbiota from patients with ulcerative colitis and healthy controls[J]. Benef Microbes, 2012, 3: 287–297. DOI:10.3920/BM2012.0018 |
| [12] | Kaparakis-Liaskos M, Ferrero RL. Immune modulation by bacterial outer membrane vesicles[J]. Nat Rev Immunol, 2015, 15: 375–387. DOI:10.1038/nri3837 |
| [13] | Zhao K, Deng X, He C, et al. Pseudomonas aeruginosa outer membrane vesicles modulate host immune responses by targeting the toll-like receptor 4 signaling pathway[J]. Infect Immun, 2013, 81: 4509–4518. DOI:10.1128/IAI.01008-13 |
| [14] | Zariri A, Beskers J, van de Waterbeemd B, et al. Meningococcal outer membrane vesicle composition-dependent activetion of the innate immune response[J]. Infect Immun, 2016, 84: 3024–3033. DOI:10.1128/IAI.00635-16 |
| [15] | Kim JH, Yoon YJ, Lee J, et al. Outer membrane vesicles derived from Escherichia coli up-regulate expression of endothelial cell adhesion molecules in vitro and in vivo[J]. PLoS One, 2013, 8: e59276. DOI:10.1371/journal.pone.0059276 |
| [16] | Ben-Amor K, Heilig H, Smidt H, et al. Genetic diversity of viable, injured, and dead fecal bacteria assessed by fluorescence-activated cell sorting and 16S rRNA gene analysis[J]. Appl Environ Microbiol, 2005, 71: 4679–4689. DOI:10.1128/AEM.71.8.4679-4689.2005 |
| [17] | Matsuki T, Watanabe K, Fujimoto J, et al. Development of 16S rRNA-gene-targeted group-specific primers for the detection and identification of predominant bacteria in human feces[J]. Appl Environ Microbiol, 2002, 68: 5445–5451. DOI:10.1128/AEM.68.11.5445-5451.2002 |
| [18] | Bartosch S, Fite A, Macfarlane GT, et al. Characterization of bacterial communities in feces from healthy elderly volunteers and hospitalized elderly patients by using real-time PCR and effects of antibiotic treatment on the fecal microbiota[J]. Appl Environ Microbiol, 2004, 70: 3575–3581. DOI:10.1128/AEM.70.6.3575-3581.2004 |
| [19] | Conte MP, Schippa S, Zamboni I, et al. Gut-associated bacterial microbiota in paediatric patients with inflammatory bowel disease[J]. Gut, 2006, 55: 1760–1767. DOI:10.1136/gut.2005.078824 |
| [20] | Byun R, Nadkarni MA, Chhour KL, et al. Quantitative analysis of diverse Lactobacillus species present in advanced dental caries[J]. J Clin Microbiol, 2004, 42: 3128–3136. DOI:10.1128/JCM.42.7.3128-3136.2004 |
| [21] | Matsuki T, Watanabe K, Fujimoto J, et al. Use of 16S rRNA gene-targeted group-specific primers for real-time PCR analysis of predominant bacteria in human feces[J]. Appl Environ Microbiol, 2004, 70: 7220–7228. DOI:10.1128/AEM.70.12.7220-7228.2004 |
| [22] | Muhling M, Woolven-Allen J, Murrell JC, et al. Improved group-specific PCR primers for denaturing gradient gel electrophoresis analysis of the genetic diversity of complex microbial communities[J]. ISME J, 2008, 2: 379–392. DOI:10.1038/ismej.2007.97 |
| [23] | Park KS, Lee J, Jang SC, et al. Pulmonary inflammation induced by bacteria-free outer membrane vesicles from Pseudomonas aeruginosa[J]. Am J Respir Cell Mol Biol, 2013, 49: 637–645. DOI:10.1165/rcmb.2012-0370OC |
| [24] | Aiba T, Susa M, Fukumori S, et al. The effects of culture conditions on CYP3A4 and MDR1 mRNA induction by 1α, 25-dihydroxyvitamin D3 in human intestinal cell lines, Caco-2 and LS180[J]. Drug Metab Pharmacokinet, 2005, 20: 268–274. DOI:10.2133/dmpk.20.268 |
| [25] | Zhang Y, Li Y, Li Q. Inhibition of cytochrome P4503A in rat liver by the diorganotin (IV) compound di-n-butyl-di-(4-chlorobenzo-hydroxamato)tin (IV) and its probable mechanism[J]. Molecules, 2012, 17: 10994–11009. DOI:10.3390/molecules170910994 |
| [26] | Chisaki I, Kobayashi M, Itagaki S, et al. Liver X receptor regulates expression of MRP2 but not that of MDR1 and BCRP in the liver[J]. Biochim Biophys Acta, 2009, 1788: 2396–2403. DOI:10.1016/j.bbamem.2009.08.014 |
| [27] | Liu H, Wu B, Pan G, et al. Metabolism and pharmacokinetics of mangiferin in conventional rats, pseudo-germ-free rats, and streptozotocin-induced diabetic rats[J]. Drug Metab Dispos, 2012, 40: 2109–2118. DOI:10.1124/dmd.112.045849 |
| [28] | Round JL, Mazmanian SK. The gut microbiota shapes intestinal immune responses during health and disease[J]. Nat Rev Immunol, 2009, 9: 313–323. DOI:10.1038/nri2515 |
| [29] | Rooks MG, Veiga P, Wardwell-Scott LH, et al. Gut microbiome composition and function in experimental colitis during active disease and treatment-induced remission[J]. ISME J, 2014, 8: 1403–1417. DOI:10.1038/ismej.2014.3 |
| [30] | van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile[J]. N Engl J Med, 2013, 368: 407–415. DOI:10.1056/NEJMoa1205037 |
| [31] | Borody TJ, Paramsothy S, Agrawal G. Fecal microbiota transplantation:indications, methods, evidence, and future directions[J]. Curr Gastroenterol Rep, 2013, 15: 337. DOI:10.1007/s11894-013-0337-1 |
| [32] | Baek SJ, Kim SH, Lee CK, et al. Relationship between the severity of diversion colitis and the composition of colonic bacteria:a prospective study[J]. Gut Liver, 2014, 8: 6. |
| [33] | Bullock NR, Booth JC, Gibson GR. Comparative composition of bacteria in the human intestinal microflora during remission and active ulcerative colitis[J]. Curr Issues Intest Microbiol, 2004, 5: 59–64. |
| [34] | Toda T, Ohi K, Kudo T, et al. Antibiotics suppress CYP3A in the mouse liver by reducing lithocholic acid-producing intestinal flora[J]. J Pharm Soc Jpn, 2009, 129: 601–608. |
| [35] | Cerveny L, Svecova L, Anzenbacherova E, et al. Valproic acid induces CYP3A4 and MDR1 gene expression by activetion of constitutive androstane receptor and pregnane X receptor pathways[J]. Drug Metab Dispos, 2007, 35: 1032–1041. DOI:10.1124/dmd.106.014456 |
| [36] | Pascussi JM, Vilarem MJ. Inflammation and drug metabolism:NF-kB and the CAR and PXR xeno-receptors[J]. Med Sci (Paris), 2008, 24: 301–305. DOI:10.1051/medsci/2008243301 |
 2017, Vol. 52
2017, Vol. 52


