随着生活方式和社会心理环境的改变, 抑郁症在世界范围内的发病率逐年增加。然而, 一直以来临床抑郁症的防治缺乏快速及长期有效的干预策略, 并且据估计约有30%~50% 抑郁患者对现有抗抑郁药物不敏感[1]。心理社会因素、遗传因素和环境因素共同参与了抑郁症的发病和进展, 但是目前其中的核心病理环节仍不清晰。2002年左右, 临床上干扰素α等免疫调节剂诱发精神异常和抑郁样行为的现象引起了研究者对于细胞因子行为调节作用的关注, 也开启了炎症与抑郁症相关性研究的序幕[2, 3]。近十年来, 基础和临床研究已充分确证了炎症失调在抑郁症等精神疾病中的作用[4]。2013年美国精神病学会已将炎症指标列入到最新的抑郁症诊断指南中[5]。深入研究抑郁症中炎症反应的调控因素和干预策略已成为重要的方向。
抑郁症中的炎症反应失调涉及到全身多个系统的相互作用, 体现了其“心身共病”的特征[6]。近年来, 基础和临床研究均提示免疫调控异常是抑郁症炎症反应失调的重要基础, 与抑郁相关的神经生化反应、精神行为和躯体症状等指标密切相关。在这些病理网络事件中, 以“神经-免疫-代谢”互动异常为核心的中枢-外周对话是抑郁相关炎症免疫机制紊乱的重要基础 (图 1) 。抑郁症中免疫代谢调节异常为抗抑郁药物作用靶点和机制的研究提供了新视角, 对于探讨创新的抑郁症干预策略有着重要启示。
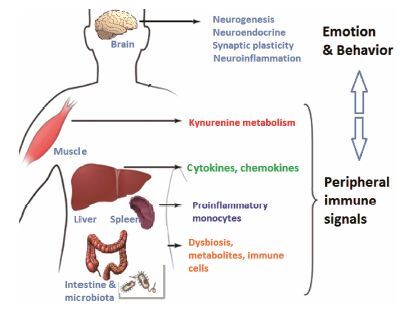
|
Figure 1 Close coupling of emotion, behavior with the periph-eral immune and metabolic signals through bidirectional brain-periphery communications |
中枢免疫微环境是影响神经发育和功能的重要因素。研究表明, 小胶质细胞参与到中枢免疫失调下突触可塑性障碍和神经递质代谢紊乱等过程, 是慢性精神心理应激等诱导抑郁样行为的重要机制[7]。胶质细胞-神经元相互作用的紊乱是精神情绪异常的重要基础, 并可增加中枢对于后续刺激的敏感性[8]。中枢代谢环境的改变是影响小胶质细胞等免疫调节细胞的重要因素。应激状态下, 糖皮质激素、谷氨酸和ATP等内源性物质水平出现变化, 引发胶质细胞形态改变和功能异常, 最终导致区域性炎症信号的过度激活和突触功能的异常。例如, 在慢性社交应激小鼠中的研究表明, 抑郁敏感小鼠脑内星形胶质细胞释放的ATP水平显著降低, 而特异性增加星形胶质细胞的ATP释放或者外源性给予ATP均可缓解相应的抑郁样行为[9]。
近年研究发现, 外周免疫细胞与脑内胶质细胞的相互作用同样参与到中枢炎症反应和行为情绪的调控。例如, Wohleb等[10, 11]发现对小鼠进行慢性社交应激后, 脾脏的Ly6Chi单核细胞向中枢的浸润会促进小胶质细胞活化并加重焦虑等行为, 而阻断该浸润过程可以显著缓解相关抑郁样行为。在应激相关小鼠抑郁模型中, 阻断外周调节性T细胞 (Treg) 可加重抑郁样行为以及细胞因子水平和单胺能神经功能的紊乱[12]。最近有学者[13]提出Th17细胞可能通过激活小胶质细胞、破坏血脑屏障功能等途径参与抑郁行为的调节。以上研究结果共同说明了神经-免疫系统互动的异常是导致应激等状态下中枢免疫稳态失衡、促进抑郁发生发展的重要途径。
1.2 循环系统炎症/免疫指标异常大量临床研究表明,抑郁病人外周血中常常出现粒细胞、单核细胞等免疫细胞比例的升高, 以及白细胞介素-6 (IL-6) , 肿瘤坏死因子-α (TNF-α), C反应蛋白 (CRP) 等水平上调[14]; 而在接受三环类抗抑郁药治疗的部分患者中可观察到血液中IL-6水平明显下降, 进一步证实了外周免疫系统与抑郁行为的密切联系[15]。最近一项临床研究发现, 在正常志愿者中诱导悲伤情绪可升高血液白介素-18(IL-18) 水平, 在抑郁症志愿者中这种作用更为明显[16]。精神情绪状态与外周免疫系统的互动机制, 引发了研究者的探索。目前, 下丘脑-垂体-肾上腺轴的活化被认为是压力等情绪因素调节外周免疫系统的主要途径。研究发现, 精神应激因素可以通过糖皮质激素、肾上腺素受体等调节免疫细胞的表型和应答功能。例如, 抑郁患者外周皮质酮水平显著升高, Th17细胞、Treg细胞和自然杀伤细胞构成比例的改变及细胞因子分泌功能的异常, 与单核细胞的高度活化状态相关[17]。最近一项基于慢性社交应激小鼠模型的研究发现, 应激前血液循环中的单核细胞数与小鼠对精神应激的敏感性相关; 敏感小鼠实验前具有更高的单核细胞比例, 且单核细胞刺激后释放出更多的IL-6[18]。
1.3 外周器官/组织区域性免疫调节异常抑郁患者同时罹患肿瘤、心脑血管疾病、2型糖尿病和肠炎的风险显著增加。这些抑郁共病现象提高了临床诊治的复杂性, 也进一步提示外周器官、组织区域性的免疫调节异常在抑郁发生、发展和复发中的重要作用。抑郁症患者常出现胃肠功能的异常 (如胃肠动力异常、便秘、慢性肠炎), 而胃肠道疾病患者也常可表现出抑郁样行为[19]。“肠道菌群-肠-脑轴”介导的脑肠互动是关联抑郁行为与胃肠功能异常的重要途径。慢性精神应激等因素可导致肠道黏膜免疫屏障功能的失调, 例如上皮细胞屏障的破坏[20]、Treg细胞分化和树突状细胞分泌谱的改变[21]、肠道微生态的失衡和代谢谱的改变[22, 23]。这些局部的免疫调节作用可能进一步影响系统性炎症反应和循环免疫细胞的功能, 从而对远端的组织 (如大脑) 产生影响。其中, 肠道菌群通过代谢产物、免疫细胞和迷走神经等途径调控神经精神症状是近年的研究热点[24]。例如, 移植肥胖小鼠的肠道菌群至正常无菌小鼠中可以直接引起抑郁样行为、肠道屏障功能的破坏、系统性炎症反应及神经炎症反应[25]。与此一致的是, 临床抑郁病人粪便菌群中硬壁菌门 (Firmicutes)、拟杆菌门 (Bacteroidetes) 和放线菌门 (Actinobacteria) 细菌的比例出现明显变化, 将以上菌群移植到无菌小鼠体内可诱导抑郁行为和氨基酸代谢的改变[26]。慢性精神应激还可以影响脾脏的免疫环境, 从而通过免疫细胞的中枢浸润参与到抑郁等行为的调节。Wohleb等[11]研究发现, 小鼠接受社交应激后脾脏可以成为活化状态单核细胞的储库; 24天后, 低强度的应激可以通过交感神经促进Ly6Chi单核细胞从脾脏的迁移, 而脾切除后可明显缓解相关焦虑行为。
2 抗抑郁药物的免疫代谢调节作用 2.1 经典抗抑郁药的免疫调节作用三环类抗抑郁药是基于调控突触间隙肾上腺素和五羟色胺水平而研发的一类药物。随着神经免疫研究的深入,经典抗抑郁药物的免疫调节作用引起了研究者的兴趣。近年来, 氟西汀 (fluoxetine)、米帕明 (imipramine) 对抑郁模型动物中枢和外周炎症调节作用陆续得到报道, 如小胶质细胞表型转变、T细胞增殖和分泌功能、血清IL-6水平[27-29]。在临床治疗中, 也有报道氟西汀等药物调节抑郁患者外周血液中的炎症、免疫指标。此外, 抗焦虑药劳拉西泮和氯硝西泮可改善慢性社交应激小鼠焦虑和抑郁行为, 增加中枢γ-氨基丁酸 (GABA) 能神经活性的同时, 还具有神经免疫调节作用, 包括抑制应激诱导的血浆IL-6水平上升, 循环单核细胞和粒细胞的迁移以及巨噬细胞的中枢浸润[30]。近年研究还发现某些临床抗抑郁药可缓解慢性疼痛、肿瘤等相关炎性疾病, 进一步证明了该类药物的免疫调节作用[31]。以上研究进展揭示了经典抗抑郁药的免疫调控新特点, 后续研究有望发现抑郁及相关疾病的干预靶点或策略。
2.2 色氨酸-犬尿氨酸代谢调控与免疫色氨酸-犬尿氨酸代谢通路的紊乱已成为机体免疫-代谢调节紊乱的重要特征之一[32]。吲哚胺2, 3-二氧化酶1 (indoleamine 2, 3-dioxygenase 1, IDO1) 和色氨酸2, 3-双加氧酶 (tryptophan 2, 3-dioxygenase, TDO) 是催化色氨酸向犬尿氨酸 (kynurenine, KYN) 代谢转化的关键酶。KYN可进一步在犬尿氨酸单胺氧化酶 (kynurenine 3-monooxygenase, KMO)、犬尿氨酸转氨酶 (kynurenine aminotransferase, KAT) 的作用下产生具有神经免疫活性的内源性物质3-羟基犬尿氨酸 (3-hydroxykynurenine, 3-HK) 及犬尿喹啉酸 (kynurenic acid, KA), 构成了该通路生理病理作用的基础[33]。临床抑郁病人和抑郁模型小鼠中均可观察到外周和中枢IDO1活性的上调, 表明其在抑郁症药物干预中的潜在价值[32]。慢性社交应激可诱导血液中KYN及下游3-HK、KA的上调以及TNF-α、IFN-γ水平的增加, 抑制IDO1可逆转犬尿氨酸代谢异常及行为学异常[34]。另一项在慢性疼痛抑郁共病大鼠中的研究表明, 慢性疼痛可能通过IL-6诱导海马区IDO1上调, 促进犬尿氨酸代谢通路活化。采用IDO基因敲除或者IDO1抑制剂1-甲基色氨酸 (1-MT) 抑制海马区IDO1活性可以同时改善痛觉敏感和抑郁行为[35]。此外, 调控KYN下游代谢通路也是潜在的抑郁症干预策略。例如, 在慢性不可预测应激诱导的小鼠抑郁模型中, 运动的抗抑郁作用与激活骨骼肌KAT功能相关; 增加骨骼肌KAT功能可促进犬尿氨酸向犬尿喹啉酸的代谢转化, 从而降低中枢犬尿氨酸的水平[36]。临床研究中耐力运动也表现出同样的KAT诱导作用[37]。在中枢注射LPS诱导的小鼠抑郁样行为中, 本课题组前期研究表明人参皂苷Rg1调控外周循环中的KYN向3-HK的代谢转化, 进而降低中枢3-HK与KA的比例, 是其发挥抗抑郁活性的重要机制之一[38]。此外, TDO是调控色氨酸代谢的另一酶, 主要在肝脏表达。研究发现, 长期的束缚应激 (2 h, 连续10天) 可以诱导大鼠肝脏TDO表达和活力的上调以及犬尿氨酸水平的升高, 而TDO抑制剂allopurinol可抑制犬尿氨酸水平上调, 缓解相关抑郁行为[39]。
2.3 炎症小体活化及其效应因子的调控炎症小体(inflammasome) 是机体调节炎症-免疫过程的重要信号蛋白复合体。近年来, 炎症小体介导的无菌炎症反应 (sterile inflammatory process) 在抑郁相关中枢和外周炎症反应中的作用受到关注[40]。研究发现, 在接受慢性应激的小鼠中, NLRP3炎症小体被激活并通过caspase1促进白介素1β (IL-1β) 和白介素18 (IL-18) 的释放; Caspase1敲除可以显著改善小鼠焦虑和抑郁行为[41]。最近的机制研究发现, 精神应激下海马区星形胶质细胞ATP释放增加, 通过P2X7受体激活NLRP3炎症小体, 促进IL-1β的释放。采用P2X7受体拮抗剂可以显著抑制炎症小体活化及改善抑郁样行为[42]。作为炎症小体活化后的重要效应因子, IL-1β可显著诱导脑内IDO和KMO的表达, 抑制神经生成, 而KMO抑制剂Ro61-8048可逆转IL-1β的作用, 具有潜在的抗抑郁价值[43]。另一项在雌激素缺乏相关抑郁中的研究发现, 卵巢切除可诱导P2X7受体的上调, 激活NLRP3炎症小体而促进IL-1β和IL-18的释放, 给予炎症小体抑制剂VX-765可以缓解焦虑和抑郁样行为[44]。此外, 米诺环素 (minocycline) 和氟西汀等上市药物被证明具有抑制炎症小体的作用, 可能是其中枢保护作用的重要机制[41, 45]。以上研究结果提示, 炎症小体是联系心理社会应激、免疫调节和精神情绪异常的重要信号蛋白, 为理解抑郁等精神疾病及相关外周疾病的发病机制提供了新的视角[46]。
2.4 外周免疫代谢调控抑郁可诱发或促进躯体疾病,加重躯体疾病的痛苦, 使临床治疗更加复杂。外周免疫失调与精神情绪异常构成了潜在的恶性循环病理网络, 提示抑郁症的调控不应仅局限于中枢[47]。此外, 考虑到中枢靶向药物开发存在的诸多挑战, 从外周免疫系统中寻找抑郁症等疾病的干预靶点是推动相关药物研发的重要途径[48]。抑郁状态下外周异常的免疫效应因子以及相关的代谢通路提供了潜在的药物靶标。采用抗体拮抗外周炎症因子的作用是常见的抑郁外周干预策略之一。目前临床前研究表明TNFα抗体 (infliximab)、IL-6R抗体和IL12/23抗体等具有较好的抗抑郁和改善神经炎症的作用。同时, 有临床研究报道infliximab等抗体药物可以缓解抑郁患者的睡眠障碍和情绪异常[49]。此外, 调控外周免疫细胞也表现出潜在的治疗价值。Beurel等[50]研究报道小鼠抑郁状态下脑内的Th17细胞浸润增加, 采用基因、抗体或者化学抑制剂 (SR1001) 阻断Th17细胞的形成可以提高小鼠的抑郁抵抗性。本课题组研究也表明外周阻断Ly6Chi单核细胞的活化与趋化能力可以显著改善神经炎症和慢性社交应激所诱导的抑郁样行为[38]。
近年来, 国内外学者对情志异常参与的躯体疾病逐渐重视, 并提出了“心身同治”的观点。值得一提的是, 中医历来重视情志疾病相关躯体症状, 基于整体调节的原则辨证施治。与此一致的是, 很多用于抑郁相关疾病的中药成分具有广泛的神经-免疫调节作用, 表现出全身多环节协同作用的特点。例如, 人参皂苷类成分口服生物利用度低, 其显著的抗抑郁和中枢保护作用与外周的炎症调控及代谢调节作用相关[51]。以主要活性成分人参皂苷Rg1为例, 本课题组研究发现外周分布的Rg1可以通过抑制外周Ly6Chi单核细胞的趋化和促炎作用而实现对中枢神经系统的远程调节[38]。
2.5 肠道菌群相关免疫代谢信号随着研究不断深入揭示肠道菌群与机体生理病理过程的广泛联系,重新构建肠道菌群的稳态 (益生菌、益生元) 或者直接调控菌群与机体相互作用的关键信号 (如代谢产物、免疫介质等) 已成为药物研发领域的热点[52]。例如, 在慢性束缚性应激诱导的大鼠抑郁模型中, 补充瑞士乳杆菌 (Lactobacillus helveticus) NS8可以改善相关抑郁、焦虑行为和认知障碍, 同时可以降低血浆皮质酮水平, 恢复脑内五羟色胺代谢稳态[53]。通过富多不饱和脂肪酸类饮食可以改善应激诱导的大鼠肠道菌群紊乱, 降低血浆皮质酮水平, 提高对于抑郁行为的抵抗性[54]。此外, 某些具有抗抑郁活性的化合物被发现具有调节肠道菌群稳态的作用。例如, caspase 1抑制剂米诺环素改善小鼠抑郁行为与纠正应激导致的肠道菌群紊乱相关[41]。这些结果提示在研究抗抑郁活性化合物作用机制中需要关注潜在的肠道菌群调节作用, 以发现新的抗抑郁新靶点。
3 问题及展望有关抑郁症病理网络中免疫调控异常的发现较好解释了环境、心理、药物和疾病等因素诱导情绪异常的机制, 弥补了经典“单胺类递质假说”的局限性。将神经-免疫-代谢调控网络的研究进展整合到抑郁症的神经生物学机制和药物开发研究中有着重要的科学价值[55]。从免疫代谢调控异常角度揭示抑郁症行为异常的起始、促进和加重因素以及机体内在的抗抑郁“平衡”因素, 有望为抑郁症及相关伴随性疾病开发更有效和个体化的治疗策略提供新的研究视角。
尽管近年来对于抑郁等精神疾病中的神经-免疫网络异常现象认识较多, 但神经精神与免疫系统异常相互影响的具体机制是尚未回答的关键科学问题。目前对于外周免疫系统与中枢神经系统互动对话的关键细胞和分子机制还不够了解, 特别是应激等因素诱导外周细胞因子和免疫细胞状态功能转变的途径, 以及后续影响中枢神经与免疫微环境的分子机制不够清晰。尽管目前已经确切发现临床抑郁病人肠道菌群发生明显改变, 但是关于菌群与宿主双向互动的深层机制以及调控策略仍存在许多疑问[56, 57]。目前有研究提示肠道菌群可影响色氨酸-犬尿氨酸代谢通路而发挥情绪和精神等中枢调节作用, 但是其他的内源性代谢通路以及菌群-宿主共代谢物的作用还有待进一步挖掘[32]。此外, 目前抑郁症相关免疫异常的核心环节仍不清楚, 抑郁症发生发展过程中外周免疫抑制和激活的复杂共存学术界仍然存在着争议[58]。围绕这些关键问题, 后续研究的深入需要多学科和技术之间的协同, 从神经、免疫、代谢、内分泌关联的角度加深对细胞分子机制的理解。此外, 围绕中枢-外周关联的生物学机制, 通过反向药理学和化学生物学的方法, 发现具有确切抗抑郁作用化合物或药物的免疫调控新机制和靶点, 是推动创新药物研究的重要途径[59]。
抑郁症有着复杂的病理基础和表现形式, 因而调控免疫反应在抑郁防治中的作用仍需加强临床验证和转化。基础研究需要全面研究免疫异常在不同抑郁亚型的病理生理机制中的作用[60]。事实上, 有临床研究报道并不是对所有抑郁症患者均能从免疫调控疗法获益。一项随机、双盲、对照临床实验发现infliximab主要对基础C-反应蛋白和TNF水平较高的患者表现出显著的抑郁改善作用[61]。由于抑郁症是一种异质性的疾病, 病人个体的免疫失调程度不同, 免疫代谢相关生物标记物 (群) 的发现可以有助于预测出能够对免疫调节药物受益的患者[62]。
未来的基础研究中还应密切关注抑郁临床治疗的特点和需求, 提高临床转化的成功率。抑郁共病现象给临床治疗带来的挑战, 在关注患者精神情绪调节的同时, 对抑郁相关外周免疫紊乱环节进行干预, 有望对抑郁症状态下的多个病理节点实现调控从而提高整体疗效[47]。此外, 结合现有临床抗抑郁药物的不足, 如何从免疫代谢调节的角度促进药物快速而持久的抗抑郁作用, 如何设计个体化的免疫代谢调节治疗方案, 减少抑郁症的复发或者提高对于相关致病因素的耐受性等都是需要关注的具体问题。
| [1] | Krishnan V, Nestler EJ. The molecular neurobiology of depression[J]. Nature, 2008, 455: 894–902. DOI:10.1038/nature07455 |
| [2] | Kovacs D, Kovacs P, Eszlari N, et al. Psychological side effects of immune therapies:symptoms and pathomechanism[J]. Curr Opin Pharmacol, 2016, 29: 97–103. DOI:10.1016/j.coph.2016.06.008 |
| [3] | Capuron L, Gumnick JF, Musselman DL, et al. Neurobehavioral effects of interferon-alpha in cancer patients:phenomenology and paroxetine responsiveness of symptom dimensions[J]. Neuropsychopharmacology, 2002, 26: 643–652. DOI:10.1016/S0893-133X(01)00407-9 |
| [4] | Dantzer R, O'Connor JC, Freund GG, et al. From inflammation to sickness and depression:when the immune system subjugates the brain[J]. Nat Rev Neurosci, 2008, 9: 46–56. DOI:10.1038/nrn2297 |
| [5] | Hodes GE, Kana V, Menard C, et al. Neuroimmune mechanisms of depression[J]. Nat Neurosci, 2015, 18: 1386–1393. DOI:10.1038/nn.4113 |
| [6] | Penninx BW, Milaneschi Y, Lamers F, et al. Understanding the somatic consequences of depression:biological mechanisms and the role of depression symptom profile[J]. BMC Med, 2013, 11: 129. DOI:10.1186/1741-7015-11-129 |
| [7] | Yirmiya R, Rimmerman N, Reshef R. Depression as a microglial disease[J]. Trends Neurosci, 2015, 38: 637–658. DOI:10.1016/j.tins.2015.08.001 |
| [8] | Delpech JC, Madore C, Nadjar A, et al. Microglia in neuronal plasticity:influence of stress[J]. Neuropharmacology, 2015, 96: 19–28. DOI:10.1016/j.neuropharm.2014.12.034 |
| [9] | Cao X, Li LP, Wang Q, et al. Astrocyte-derived ATP modulates depressive-like behaviors[J]. Nat Med, 2013, 19: 773–777. DOI:10.1038/nm.3162 |
| [10] | Wohleb ES, Powell ND, Godbout JP, et al. Stress-induced recruitment of bone marrow-derived monocytes to the brain promotes anxiety-like behavior[J]. J Neurosci, 2013, 33: 13820–13833. DOI:10.1523/JNEUROSCI.1671-13.2013 |
| [11] | Wohleb ES, McKim DB, Shea DT, et al. Re-establishment of anxiety in stress-sensitized mice is caused by monocyte trafficking from the spleen to the brain[J]. Biol Psychiatry, 2014, 75: 970–981. DOI:10.1016/j.biopsych.2013.11.029 |
| [12] | Kim SJ, Lee H, Lee G, et al. CD4+CD25+ regulatory T cell depletion modulates anxiety and depression-like behaviors in mice[J]. PLoS One, 2012, 7: e42054. DOI:10.1371/journal.pone.0042054 |
| [13] | Slyepchenko A, Maes M, Kohler CA, et al. T helper 17 cells may drive neuroprogression in major depressive disorder:proposal of an integrative model[J]. Neurosci Biobehav Rev, 2016, 64: 83–100. DOI:10.1016/j.neubiorev.2016.02.002 |
| [14] | Haapakoski R, Mathieu J, Ebmeier KP, et al. Cumulative meta-analysis of interleukins 6 and 1beta, tumour necrosis factor alpha and C-reactive protein in patients with major depressive disorder[J]. Brain Behav Immun, 2015, 49: 206–215. DOI:10.1016/j.bbi.2015.06.001 |
| [15] | Goldsmith DR, Rapaport MH, Miller BJ. A meta-analysis of blood cytokine network alterations in psychiatric patients:comparisons between schizophrenia, bipolar disorder and depression[J]. Mol Psychiatry, 2016, 21: 1696–1709. DOI:10.1038/mp.2016.3 |
| [16] | Prossin AR, Koch AE, Campbell PL, et al. Acute experimental changes in mood state regulate immune function in relation to central opioid neurotransmission:a model of human CNS-peripheral inflammatory interaction[J]. Mol Psychiatry, 2016, 21: 243–251. DOI:10.1038/mp.2015.110 |
| [17] | Grosse L, Hoogenboezem T, Ambree O, et al. Deficiencies of the T and natural killer cell system in major depressive disorder:T regulatory cell defects are associated with inflammatory monocyte activation[J]. Brain Behav Immun, 2016, 54: 38–44. DOI:10.1016/j.bbi.2015.12.003 |
| [18] | Hodes GE, Pfau ML, Leboeuf M, et al. Individual differences in the peripheral immune system promote resilience versus susceptibility to social stress[J]. Proc Natl Acad Sci U S A, 2014, 111: 16136–16141. DOI:10.1073/pnas.1415191111 |
| [19] | Van Oudenhove L, Crowell MD, Drossman DA, et al. Biopsychosocial aspects of functional gastrointestinal disorders[J]. Gastroenterology, 2016, DOI:10.1053/j.gastro.2016.02. 027. |
| [20] | Zheng PY, Feng BS, Oluwole C, et al. Psychological stress induces eosinophils to produce corticotrophin releasing hormone in the intestine[J]. Gut, 2009, 58: 1473–1479. DOI:10.1136/gut.2009.181701 |
| [21] | Wu W, Sun M, Zhang HP, et al. Prolactin mediates psychological stress-induced dysfunction of regulatory T cells to facilitate intestinal inflammation[J]. Gut, 2014, 63: 1883–1892. DOI:10.1136/gutjnl-2013-306083 |
| [22] | Bailey MT, Dowd SE, Galley JD, et al. Exposure to a social stressor alters the structure of the intestinal microbiota:implications for stressor-induced immunomodulation[J]. Brain Behav Immun, 2011, 25: 397–407. DOI:10.1016/j.bbi.2010.10.023 |
| [23] | Aoki-Yoshida A, Aoki R, Moriya N, et al. Omics studies of the murine intestinal ecosystem exposed to subchronic and mild social defeat stress[J]. J Proteome Res, 2016, 15: 3126–3138. DOI:10.1021/acs.jproteome.6b00262 |
| [24] | Schroeder BO, Backhed F. Signals from the gut microbiota to distant organs in physiology and disease[J]. Nature Med, 2016, 22: 1079–1089. DOI:10.1038/nm.4185 |
| [25] | Bruce-Keller AJ, Salbaum JM, Luo M, et al. Obese-type gut microbiota induce neurobehavioral changes in the absence of obesity[J]. Biol Psychiatry, 2015, 77: 607–615. DOI:10.1016/j.biopsych.2014.07.012 |
| [26] | Zheng P, Zeng B, Zhou C, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host's metabolism[J]. Mol Psychiatry, 2016, 21: 786–796. DOI:10.1038/mp.2016.44 |
| [27] | Frick LR, Rapanelli M, Cremaschi GA, et al. Fluoxetine directly counteracts the adverse effects of chronic stress on T cell immunity by compensatory and specific mechanisms[J]. Brain Behav Immun, 2009, 23: 36–40. DOI:10.1016/j.bbi.2008.06.010 |
| [28] | Ramirez K, Sheridan JF. Antidepressant imipramine diminishes stress-induced inflammation in the periphery and central nervous system and related anxiety-and depressivelike behaviors[J]. Brain Behav Immun, 2016, 57: 293–303. DOI:10.1016/j.bbi.2016.05.008 |
| [29] | Kreisel T, Frank MG, Licht T, et al. Dynamic microglial alterations underlie stress-induced depressive-like behavior and suppressed neurogenesis[J]. Mol Psychiatry, 2014, 19: 699–709. DOI:10.1038/mp.2013.155 |
| [30] | Ramirez K, Niraula A, Sheridan JF. GABAergic modulation with classical benzodiazepines prevent stress-induced neuroimmune dysregulation and behavioral alterations[J]. Brain Behav Immun, 2016, 51: 154–168. DOI:10.1016/j.bbi.2015.08.011 |
| [31] | Norden DM, Devine R, Bicer S, et al. Fluoxetine prevents the development of depressive-like behavior in a mouse model of cancer related fatigue[J]. Physiol Behav, 2015, 140: 230–235. DOI:10.1016/j.physbeh.2014.12.045 |
| [32] | Kennedy PJ, Cryan JF, Dinan TG, et al. Kynurenine pathway metabolism and the microbiota-gut-brain axis[J]. Neuropharmacology, 2016, 112(Pt B): 399–412. |
| [33] | Stone TW, Stoy N, Darlington LG. An expanding range of targets for kynurenine metabolites of tryptophan[J]. Trends Pharmacol Sci, 2013, 34: 136–143. DOI:10.1016/j.tips.2012.09.006 |
| [34] | Fuertig R, Azzinnari D, Bergamini G, et al. Mouse chronic social stress increases blood and brain kynurenine pathway activity and fear behaviour:both effects are reversed by inhibition of indoleamine 2,3-dioxygenase[J]. Brain Behav Immun, 2016, 54: 59–72. DOI:10.1016/j.bbi.2015.12.020 |
| [35] | Kim H, Chen L, Lim G, et al. Brain indoleamine 2,3-dioxygenase contributes to the comorbidity of pain and depression[J]. J Clin Invest, 2012, 122: 2940–2954. DOI:10.1172/JCI61884 |
| [36] | Agudelo LZ, Femenia T, Orhan F, et al. Skeletal muscle PGC-1alpha1 modulates kynurenine metabolism and mediates resilience to stress-induced depression[J]. Cell, 2014, 159: 33–45. DOI:10.1016/j.cell.2014.07.051 |
| [37] | Schlittler M, Goiny M, Agudelo LZ, et al. Endurance exercise increases skeletal muscle kynurenine aminotransferases and plasma kynurenic acid in humans[J]. Am J Physiol Cell Physiol, 2016, 310: C836–840. DOI:10.1152/ajpcell.00053.2016 |
| [38] | Zheng X, Ma S, Kang A, et al. Chemical dampening of Ly6Chi monocytes in the periphery produces anti-depressant effects in mice[J]. Sci Rep, 2016, 6: 19406. DOI:10.1038/srep19406 |
| [39] | Gibney SM, Fagan EM, Waldron AM, et al. Inhibition of stress-induced hepatic tryptophan 2,3-dioxygenase exhibits antidepressant activity in an animal model of depressive behaviour[J]. Int J Neuropsychopharmacol, 2014, 17: 917–928. DOI:10.1017/S1461145713001673 |
| [40] | Fleshner M, Frank M, Maier SF. Danger signals and inflammasomes:stress-evoked sterile inflammation in mood disorders[J]. Neuropsychopharmacology, 2017, 42: 36–45. DOI:10.1038/npp.2016.125 |
| [41] | Wong ML, Inserra A, Lewis MD, et al. Inflammasome signaling affects anxiety-and depressive-like behavior and gut microbiome composition[J]. Mol Psychiatry, 2016, 21: 797–805. DOI:10.1038/mp.2016.46 |
| [42] | Iwata M, Ota KT, Li XY, et al. Psychological stress activates the inflammasome via release of adenosine triphosphate and stimulation of the purinergic type 2X7 receptor[J]. Biol Psychiatry, 2016, 80: 12–22. DOI:10.1016/j.biopsych.2015.11.026 |
| [43] | Zunszain PA, Anacker C, Cattaneo A, et al. Interleukin-1beta:a new regulator of the kynurenine pathway affecting human hippocampal neurogenesis[J]. Neuropsychopharmacology, 2012, 37: 939–949. DOI:10.1038/npp.2011.277 |
| [44] | Xu Y, Sheng H, Bao Q, et al. NLRP3 inflammasome activation mediates estrogen deficiency-induced depressionand anxiety-like behavior and hippocampal inflammation in mice[J]. Brain Behav Immun, 2016, 56: 175–186. DOI:10.1016/j.bbi.2016.02.022 |
| [45] | Du RH, Tan J, Sun XY, et al. Fluoxetine inhibits NLRP3 inflammasome activation:implication in depression[J]. Int J Neuropsychopharmacol, 2016, DOI:10.1093/ijnp/pyw037. |
| [46] | Iwata M, Ota KT. Duman RS The inflammasome:pathways linking psychological stress, depression, and systemic illnesses[J]. Brain Behav Immun, 2013, 31: 105–114. DOI:10.1016/j.bbi.2012.12.008 |
| [47] | Zheng X, Zhang X, Wang G, et al. Treat the brain and treat the periphery:toward a holistic approach to major depressive disorder[J]. Drug Discov Today, 2015, 20: 562–568. DOI:10.1016/j.drudis.2015.03.015 |
| [48] | Haroon E, Raison CL, Miller AH. Psychoneuroimmunology meets neuropsychopharmacology:translational implications of the impact of inflammation on behavior[J]. Neuropsychopharmacology, 2012, 37: 137–162. DOI:10.1038/npp.2011.205 |
| [49] | Weinberger JF, Raison CL, Rye DB, et al. Inhibition of tumor necrosis factor improves sleep continuity in patients with treatment resistant depression and high inflammation[J]. Brain Behav Immun, 2015, 47: 193–200. DOI:10.1016/j.bbi.2014.12.016 |
| [50] | Beurel E, Harrington LE. Jope RS Inflammatory T helper 17 cells promote depression-like behavior in mice[J]. Biol Psychiatry, 2013, 73: 622–630. DOI:10.1016/j.biopsych.2012.09.021 |
| [51] | Kang A, Hao H, Zheng X, et al. Peripheral anti-inflammatory effects explain the ginsenosides paradox between poor brain distribution and anti-depression efficacy[J]. J Neuroinflammation, 2011, 8: 100. DOI:10.1186/1742-2094-8-100 |
| [52] | Schmidt C. Mental health:thinking from the gut[J]. Nature, 2015, 518: S12–15. DOI:10.1038/518S13a |
| [53] | Liang S, Wang T, Hu X, et al. Administration of Lactobacillus helveticus NS8 improves behavioral, cognitive, and biochemical aberrations caused by chronic restraint stress[J]. Neuroscience, 2015, 310: 561–577. DOI:10.1016/j.neuroscience.2015.09.033 |
| [54] | Pusceddu MM, El Aidy S, Crispie F, et al. N-3 polyunsaturated fatty acids (PUFAs) reverse the impact of early-life stress on the gut microbiota[J]. PLoS One, 2015, 10: e0139721. DOI:10.1371/journal.pone.0139721 |
| [55] | Wohleb ES, Franklin T, Iwata M, et al. Integrating neuroimmune systems in the neurobiology of depression[J]. Nat Rev Neurosci, 2016, 17: 497–511. DOI:10.1038/nrn.2016.69 |
| [56] | Jiang H, Ling Z, Zhang Y, et al. Altered fecal microbiota composition in patients with major depressive disorder[J]. Brain Behav Immun, 2015, 48: 186–194. DOI:10.1016/j.bbi.2015.03.016 |
| [57] | Dinan TG, Cryan JF. Microbes, immunity, and behavior:psychoneuroimmunology meets the microbiome[J]. Neuropsychopharmacology, 2017, 42: 178–192. DOI:10.1038/npp.2016.103 |
| [58] | Blume J, Douglas SD, Evans DL. Immune suppression and immune activation in depression[J]. Brain Behav Immun, 2011, 25: 221–229. DOI:10.1016/j.bbi.2010.10.008 |
| [59] | Hao H, Zheng X, Wang G. Insights into drug discovery from natural medicines using reverse pharmacokinetics[J]. Trends Pharmacol Sci, 2014, 35: 168–177. DOI:10.1016/j.tips.2014.02.001 |
| [60] | Lamers F, Vogelzangs N, Merikangas KR, et al. Evidence for a differential role of HPA-axis function, inflammation and metabolic syndrome in melancholic versus atypical depression[J]. Mol psychiatry, 2013, 18: 692–699. DOI:10.1038/mp.2012.144 |
| [61] | Raison CL, Rutherford RE, Woolwine BJ, et al. A randomized controlled trial of the tumor necrosis factor antagonist infliximab for treatment-resistant depression:the role of baseline inflammatory biomarkers[J]. JAMA Psychiatry, 2013, 70: 31–41. DOI:10.1001/2013.jamapsychiatry.4 |
| [62] | Milaneschi Y, Lamers F, Peyrot WJ, et al. Polygenic dissection of major depression clinical heterogeneity[J]. Molecular psychiatry, 2016, 21: 516–522. DOI:10.1038/mp.2015.86 |
 2017, Vol. 52
2017, Vol. 52


