2. 山西大学生物技术研究所, 山西 太原 030006
2. Insititute of Biotechnology, Shanxi University, Taiyuan 030006, China
药用植物的活性成分是在基因型和环境的双重作用下形成的[1]。基因型是先天的决定因素, 而生长环境是后天的决定因素, 其基因的表达与否关键看后天环境的影响。植物的生长环境包括内环境和外环境, 内环境主要包括生命因子和非生命因子, 其中生命因子主要是植物内生真菌[2]。由于内生真菌与药用植物的“协同进化的关系”, 并且内生真菌能快速、高度专一和选择性地诱导宿主植物特定功能基因的表达[3], 因此, 内生真菌侵染宿主后可能会产生与宿主相同的或相似的次级代谢产物[4], 也可能刺激植物的生长发育和调节宿主植物的次生代谢及增强宿主对环境的适应能力[5]。
红景天是景天科(Crassulaceae)红景天属(Rhodiola)的多年生草本药用植物, 红景天苷(salidroside)是其主要的活性成分之一, 具有抗氧化、抗疲劳、抗辐射等多种药理活性, 它在植物体内的积累是通过桂皮酸合成代谢途径[6]。本研究是向大花红景天组培苗接种真菌ZPR-R-1后, 筛选红景天体内稳定表达的管家基因; 在荧光定量PCR技术条件下, 采用双内参基因组合, 能快速、稳定、可重复性地分析红景天苷合成途径中苯丙氨酸解氨酶基因(PAL)、酪氨酸脱羧酶基因(TyDC)、酪氨酸转氨酶基因(TAT)和尿苷二磷酸葡萄糖转移酶基因(UDPGT) 4个关键酶基因表达量的变化规律。这为生物共生、生物胁迫条件下, 从分子水平研究红景天苷代谢途径关键酶活性的表达规律和分子机制提供方法和科学依据。
材料与方法材料 红景天组培苗为本课题组建立的大花红景天组培苗繁殖体系[7]。本研究使用的真菌编号为ZPRa-R-1, 隶属于Phialocephala fortinii, GenBank (http://www.ncbi.nlm.nih.gov)库编号为KJ542299, 由本课题组分离、筛选、鉴定, 保藏于山西大学应用化学研究所生物化工实验室。
试剂与仪器 柱式RNA抽提纯化试剂盒购自上海生工生物工程股份有限公司; 反转录试剂盒Trans Scrip® One-Step gDNA remover and cDNA Synthsis Super Mix和实时荧光定量PCR试剂盒Trans Scrip® Tip Green qRT-PCR Super Mix购自北京全式金公司(Trans Gen Biotech); 红景天苷对照品(中国食品药品检定研究院, 批号110818-201005);甲醇(美国Fisher公司, 色谱纯); 其余试剂均为分析纯。BIO-RAD CFx96TM Real-Time system (Bio-rad, USA); Ailent 1200高效液相色谱仪(Agilent, USA)。
红景天组培苗与内生真菌共培养无菌条件下, 打取直径为0.5 cm的ZPRa-R-1菌饼2块, 接种于红景天组培苗根茎部, 培养条件见文献[7]。分别于4、6、8、10、12、14、16天时采集菌苗共生样品, 不接种的组培苗作为对照(CK)。将所采集的样品一部分在液氮中速冻10 min, 之后放入-80 ℃冰箱中长期保存, 用于提取RNA, 另一部分烘干, 用于测定红景天苷的含量。
cDNA第1链的合成 cDNA的合成按照Trans Scrip® One-Step gDNA remover和cDNA Synthsis Super Mix试剂盒说明书要求进行。
引物的合成及验证 参考文献[8, 9], 选取8个管家基因进行内参基因筛选, 分别是α微管蛋白基因(TUA)、肌动蛋白基因(ACT)、甘油醛磷酸脱氢酶基因(GAPDH)、β微管蛋白基因(TUB)、植物螯合肽合成酶基因(PCS)、衔接蛋白复合物a亚基(AP-2A)、细胞色素P450超家族(CYP)、泛素(UBQ)。对红景天苷合成途径中的4个关键酶基因[10, 11]活性进行研究, 分别是PAL、TyDC、TAT、UDPGT。
通过比对家族基因[12-14], 利用Blast primer设计出能扩增高特异性区段的引物, 避免PCR过程中的交叉污染, 见表 1。通过扩增产物电泳, 分析产物长度、电泳条带数及是否有非特异性扩增等, 结合分析熔解曲线和扩增效率来判断引物的特异性。
| Table 1 Primers of eight housekeeping genes and four key genes in R. crenulataused for quantitative RT-PCR |
qPCR的反应条件 采用Trans Scrip® Tip Green qRT-PCR Super Mix试剂盒。扩增反应程序为: 94 ℃预变性30 s; 95 ℃变性5 s, 56 ℃退火15 s, 72 ℃延伸10 s, 45个循环。
管家基因数据的分析 使用geNorm、Normfinder和BestKeeper软件综合分析管家基因在内生真菌互作条件下红景天组培苗样品中的表达稳定性[8, 9], 获得管家基因稳定性排名。采用geNorm软件计算n个(2≤n≤7)基因作为内参基因得出标准化因子的配对变异值Vn/n+1, 确定最佳内参基因组合数目。
关键酶基因的数据分析 利用Excel软件计算每个样品PAL、TyDC、TAT、UDPGT的相对表达量, 并以GAPDH和PCS作为双内参, 进行实验误差矫正。利用2-ΔΔCt的方法[15]计算同一时期回接内生真菌后PAL、TyDC、TAT、UDPGT基因相对于未回接内生真菌的表达差异倍数。用SPSS软件分析对照组和处理组数据之间的差异性, 单因素方差分析, 以P < 0.05表示有统计学差异。
红景天苷的提取和测定 参照Cui等[16]的方法提取上述采集样品中红景天苷并测定其含量。
相关性分析 应用SPSS软件处理数据, 并进行显著性检验和相关性分析。
结果与分析 1 RNA质量检验样品总RNA经1.2%的琼脂糖凝胶电泳检测条带清晰, 无弥散现象; 28S rRNA/18S rRNA=2, 说明RNA的完整性良好, OD260/280在1.9~2.1之间, 说明RNA的纯度较高, 达到后续实验样品质量要求。
2 引物扩增效率和特异性分析根据绘制标准曲线, 得出12个基因的相关系数R2 > 0.980, 同时扩增效率在90%~109%内, 符合qRT-PCR的要求。产物经1.2%琼脂糖凝胶电泳检测见图 1 (A), 各条带大小与期望值相一致, 不存在其他非特异性扩增条带。进一步分析各管家基因的熔解曲线见图 1 (B), 都只产生单一熔解峰, 各样品之间曲线重复性良好。
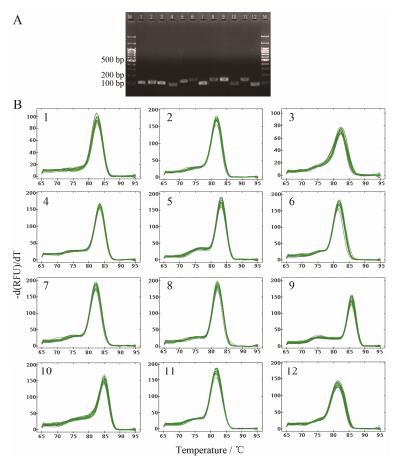 | Figure 1 Agarose electrophoresis (A) and melting curve (B) for housekeeping genes and key enzyme genes associated with salidroside synthesis in R. crenulata. 1-8 housekeeping genes (1: TUA, 2: ACT, 3: GAPDH, 4:TUB, 5: PCS; 6: AP-2A, 7: CYP, 8: UBQ); 9-12 key enzyme genes (9: PAL, 10: TyDC, 11: TAT, 12: UDPGT) |
BestKeeper软件主要是利用管家基因的Ct值来计算标准偏差(SD), SD值越小, 管家基因越稳定。结果见表 2, GAPDH的SD值最小为0.24, 为8个管家基因中稳定性最强, 其次是TUA、PCS等。
| Table 2 Aanlysis result of expression stability of housekeeping genes by BestKeeper software. CP: Value of Ct; Geo mean: Geometric mean; Ar mean: Arithmetic mean; SD: Standard deviation |
通过NormFinder程序分析会得到每个基因的表达稳定值M, 并且M值越小, 基因表达越稳定, 反之亦然。表 3结果表明, 最稳定的基因是PCS, 其次是GAPDH, 最不稳定的是ACT。
| Table 3 Results of expression stability of housekeeping genes by NormFinder software |
geNorm软件是用稳定指数M值确定管家基因的稳定性, 通常以M=1.5为阈值, M值越小, 管家基因越稳定。结果(图 2)表明: 8个管家基因都比较稳定, 其中GAPDH和PCS的M值最低, 稳定性最好。而ACT稳定性最差。
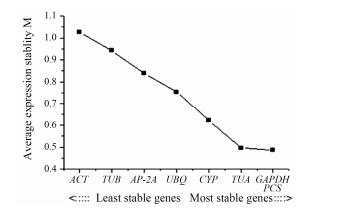 | Figure 2 Results of housekeeping genes of R. crenulata inocu lated with ZPRa-R-1 by geNorm analysis |
单个内参基因表达不稳定, 常采用多个内参基因进行qRT-PCR校正, 以得到更为准确的结果[17]。在geNorm软件中, 以Vn/n+1为选择阀值, 当Vn/n+1 < 0.15时, n个内参基因为适宜数量; 若Vn/n+1 > 0.15时, 则需要添加内参基因数目。由图 3可以看出, V2/3小于0.15, 只需选用两个稳定表达的内参基因组合即可。综合上述研究结果, 选择GAPDH和PCS为本研究的内参基因。
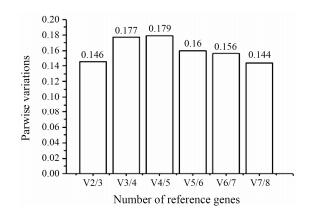 | Figure 3 Confirmation of numbers of reference genes used for normalization |
ZPRa-R-1与大花红景天组培苗互作条件下, 大花红景天PAL基因的表达活性见图 4, 其相对表达量经历了先升高, 而后下降的趋势, 具有显著性变化结果(P < 0.05)。其中, 互作6~14天时, 内生真菌能显著促进宿主红景天PAL基因表达量; 互作16天之后, 表达量为对照组0.52倍, 不利于该基因表达。
 | Figure 4 Effect of endophytic fungus on the expression of PAL in R. crenulata. n=3, x±s. P < 0.05 |
由图 5可知内生真菌与大花红景天组培苗互作4和6天时, TyDC基因的相对表达量与对照组的差异不显著(P > 0.05);互作8~12天时, 其相对表达量显著升高(P < 0.05);第12天时表达量达最大, 为对照组的2.9倍; 互作14天之后, TyDC基因的相对表达量低于对照。
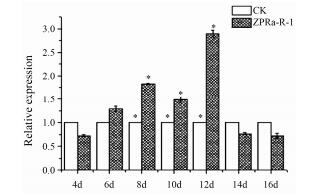 | Figure 5 Effect of endophytic fungus on the expression of TyDCin R. crenulata. n=3, x±s. P < 0.05 |
由图 6可知, 内生真菌没有显著地提高红景天TAT基因的表达量。互作4、14、16天时, TAT的相对表达量显著低于对照(P < 0.05);互作6~12天, TAT的相对表达量与对照没有显著性差异。
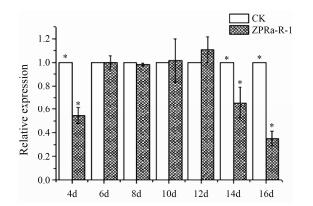 | Figure 6 Effect of endophytic fungus on the expression of TAT in R. crenulata. n=3, x±s. P < 0.05 |
由图 7可知, 活性菌能显著促进UDPGT的表达量(P < 0.05)。互作8天时, UDPGT的相对表达量达到峰值, 为对照组的17.15倍。其后出现下降趋势。
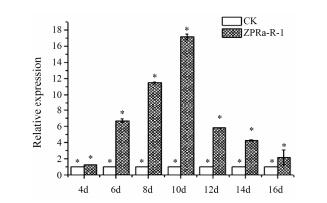 | Figure 7 Effect of endophytic fungus on the expression of UDPGT in R. crenulata. n=3, x±s. P < 0.05 |
本研究对真菌接种苗不同时间段红景天苷的含量进行对应分析, 图 8表明, ZPRa-R-1接种于红景天组培苗之初, 能够逐步促进红景天苷含量的积累, 第10天时, 达到最大值0.642 mg·g-1, 而此时对照组为0.243 mg·g-1, 约为2.7倍。之后, 含量逐步下降。
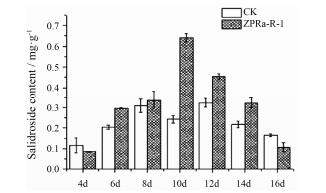 | Figure 8 Effect of endophytic fungi on the content of salidrosid in Rhodiola. n=3, x±s |
相关性分析结果表明, 真菌接种红景天, 主要成分红景天苷的积累变化与代谢途径中关键酶基因PAL、TyDC、UDPGT的表达活性之间存在正相关关系。与PAL基因的相关性极显著(P < 0.01), 其相关系数为0.971;与TyDC和UDPGT基因相关性显著(P < 0.05);与TAT基因之间的相关系数为0.237, 可视为没有相关性。这对研究内生真菌促进宿主红景天苷的积累具有重要意义。
讨论大花红景天是被历版中华人民共和国《药典》收录的中药红景天指定的唯一基源植物。但大花红景天栽培中面临的问题是主要活性成分红景天苷等含量积累太慢, 至少5~7年[18]。人们采用模拟野生环境等办法无法解决这一问题。近年来, 许多学者在细胞培养[19]、组织培养[7]、基因调控[10, 20]等方面进行了广泛研究, 但尚未获得成熟的解决办法。其中最为关键的问题是生物合成红景天苷的桂皮酸途径中具体分支路径、关键酶基因时空表达规律不清楚, 甚至合成代谢途径面临争议[17]等。本研究以一株内生真菌ZPRa-R-1与红景天共生而促进红景天苷积累为基础, 对争议的苯丙氨酸途径和酪氨酸途径的关键酶基因表达规律进行研究, 从分子水平揭示其表达规律。本研究表明内生真菌ZPRa-R-1能使PAL、TyDC和UDPGT表达增加, 同时也促进了红景天苷的积累, 然而, 对TAT的表达量却没有显著影响。PAL、TyDC、UDPGT等关键酶基因的表达与红景天苷的含量之间的相关性及变化趋势, 可能与植物对真菌胁迫防御反应、共生协同效应、真菌繁殖过剩等过程有关。
本研究首次选择大花红景天的8个管家基因作为候选内参基因, 进而采用双基因组合进行关键酶基因表达的研究, 这为利用内生真菌调控大花红景天的主要代谢产物红景天苷的生产、红景天苷合成途径中的关键酶基因时空表达规律、红景天苷生物合成及代谢途径等的研究提供了分子理论依据。
| [1] | Xing ZB, Long YH, Lao FY, et al. Effect of endophytic fungi on expression of key enzyme genes in saponins biosynthesis and Eleutherococcus senticosus saponins content[J]. China J Chin Mater Med (中国中药杂志), 2012, 37 :2041–2045. |
| [2] | Cheng ML, Huang LQ. Effect of endophytic fungi in plant on the information of Genuine herb[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2006, 13 :40–42. |
| [3] | Zhao J, Davis LC, Verpoorle R. Elicitor signal transduction leading to production of plant secondary metabolite[J]. Biotechnol Adv, 2005, 23 :283–333. DOI:10.1016/j.biotechadv.2005.01.003 |
| [4] | El-Hawary SS, Mohammed R, AbouZid SF, et al. Solamargine production by a fungal endophyte of Solanum nigrum[J]. J Appl Microbiol, 2016, 120 :900–911. DOI:10.1111/jam.13077 |
| [5] | Rodriguez RJ, Henson J. Stress tolerance in plants via habitatadapted symbiosis[J]. Int Soc Microb Ecol J, 2008, 2 :404–416. |
| [6] | Panossian A, Wikman G, Sarris J. Rosenroot (Rhodiola rosea):traditional use, chemical composition, pharmacology and clinical efficacy[J]. Phytomedicine, 2010, 17 :481–493. DOI:10.1016/j.phymed.2010.02.002 |
| [7] | Wang ML, Zhong NS, Guo TT, et al. Effects of plant growth substances on callus induction and shoot regeneration of Rhodiola crenulata Hook. f. et Thoms[J]. Acta Phytophysiol Sin (植物生理学报), 2014, 50 :192–196. |
| [8] | Yuan W, Wan JH, Yang YJ. Characterization and selection of reference genes for real-time quantitative RT-PCR of plants[J]. Bull Bot (植物学报), 2012, 47 :427–436. |
| [9] | Xu ZC, Xu J, Ji AJ, et al. Genome-wide selection of superior reference genes for expression studies in Ganoderma lucidum[J]. Gene, 2015, 574 :352–358. DOI:10.1016/j.gene.2015.08.025 |
| [10] | Ma LQ, Yao DY, Wang YN, et al. Effects of over expression of endogenous phenylalanine ammonia-lyase (PALrsl) on accumulation of salidrside in Rhodiola sachlinensis[J]. Plant Biol, 2008, 10 :323–333. DOI:10.1111/j.1438-8677.2007.00024.x |
| [11] | Zhang ZR, Liao ZH. Advances in studies on biosynthesis pathway and biotechnology of salidroside[J]. Chin Tradit Herb Drugs (中草药), 2010, 41 :1571–1574. |
| [12] | Pruitt KD, Tatusova T, Maglott DR. NCBI reference sequences (RefSeq):a curatednon-redundant sequence database of genomes, transcripts and proteins[J]. Nucleic Acids Res, 2005, 33 :501–504. DOI:10.1093/nar/gki476 |
| [13] | Lescot M, Dhais P, Thijs G, et al. A database of plant cis-acting regulatory elements and a portal to tools for insilico analysis of promoter sequences[J]. Nucleic Acids Res, 2002, 30 :325–327. DOI:10.1093/nar/30.1.325 |
| [14] | Li Y, Baldauf S, Lim EK, et al. Phylogenetic analysis of the UDP-glycosyltransferase multigene family of Arabidopsis thaliana[J]. J Biol Chem, 2001, 276 :4338–4343. DOI:10.1074/jbc.M007447200 |
| [15] | Pfaffl MW. A new mathematical model for relative quantifycation in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29 :45–50. DOI:10.1093/nar/29.9.e45 |
| [16] | Cui JL, Guo TT, Wang ML, et al. Simultaneous determination of five active compounds in wild and culture materials of Rhodiola crenulata by RP-HPLC[J]. China Pharm J (中国药学杂志), 2016, 51 :230–233. |
| [17] | Su XJ, Fan BG, Yuan LC, et al. Selection and validation of reference genes for quantitative RT-PCR analysis of gene expression in Populus trichocarpa[J]. Bull Bot (植物学报), 2013, 48 :507–518. |
| [18] | Grech-Baran M, Syklowska-Baranek K, Pietrosiuk A. Approaches of Rhodiola kirilowii and Rhodiola rosea field cultivation in Poland and their potential health benefits[J]. Ann Agric Envion Med, 2015, 22 :281–285. DOI:10.5604/12321966.1152081 |
| [19] | Xu JF, Liu CB, Han AM, et al. Strategies for the improvement of salidroside production in cell suspension cultures of Rhodiola sachalinensis[J]. Plant Cell Rep, 1998, 17 :288–293. DOI:10.1007/s002990050394 |
| [20] | Zhang JX, Ma LQ, Yu HS, et al. A tyrosine decarboxylase catalyzes the initial reaction of the salidroside biosynthesis pathway in Rhodiola sachalinensis[J]. Plant Cell Rep, 2011, 30 :1443–1453. DOI:10.1007/s00299-011-1053-7 |
 2016, Vol. 51
2016, Vol. 51


