2. 军事医学科学院放射与辐射医学研究所, 北京 100850
2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Bejing 100850, China
青蒿素是从黄花蒿中提取的倍半萜内酯药物, 屠呦呦研究团队发现青蒿素是抗疟有效成分[1], 已拯救数以百万计患者的生命。青蒿素除有抗疟疾的作用外, 还有抗炎作用, 如风湿性关节炎[2]、红斑狼疮[3]和败血症[4]等。青蒿琥酯是青蒿素衍生物, 水溶性较青蒿素稍有增加, 但仍然主要表现为脂溶性。青蒿琥酯可有效抑制肺组织中白介素-4 (IL-4)、IL-5、IL-13的水平和肺组织促炎症反应的表达, 减轻哮喘症状[5]。青蒿琥酯口服后吸收差, 口服生物利用度只有30%, 同时分子中的过氧键在体内易被破坏, 进一步减弱了药物作用[6]。
急性肺损伤(acute lung injury, ALI)由各种严重非心源性致病因素(如吸入有毒气体、大量输血)造成, 以呼吸困难和难治性低氧血症为主要表现。它可迅速发展成急性呼吸窘迫综合症(acute respiratory distress syndrome, ARDS)。后者是公认的致死性肺部疾病, 死亡率可达35%~50%[7, 8]。ALI病因复杂, 炎性细胞因子和趋化因子间的复杂网络调控, 在启动放大和促进病理进程中起到重要作用[9]。
肺部给药是一种非侵入性给药方式, 特别适合肺部疾病治疗。肺吸入药物可直接作用于病灶, 避免全身给药造成的生物利用度低和毒副作用, 可减小给药剂量[10]。脂质体是磷脂双分子层构成的囊泡, 可包裹水溶性药物和脂溶性药物, 提高药物的生物利用度, 降低或减少药物不良反应及增加药物稳定性等。
目前临床上已有多个肺吸入制剂用于治疗肺部疾病, 如布地奈德福莫特罗粉雾剂和沙丁胺醇气雾剂治疗哮喘; 沙美特罗替卡松粉雾剂治疗可逆性阻塞性气道疾病。本实验室曾将姜黄素制备成脂质体粉雾剂治疗急性肺损伤, 药效优于原料药, 脂质体使药物更易进入细胞发挥抗炎作用[11]; 将冬凌草甲素制备成纳米混悬液冻干粉, 对大鼠急性肺损伤疗效显著[12]; 用二甲硅油纳米乳治疗急性肺损伤[13]。本文基于青蒿琥酯的性质和肺吸入给药特点, 制备了青蒿琥酯脂质体, 并冻干后得到粉雾剂(dry powder inhalers, DPI), 通过气管给药使药物直接作用于肺组织, 治疗急性肺损伤, 并探讨了药物的作用机制。
材料与方法动物 SPF级SD大鼠(军事医学科学院实验动物中心提供), 雄性, 体重220~240 g, 许可证号: SCXK-(军) 2012-0004, 充分给水和食物。
试剂及药物 青蒿琥酯(Adamas Reagent Co., Ltd.); 地塞米松(河南润弘制药股份有限公司); 脂多糖(lipopolysaccharide, LPS, Sigma公司); 大豆磷脂(上海太伟药业有限公司); 胆固醇(国药集团化学试剂有限公司); 大鼠IL-6 ELISA试剂盒, 大鼠TNF-α ELISA试剂盒(北京易科拜德科技有限公司); BCA Protein Assay Kit (康为世纪生物科技有限公司)。
主要仪器 BDS200-FL倒置荧光显微镜(重庆奥特光学仪器有限责任公司); ELX800酶标仪(美国伯腾仪器有限公司); BT100-1J恒流泵(保定兰格恒流泵有限公司); 纳米粒度仪(Zetasizer Nano ZS, 英国马尔文公司); BT-2001激光粒度仪(丹东百特仪器有限公司); 吸入药物粒度分布测定仪(Next Generation Impactor, NGI, 英国Copley公司); H-7650透射电子显微镜(80 kV, 日本Hitachi公司); TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司); FD-1-55-100冻干机(北京博医康实验仪器有限公司); MJ咽喉镜(江苏迈骏医疗科技有限公司)。
脂质体处方优化 通过预实验, 分析确定了影响青蒿琥酯脂质体包封率的3个主要因素, 各因素取3个水平, 即水化时磷酸盐缓冲溶液(PBS)的量为5、10和15 mL, 大豆磷脂与胆固醇的质量比为5:1、10:1和15:1, 药物与磷脂的摩尔比为1:1、1:2和1:3。采用正交设计试验来筛选处方, 以包封率和载药量为筛选指标。
脂质体粉雾剂制备 用薄膜分散法制备青蒿琥酯脂质体。根据正交设计试验结果得到的最优处方, 称取适量大豆磷脂、胆固醇和青蒿琥酯, 加入氯仿与甲醇(2:1, v/v)混合溶液使之完全溶解, 于45 ℃旋转蒸发器上蒸发1 h, 加入含有甘露醇的PBS, 超声30 min, 即得青蒿琥酯脂质体。冷冻干燥72 h, 得青蒿琥酯脂质体粉雾剂(liposomal artesunate dry powder inhalers, LADPIs)。
粒径与电位测定和电镜观察 用纳米激光粒度仪对青蒿琥酯脂质体的粒度和zeta电位进行测定, 温度为25 ℃, 体积为1 mL, 每份样品平行测定3次。取少量青蒿素脂质体用水稀释, 取5 μL滴至铜网支持碳膜上, 5%磷钨酸溶液(pH 7.0)负染, 空气中干燥, 用透射电镜观察粒子的形态。
青蒿琥酯含量测定方法 配制1 mg·mL-1青蒿琥酯乙醇溶液作为标准贮备液, 取2 mL, 用2% NaOH-无水乙醇(4:1, v/v)混合溶液稀释至25 mL, 于60 ℃恒温水浴中反应30 min, 冷却至室温[14]。分别取反应溶液0.5、1、1.5、2、2.5、3和3.5 mL, 用2% NaOH-无水乙醇(4:1, v/v)混合溶液稀释至10 mL, 摇匀, 分别得到7.7、15.4、23.0、30.7、38.4、46.1和53.8 μg·mL-1标准液, 在最大吸收波长237 nm处测定吸收度值(A), 得到标准曲线方程为A=32.778 C + 0.023 4 (r=0.999 7), 线性范围7.7~53.8 μg·mL-1。
包封率与载药量测定 用葡聚糖G-25凝胶色谱柱分离青蒿琥酯脂质体。加入青蒿琥酯脂质体1 mL, 用水洗脱, 收集洗脱液, 每管3 mL, 分别加入5 mL无水乙醇后, 用2% NaOH-无水乙醇(4:1, v/v)溶液稀释至10 mL, 参考“青蒿琥酯含量测定方法”测得浓度。按以下公式计算包封率、载药量和综合评分。
| $ 包封率\left( \% \right) = 包封的药物量/投药量 \times 100\% $ | (1) |
| $ 载药量\left( \% \right) = 包封的药物量/载药脂质体的总重量 \times 100\% $ | (2) |
| $ 综合评{分^{\left[ {15} \right]}} = 包封率 \times 0.7 + 载药量 \times 0.3 $ | (3) |
包封率是评价脂质体的重要因素, 因此公式(3)中包封率的权重系数定为0.7, 载药量为0.3, 作为综合评价指标对制备工艺进行筛选。
空气动力学粒径测定 取3份LADPIs, 用量筒法测定粒子振实密度, 用激光粒度仪测定粒子几何粒径(De)。按公式(4)[16]计算空气动力学粒径。
| $ {D_{\rm{a}}} = {D_{\rm{c}}}{\left( {{\rho _{\rm{p}}}/{\rho _{\rm{0}}}X} \right)^{1/2}} $ | (4) |
式中Da和De分别为空气动力学粒径和几何学粒径; ρp为有效颗粒密度, 其为振实密度的1.26倍, ρ0为参照密度, 等于1 g·cm-3, X为动态形态因子(球形时X=1, 本文采用1)。粒子的几何粒径、密度和形状都会影响空气动力学粒径[17]。空气动力学粒径是影响药物沉积部位的最主要因素, 一般认为空气动力学粒径在1~5 μm的粒子可以到达肺深部[18]。
肺部沉积率的测定 取20份LADPIs, 每份40 mg, 装入3号羟丙甲纤维素(HPMC)胶囊(苏州胶囊有限公司)中, 通过药物吸入器, 将药物吸入粒度分布测定仪中, 连续吸入20粒, 停泵后打开测定仪, 用20 mL水清洗每个隔室(装置、喉部、1~8级共10个隔室), 连续两次, 合并后转入50 mL量瓶, 无水乙醇定容, 然后吸取5 mL, 用2% NaOH-无水乙醇(4:1, v/v)溶液稀释至10 mL, 参考“青蒿琥酯含量测定方法”, 测定每个隔室中青蒿琥酯含量, 按下面公式计算粉雾剂肺部沉积率。
| $ 肺部沉积率\left( \% \right) = 2 \sim 7级青蒿琥酯的含量/各个级别的总含量 \times 100\% $ | (5) |
体外释放的测定 取3份青蒿琥酯原料药, 每份1 mg, 装入预先处理好的透析袋(截留分子质量3 500)中, 并加入人工肺液3 mL[19], 将其放入250 mL体积的锥形瓶中, 并加入人工肺液20 mL, 在37 ℃振荡, 每1 h取透析袋外溶液1 mL, 并补充相同温度和体积的人工肺液, 12 h后每隔12 h取样一次并补液。取3份LADPIs, 每份15 mg (约含青蒿琥酯1 mg), 释药测定方法同上。参考“青蒿琥酯含量测定方法”, 测定释放液中青蒿琥酯的含量。
急性肺损伤大鼠模型的建立及给药 将36只大鼠随机分为6组, 每组6只, 即正常组、模型组、阳性药地塞米松组、青蒿琥酯原料药组、空白脂质体粉雾剂组和青蒿琥酯脂质体粉雾剂组。除正常组大鼠气管喷入生理盐水0.3 mL, 其他组按LPS 5 mg·kg-1经气管喷入建立ALI模型。于造模1 h后, 空白脂质体组每只大鼠经气管喷入空白脂质体粉雾剂15 mg; 青蒿琥酯原料组气管喷入青蒿琥酯原料药(180目)与可吸入乳糖(Inhalac 400, 德国美剂乐集团)混合粉末15 mg (含青蒿琥酯约1 mg); LADPIs组每只大鼠气管喷入LADPIs 15 mg (含青蒿琥酯约1 mg); 阳性药地塞米松组每只大鼠气管喷入地塞米松溶液(5 mg:1 mL) 5 mg·kg-1。
IL-6、TNF-α和总蛋白的含量测定 用水合氯醛麻醉大鼠, 开胸, 使主、支气管清楚地暴露在术野中。用灭菌手术线结扎右侧支气管, 在主气管处剪一个T型小开口, 将自制导管前端嵌入, 直至主气管下端分叉处。用无菌注射器抽取4 ℃生理盐水2 mL, 经自制导管缓缓注入, 可观察到左肺充盈, 停留30 s, 抽回灌注液体, 再注入该液体, 反复抽注3次, 最后将液体全部抽回, 转移至5 mL离心管中, 重复灌洗1次, 灌洗液的回收率大于90%。灌洗液合并后以3 500 r·min-1离心10 min, 取上清液, 放置-80 ℃保存, 用ELISA试剂盒检测大鼠肺组织中TNF-α和IL-6的水平。用BCA Protein Assay Kit测定大鼠肺组织中总蛋白含量。
肺组织病理检测 各组大鼠肺泡灌洗结束后, 立即取右肺中叶, 用10%甲醛溶液固定, 苏木精-伊红(HE)染色, 制作石蜡病理切片, 显微镜观察。
统计学分析 采用SPSS 17.0软件进行统计学分析(单因素方差分析, LSD), P < 0.05具有显著性差异。实验数据以均数±标准差(x±s)表示。
结果 1 青蒿琥酯脂质体粉雾剂处方及制备工艺的确定测得每个实验条件下包封率和载药量。以综合评分为评价指标, 其中影响因素是药脂比 > 大豆磷脂/胆固醇比 > PBS量。结合包封率、载药量和综合评分, 最优处方为药脂比=1:3 (mol/mol), 大豆磷脂/胆固醇比为10:1 (w/w), PBS (0.05 mol·L-1)量为10 mL, 甘露醇/脂质体质量比为1.5。用此处方制备的LADPIs休止角达到32.7°, 接近于30°, 流动性较好, 可做到分剂量准确。
2 青蒿琥酯脂质体的理化性质 2.1 粒径、zeta电位及形态粒径及zeta电位是影响制剂体内行为的重要因素[20]。按最优处方制备青蒿琥酯脂质体, 粒径(图 1A)为(47.3±12.7) nm (n=3), 多项分散系数PDI为0.3±0.05, 粒径均一。Zeta电位(图 1B)为(-13.7±2.6) mV (n=3)。冷冻干燥前的青蒿琥酯脂质体(图 1C)和粉雾剂重悬液(图 1D)均呈规则类球形, 前者粒径约为43 nm, 粉雾剂复溶分散后的粒径约为42 nm, 表明青蒿琥酯脂质体的冻干处方和工艺不影响脂质体的稳定性。
 | Figure 1 Particle size, zeta potential and morphologies of artesunate liposomes. A: Particle size of artesunate liposome; B: Zeta potential of artesunate liposome. Morphology of lipo somal artesunate dry powder inhalers (LADPIs) by transmission electron microscopy. C: Artesunate liposomes; D: Constructed dry powder inhaler (DPI) suspension |
按照优选处方制备3批青蒿琥酯脂质体, 平行测定3次, 脂质体包封率为(71.4±0.9)%, 载药量为(7.1±0.2)%, 表明优选处方得到青蒿琥酯脂质体包封率高、工艺稳定。该批脂质体粉雾剂水化后的包封率为72.3%, 载药量为6.96%, 说明冻干和水化基本不影响脂质体的结构和青蒿琥酯的包封。
3 青蒿琥酯脂质体粉雾剂的理化性质 3.1 外观青蒿琥酯脂质体为均匀半透明的混悬液。脂质体冷冻干燥后粉雾剂为白色粉末, 粉雾剂复溶分散后仍然为均匀混悬液。
3.2 粉雾剂空气动力学粒径空气动力学粒径在1~5 μm内, 可以到达肺深部。青蒿琥酯脂质体粉雾剂几何粒径为8.4 μm, 振实密度为0.2 g·mL-1, 空气动力学粒径为(4.2±0.05) μm (n=3), 适合肺吸入给药。
3.3 粉雾剂肺部沉积率肺部沉积率可以模拟体内药物分布, LADPIs在各个级别均有分布, 2~7级占所有级别含量为34.5% (图 2), 即有34.5%青蒿琥酯脂质体沉积在肺部, 肺部沉积率较高。肺部沉降率也证明LADPIs能满足粉雾剂给药要求。
 | Figure 2 Deposition of LADPIs in the Next Generation Impactor (NGI) |
在人工肺液中, LADPIs和青蒿琥酯原料药的释药都较快, 12 h后均可达到60%左右。二者的释药曲线也相近。青蒿琥酯释药特点证明药物在人工肺液中的溶解较好, 脂质体对药物释放影响很小, 在肺内很快释药发挥作用(图 3)。
 | Figure 3 Release of artesunate powder and LADPIs |
ALI模型组、空白脂质体粉雾剂组大鼠外观和行为均出现不同程度变化, 包括自主活动明显减少、状态萎靡、精神倦怠和缩成一团; 呼吸节奏加快, 频率加强, 并伴有喘鸣音; 出现较为严重腹泻和便溏。地塞米松组、青蒿琥酯原料药组和青蒿琥酯脂质体粉雾剂组大鼠行为活动基本正常, 呼吸和消化道症状较轻。正常对照组大鼠行为活动正常, 均未出现上述症状。
5 青蒿琥酯脂质体具有减轻肺损伤的作用肺部病变程度可以直接反映肺损伤情况。解剖分离的肺组织直接观察发现, 正常组大鼠肺组织外观色泽粉红、无明显异常改变; 模型组和空白脂质体粉雾剂组大鼠肺体积肿大、色泽暗红; 地塞米松组、青蒿琥酯原料药组和LADPIs组大鼠肺组织上述症状较轻。病理切片的显微镜检查发现, 正常对照组大鼠肺组织结构清晰、肺泡腔完整、肺泡腔内无炎性细胞的浸润和肺泡壁薄(图 4a); 模型组大鼠肺泡结构被广泛破坏, 肺间质明显增厚, 肺泡腔内充满粉红色渗出液, 大量炎症细胞浸润(图 4b); 空白脂质体粉雾剂组大鼠肺组织病变与模型组类似, 未见减轻(图 4c)。地塞米松组(图 4d)、青蒿琥酯原料药组(图 4e)和LADPIs组(图 4f)大鼠肺组织病变较模型组减轻, 尤其是渗出性病变显著减轻, 只观察到少量炎症细胞浸润的现象。肺组织结构较完整, 肺间质稍有增厚。
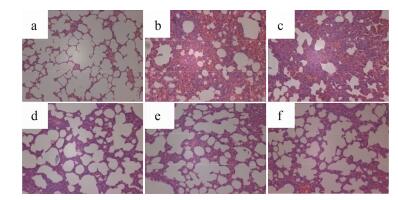 | Figure 4 Histopathological sections of rat lung tissues (HE staining, 100×). a: Healthy rat lung; b: Lung of acute lung injury (ALI) models; c: Lung of blank liposome group; d: Lung of dexamethasone group; e: Lung of artesunate powder group; f: Lung of LADPIs group |
IL-6和TNF-α是典型炎症指标。ALI产生时, 肺内的IL-6具有促炎特性, 能使中性粒细胞募集、渗透, 产生中性粒细胞介导的组织损伤和导致肺水肿。TNF-α被认为是介导ALI的主要细胞因子, 同时, 肺巨噬细胞释放的TNF-α激活损伤粒细胞、内皮细胞和血小板等, 诱导组织细胞的损伤[21, 22]。ALI时肺泡上皮细胞被大量破坏, 使蛋白渗透进入肺泡。在本研究中, LPS诱导产生大鼠ALI, 模型组和空白脂质体粉雾剂组大鼠肺泡灌洗液IL-6、TNF-α和蛋白含量比正常组高且存在显著性差异(P < 0.05); LADPIs组大鼠肺泡灌洗液IL-6、TNF-α水平与正常组无显著性差异(P > 0.05);地塞米松组、青蒿琥酯原料药组和LADPIs组大鼠肺泡灌洗液IL-6、TNF-α和蛋白含量比模型组低且存在显著性差异(P < 0.05)。LADPIs组大鼠肺泡灌洗液IL-6、TNF-α和蛋白含量比青蒿琥酯原料药组低且两者之间存在显著性差异(P < 0.05)。因此, 青蒿琥酯可抑制IL-6和TNF-α表达, 且可能具有保护肺泡上皮细胞的作用, 特别是青蒿琥酯脂质体的效果更加明显, 表明脂质体剂型可提高脂溶性的青蒿琥酯的肺内利用(图 5)。
 | Figure 5 Levels of IL-6 (A), proteins in the lung bronchial veolar lavage fluid (BALF, B) and TNF-α(C) of lipopolysac charide (LPS)-induced ALI rat lungs. n=6, x±s. P < 0.05, **P < 0.01 |
ALI主要发病机制是过度失控的炎性反应和促炎抗炎反应失衡。肺损伤时, 巨噬细胞释放促炎性因子IL-6和TNF-α等, 导致中性粒细胞从肺微血管进入肺泡中, 活化的中性粒细胞释放白三烯、蛋白酶和血小板活化因子, 后者会导致肺组织损伤、水肿、表面活性剂失活和透明膜形成[23]。本文发现青蒿琥酯可减轻脂多糖诱导的大鼠ALI, 并证明青蒿琥酯通过抑制IL-6和TNF-α的表达而发挥抗炎作用。青蒿琥酯降低总蛋白含量, 有可能是青蒿琥酯具有保护肺泡上皮细胞的作用。
青蒿琥酯是青蒿素衍生物, 难溶于水。为增强青蒿琥酯生理环境中的扩散效果, 提高青蒿琥酯生物利用率, 本文用薄膜分散法将青蒿琥酯制备成脂质体。脂质体将青蒿琥酯包封于类脂质双分子层薄膜中, 利用脂质体高度分散、在生理环境中易扩散、易与细胞膜融合的特点, 将青蒿琥酯递送入细胞内部, 更好地发挥抗炎作用。
体外肺部沉降率实验可较好地评估粉雾剂在呼吸道不同部位的沉积效果。在60 L·min-1气流速度条件下, 撞击器的1~7级截止的粒径大小分别为8.06、4.43、2.82、1.66、0.94、0.55和0.34 μm。其中1级粒径较大, 一般分布在上呼吸道; 2~7级粒子的粒径小于5 μm, 较易进入肺部, 并能沉积在肺深部; 而8级粒子的粒径太小并较轻, 易随呼吸排出体外, 不能沉积在肺深处。因此, 一般选择2~7级沉积的药物百分含量代表粉雾剂肺部沉积率。LADPIs肺部沉积率为34.5%。
预实验证明肺吸入给予ALI大鼠不同剂量(0.5、1、2 mg)的青蒿琥酯原料药, 发现0.5 mg剂量时治疗效果不佳, 1和2 mg剂量时效果较好, 但相差不大。作者选择青蒿琥酯脂质体粉雾剂的量为15 mg, 含青蒿琥酯约1 mg, 治疗ALI效果较好, 同时也证明比相同剂量的原料药好。
本文通过气管喷入LPS造成ALI, 模型成功率较高。将青蒿琥酯脂质体粉雾剂通过气管喷入大鼠肺部, 使药物直接到达损伤部位, 并由于脂质体剂型特点, 提高肺部药物浓度和生物利用度, 改善了青蒿琥酯对ALI的治疗效果。因此, 青蒿琥酯脂质体肺吸入粉雾剂有望成为治疗ALI的有效制剂。
| [1] | Tu YY, Ni MY, Zhong YR, et al. Studies on the constituents of Artemisia annua L[J]. Acta Pharm Sin (药学学报), 1981, 16 :366–370. |
| [2] | Xu H, He Y, Yang X, et al. Anti-malarial agent artesunate inhibits TNF-α-induced production of proinflammatory cytokines via inhibition of NF-κB and PI3 kinase/Akt signal pathway in human rheumatoid arthritis fibroblast-like synoviocytes[J]. Rheumatology, 2007, 46 :920–926. DOI:10.1093/rheumatology/kem014 |
| [3] | Jin O, Zhang H, Gu Z, et al. A pilot study of the therapeutic efficacy and mechanism of artesunate in the MRL/LPR murine model of systemic lupus erythematosus[J]. Cell Mol Immunol, 2009, 6 :461–467. DOI:10.1038/cmi.2009.58 |
| [4] | Li B, Li J, Pan X, et al. Artesunate protects sepsis model mice challenged with Staphylococcus aureus by decreasing TNF-α release via inhibition of TLR2 and Nod2 mRNA expressions and transcription factor NF-κB activation[J]. Int Immunopharmacol, 2010, 10 :344–350. DOI:10.1016/j.intimp.2009.12.006 |
| [5] | Ho WH, Cheng C, Peh HY, et al. Anti-malarial drug artesunate ameliorates oxidative lung damage in experimental allergic asthma[J]. Free Radic Biol Med, 2012, 53 :498–507. DOI:10.1016/j.freeradbiomed.2012.05.021 |
| [6] | Chinaeke EE, Chime SA, Ogbonna JDN, et al. Evaluation of dika wax-soybean oil-based artesunate-loaded lipospheres:in vitro-in vivo correlation studies[J]. J Microencapsul, 2014, 31 :796–804. DOI:10.3109/02652048.2014.940008 |
| [7] | Raghavendran K, Napolitano LM. Ali and ards:challenges and advances[J]. Crit Care Clin, 2011, 27 :429–437. DOI:10.1016/j.ccc.2011.05.006 |
| [8] | Ferguson ND, Fan E, Camporota L, et al. The berlin definition of ARDS:an expanded rationale, justification, and supplementary material[J]. Intensive Care Med, 2012, 38 :1573–1582. DOI:10.1007/s00134-012-2682-1 |
| [9] | Zambon M, Vincent JL. Mortality rates for patients with acute lung injury/ARDS have decreased over time[J]. Chest, 2008, 133 :1120–1127. DOI:10.1378/chest.07-2134 |
| [10] | Jin YG, Li M. Pulmonary drug delivery systems and progress in their applications to lung disease treatment[J]. J Int Pharm Res (国际药学研究杂志), 2015, 42 :289–295. |
| [11] | Zhang J, Li MY, Xiang ML, et al. Preparation and pharmacodynamic study of curcumin liposome dry powder inhalation[J]. Mil Med Sci (军事医学), 2013, 37 :692–695. |
| [12] | Xiang XQ, Du LN, Li M, et al. Preparation of oridonin dry powder for inhalation and its therapeutic effect on acute lung injury of rats[J]. J Int Pharm Res (国际药学研究杂志), 2014, 41 :211–215. |
| [13] | Zhu L, Li M, Dong J, et al. Dimethyl silicone dry nanoemulsion inhalations:formulation study and anti-acute lung injury effect[J]. J Int Pharm, 2015, 491 :292–298. DOI:10.1016/j.ijpharm.2015.06.041 |
| [14] | Qu JJ, Feng SH. Preparation of artemisinin liposomes and study on its performance[J]. Beijing Union Univ Nat Sci (北京联合大学学报(自然科学版)), 2010, 24 :14–18. |
| [15] | Yan RL, Liu ZG. Study on optimizing prescription of baicalein long circulating liposomes[J]. J Chin Med Mater (中药材), 2010, 33 :122–125. |
| [16] | Pilcer G, Amighi K. Formulation strategy and use of excipients in pulmonary drug delivery[J]. J Int Pharm, 2010, 392 :1–19. DOI:10.1016/j.ijpharm.2010.03.017 |
| [17] | Depreter F, Pilcer G, Amighi K. Inhaled proteins:challenges and perspectives[J]. J Int Pharm, 2013, 447 :251–280. DOI:10.1016/j.ijpharm.2013.02.031 |
| [18] | Elversson J, Millqvist-Fureby A, Alderborn G, et al. Droplet and particle size relationship and shell thickness of inhalable lactose particles during spray drying[J]. J Pharm Sci, 2003, 92 :900–910. DOI:10.1002/jps.10352 |
| [19] | He Y. Studies on Powder Aerosols for Inhalation of Fhcin (返魂草素吸入粉雾剂的研究)[D]. Dalian:Dalian Medical University, 2013. |
| [20] | Yang Y, Xie X, Yang Y, et al. A review on the influences of size and surface charge of liposome on its targeted drug delivery in vivo[J]. Acta Pharm Sin (药学学报), 2013, 48 :1644–1650. |
| [21] | Wan L, Tan J, Wan S, et al. Anti-inflammatory and antioxidative effects of dexpanthenol on lipopolysaccharide induced acute lung injury in mice[J]. Inflammation, 2016, 39 :1757–1763. DOI:10.1007/s10753-016-0410-7 |
| [22] | Bhatia M, Moochhala S. Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome[J]. J Pathol, 2004, 202 :145–156. DOI:10.1002/(ISSN)1096-9896 |
| [23] | Matthay M, Zimmerman G. Acute lung injury and the acute respiratory distress syndrome[J]. Am J Respir Cell Mol Biol, 2005, 33 :319–327. DOI:10.1165/rcmb.F305 |
 2016, Vol. 51
2016, Vol. 51


