2. 浙江海正药业股份有限公司, 浙江 台州 318000;
3. 军事医学科学院基础医学研究所, 北京 100850
2. Zhejiang Hisun Pharmaceutical Co., Ltd., Taizhou 318000, China;
3. Beijing Institute of Basic Medical Sciences, Beijing 100850, China
重组单克隆抗体(单抗)药物因其靶向明确、高特异性以及优越的药代动力学特性, 在肿瘤、自身免疫性疾病、感染性疾病等治疗领域得到广泛的应用, 成为生物药的主要组成部分。但作为复杂的蛋白大分子药物, 单抗其本身的稳定性受到各种复杂条件的影响, 无论是在生产、纯化、灌装还是存储、运输等过程中都可能造成其异质性, 产生诸如:电荷、分子大小等变异体。变异体的产生会影响产品的理化性质、生物学活性、体内药代动力学等特征。因此为有效地对单抗药物的质量进行控制, 保证其安全性和有效性, 在临床前和临床研究期间须对单抗药物的稳定性进行全面评估和深入质量研究, 进而制定对应的质控策略。
分子大小变异体是抗体药物常见的变异体类型, 也是抗体稳定性评价和研究中需重点关注的变异体类型。单抗在特定的条件下, 或会形成高分子量分子如二聚体[1]、多聚体[2, 3]; 或发生降解、断裂形成低分子量的片段[4]。分子大小变异体会影响抗体的活性或效价, 并会改变药物在体内的代谢[4, 5], 或增加免疫原性[6, 7], 对产品的安全性和有效性带来挑战。而强制降解(如高温)条件下的稳定性研究, 常可以获得单抗药物可能的降解途径、降解速率和敏感条件的信息, 这对于产品质量标准制订和产品有效期的设定, 以及产品工艺和制剂处方的优化具有指导意义[8, 9]。
rhumAb1为糖基化改造Ⅱ型抗CD20人源化单克隆抗体, 通过对Obinutuzumab (商品名Gazyva)[10]的序列进行优化后获得, 其抗原的结合表位和作用机制与Obinutuzumab[11]一致。rhumAb1在经基因工程改造的去岩藻糖化的细胞株(CHOK1-AF)中表达, 其不含岩藻糖的糖型比例 > 99%, 显著高于Obinutuzumab, 具有更强的抗体依赖细胞介导的细胞毒活性(antibody dependent cell mediated cytotoxicity, ADCC)[12]。该抗体产品经分子排阻色谱(size exclusion chromatography, SEC-HPLC)和非还原毛细管电泳法(capillary elec trophoresis sodium dodecyl sulfate, CE-SDS)检测, 其纯度分别为99.8%和97.4%;但在高温强制降解条件下(40 ℃), 其高分子量(聚体)和低分子量(片段)变异体的种类和数量会随时间逐渐增加。本研究通过SEC-HPLC、CE-SDS并结合液质联用(liquid chro matography-mass spectrometry, LC-MS)、ADCC等技术手段, 对rhumAb1在高温破坏后的分子大小变异体的组成和活性进行鉴定和研究, 为有效进行质量控制奠定基础, 也为了解其他单抗药物可能具有的高温降解机制及其分子大小变异体种类提供借鉴。
材料与方法主要设备及试剂 1260高效液相色谱仪(Agilent公司); TripleTOF质谱仪及质谱分析软件PeakView (AB Sciex公司); 毛细管电泳仪PA800 plus (AB Sciex公司); 酶标仪Spectramax I3 (Molecular Devices公司); 细胞计数仪IC1000 (Countstar公司); 二氧化碳培养箱(Thermo公司)。
重组人源化单克隆抗体rhumAb1 (批号20141006;规格8 mL:200 mg, 北京天广实生物技术股份有限公司); NK-92MI-CD16a细胞(华博生物医药技术有限公司); Daudi细胞(ATCC); MEM培养基(Gibco公司); FBS (Biowest公司); 细胞毒检测试剂盒(LDH) (Roche公司); 二硫苏糖醇(dithiothreitol, DTT, Sigma公司); 碘乙酰胺(IAM, Sigma公司); 胰酶(Promega公司); TCEP (Sigma公司); MOPS (Sigma公司); SDS-MW Analysis Kit (AB Sciex公司); 甲酸(CNW公司); 色谱乙腈(Fisher公司)。
样品高温破坏处理 取rhumAb1 (批号20141006;规格8 mL:200 mg), 倒置于40±3 ℃, 于恒温恒湿箱中(相对湿度75%±5%), 分别处理7天、15天和30天。
SEC-HPLC分析 色谱柱TSK-GEL G3000 SWxl (7.8 mm × 300 mm, TOSOH公司), 流动相为0.20 mol·L-1磷酸钾缓冲液、0.25 mol·L-1氯化钾(pH 6.2), 流速为0.5 mL·min-1, 柱温: 30 ℃, 波长280 nm检测, 进样50 µg, 运行时间30 min。
分子大小变异体组分富集 rhumAb1的分子大小变异体研究流程图如图 1所示, 通过SEC-HPLC分离富集SEC-1~SEC-4四个组分, 10 kDa的超滤管超滤浓缩, SEC-1~SEC-4四个组分富集后分别命名为F1、F2、F3、F4 (图 1)。
 | Figure 1 The workflow for characterization of rhumAb1 size variants. SEC-HPLC: Size exclusion chromatography; CE-SDS: Capillary electrophoresis sodium dodecyl sulfate; LC-MS: Liquid chromatography-mass spectrometry; ADCC: Antibody dependent cell mediated cytotoxicity |
非还原CE-SDS分析 取样品100 µg, 加入缓冲液(SDS-MW Analysis Kit) 50 µL、1 mol·L-1碘乙酰胺1.5 µL, 加超纯水至100 µL, 70 ℃水浴10 min, 离心后取上清液进样分析。毛细管电泳仪器参数:进样电压5 kV, 进样时间20 s; 分离电压15 kV, 分离时间40 min; 极性:负极到正极(反向); PDA检测器, 检测波长220 nm; 毛细管柱: uncoated, 内径50 μm, 有效长度20 cm, 总长度30 cm。
还原CE-SDS分析 取样品100 µg, 分别加入β-巯基乙醇5 µL、缓冲液(SDS-MW Analysis Kit) 50 µL, 加入超纯水至100 µL, 其余操作同非还原CE-SDS分析。
蛋白分子量检测(LC-MS) 样品稀释至1 mg·mL-1后液质联用分析, 色谱柱R1/20 (2.1 mm × 30 mm, Applied Biosystems公司), 流动相A: 0.1%甲酸水溶液; 流动相B: 0.1%甲酸乙腈溶液, 流速为1 mL·min-1, 柱温: 50 ℃, B相比例在10 min内由1%升至98%, 洗脱蛋白。质谱检测模式:正离子模式, 质荷比范围: 600~4 000 Da, 其他主要参数为CUR 35.0, GS1: 55.0, GS2 55.0, TEM: 400.0, ISVF: 5 500.0, CE: 30.0, DP: 300.0。
还原分子量检测:样品稀释至1 mg·mL-1加入DTT至20 mmol·L-1, 37 ℃孵育30 min后, 同法检测。
断裂位点的二级质谱确认 样品经变性缓冲液(6 mol·L-1盐酸胍, 300 mmol·L-1醋酸钠, pH 5.0)稀释至1 mg·mL-1后, 加1 mol·L-1 TCEP至终浓度为10 mmol·L-1, 37 ℃孵育15 min; 样品经PD-10柱置换溶液为酶解缓冲液(20 mmol·L-1 MOPS, 0.5 mmol·L-1 TCEP, pH 7.0)后, 按照胰酶:样品=1:35的比例加入胰蛋白酶, 短暂涡旋混匀后, 37 ℃水浴酶切2 h后液质联用分析。
色谱条件为:色谱柱Jupiter C18 column (2.0 mm × 250 mm, Phnomenex公司), 流动相A: 0.1%甲酸的水溶液; 流动相B: 0.1%甲酸的乙腈溶液, 流速为0.25 mL·min-1, 柱温: 55 ℃, B相比例在10 min内由1%升至10%, 90 min内由10%升至40%分离肽段; 质谱检测模式:正离子模式, 一级质荷比范围: 350~2 500 Da, 二级质荷比范围: 100~1 250 Da, 其他主要参数为CUR 25.0, GS1: 55.0, GS2 55.0, TEM: 550.0, ISVF: 5 500.0, CES: 5, DP: 100.0。
ADCC活性检测 将样品稀释为0.5 μg·mL-1后, 10倍梯度稀释获得8个浓度点, 以每孔20 μL加入96孔板中, 每孔加入NK92-MI-CD16a细胞悬液(密度为每毫升12.5×105个) 40 μL和Daudi细胞悬液(密度为每毫升2.5×105个) 40 μL, 混匀, 37 ℃、5% CO2细胞培养箱中培养4 h。用细胞毒检测试剂盒(LDH)显色, 492 nm处读取OD值, softmax软件进行四参数方程拟合分析, 根据样品和参比品的半数有效浓度(EC50), 按照以下公式计算出供试品的相对活性。
| $ ADCC相对活性\left( \% \right) = \frac{{参比品{\rm{E}}{{\rm{C}}_{50}}}}{{供试品{\rm{E}}{{\rm{C}}_{50}}}} \times 100\% $ |
经SEC-HPLC分析, rhumAb1单体的含量为99.8%, 仅含0.2%的高分子量组分(SEC-1) (图 2A); 非还原CE-SDS分析, rhumAb1主峰纯度为97.4%, 含有多个小分子量的片段(图 2B); 高温(40 ℃)破坏后, SEC-HPLC和非还原CE-SDS的检测表明rhumAb1的分子大小变异体的种类和比例皆显著增加, 单体比例分别下降至98.5%和94.1% (图 2A和图 2B)。
 | Figure 2 Analysis of rhumAb1 size variants by SEC-HPLC and non-reduced CE-SDS. A: SEC-HPLC analysis of rhumAb1 sizevariants; B: Non-reduced CE-SDS analysis of rhumAb1 size variants; C: SEC-HPLC analysis of the fractions (F1-F4); D: Non-reduced CE-SDS analysis of the fractions (F1-F4) |
rhumAb1的分子大小变异体研究流程图如图 1所示, rhumAb1 (批号: 20141006)高温(40 ℃)破坏30天后, 经SEC-HPLC分离、富集, 得到4个组分(F1、F2、F3和F4), 通过SEC-HPLC、非还原CE-SDS并结合液质联用(LC-MS)、ADCC活性等方法对组分F1~F4的组成和活性进行鉴定和研究。
经SEC-HPLC分析, F1~F4主要对应了SEC-HPLC中的4个分子大小变异体SEC-1~SEC-4 (图 2C), 各组分相对应的纯度如表 1所示, 皆在84.5%以上; F1~F4经非还原CE-SDS分析, 结果如图 2D和表 2所示, F1主要为NR-7组分; F2主要为NR-6和NR-5; F3主要为NR-4和NR-3; F4主要为NR-2和NR-1。
| Table 1 SEC-HPLC analysis results of the fractions (F1-F4) |
| Table 2 Non-reduced CE-SDS analysis results of the fractions (F1-F4) |
经SEC-HPLC和非还原CE-SDS分析, F1中的变异体主要为SEC-1 (图 2C)和NR-7 (图 2D); 经LC-MS分析, F1的主要分子量为297 259.4 Da (图 3A), 与rhumAb1的二聚体的理论分子量一致(表 3)。
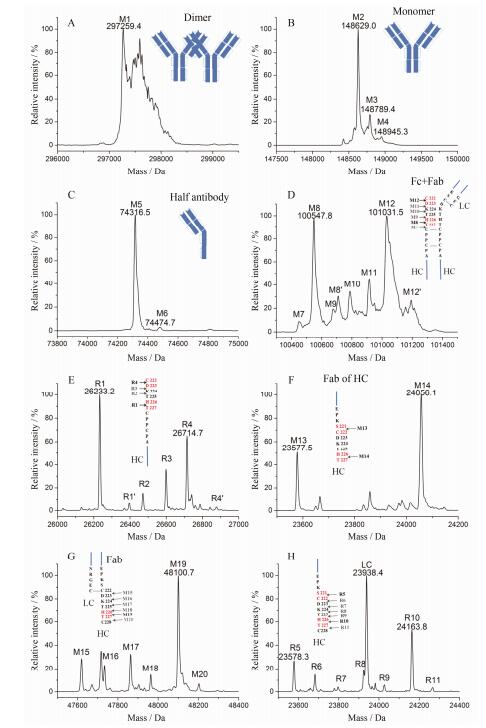 | Figure 3 Molecular mass analysis of F1-F4 by LC-MS. A: F1 (NR-7); B: F2 (NR-6); C: F3 (NR-3); D: F3 (NR-4); E: Reduced F3; F: F4 (NR-1); G: F4 (NR-2); H: Reduced F4. HC: Heavy chain; LC: Light chain; (Cleavage sites of heavy-chain hinge region were shown by arrows) |
| Table 3 Molecular mass determination results of the fraction F1-F4 |
经SEC-HPLC分析, F2中99.7%为SEC-2 (表 1); 经CE-SDS分析, F2中97.4%为NR-6, 1.8%为NR-5 (表 2)。LC-MS分析表明F2主要分子量为148 629.0 Da (M2)、148 789.4 Da (M3)和148 945.3 Da (M4) (图 3B), 为不同N糖修饰的rhumAb1单体(表 3); LC-MS分析未发现NR-5对应的质谱信号, 根据NR-5在CE-SDS中的相对分子量(约125 kDa), 推测NR-5为CE-SDS的样品处理过程中, 轻链与重链间二硫键被破坏后而形成的2个重链和1个轻链的复合物(HHL)[13, 14]。
2.2.3 F 3组分鉴定经SEC-HPLC分析, F3中90.3%为SEC-3 (表 1); 经CE-SDS分析, F3中79.2%为NR-4, 4.2%为NR-3 (表 2)。LC-MS分析发现F3在75 kDa和100 kDa附近存在多个分子量, 分别对应NR-3和NR-4变异体。
F3在75 kDa附近(即NR-3)的主要分子量为74 316.5 Da (图 3C), 为抗体的半抗(轻链+重链)。F3在100 kDa (NR-4)附近的分子量分布如图 3D和表 3所示, 含有M7~M12等多个分子量, 通过对比理论分子量, 确认NR-4为抗体重链铰链区断裂, 丢失了一个Fab区域后剩余的Fc+Fab部分; 铰链区的S221-C222-D223-K224-T225-H226-T227-C228区域存在多个断裂位点, 其中H226-T227和C222-D223为两个主要断裂位点, 断裂后形成M8和M12。
F3的断裂位点也通过还原后的LC-MS检测进行确证。F3经DTT还原后, 除轻链和重链外, 也存在多个片段R1~R4 (图 3E), 通过对比理论分子量, 确认R1~R4为铰链区断裂后重链C端, 其中H226-T227和C222-D223为主要断裂位点。
2.4 F4组分鉴定经SEC-HPLC分析, F4中89.8%为SEC-4 (表 1); 经CE-SDS分析, F4中33.2%为NR-1, 59.7%为NR-2 (表 2)。LC-MS分析发现F4在25 kDa和50 kDa附近分别存在多个分子量, 对应了NR-1和NR-2变异体。
F4在25 kDa (NR-1)附近的分子量分布如图 3F和表 3所示, 主要为单抗在铰链区断裂后重链的Fab区, 主要断裂位点为S221-C222 (M13)和T225-H226 (M14), 其中M14比HC (1-225)的理论分子量多32 Da左右(表 3), 而还原后分子量(R9)与HC (1-225)的理论分子量一致(表 4), 推测M14为222位的半胱氨酸(C)与一个硫分子形成二硫键所致。F4在50 kDa (NR-2)附近的分子量分布如图 3G和表 3所示, 为铰链区断裂后的Fab部分, 其主要断裂位点为H226-T227。
| Table 4 Molecular mass determination results of reduced F3 and F4 |
F4经DTT还原后, LC-MS检测蛋白分子量如图 3H和表 4所示, 存在多个片段R5~R11, 通过对比理论分子量, 确认R5~R11为铰链区断裂后重链的N端, 其中H226-T227为主要断裂位点, 断裂后形成R10。
2.5 液质联用二级质谱(LC-MS/MS)对主要断裂位点的确认为了进一步确认断裂位点, 经还原处理、胰酶酶切后的肽图用LC-MS/MS进行分析。F3样品断裂区域的序列为: KSC222-D223KTH226-T227CPPCPAPELLGGPSVFLFPPKPK (-:为主要断裂区域); H226-T227断裂后经胰酶酶切形成肽段: TCPPC PAPELLGGPSVFLFPPKPK, 其3价离子(831.44 Da)进行二级质谱分析(图 4A), 肽段序列经多个b/y离子确认; C222-D223断裂后经胰酶酶切形成仅含两个氨基酸的肽段DK, 不易检测; 但检测到其胰酶漏切的肽段DKTHTCPPCPAPELLGGPSVFLFPPKPK, 对其4价离子(744.14 Da)进行二级质谱分析(图 4B), 经b/y离子确认其肽段序列。
 | Figure 4 Identification of the cleavage sites by tandem mass spectra. The confirmed y and b series of ions are highlighted in red. A: MS/MS spectra of the (M+3H)3+ precursor peptide ion (T227-K250, m/z 831.4 Da). B: MS/MS spectra of the (M+4H)4+ precursor peptide ion (D223-K250, m/z 744.1 Da) |
F4中组分的断裂位点与赖氨酸相邻(KS221-C222DKT225-H226-T227), 经胰酶酶解为单氨基酸或短肽(S、T、TH), 与溶剂共洗脱, 难以检出。
3 ADCC活性ADCC活性检测结果如图 5A所示, F1、F3和F4组分的ADCC活性分别相当于F2 (rhumAb1的完整单体)的76.8%、14.1%和5.9%。F1的ADCC活性为F2组分的76.8%, 但考虑到F1中含有11.8%的单体, 因此rhumAb1二聚体的ADCC活性仅相当于单体活性的一半左右; F3和F4组分的ADCC活性为14.1%和5.9%, 与F3和F4组分残留的少量单体比例(8.9%和7.0%)相近, 推测其少量的活性主要由F3和F4组分中残留的抗体单体所致, 而SEC-3 (NR-3和NR-4)和SEC-4 (NR-1和NR-2)则基本无ADCC活性。
 | Figure 5 ADCC activity of F1-F4. A: ADCC activity of F1-F4; B: The schematic diagram of ADCC mechanism |
稳定性研究是贯穿于整个药品研发阶段和支持药品上市及上市后研究的重要内容, 也是产品质量标准制订、产品有效期设定的依据和基础。《生物制品稳定性研究技术指导原则(试行)》也指出在生物制品的稳定性研究中, 对于新的降解产物出现或者是含量变化超出限度时, 建议对其进行鉴定, 同时开展安全性与有效性的评估。尽管单抗与其他重组蛋白类药物相比比较稳定, 但单抗的稳定性也受到各种复杂条件的影响, 形成各种变异体。而分子大小变异体是关系到单抗产品的安全性和有效性, 同时也是生产工艺的可控性、制剂处方的合理性和单抗产品稳定性的重要的评价指标。因此, 鉴定分子大小变异体的种类, 研究其形成机制, 评估其对产品的影响, 并进行恰当合理的控制, 是贯穿整个产品研发、生产周期中的重要工作。
SEC-HPLC和CE-SDS是单抗分子大小纯度检测的主要手段, SEC-HPLC能够较好地区分抗体的聚体和单体, 主要反映生理状态下的分子大小分布; CE-SDS在阴离子表面活性剂十二烷基磺酸钠SDS的存在下, 会将蛋白分子去折叠, 检测变性条件下分子大小分布, 对于抗体的低分子量片段有着更高的分辨率[15]。rhumAb1在强制降解条件下(高温40 ℃), 其分子大小变异体随时间逐渐增加, 经SEC-HPLC分析含有4个分子大小变异体(SEC-1~SEC-4), 非还原CE-SDS分析含有7个主要的分子大小变异体(NR-1~NR-7)。本研究利用SEC-HPLC富集了4个分子大小组分(F1~F4)后, 通过SEC、CE-SDS并结合液质联用(LC-MS)和二级质谱等技术手段鉴定了各分子大小变异体的主要组成和结构: SEC-1和NR-7为rhumAb1的二聚体分子(图 3A); SEC-2包含非还原CE-SDS中的NR-5和NR-6, NR-6为单体分子(图 3B), 而NR-5为在CE-SDS的样品处理过程中, 形成的2个重链和1个轻链的复合物(HHL); SEC-3包含NR-3和NR-4, 其中NR-3为rhumAb1的半抗(轻链+重链) (图 3C), NR-4为重链铰链区断裂形成的Fc+ Fab (图 3D); SEC-4中含有NR-1和NR-2, 其中NR-1为铰链区断裂后重链的Fab区(图 3F), NR-2为铰链区断裂后的Fab部分(图 3G)。SEC-3、SEC-4以及NR-1~NR-4皆是由于重链铰链区的断裂所致, 断裂位点主要集中在S221-C222-D223-K224-T225-H226-T227-C228区域, 其中C222-D223和H226-T227为主要断裂位点。抗体的铰链区断裂是抗体分子中一种常见的碎片产生方式[4], 其经β体消除[16]或自由基介导的以半胱氨酸和组氨酸为中心的电子转移反应[17-19]等化学过程而断裂, 并且会受到环境(温度、pH、金属离子等)的影响, 该区域的断裂是抗体分子中一种常见的碎片产生方式[4], 因此本研究也为其他抗体药物的分子大小变异体的鉴定提供了参考。
rhumAb1为新一代糖基化改造的Ⅱ型抗CD20的IgG1κ抗体, ADCC是其发挥抗肿瘤作用的主要机制, rhumAb1首先通过Fab区与靶细胞表面的CD20抗原(同源四聚体)相结合[20, 21], 效应细胞(如人自然杀伤NK细胞)借助其表面受体(如FcγRIIIA)与rhumAb1的Fc区结合, NK细胞活化后通过释放穿孔素、颗粒酶等细胞毒物质杀伤靶细胞, 发挥ADCC的作用。rhumAb1通过敲除岩藻糖提高FcγRIIIA的亲和力从而增强了结合或募集ADCC效应细胞的能力, 提高了ADCC活性。本研究对rhumAb1分子大小变异体的ADCC活性也进行了研究, 如图 5B所示, F1 (二聚体)的每个分子中虽包含了两个单体, 但只能结合一个抗原的同源四聚体, 故其ADCC活性仅相当于F2 (单体)的一半; F3 (Fc+Fab、半抗)尽管其分子中仍含有一个Fab区, 但基本没有ADCC活性, 表明rhumAb1与抗原的稳定结合需要抗体(Fab')2区双臂的协同作用; F4 (Fab、重链的Fab区)因没有Fc区无法与NK细胞的表面受体结合, 因此没有ADCC活性。ADCC活性鉴定结果表明rhumAb1在高温强制破坏条件下产生的分子大小变异体会降低产品的活性, 因此在生产、储存和运输过程中需避免rhumAb1产品暴露于高温环境, 以保证rhumAb1的产品质量。
本研究通过高效液相色谱和毛细管电泳两种不同分离原理的分析方法, 并结合液质联用技术对rhumAb1主要变异体(聚合体以及降解片段)的组成进行了鉴定, 确定了主要成分的分子量和降解的位点, 阐明了rhumAb1在高温条件下的降解途径, 为评估产品有效的储运条件和制定相应的质控策略奠定了基础。本研究发现的主要变异体(如聚体和铰链区断裂)是抗体药物中常见的变异体种类, 其降解途径和形成机制也具有普遍意义, 因此本研究为其他抗体药物的降解机制和途径的研究提供了参考。
| [1] | Plath F, Ringler P, Graff-Meyer A, et al. Characterization of mAb dimers reveals predominant dimer forms common in therapeutic mAbs[J]. MAbs, 2016, 8 :928–940. DOI:10.1080/19420862.2016.1168960 |
| [2] | Moore JM, Patapoff TW, Cromwell ME. Kinetics and thermodynamics of dimer formation and dissociation for a recombinant humanized monoclonal antibody to vascular endothelial growth factor[J]. Biochemistry, 1999, 38 :13960–13967. DOI:10.1021/bi9905516 |
| [3] | Roberts CJ. Therapeutic protein aggregation:mechanisms, design, and control[J]. Trends Biotechnol, 2014, 32 :372–380. DOI:10.1016/j.tibtech.2014.05.005 |
| [4] | Vlasak J, Ionescu R. Fragmentation of monoclonal antibodies[J]. MAbs, 2011, 3 :253–263. DOI:10.4161/mabs.3.3.15608 |
| [5] | Eon-Duval A, Broly H, Gleixner R. Quality attributes of recombinant therapeutic proteins:an assessment of impact on safety and efficacy as part of a quality by design development approach[J]. Biotechnol Prog, 2012, 28 :608–622. DOI:10.1002/btpr.1548 |
| [6] | Ratanji KD, Derrick JP, Dearman RJ, et al. Immunogenicity of therapeutic proteins:influence of aggregation[J]. J Immunotoxicol, 2014, 11 :99–109. DOI:10.3109/1547691X.2013.821564 |
| [7] | Roberts CJ. Protein aggregation and its impact on product quality[J]. Curr Opin Biotechnol, 2014, 30 :211–217. DOI:10.1016/j.copbio.2014.08.001 |
| [8] | ICH. Stability Testing of New Drug Substances and Products, Q1A (R2)[S/OL]. 2003[2016-05-01]. http://www.ich.org/products/guidelines/quality/quality-single/article/stability-testingof-new-drug-substances-and-products.html. |
| [9] | ICH. Stability Testing of Biotechnological/Biological Products, Q5C[S/OL]. 1995[2016-05-01]. http://www.ich.org/products/guidelines/quality/quality-single/article/stability-testing-ofbiotechnologicalbiological-products.html. |
| [10] | Pablo U, Peter B, Claudia F, et al. Antigen binding molecules with increased fc receptor binding affinity and effector function:US, 2005/0123546A1[P]. 2005-06-09. |
| [11] | Smolej L. Targeted treatment for chronic lymphocytic leukemia:clinical potential of obinutuzumab[J]. Pharmacogenomics Pers Med, 2015, 8 :1–7. |
| [12] | Awasthi A, Ayello J, Van de Ven C, et al. Obinutuzumab (GA101) compared to rituximab significantly enhances cell death and antibody-dependent cytotoxicity and improves overall survival against CD20+ rituximab-sensitive/-resistant Burkitt lymphoma (BL) and precursor B-acute lymphoblastic leukaemia (pre-B-ALL):potential targeted therapy in patients with poor risk CD20+ BL and pre-B-ALL[J]. Br J Haematol, 2015, 171 :763–775. DOI:10.1111/bjh.13764 |
| [13] | Liu H, Gaza-Bulseco G, Chumsae C, et al. Characterization of lower molecular weight artifact bands of recombinant monoclonal IgG1 antibodies on non-reducing SDS-PAGE[J]. Biotechnol Lett, 2007, 29 :1611–1622. DOI:10.1007/s10529-007-9449-8 |
| [14] | Zhu ZC, Chen Y, Ackerman MS, et al. Investigation of monoclonal antibody fragmentation artifacts in non-reducing SDS-PAGE[J]. J Pharm Biomed Anal, 2013, 83 :89–95. DOI:10.1016/j.jpba.2013.04.030 |
| [15] | Gahoual R, Beck A, Leize-Wagner E, et al. Cutting-edge capillary electrophoresis characterization of monoclonal antibodies and related products[J]. J Chromatogr B, 2016, 1032 :61–78. DOI:10.1016/j.jchromb.2016.05.028 |
| [16] | Cohen SL, Price C, Vlasak J. Beta-elimination and peptide bond hydrolysis:two distinct mechanisms of human IgG1 hinge fragmentation upon storage[J]. J Am Chem Soc, 2007, 129 :6976–6977. DOI:10.1021/ja0705994 |
| [17] | Yan B, Yates Z, Balland A, et al. Human IgG1 hinge fragmentation as the result of H2O2-mediated radical cleavage[J]. J Biol Chem, 2009, 284 :35390–35402. DOI:10.1074/jbc.M109.064147 |
| [18] | Yates Z, Gunasekaran K, Zhou H, et al. Histidine residue mediates radical-induced hinge cleavage of human IgG1[J]. J Biol Chem, 2010, 285 :18662–18671. |
| [19] | Yan B, Boyd D. Breaking the light and heavy chain linkage of human immunoglobulin G1(IgG1) by radical reactions[J]. J Biol Chem, 2011, 286 :24674–24684. DOI:10.1074/jbc.M111.255026 |
| [20] | Niederfellner G, Lammens A, Mundigl O, et al. Epitope characterization and crystal structure of GA101 provide insights into the molecular basis for type I/Ⅱ distinction of CD20 antibodies[J]. Blood, 2011, 118 :358–367. DOI:10.1182/blood-2010-09-305847 |
| [21] | Klein C, Lammens A, Schafer W, et al. Epitope interactions of monoclonal antibodies targeting CD20 and their relationship to functional properties[J]. MAbs, 2013, 5 :22–33. DOI:10.4161/mabs.22771 |
 2016, Vol. 51
2016, Vol. 51


