2. 中山大学药学院, 广东 广州 510006;
3. 中山大学附属第二医院, 广东 广州 510080;
4. 中山大学附属第一医院, 广东 广州 510080
2. School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China;
3. The Second Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China;
4. The First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China
五酯片是常用的五味子制剂, 收载于国家食品药品监督管理局标准(国药准字Z20025766), 为华中五味子的乙醇提取物制剂, 质控成分为五味子酯甲(schisantherin A), 此外还包括五味子甲素(schi sandrin A)、五味子乙素(schisandrin B)、五味子丙素(schisandrin C)、五味子醇甲(schisandrol A)、五味子醇乙(schisandrol B)等主要木脂素活性成分, 具有抗肝细胞损伤、改善肝细胞代谢的作用, 可降低转氨酶, 对CCl4及乙醇等化学物质引起的肝损伤及自身免疫性肝损伤有全面的保护作用, 是常用的护肝药物[1-4]。作者先前采用LC-MS/MS的方法测定了五酯片中各木脂素活性成分的含量, 结果表明五酯片乙醇提取液中五味子甲素、乙素、丙素、醇甲、醇乙、酯甲的含量分别为12.57±1.59、0.027±0.003 1、0.047±0.005 4、0.077±0.008 6、0.89±0.10和12.97±1.20 mg·g-1[5], 五味子甲素及五味子酯甲在片剂中的含量较高。
五酯片常与他克莫司(一种价格较贵的免疫抑制剂)合用, 以防治器官移植患者中高发的药源性肝功能损害。作者前期研究提示, 五酯片及其活性成分可通过抑制CYP3A介导的代谢, 从而抑制他克莫司的肠及肝首过效应使其血药浓度升高2~3倍[5-7]。据Iwata等[8]报道, 五味子醇甲、醇乙及酯甲在人肝微粒体中对CYP3A的IC50分别为: > 100、6.7~10.1及0.25μmol·L-1。但是, 灌胃给药后, 五酯片各活性成分在大鼠体内是否容易蓄积、其在大鼠肠道及肝脏组织中的浓度是否达到其对CYP3A的抑制浓度, 目前尚不清楚。因此, 本研究利用LC-MS/MS方法检测单次给药后五酯片各木脂素活性成分在大鼠肠道及肝脏的浓度, 考察五酯片各活性成分在大鼠肠道、肝脏的分布特点及随时间的变化规律。
材料与方法仪器设备 Waters 2695 Alliance高效液相色谱仪、Quattro Micro TM三重四极杆质谱系统。
药品与试剂 五味子甲素(≥98%, 批号: 090209)、五味子乙素(≥98%, 批号: 091109)、五味子丙素(≥98%, 批号: 090528)、五味子醇甲(≥98%, 批号: 090722)、五味子醇乙(≥98%, 批号: 090927)、五味子酯甲(≥98%, 批号: 090826), 上述6个五酯片活性成分均购自上海融禾医药科技有限公司; 五酯片(广西方略药业集团有限公司, 批号: 090910);子囊霉素(FK520, 95%, BIOMOL Research Labs., Inc.); 乙酸铵(分析纯, 天津市大茂化学试剂厂, 批号: 070303);硫酸锌(分析纯, 广州化学试剂厂, 批号: 20090319-2);实验中成分含量分析所用试剂均为色谱纯。
实验动物 清洁级Sprague-Dawley (SD)大鼠24只, 雄性, 220~250 g, 由中山大学实验动物中心提供[合格证号: SCXK (粤) 2009-0011], 于SPF级环境饲养, 动物室内温度20~25 ℃、相对湿度40%~70%、每小时换气次数10~15次, 保持12 h光照循环; 期间自由饮水进食, 提供实验室标准动物饲料, 符合我国《实验动物管理条例》和《医学实验动物管理实施细则》。实验前禁食12 h, 自由饮水。
LC-MS/MS条件 LC-MS/MS条件与文献[9]方法相同。具体如下:色谱分析柱为Hypersil BDS C18色谱柱(2.1 mm × 50 mm, 3 μm, 大连依利特科学仪器有限公司); 流动相为甲醇-水(含2 mmol·L-1乙酸铵) (95:5, v/v); 流速为200 μL·min-1; 柱温及样品室温度为20 ℃。每个样品的进样体积为20 μL, 分析时间为2 min。采用电喷雾离子化源(ESI+), 电喷雾电压(capillary voltages)为3 kV, 萃取电压(extractor)为2 V, 脱溶剂温度为350 ℃, 离子源温度为110 ℃, 脱溶剂气为氮气(550 L·h-1), 碰撞气为氩气(50 L·h-1)。选择m/z 417.1→316.1 (五味子甲素)、m/z 401.3→300.4 (五味子乙素)、m/z 385.3→285.3 (五味子丙素)、m/z 433.1→384.1 (五味子醇甲)、m/z 417.4→ 368.3 (五味子醇乙)、m/z 599.0→415.1 (五味子酯甲)及m/z 809.5→756.4 (内标FK520)作为各个成分的检测通道。
大鼠肝脏及肠道匀浆样品的预处理 大鼠肝脏及肠道组织匀浆样品200 μL置2 mL塑料离心管中, 加入内标FK520溶液10 μL, 涡旋振荡30 s混匀; 加入蛋白沉淀剂0.1 mol·L-1 ZnSO4溶液400 μL, 涡旋振荡1 min; 再加入另一蛋白沉淀剂乙腈400 μL, 涡旋振荡1 min。静置10 min, 16 000 r·min-1离心5 min。转移上层有机相至另一5 mL离心管中, 加入1.5 mL乙酸乙酯, 涡旋振荡1 min, 静置10 min, 3 500 r·min-1离心10 min。吸上清液至另一干净1.5 mL离心管中, 于真空干燥器中挥干。残渣用流动相200 μL复溶, 涡旋混合1 min, 16 000 r·min-1离心5 min, 取上清液140 μL加入进样瓶, 进样20 μL进行LC-MS/MS分析。
方法特异性 通过考察6个来自不同大鼠的空白肝脏组织样品色谱图、空白肝脏组织样品外加内标(IS)及五酯片各木脂素成分的色谱图以及用药后实际肝脏组织样品色谱图来反映方法的特异性。
方法准确度与精密度 制备五酯片木脂素活性成分质控浓度的大鼠肝脏组织样品(低、中、高浓度各5个样品), 按上述步骤处理后同时进行LC-MS/MS分析, 考察分析方法的批内精密度和准确度; 通过在不同天连续制备并测定3个合格的分析批(共45个样品), 考察分析方法的批间精密度和准确度。
方法回收率及基质效应 制备五酯片各木脂素活性成分质控浓度的肝脏组织样品(低、中、高浓度各5个样品), 按上述步骤处理, 进行LC-MS/MS分析, 得目标分析物峰面积为A1, 目标分析物峰面积经标准曲线换算得浓度C; 取空白肝脏样品数份, 按上述样品预处理步骤进行处理, 用所得溶液配制质控浓度的目标分析物等标溶液(每浓度各5个样品), 进行LC-MS/MS分析, 得峰面积为A2; 按照“(A1/A2)×100%”计算提取(绝对)回收率, 按照“(C/对应已知浓度)×100%”计算方法(相对)回收率。同时, 制备目标分析物等浓度标液, 进样分析, 得目标分析物峰面积为A3, 依据“(A2/A3)×100%”考察绝对基质效应。
单次灌胃给予五酯片后其木脂素活性成分在大鼠肝脏及肠道的分布 参考五酯片各木脂素活性成分血药浓度-时间曲线变化趋势[9], 选择0.25、1.5、4、6、10和24 h等7个时间点反映吸收相、分布相和消除相的药物分布情况。SD大鼠随机分组后, 给药前一天禁食不禁水12 h, 于次日灌胃给予五酯片混悬液(0.25 g·kg-1), 大鼠给药后2 h禁水, 4 h禁食。给药后0.25、1.5、4、6、10和24 h分批断头处死动物。按照作者已建立好的方法获取组织样本[10], 具体如下:大鼠处死后取其肝脏、小肠等组织, 并用生理盐水冲净肝脏表面的血迹及小肠中的内容物后, 用洁净滤纸吸干水分。其中对于肝脏的处理, 首先称量肝脏的总湿重, 取出约1 g肝组织。而对于小肠, 则取整段小肠称重, 用小剪刀将其剪开, 将其内容物用生理盐水轻轻洗净。用眼科剪将肝脏及小肠剪碎后按重量体积比(g:mL) 1:2加生理盐水制备成匀浆, 组织匀浆样品按200 µL分装数管后于-80 ℃贮存至测定。
样品测定及数据处理 在作者已建立好的分析方法[9]的基础上进一步建立测定大鼠肝脏及肠道中五酯片各木脂素活性成分的快速、灵敏、专属的LC-MS/MS方法, 并对方法的特异性、灵敏度、精密度与准确度、介质效应和回收率等指标进行了验证, 用于检测大鼠肝脏及肠道中五酯片各木脂素活性成分的浓度C0 (ng·mL-1)。对于浓度超出线性范围的生物样本, 用相应的空白生物样本将其稀释, 混匀进行处理后, 再进行LC-MS/MS分析。
结果 1 检测大鼠肝脏及肠道中五酯片木脂素活性成分的LC-MS/MS法的确证虽然作者已建立检测大鼠全血中五酯片各木脂素活性成分的含量测定方法, 但是本实验中需要检测的样本为大鼠的肝脏及肠道组织, 这是与全血不一样的生物介质。因此, 作者在已建立的大鼠全血LC-MS/MS方法的基础上对方法的特异性、精密度与准确度、基质效应和回收率等指标进行了验证。由于预实验显示在大鼠全血、肠道及肝脏组织中无法检测到五味子乙素及丙素, 故未对五味子乙素及丙素的方法学进行相关验证。
1.1 特异性结果表明, 已建立的分析方法同样适用于检测大鼠肝脏及肠道中五酯片各木脂素活性成分的浓度。生物样品中五酯片各木脂素成分与内标峰形良好, 在目标峰保留时间内无杂质峰干扰, 相应色谱图见图 1。
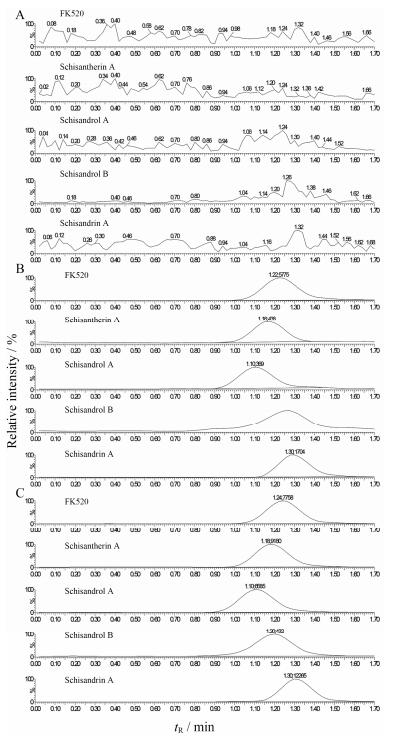 | Figure 1 Representative multiple reaction monitoring (MRM) chromatograms of FK520 and lignans of Wuzhi tablet in rat hepatic tissue. A: A blank hepatic tissue sample; B: A blank hepatic tissue sample spiked with FK520 and lignans of Wuzhi tablet; C: A hepatic tissue sample from a rat after a single oral administration of Wuzhi tablet (WZ, 0.25 g·kg-1) for 0.25 h |
五酯片各木脂素活性成分的标准曲线结果(斜率和截距及相关系数)均由Masslynx V 4.0软件自动计算获得。所有样本的标准曲线各浓度点的偏差在SFDA所推荐的可接受范围之内, 线性相关程度良好(r2 > 0.98), 符合生物样品分析要求。其中, 在大鼠肝脏及肠道组织中五酯片木脂素各活性成分线性范围及代表性的标准曲线见表 1。
| Table 1 Representative calibration curves for determination of lignans in Wuzhi tablet in rat hepatic tissue and small intestinal tissue |
五酯片木脂素活性成分(包括五味子甲素、醇甲、醇乙及酯甲)在大鼠肝脏及肠道组织的批内精密度RSD分别在3.6%~8.9%及2.5%~10.6%内, 其批间精密度的RSD分别在5.7%~19.2%及5.1%~18.0%内; 其在大鼠肝脏及肠道组织的批内标准偏差分别在-15.0%~6.0%及-11.0%~10.0%内, 其批间标准偏差分别在-4.6%~14.0%及-10.7%~9.1%内。所有生物样品的精密度与准确度均在SFDA推荐的可接受范围之内, 符合生物样品的检测要求。
1.4 回收率及基质效应大鼠肝脏组织中, 五味子甲素、醇甲、醇乙及酯甲的相对回收率范围分别为47.2%~53.2%、49.4%~54.4%、51.7%~54.0%及57.9%~63.4%, 其基质效应依次分别为68.1%~77.4%、56.8%~63.2%、63.2%~67.4%及72.0%~78.2%。大鼠肠道组织中, 五味子甲素、醇甲、醇乙及酯甲的相对回收率范围分别为52.6%~57.3%、57.8%~63.7%、50.2%~58.3%及50.2%~52.8%, 其基质效应依次分别为57.1%~66.5%、52.7%~60.7%、63.2%~67.4%及58.4%~68.9%。大鼠肝脏及肠道组织中, 五酯片各木脂素活性成分的低、中、高浓度的提取回收率相近; 所有低、中、高浓度待测物的基质效应相近, 重现性好, 不存在浓度依赖性; 均符合生物样品分析的要求。
2 五酯片木脂素活性成分在大鼠肝脏及肠道的分布 2.1 五酯片木脂素活性成分在大鼠肝脏的分布单次灌胃给予五酯片(0.25 g·kg-1)后, 0.25、1.5、4、6、10和24 h大鼠肝脏中五味子甲素、醇甲、醇乙及酯甲的平均浓度见图 2。结果表明, 五酯片各木脂素活性成分在大鼠肝脏中的浓度随着给药时间的推移而降低。
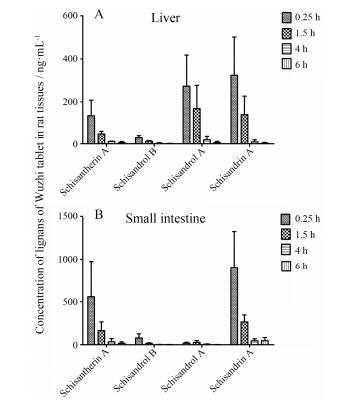 | Figure 2 Concentration of lignans of Wuzhi tablet in liver (A) and small intestine (B) of rats after an oral dose of Wuzhi tablet (WZ, 0.25 g·kg-1) for different time points. n=4, x±s |
单次灌胃给予五酯片0.25 h后, 五味子甲素、醇甲、醇乙、酯甲在大鼠肝脏中的浓度最高, 分别为323.4±178.4、272.6±144.6、28.8±14.0及134.7±72.8 ng·mL-1, 五味子甲素的浓度最高, 其次为五味子醇甲、酯甲。由于本次实验所有生物样本均按1:2稀释, 因此, 所测得的木脂素各活性成分的浓度乘以2即为五酯片各木脂素活性成分在相应组织中的浓度。单次灌胃给予五酯片0.25 h后, 五味子甲素、醇甲、醇乙及酯甲在大鼠肝脏中的实际摩尔浓度分别约为: 1.6、1.3、0.1及0.5 μmol·L-1; 其中, 五味子酯甲在肝脏中的浓度已超过文献[8, 11]报道的五味子酯甲在人及大鼠肝微粒体中对CYP3A的IC50值, 提示单次灌胃给予五酯片可抑制肝脏CYP3A的活性。
灌胃给予五酯片后0.25~4 h, 五酯片各木脂素活性成分在大鼠肝脏的浓度下降较快; 灌胃给予五酯片10 h后除个别大鼠外, 其余大鼠的肝脏检测不到五酯片各木脂素活性成分; 灌胃给予五酯片24 h后均检测不到五酯片各木脂素活性成分; 提示五酯片各木脂素活性成分在大鼠肝脏中消除迅速, 不容易在肝脏中蓄积。本研究中在大鼠肝脏均未检测到五味子乙素及五味子丙素。
2.2 五酯片木脂素活性成分在大鼠肠道的分布单次灌胃给予五酯片(0.25 g·kg-1)后, 0.25、1.5、4、6、10和24 h大鼠肠道中五味子甲素、醇甲、醇乙及酯甲的平均浓度见图 2。结果表明, 五酯片各木脂素活性成分在大鼠肠道中的浓度随着给药时间的推移而降低。
单次灌胃给予五酯片0.25 h后, 五味子甲素、醇甲、醇乙、酯甲在大鼠肠道中的浓度最高, 分别为904.7±418.9、17.4±11.4、77.0±49.2及556.5±419.9 ng·mL-1, 五味子甲素的浓度最高, 其次为五味子酯甲。由于本次实验所有生物样本均按1:2稀释, 因此, 所测得的木脂素各活性成分的浓度乘以2即为五酯片各木脂素活性成分在相应组织中的浓度。因此, 单次灌胃给予五酯片0.25 h后, 五味子甲素、醇甲、醇乙及酯甲在大鼠肠道中的实际摩尔浓度分别约为: 4.3、0.08、0.4及2.1 μmol·L-1, 其中, 五味子酯甲在肠道中的浓度远远大于文献[8, 11]报道的五味子酯甲在人及大鼠肝微粒体中对CYP3A的IC50值, 表明单次灌胃给予五酯片可抑制肠道CYP3A的活性。
与在肝脏中分布的情形一样, 灌胃给予五酯片后0.25~4 h, 五酯片各活性成分在大鼠肠道的浓度下降较快; 灌胃给予五酯片10 h后, 在大鼠肠道中基本检测不到五酯片的其他活性成分(五味子醇乙除外); 灌胃给予五酯片24 h后大鼠肠道均检测不到五酯片各木脂素活性成分; 提示五酯片各木脂素活性成分在大鼠肠道中消除迅速, 不容易在肠道中蓄积。
讨论本实验研究了单次灌胃给药途径下, 五酯片各木脂素活性成分在大鼠肠道、肝脏的分布特点及组织中药物浓度随给药时间的变化规律, 为临床上科学合理地合用五酯片与他克莫司提供实验依据。
单次灌胃给予五酯片0.25 h后, 五味子甲素、醇甲、醇乙、酯甲在大鼠肠道及肝脏中的浓度最高, 表明五味子甲素、醇甲、醇乙、酯甲灌胃后可以被迅速吸收。灌胃给予五酯片后0.25~4 h, 五酯片各木脂素活性成分在大鼠肠道及肝脏的浓度下降较快, 表明五酯片各木脂素活性成分在这些脏器代谢较快。灌胃给予五酯片10 h后基本检测不到五酯片各木脂素活性成分, 提示五酯片各木脂素活性成分在大鼠肠道、肝脏中消除迅速, 不容易在相关脏器蓄积。此外, 还考察了连续灌胃给予大鼠五酯片14天后, 测定其木脂素活性成分在大鼠各个脏器的浓度, 结果与单次给药相似, 灌胃给予五酯片24 h后, 在大鼠的肝脏、肾脏、胰脏、胸腺、心脏、肺、脑、脂肪、肌肉、睾丸、肠道和胃均检测不到五酯片各木脂素活性成分, 进一步确证五酯片各木脂素活性成分不容易在脏器中蓄积。
灌胃给予五酯片后, 五酯片各木脂素活性成分在大鼠肠道中的浓度高于其在肝脏的浓度(五味子醇甲除外), 这与前期研究结果[5, 6]相呼应。前期研究表明, 五酯片及其木脂素活性成分通过抑制他克莫司(免疫抑制剂, CYP3A底物)的肠首过效应及肝首过效应而使他克莫司的生物利用度升高, 其中抑制他克莫司的肠首过效应是主要原因。本次实验表明, 五酯片各木脂素活性成分在大鼠肠道的浓度远高于其在肝脏中的浓度, 提示五酯片各木脂素活性成分抑制肠道CYP3A活性的作用要强于其抑制肝脏CYP3A活性的作用。
Iwata等[8]报道, 五味子醇甲、醇乙及酯甲在人肝微粒体中对CYP3A的IC50分别为: > 100、6.7~10.1及0.25 μmol·L-1。作者利用人肝微粒体实验也得到相似的结果, 五味子甲素、醇甲、醇乙及酯甲在人肝微粒体中对CYP3A的IC50分别为 > 50、 > 50、2.3及0.3 μmol·L-1。单次灌胃给予五酯片0.25 h后, 五味子甲素、醇甲、醇乙及酯甲在大鼠肝脏中的实际摩尔浓度分别约为1.6、1.3、0.1及0.5 μmol·L-1; 各木脂素活性成分在大鼠肠道中的实际摩尔浓度分别约为4.3、0.08、0.4及2.1 μmol·L-1; 五味子酯甲在大鼠肝脏及肠道的浓度均超过了其对CYP3A的IC50值, 表明单次灌胃给予五酯片后其质控成分五味子酯甲可抑制大鼠肝脏及肠道的CYP3A活性。
总之, 单次灌胃给予五酯片, 其木脂素活性成分不容易在大鼠肝脏及肠道蓄积; 五味子酯甲、甲素、醇乙在肠道中的浓度高于其在肝脏中的浓度, 五酯片对大鼠肠道CYP3A的抑制作用强于其对肝脏CYP3A的作用。
| [1] | Huyke C, Engel K, Simon-Haarhaus B, et al. Composition and biological activity of different extracts from Schisandra sphenanthera and Schisandra chinensis[J]. Planta Med, 2007, 73 :1116–1126. DOI:10.1055/s-2007-981559 |
| [2] | Loo WT, Cheung MN, Chow LW. Fructus Schisandrae (Wuweizi)-containing compound inhibits secretion of HBsAg and HBeAg in hepatocellular carcinoma cell line[J]. Biomed Pharmacother, 2007, 61 :606–610. DOI:10.1016/j.biopha.2007.08.023 |
| [3] | Xin HW, Li Q, Wu XC, et al. Effects of Schisandra sphenanthera extract on the blood concentration of tacrolimus in renal transplant recipients[J]. Eur J Clin Pharmacol, 2011, 67 :1309–1311. DOI:10.1007/s00228-011-1075-7 |
| [4] | Xin HW, Wu XC, Li Q, et al. Effects of Schisandra sphenanthera extract on the pharmacokinetics of tacrolimus in healthy volunteers[J]. Br J Clin Pharmacol, 2007, 64 :469–475. DOI:10.1111/bcp.2007.64.issue-4 |
| [5] | Qin XL, Chen X, Wang Y, et al. In vivo to in vitro effects of six bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) on the CYP3A/P-glycoprotein-mediated absorption and metabolism of tacrolimus[J]. Drug Metab Dispos, 2014, 42 :193–199. |
| [6] | Qin XL, Bi HC, Wang XD, et al. Mechanistic understanding of the different effects of Wuzhi tablet (Schisandra sphenanthera extract) on the absorption and first-pass intestinal and hepatic metabolism of tacrolimus (FK506)[J]. Int J Pharm, 2010, 389 :114–121. DOI:10.1016/j.ijpharm.2010.01.025 |
| [7] | Qin XL, Yu T, Li LJ, et al. Effect of long-term coadministration of Wuzhi tablet (Schisandra sphenanthera extract) and prednisone on the pharmacokinetics of tacrolimus[J]. Phytomedicine, 2013, 20 :375–379. DOI:10.1016/j.phymed.2012.11.008 |
| [8] | Iwata H, Tezuka Y, Kadota S, et al. Identification and characterization of potent CYP3A4 inhibitors in Schisandra fruit extract[J]. Drug Metab Dispos, 2004, 32 :1351–1358. DOI:10.1124/dmd.104.000646 |
| [9] | Qin XL, Chen X, Zhong GP, et al. Effect of tacrolimus on the pharmacokinetics of bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) and the potential roles of CYP3A and P-gp[J]. Phytomedicine, 2014, 21 :766–772. DOI:10.1016/j.phymed.2013.12.006 |
| [10] | Qin XL, Bi HC, Wang CX, et al. Study of the effect of Wuzhi tablet (Schisandra sphenanthera extract) on tacrolimus tissue distribution in rat by liquid chromatography tandem mass spectrometry method[J]. Biomed Chromatogr, 2010, 24 :399–405. |
| [11] | Lai L, Hao HP, Wang Q, et al. Effects of short-term and long-term pretreatment of Schisandra lignans on regulating hepatic and intestinal CYP3A in rats[J]. Drug Metab Dispos, 2009, 37 :2399–2407. DOI:10.1124/dmd.109.027433 |
 2016, Vol. 51
2016, Vol. 51


