miRNA是一类长度约为19~25个核苷酸的小分子单链非编码RNA, 通过与靶基因mRNA 3'端非编码区(3'-untranslated region, 3'-UTR)特定序列的碱基互补结合, 导致靶基因mRNA降解或抑制蛋白质的翻译过程, 从而在转录后水平调控靶基因的表达[1]。OATP1B1蛋白的编码基因为SLCO1B1, 定位于染色体12p12位, 是有机阴离子转运多肽家族中最为重要的成员[2, 3]。已有研究证实, OATP1B1除参与转运甲状腺激素、胆汁酸、非结合型胆红素等多种内源性物质外, 还介导多种临床常用药物的肝脏跨膜转运, 如调血脂药(阿托伐他汀、普伐他汀)、抗高血压药(奥美沙坦、缬沙坦)、抗高血糖药(那格列奈、瑞格列奈)、抗恶性肿瘤药(甲氨喋呤、伊立替康)等[4-8], 与其吸收、分布及排泄等过程具有十分密切的相关性, 并影响药物的疗效, 甚至有可能导致不良反应的发生。目前研究表明, miRNA参与调控众多药物代谢酶和转运体的表达, 在药物代谢和处置过程中发挥重要的作用[9-11]。本课题组前期围绕“microRNA-PXR-OATP1B1”通路开展研究, 结果发现PXR的蛋白表达量受miR-148a转录后调控的影响, 且miR-148a可间接调控OATP1B1的表达, miRNA能否直接调控OATP1B1表达已引起了作者的高度关注。通过生物信息学软件Targetscan、miRBase、miRanda及RNA Hybrid预测, 发现miR-206/miR-613种子序列与OATP1B1 mRNA 3'-UTR互补配对, 具有较高的特异性, 且它们之间形成的二级结构较为稳定。因此, miR-206/miR-613能否调控OATP1B1蛋白表达, 其作用机制是否与转录后调控有关, 值得深入研究。本研究拟借助分子生物学技术, 探究miR-206/miR-613对OATP1B1基因和蛋白表达的影响, 阐明其作用机制, 为OATP1B1转运能力的改变而引起的药物反应个体差异研究提供新的思路。
材料与方法 仪器与试剂二氧化碳培养箱(德国贺利氏公司); CKX-41型倒置光学显微镜(日本Olympus公司); 普通PCR仪(北京六一仪器厂); 实时荧光定量PCR仪、水平电泳系统、垂直电泳系统(美国Bio-Rad公司); 多功能酶标仪、增强化学荧光试剂(ECL) (美国Thermo Fisher公司)。DMEM高糖培养基(北京索莱宝生物科技有限公司); 胎牛血清(FBS, 以色列Biological Industries公司、杭州四季青公司); 细胞转染试剂Lipofectamine 2000 (Invitrogen); Trizol总RNA提取试剂盒、逆转录试剂盒、SYBR Green实时荧光定量PCR试剂盒、山羊抗小鼠IgG/辣根酶标记抗体(北京全式金生物技术有限公司); 鼠抗人OATP1B1单克隆抗体(英国Abcam公司); 鼠抗人β-actin单克隆抗体(北京中杉金桥生物科技有限公司); miR-206/miR-613拟似物(mimic)和抑制物(inhibitor)、miR-206/miR-613及内参U6 RT引物及上下游引物、野生型(pMIR/OATP1B1-WT)及突变型(pMIR/OATP1B1-Mut)双荧光素酶报告质粒(广州锐博生物科技有限公司); 双荧光报告基因活性检测试剂盒(Dual-Luciferase® Reporter Assay System) (美国Promega公司)。
生物信息学分析采用生物信息学软件如: TargetScan、miRBase、miRanda及RNA Hybrid, 根据miRNA种子序列与OATP1B1 mRNA 3'-UTR互补结合的方式及结合位点最小自由能预测和筛选出可能靶向作用于OATP1B1 mRNA 3'-UTR的miRNAs。
细胞培养HepG2细胞及HEK293T细胞分别置于含10%的BI胎牛血清、10%的四季青胎牛血清的DMEM高糖培养基中, 在37 ℃、5% CO2、饱和湿度培养箱中静置培养。
寡核苷酸转染转染前一天, 取对数生长期HepG2细胞接种于不含双抗的培养基中, 以每毫升4×105个细胞接种于6孔板。待6孔板细胞长至50%时, 用1×PBS轻洗1次, 以去除残余血清, 并在各孔中加入无血清培养基1.5 mL。用细胞转染试剂Lipofectamine 2000, 按照说明书操作, 分别转染miR-206/miR-613拟似物、拟似物对照或miR-206/ miR-613抑制物、抑制物对照到HepG2细胞, 拟似物和抑制物的终浓度分别为50和200 nmol·L-1, 培养48 h后, 提取总RNA或总蛋白进行后续分析。
RT-qPCR法检测miR-206/miR-613及OATP1B1 mRNA表达利用全式金的Trizol试剂盒提取HepG2细胞总RNA, 取总RNA 5 μL利用逆转录试剂盒及miR-206/miR-613及U6 RT引物, 依据说明书操作步骤, 得到miRNA RT产物即cDNA。另取总RNA 5 μL利用逆转录试剂盒, 依据说明书操作步骤, 得到逆转录产物cDNA。以上述逆转录反应所得cDNA为模板进行RT-qPCR反应。热循环条件: 95 ℃预变性20 s, 95 ℃变性2 s, 60 ℃退火20 s, 70 ℃延伸10 s, 共40个循环, 每组设3个复孔, 实验重复3次。miR-206/ miR-613及OATP1B1 mRNA的内参分别为U6及GAPDH。基因的相对定量采用2-ΔΔCt公式计算。用于进行RT-qPCR反应的引物如下:目的OATP1B1-Forward 5'-GCATCCTTACTAATCCCCTGTATG-3'; OATP1B1-Reverse 5'-AGGTATGGTTATGACTCCCAA TAAG-3';内参GAPDH-Forward 5'-CAGGGCTGCTT TTAACTCTGGT-3'; GAPDH-Reverse 5'-GATTTTGG AGGGATCTCGCT-3'。
Western blot法检测OATP1B1蛋白表达收集6孔板细胞, 置于冰上, 用1×PBS轻洗2次, 每孔加入RIPA裂解液100 μL, 裂解20 min, 刮下细胞并吸至离心管, 于14 000×g、4 ℃离心15 min, 吸取上清于1.5 mL离心管, 并用BCA法进行蛋白定量。取50 μg蛋白与6×上样缓冲液混匀后, 瞬时离心, 于70 ℃水浴15 min变性后, 用10% SDS-PAGE分离, 转移至PVDF膜, 5%脱脂牛奶封闭2 h, 分别孵育鼠抗人OATP1B1一抗(按1:1 000比例), 鼠抗人β-actin一抗(按1:1 000比例), 4 ℃过夜, TBST慢摇洗膜3次, 每次15 min, 用辣根过氧化物酶标记的山羊抗小鼠二抗室温孵育1 h, TBST快摇洗膜5次, 加入ECL发光液反应2~3 min, 置于暗室曝光。β-Actin作为内参, 用Image Lab软件分析各条带的光密度值。
双荧光素酶报告实验取对数生长期的HEK293T细胞及HepG2细胞, 消化HEK293T细胞及HepG2细胞分别以每毫升3.0×105个、4.0×105个的细胞密度接种至24孔板, 待细胞生长至80%时, 共转染miRNAs拟似物(拟似物对照、miR-206/miR-613拟似物)及野生型荧光报告质粒或突变型双荧光报告质粒到HEK293T细胞, 共转染miRNAs抑制物(抑制物对照、miR-206/miR-613抑制物)及野生型或突变型双荧光报告质粒到HepG2细胞, 培养24 h后, 用1×PLB置于摇床上分别裂解HEK293T细胞及HepG2细胞15和20 min。按照Dual-Luciferase® Reporter Assay System试剂盒说明书操作, 在多功能酶标仪上分别检测各组萤火虫荧光素酶活性和海肾荧光素酶活性, 萤火虫荧光素酶作为内参。
统计学处理各个实验组的数据均以均数±标准差(mean±SD)表示, 采用SPSS 17.0统计软件进行方差齐性检验﹑单因素方差分析(one-way ANOVA)及相关分析, 各组之间的比较采用LSD法; 结果以P < 0.05表示差异具有统计学意义。
结果 1 生物信息学分析TargetScan软件预测发现, miR-206/miR-613种子序列与OATP1B1 mRNA 3'-UTR互补配对, 配对方式为8 mer, 具有较高的特异性, 且miR-206/miR-613与OATP1B1 mRNA 3'-UTR结合的Context++ score percentile均为99, 大于90。miR-206/miR-613与OATP1B1 mRNA 3'-UTR的碱基对齐方式如图 1所示。miRanda软件预测发现, miR-206/miR-613与OATP1B1结合的mirSVR score分别为-0.967 1、-0.929 9, PhastCons score分别为0.553 1、0.553 1, 表明miRNA-mRNA二者结合较稳定, PhastCons score反映基因非编码区在各物种中进化保守性强弱, 其分值要求大于等于0, 分值越大保守性越好。经RNA Hybrid软件分析发现, OATP1B1 mRNA 3'-UTR与miR-206/miR-613结合位点5'端7个核苷酸序列的自由能分别为-22.4、-23.8 kcal·mol-1, 均低于它们各自的随机平均自由能阈值。miRNA-mRNA二者结合的二级结构如图 2所示。综上所述, miR-206/miR-613种子序列与OATP1B1 mRNA 3'-UTR互补配对, 具有较高的特异性, 且它们之间形成的二级结构较为稳定, miR-206/miR-613很可能靶向调控OATP1B1表达。
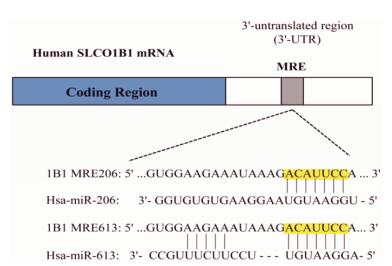 | Figure 1 The predicted target sequence for miR-206/miR-613 in 3'-UTR of OATP1B1 mRNA |
 | Figure 2 The secondary structures and the minimum free energy of miR-206 (A) and miR-613 (B) binding with OATP1B1 mRNA 3'-UTR by RNA hybrid |
结果表明, 与对照组相比, miR-206拟似物和miR-613拟似物分别作用于HepG2细胞48 h后能明显上调miR-206和miR-613的表达水平, miR-206拟似物组和miR-613拟似物组, miR-206和miR-613的表达水平分别上调1 227.85倍和935.38倍, 差异具有统计学意义。结果如图 3A所示。与对照组相比, miR-206抑制物和miR-613抑制物分别作用于HepG2细胞48 h后明显下调miR-206和miR-613表达水平, miR-206抑制物组和miR-613抑制物组, miR-206和miR-613表达水平仅为对照组的48%和67%, 差异具有统计学意义。结果如图 3B所示。由此可见, 过表达或抑制表达miR-206/miR-613的HepG2细胞模型已建立。
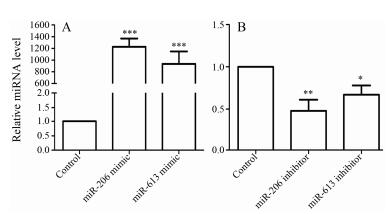 | Figure 3 Effect of transfection of miR-206/miR-613 mimic (A) or inhibitor (B) into HepG2 cells on the expression of miR-206/ miR-613. n=3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs Control |
研究发现, 与对照组相比, miR-206/miR-613拟似物分别作用于HepG2细胞48 h后, 各组OATP1B1 mRNA表达差异无统计学意义(P > 0.05)。结果如图 4A所示。与对照组相比, miR-206/miR-613抑制物分别作用于HepG2细胞48 h后, 各组OATP1B1 mRNA表达差异无统计学意义(P > 0.05)。结果如图 4B所示。
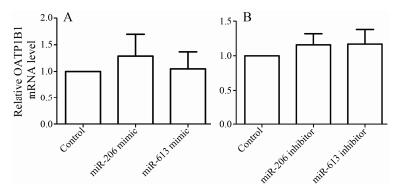 | Figure 4 Effect of overexpression (A) or inhibition (B) of miR-206/miR-613 on the expression of OATP1B1 mRNA in HepG2 cells. n=3, x±s |
研究发现, 与对照组相比, miR-206/miR-613拟似物分别作用于HepG2细胞48 h后能明显下调OATP1B1蛋白表达, miR-206拟似物组和miR-613拟似物组OATP1B1蛋白表达分别下调24.7%、38.8%, 差异具有统计学意义。结果如图 5所示。miR-206/613抑制物分别作用于HepG2细胞48 h后能明显上调OATP1B1蛋白表达。与对照组相比, miR-206抑制物组和miR-613抑制物组OATP1B1蛋白表达分别上调25%、38.2%, 差异具有统计学意义。结果如图 6所示。
 | Figure 5 Effect of overexpression of miR-206/miR-613 on OATP1B1 protein level in HepG2 cells. n=3, x±s. **P < 0.01 vs Control |
 | Figure 6 Effect of inhibition of miR-206/miR-613 on OATP1B1 protein level in HepG2 cells. n=3, x±s. **P < 0.01 vs Control |
过表达miR-206/miR-613可显著抑制pMIR/ OATP1B1-WT报告基因荧光素酶活性, 与对照组相比荧光素酶活性分别下降35%和30%, 差异具有统计学意义; 而在OATP1B1 mRNA 3'-UTR miR-206/ miR-613结合位点突变的报告基因系统中, 过表达miR-206/miR-613对报告基因荧光素酶活性均无影响。结果如图 7所示。抑制表达miR-206/miR-613可诱导报告基因荧光素酶活性, 与对照组相比荧光素酶活性分别增加33.1%和32.5%, 差异具有统计学意义; 而在OATP1B1 mRNA 3'-UTR miR-206/miR-613结合位点突变的报告基因系统中, 抑制表达miR-206/miR-613对报告基因荧光素酶活性均无影响。结果如图 8所示。
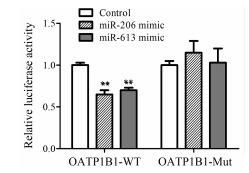 | Figure 7 The effect of overexpression of miR-206/miR-613 on luciferase activity. n=3, x±s. **P < 0.01 vs Control |
 | Figure 8 The effect of inhibition of miR-206/miR-613 on the luciferase activity. n=3, x±s. **P < 0.01 vs Control |
编码miRNA的基因位于整个基因组的不同位点, 且常簇状聚集在一起。人类miRNA分布如下: 52%位于基因间, 43%位于内含子区, 5%位于外显子[12]。人类基因组已鉴定超过1 000个miRNA, 调控大约30%~60%蛋白编码基因表达[13, 14]。由于目前已鉴定的miRNA数量较多, 通过实验逐一验证miRNA靶基因十分困难。因此, 众多研究者利用miRNA与其靶基因相互作用的规律及特性, 开发出了多种用来预测和筛选miRNA靶点的生物信息学软件。通过Targetscan、miRBase、miRanda及RNA Hybrid等生物信息学软件预测发现miR-206/miR-613种子序列与OATP1B1 mRNA 3'-UTR互补配对, 具有较高的特异性, 且它们之间形成的二级结构较为稳定, miR-206/miR-613很可能靶向调控OATP1B1表达。
在上述基础上, 本研究借助分子生物学技术, 探明miR-206/miR-613对HepG2细胞OATP1B1表达确有调控作用。过表达miR-206/miR-613, OATP1B1的蛋白表达下调, 抑制表达miR-206/miR-613, OATP1B1蛋白表达上调, 然而无论过表达还是抑制表达miR-206/miR-613, HepG2细胞中OATP1B1 mRNA表达均未发现明显改变, 提示miR-206/miR-613对OATP1B1可能存在转录后水平的调控, 确有必要进一步展开miR-206/miR-613对OATP1B1调控机制的研究。接下来通过双荧光素酶报告基因确定了miR-206/ miR-613作用于OATP1B1 mRNA 3'-UTR的确切位点, 有力地证实了miR-206/miR-613转录后调控OATP1B1的机制。研究结果显示过表达miR-206/miR-613可显著抑制pMIR/OATP1B1-WT报告基因荧光素酶活性, 抑制表达miR-206/miR-613可诱导荧光素酶活性, 而在OATP1B1 mRNA 3'-UTR miR-206/miR-613结合位点突变的报告基因系统中, 过表达或抑制表达miR-206/ miR-613对荧光素酶活性均无影响。证实了miR-206/ miR-613第2~8个碱基, 即种子序列, 与OATP1B1 mRNA 3'-UTR靶序列ACATTCC互补配对结合, 继而影响OATP1B1蛋白表达。研究结果提示OATP1B1蛋白的最终表达量可能是多种miRNAs共同作用的结果。故展开miRNAs联合效应的研究对OATP1B1表达, 乃至药物代谢酶和转运体的调控具深远意义。
研究表明, miRNA参与调控众多药物代谢酶和转运体的表达, 在药物代谢和处置过程中发挥重要的作用[9-11]。Pan等[15]研究发现, 过表达miR-328能够下调MCF-7/MX100细胞中BCRP蛋白表达, 改变其转运功能, 使细胞对米托蒽醌敏感性增加。Ikemura等[16-18]研究发现, 大鼠肝脏缺血-再灌注损伤(I/R)模型中, 小肠miR-145表达下降, 导致P-gp表达上调, 影响环孢素A的小肠吸收, 改变其在大鼠体内药代动力学过程。OATP1B1参与许多临床常用药物的转运, 其基因的序列改变或表达水平发生改变时, 将会显著影响OATP1B1的转运能力, 从而影响药物疗效, 因此OATP1B1基因多态性只能部分解释药物反应的个体差异[19]。本研究结果证实miR-206/miR-613转录后调控OATP1B1蛋白表达, 改变OATP1B1的转运功能, 使其转运底物的能力发生改变, 很可能导致某些不良反应的发生。因此, 本研究将为基于OATP1B1转运能力改变而引起的药物反应个体差异研究提供更多的理论基础以及为临床个体化用药的发展提供新思路。本实验室前期研究发现, 人血浆中miR-148a表达水平与OATP1B1底物氟伐他汀的体内药动学过程存在相关性, 推测这可能与miR-148a调控核受体PXR, 继而影响OATP1B1的表达及活性有关。因此有必要进一步观察血浆中miR-206/miR-613表达水平与OATP1B1底物(他汀类药物等)的药动学过程的相关性, 以期为制定他汀类药物的个体化给药方案奠定基础。
| [1] | Chen J, Tian W, Cai H, et al. Down-regulation of microRNA-200c is associated with drug resistance in human breast cancer[J]. Med Oncol, 2012, 29 :2527–2534. DOI:10.1007/s12032-011-0117-4 |
| [2] | König J, Cui Y, Nies AT, et al. A novel human organic anion transporting polypeptide localized to the basolateral hepatocyte membrane[J]. Am J Physiol-Gastr L, 2000, 278 :156–164. |
| [3] | Hagenbuch B. Drug uptake systems in liver and kidney:a historic perspective[J]. Clin Pharmacol Ther, 2010, 87 :39–47. DOI:10.1038/clpt.2009.235 |
| [4] | Pasanen MK, Neuvonen PJ, Niemi M. Global analysis of genetic variation in SLCO1B1[J]. Pharmacogenomics, 2008, 9 :19–33. DOI:10.2217/14622416.9.1.19 |
| [5] | Niemi M, Pasanen MK, Neuvonen PJ. Organic anion transporting polypeptide 1B1:a genetically polymorphic transporter of major importance for hepatic drug uptake[J]. Pharmacol Rev, 2011, 63 :157–181. DOI:10.1124/pr.110.002857 |
| [6] | Niemi M. Role of OATP transporters in the disposition of drugs[J]. Pharmacogenomics J, 2007, 8 :787–802. DOI:10.2217/14622416.8.7.787 |
| [7] | Han JY, Lim HS, Shin ES, et al. Influence of the organic anion-transporting polypeptide 1B1(OATP1B1) polymorphisms on irinotecan pharmacokinetics and clinical outcome of patients with advanced non-small cell lung cancer[J]. Lung Cancer, 2008, 59 :69–75. DOI:10.1016/j.lungcan.2007.07.019 |
| [8] | Maeda K, Ieiri I, Yasuda K, et al. Effects of organic anion transporting polypeptide 1B1 haplotype on pharmacokinetics of pravastatin, valsartan and temocapril[J]. Clin Pharmacol Ther, 2006, 79 :427–439. DOI:10.1016/j.clpt.2006.01.011 |
| [9] | Yu AM, Pan YZ. Noncoding microRNAs:small RNAs play a big role in regulation of ADME?[J]. Acta Pharm Sin B, 2012, 2 :93–101. DOI:10.1016/j.apsb.2012.02.011 |
| [10] | Ikemura K, Iwamoto T, Okuda M. MicroRNAs as regulators of drug transporters, drug-metabolizing enzymes, and tight junctions:implication for intestinal barrier function[J]. Pharmacol Therapeut, 2014, 143 :217–224. DOI:10.1016/j.pharmthera.2014.03.002 |
| [11] | He Y, Chevillet JR, Liu G, et al. The effects of microRNA on the absorption, distribution, metabolism and excretion of drugs[J]. Br J Pharmacol, 2015, 172 :2733–2747. DOI:10.1111/bph.12968 |
| [12] | Hinske LCG, Galante PAF, Kuo WP, et al. A potential role for intragenic miRNAs on their hosts' interactome[J]. BMC genomics, 2010, 11 :533. DOI:10.1186/1471-2164-11-533 |
| [13] | Tsuchiya Y, Nakajima M, Takagi S, et al. MicroRNA regulates the expression of human cytochrome P4501B1[J]. Cancer Res, 2006, 66 :9090–9098. DOI:10.1158/0008-5472.CAN-06-1403 |
| [14] | Bartel DP. MicroRNAs:genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116 :281–297. DOI:10.1016/S0092-8674(04)00045-5 |
| [15] | Pan YZ, Morris ME, Yu AM. MicroRNA-328 negatively regulates the expression of breast cancer resistance protein (BCRP/ABCG2) in human cancer cells[J]. Mol Pharmacol, 2009, 75 :1374–1379. DOI:10.1124/mol.108.054163 |
| [16] | Ikemura K, Yamamoto M, Miyazaki S, et al. MicroRNA-145 post-transcriptionally regulates the expression and function of P-glycoprotein in intestinal epithelial cells[J]. Mol Pharmacol, 2013, 83 :399–405. DOI:10.1124/mol.112.081844 |
| [17] | Ikemura K, Urano K, Matsuda H, et al. Decreased oral absorption of cyclosporine A after liver ischemia-reperfusion injury in rats:the contribution of CYP3A and P-glycoprotein to the first-pass metabolism in intestinal epithelial cells[J]. J Pharmacol Exp Ther, 2009, 328 :249–255. DOI:10.1124/jpet.108.145581 |
| [18] | Ikemura K, Inoue K, Mizutani H, et al. An antioxidant Trolox restores decreased oral absorption of cyclosporine A after liver ischemia-reperfusion through distinct mechanisms between CYP3A and P-glycoprotein in the small intestine[J]. Eur J Pharmacol, 2012, 690 :192–201. DOI:10.1016/j.ejphar.2012.06.031 |
| [19] | Guo Y, Zhou HH, Liu ZQ. miRNA and individual differences in drug response[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2013, 18 :443–448. |
 2016, Vol. 51
2016, Vol. 51


