哮喘和慢性阻塞性肺部疾病(COPD)都是比较常见的呼吸系统疾病, 严重威胁人类的健康和生命[1]。在过去的50年, 哮喘的发病率急剧增加。目前全球有哮喘患者3亿人, 并以每15年增加50%的速度增长[2]。COPD的发病率和死亡率都很高, 40岁以上人口的发病率为8%~10%。世界卫生组织估计, 到2020年该病将成为第三位的致死病因[3]。β2受体激动剂作为该类呼吸系统疾病的治疗药物之一[4], 在过去的15年得到了极大的重视和发展。
1 β2受体激动剂的开发思路内源性的非选择性β受体激动剂肾上腺素(1)或去甲肾上腺素(2)都是经典苯乙醇胺结构(图 1), 母核为儿茶酚。儿茶酚结构不稳定, 容易被代谢, 有不良反应大、口服无效、作用时间短等缺陷。为了克服以上缺陷, 上市的大部分β2受体激动剂都摒弃儿茶酚结构, 将苯乙醇胺苯环4位的羟基替换成氨基或氢原子, 如:马布特罗(3)、非诺特罗(4), 或3位或5位用适当的取代基取代, 例如:沙美特罗(5)、福莫特罗(6)。最新一代β2受体激动剂甚至将母核部分单一的苯环换成了稠合环, 例如茚达特罗(7)和奥达特罗(8)等。这些药物大部分是在保留足够的活性和选择性的前提下进一步延长作用时间, 达到每日给药一次的目的。本文主要介绍近15年来发现的长效β2受体激动剂。
 | Figure 1 Structures of adrenaline (1), noradrenaline (2), mabuterol (3), fenoterol (4), salmeterol (5), formoterol (6), indacaterol (7) and olodaterol (8) |
由于β2受体激动剂作为气管扩张药物的特殊性, 吸入给药不仅可以使药物快速地到达发病部位, 还能够避免口服给药出现的首过效应。因此, 近年来越来越多的研究都集中在开发适合吸入给药的β2受体激动剂。但是, 吸入给药的80%~90%会通过咽喉进入消化道, 被吸收后重新分布到全身各个组织和器官, 产生不良反应[5]。为了提高治疗指数, 一种途径是改善药物的理化性质, 使其不易被消化道吸收, 即降低口服生物利用度[6]。另一种途径是提高化合物的代谢不稳定性, 例如引入代谢不稳定的结构或基团, 使其在系统内部很快被代谢成非活性物质, 从而减轻不良反应[7]。
2 新分子实体 2.1 水杨醇类水杨醇类β2受体激动剂是被研究最透彻的一类结构, 由GlaxoSmithKline和Pfizer两家制药公司分别对其进行了不同方向上的结构改造。GlaxoSmithKlin的沙美特罗与福莫特罗相比, 有不易产生脱敏现象的优点。但是前者在高剂量吸入给药过程中, 经消化道吸收的部分会产生心肌方面的不良反应[8]。为了降低药物的口服生物利用度, 延长药物作用时间, GlaxoSmithKline做了一系列改造并取得一定进展(图 2, 表 1、2)。在沙美特罗侧链的苯环间位上引入磺胺基团, 得到化合物9。化合物9的β2受体激动活性和对β1、β3的选择性与沙美特罗相当, 但内在活性(IA)显著提高。在豚鼠离体气管条实验中起效时间短(沙美特罗27.6 min, 9·AcOH 10.8 min)。被动膜转运速率仅为4.5 nmol·L-1·s-1 (沙美特罗119 nmol·L-1·s-1), 提示9可能拥有较低的口服生物利用度。小鼠体内实验显示9的口服生物利用度小于1% (沙美特罗10%~12%), 静脉注射给药后, 血浆清除速率79 mL·min-1·kg-1 [5], 半衰期2.3 h。这些数据说明, 9不但口服生物利用度低, 而且, 进入血浆后容易代谢失活, 降低不良反应, 但其作用时间比沙美特罗短。后期因为其与红细胞的结合能力较强以及对小鼠的睾丸毒性而终止研究。
| Table 1 β2 potency, intrinsic activity (IA) and selectivity for compound 9-13. ISO: ISOprenaline |
| Table 2 Guinea pig trachea onset time and vivo pharmacoki-netic data for compound 9-13 |
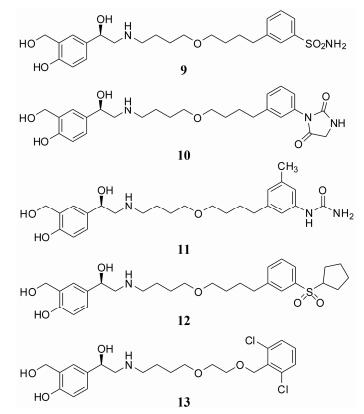 | Figure 2 Structures of compound 9-12, vilanterol (13) |
化合物10和11与9结构相似, 活性也与其相当, 小鼠体内转化率和代谢清除率更高, 但是因为无法形成作为吸入剂的盐结晶而终止研究[6, 7]。化合物12的β2受体激动活性和选择性与沙美特罗相当, 离体豚鼠气管条实验中起效时间5.1 min, 作用时间更长, 可每日给药一次。小鼠口服生物利用度小于2%。静脉注射给药后, 血浆中半衰期仅为30 min。但因为维兰特罗的上市, 化合物12没有进入临床研究[8]。
维兰特罗(vilanterol, 13), 运用软药原理在沙美特罗的长链中引入第二个氧原子, 并在尾部的苯环上引入两个氯原子。进入循环系统后代谢成14~16 (图 3), 在体内无活性和毒性。维兰特罗的活性和选择性与沙美特罗相当, 豚鼠离体气管条实验中起效时间6.6 min, 口服生物利用度小于5%。静脉注射后, 血浆中半衰期为48 min。代谢清除率为上述化合物中最高, 123 mL·min-1·kg-1, 被开发为日服一次的超长效β2受体激动剂[9]。目前已经进入Ⅲ期临床试验。
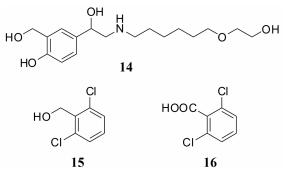 | Figure 3 Metabolites of vilanterol |
Pfizer公司也在沙美特罗的基础上进行结构改造(图 4, 表 3)。为了延长药效, 降低口服生物利用度, 提高血浆代谢清除率, 在其侧链中引入苯环和酰胺结构。化合物17的活性、作用时间与沙美特罗相当, 拥有较低的膜渗透性, 甚至会被细胞膜上转运蛋白泵到细胞外侧。推测该化合物的生物利用度较低。在小鼠实验中, 静脉注射给药的血浆清除率为123 mL·min-1·kg-1, 半衰期为1.5 h。豚鼠离体气管条实验中, 作用时间为9 h (沙美特罗6.97 h), 预示其全身不良反应会更小, 作用时间更长。除此之外也证明, 化合物17对其他受体、酶和离子通道都没有明显的亲和力[10], 化合物18是在此基础上的进一步修饰[11]。但都未见与两者有关的临床试验报道。
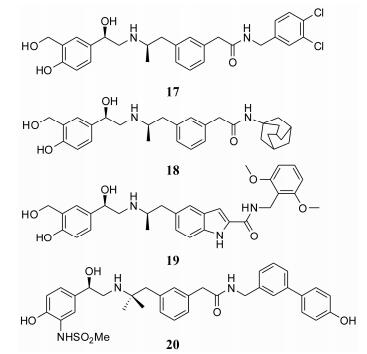 | Figure 4 Structures of compound 17-20 |
| Table 3 β2 potency, selectivity, Guinea pig trachea duration of action and vivo pharmacokinetic data for compound 17-20 |
化合物19是在沙美特罗侧链中引入吲哚和酰胺的结构。活性、选择性及作用时间与沙美特罗相当, 人肝微粒体实验中半衰期仅为4 min。小鼠实验中血浆清除率为130 mL·min-1·kg-1, 血浆半衰期为1.6 h, 口服生物利用度小于5% (沙美特罗10%~12%)。可明显减少药物进入循环系统的量并降低其在体内停留时间, 减小不良反应[12]。未见相关的临床试验报道。
2.2 苯并噻唑烷酮类西贝奈迪(sibenadet, 21) (图 5, 表 4)是AstraZeneca公司在20世纪末研发的D2/ β2双靶点激动剂[13]。但在Ⅲ期临床试验发现, 其长期药效不如当时已存在的β2受体激动剂, 终止了进一步研究[14]。随后, 该公司放弃该系列化合物的D2激动活性。将西贝奈迪侧链的砜换成酰胺得到化合物22, 一个活性良好的完全激动剂, 但在进行体内试验时, 发现它的作用时间太短[15], 因此并未将其推向临床研究。将西贝奈迪的砜换成硫原子得到化合物23, 并将母核苄位引入羟基, 设计成经典的具有苯乙醇胺骨架的β2受体激动剂。虽然23的选择性有所降低, 但在豚鼠离体气管条实验中, 半衰期却提高到了15.9 h, 口服生物利用度也只有不到1%, 满足作为日服一次的超长效吸入型β2受体激动剂的标准。然而在2011年以后, 鲜有关于该化合物的进一步报道[16]。AZD3199 (24)是贝奈迪的另一类衍生物, 在化合物22的基础上作了进一步的完善, 活性几乎没有降低, 对β1和β3的选择性均大于1 000倍, 对D2的活性比西贝奈迪低100倍, 起效时间只有11 min。小鼠口服生物利用度小于2%。豚鼠实验显示, AZD3199在给药24 h后仍有气管的舒张活性, 作用时长与茚达特罗相当或更优[17], 但最终还是终止于早期的临床研究, 原因未知。
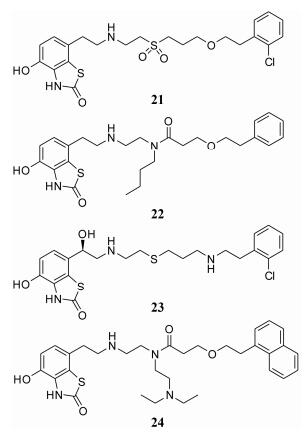 | Figure 5 Structures of sibenadet (21), 22, 23 and AZD3199 (24) |
| Table 4 β2 potency, selectivity and Guinea pig trachea onset time for standards and compound sibenadet, 23 and AZD3199 (24). IA: Intrinsic activity |
茚达特罗(indacaterol)是超长效β2受体激动剂的成功案例之一, 属于喹啉酮类, 由Novartis公司开发, 2010年在丹麦和爱尔兰上市, 2012年在美国上市。EC50值为11 nmol·L-1左右, 豚鼠气管条实验表明, 其起效时间在35 min左右, 作用时长超过12 h。虽然该药物的活性和起效时间以及β受体家族亚型的选择性不如早先上市的沙美特罗与福莫特罗, 但是该药物在上市之初的优点在于, 它几乎是首个可以日服一次的超长效β2受体激动剂。这样长的作用时间被认为是2-氨基茚部分强大的脂溶性所引起的[18]。化合物25(图 6)是由Almirall公司发现的, 它在氨基侧链部分距离氮原子两个碳距离的芳环上连入了脲的结构, 并在脲的另一个氮原子上引入了疏水基团, 旨在增加化合物的脂溶性, 以达到延长药效的作用, 在离体豚鼠气管条实验中, 该化合物的EC50值为0.050 nmol·L-1, 而在小鼠心肌组织实验中EC50大于10 000 nmol·L-1[19]。但未见进一步的相关报道。化合物TD-5471 (26)是Theravance公司发现的, 该化合物在结构的末尾引入联苯片段, pEC50为9.4, 是β2受体的完全激动剂。更重要的是, TD-5471在给药72 h时间点仍表现出剂量依赖性的支气管保护作用, 且明显高于沙美特罗, 在作用时间方面足够作为日服一次的超长效β2受体激动剂[20]。目前处于Ⅰ期临床阶段。TD-4306 (27)是在TD-5471 (26)基础上进行的改造, 虽然它舍弃了联苯的结构, 精简了一个苯环, 取而代之的是脂肪胺, 但是它的各项参数与TD-5471 (26)基本相似。在小鼠实验中其清除速率较低, 仅有0.40 L·h-1·kg-1, 但是口服生物利用度也较低, 小于1%, 可有效避免胃肠道不良反应[21]。该化合物目前正处于临床前研究。Abediterol (28)是Almirall开发的另一喹诺酮类长效β2受体激动剂, 目前处于Ⅱ期临床研究。在离体豚鼠气管条实验中, abediterol的起效时间约为23 min, 比奥达特罗、茚达特罗以及维兰特罗的起效时间长, 作用时间大于8.0 h, 比奥达特罗和茚达特罗长[22]。
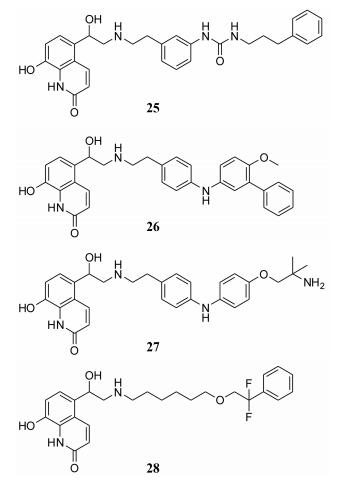 | Figure 6 Structures of 25, TD-5471 (26), TD-4306 (27) and abediterol (28) |
甲酰胺类β2受体激动剂以福莫特罗为代表, 其拥有较高内在活性, 与沙丁胺醇相当, 起效时间相对较短, 对β2受体的选择性高。Theravance在结构中骈入另一苯乙醇胺片段, 得到milveterol (29) (图 7)。该化合物较福莫特罗更优, 对β2/β1选择性大于300倍。在豚鼠实验中, 30 μg·mL-1给药量时, 在48 h仍可以检测到的气管保护作用, 而同浓度沙美特罗的作用却与对照相同[23]。该化合物于2005年进入Ⅱ期临床试验, 但至今未见更新的相关报道。
 | Figure 7 Structures of milveterol (29) and tratinterol (30) |
2010年左右Boehringer-Ingelheim报道了苯并噁嗪酮类β2受体激动剂, 最终将奥达特罗(olodaterol, 8)推向市场, 这是目前为止上市的最新的一代超长效β2受体激动剂, 实现了每日给药一次的设想。除此之外, 在给药后, 并没有观测到血浆中钾离子浓度以及心率的变化, 说明其不良反应非常小, 且口服生物利用度不到5%[23-25]。
化合物PF-610355 (20)是一个具有新母核类型的β2受体激动剂, 其β2受体激动活性为0.26 nmol·L-1较沙美特罗(0.070 nmol·L-1)弱, 豚鼠气管条舒张活性(0.31 nmol·L-1)较沙美特罗(1.0 nmol·L-1)强。离体气管条实验中, 20的作用时间与沙美特罗相当。在小鼠实验中, 20的ED50为0.10 μg (沙美特罗1.0 μg)。ED50剂量下, 20的作用时间大于8 h (沙美特罗4 h), 口服生物利用度小于5%。静脉注射后, 代谢清除率为103 mL·min-1·kg-1, 超过肝脏血流量。除此之外, 20的结晶度等理化性质优良, 适合做成干粉制剂吸入给药[1]。但是, 在Ⅱ期临床试验后, 辉瑞公司终止了该化合物用于治疗COPD的进一步研究。
川丁特罗是本课题组发现可日服两次的2-氨基-2-芳基乙醇类长效β2受体激动剂, 目前已经完成Ⅲ期临床试验。临床试验表明, 对健康的中国受试者, 单次给药25~100 μg是安全的, 没有明显的不良反应[26]。单次给药50 μg是用于治疗支气管哮喘的最安全、最有效的给药剂量[27]。川丁特罗盐与丙卡特罗的治疗效果相当, 但是不良反应更小, 仅有少数患者伴有轻微的心率增加和肌肉震颤[27, 28]。川丁特罗盐酸盐将打破国内口服类β2受体激动剂市场长期被丙卡特罗所占据的局面[29], 为患者提供更多的用药选择。
3 长效β2受体激动剂的理论基础对于第三代和正处于临床研究的β2受体激动剂具有较长作用时间的原因, 有如下几种解释: ① 扩散微动力学理论。亲脂性的药物分子在脂溶性细胞膜附近的局部浓度较高, 可以持续地与膜上受体结合, 因此作用时间较长[30]。② 外结合位点理论。对于一些氨基侧链较长的β2受体激动剂, 例如沙美特罗, 类似儿茶酚的头部深入到结合口袋的底部, 而长的侧链尾部则作用于远离该结合口袋的另一位点, 称为外结合位点。外结合位点可以使化合物停留在距离儿茶酚结合位点较近的位置, 反复发挥激动作用。③ 高内在活性理论。某些激动剂对受体具有较高的占有率, 表现出较长的作用时间[17]。④ 受体动力学理论。该理论认为, 某些激动剂与受体的解离速率较慢, 从而导致药效时间的延长[1]。⑤ 低溶解度、低渗透性理论。进入体内的药物在肺部的长时间停留并缓慢地溶解并渗入到气管平滑肌, 发挥持续的药效[31]。
4 结论尽管各大公司在过去的10年甚至20年中找到了性质相对优良的候选化合物并将其推向临床研究, 但是真正进入市场成为药物的少之又少, 难以应对由于环境恶化等因素造成的哮喘及COPD的发病率、死亡率激增所带来的挑战。因此, 寻找新的长效β2受体激动剂的工作并没有结束。除此之外, 长期使用β2受体激动剂导致患者对药物产生耐受性, 要达到相同的支气管舒张作用, 需要加大给药剂量, 这可能与细胞内的β抑制蛋白有关。给药剂量的增加提高了心脏不良反应的发生率, 这对某些患者是致命的[32]。所以, 降低药物的耐受性可能是未来β2受体激动剂的发展方向。
5 展望β2受体是G蛋白偶联受体家族中研究最透彻的成员之一。对β2受体激动剂的研究不仅使人类开发出优秀的抗哮喘、抗COPD药物, 深入的研究让研究者了解到某些偏爱性受体激动剂可以选择性地偏向G蛋白信号通路或β-抑制蛋白通路[33], 这种概念的提出能从新药研发的源头避免某些药物的不良反应, 例如阿片受体激动剂等[32]。也有某些β2受体激动剂可以偏爱性地激活Gs蛋白信号通路而不是Gi蛋白信号通路, 起到心肌保护作用[34]。除此之外, 也有研究发现在β2受体中存在变构结合位点[35]。总而言之, β2受体激动剂相关研究的意义不仅局限于β2受体本身, 更为G蛋白偶联受体家族其他成员的研究提供了模板和参考。
| [1] | Glossop PA, Lane CA, Price DA, et al. Inhalation by design:novel ultra-long-acting β2-adrenoreceptor agonists for inhaled once-daily treatment of asthma and chronic obstructive pulmonary disease that utilize a sulfonamide agonist headgroup[J]. J Med Chem, 2010, 53 :6640–6652. DOI:10.1021/jm1005989 |
| [2] | Azad MB, Coneys JG, Kozyrskyj AL, et al. Probiotic supplementation during pregnancy or infancy for the prevention of asthma and wheeze:systematic review and meta-analysis[J]. Br Med J, 2013, 347 :f6471. DOI:10.1136/bmj.f6471 |
| [3] | Fitzgerald MF, Fox JC. Emerging trends in the therapy of COPD:bronchodilators as mono-and combination therapies[J]. Drug Discov Today, 2007, 12 :472–478. DOI:10.1016/j.drudis.2007.04.003 |
| [4] | Ji HJ, Hu JF, Cheng NH. Advances in the study of small molecule antagonists of chemokine receptors as anti-asthma agents[J]. Acta Pharm Sin (药学学报), 2011, 46 :1286–1290. |
| [5] | Procopiou PA, Barrett VJ, Bevan NJ, et al. Synthesis and structure-activity relationships of long-acting β2 adrenergic receptor agonists incorporating arylsulfonamide groups[J]. J Med Chem, 2009, 52 :2280–2288. DOI:10.1021/jm801016j |
| [6] | Procopiou PA, Barrett VJ, Ford AJ, et al. The discovery of long-acting saligenin β2 adrenergic receptor agonists incorporating a urea group[J]. Bioorg Med Chem, 2011, 19 :6026–6032. DOI:10.1016/j.bmc.2011.08.043 |
| [7] | Procopiou PA, Barrett VJ, Bevan NJ, et al. The discovery of long-acting saligenin β2 adrenergic receptor agonists incorporating hydantoin or uracil rings[J]. Bioorg Med Chem, 2011, 19 :4192–4201. DOI:10.1016/j.bmc.2011.05.064 |
| [8] | Procopiou PA, Barrett VJ, Bevan NJ, et al. Synthesis and structure-activity relationships of long-acting β2 adrenergic receptor agonists incorporating metabolic inactivation:an antedrug approach[J]. J Med Chem, 2010, 53 :4522–4530. DOI:10.1021/jm100326d |
| [9] | Procopiou PA, Barrett VJ, Biggadike K, et al. Discovery of a rapidly metabolized, long-acting β2 adrenergic receptor agonist with a short onset time incorporating a sulfone group suitable for once-daily dosing[J]. J Med Chem, 2014, 57 :159–170. DOI:10.1021/jm401532g |
| [10] | Brown AD, Bunnage ME, Glossop PA, et al. The discovery of long acting β2-adrenoreceptor agonists[J]. Bioorg Med Chem Lett, 2007, 17 :4012–4015. DOI:10.1016/j.bmcl.2007.04.081 |
| [11] | Brown AD, Bunnage ME, Glossop PA, et al. The discovery of adamantyl-derived, inhaled, long acting β2-adrenoreceptor agonists[J]. Bioorg Med Chem Lett, 2008, 18 :1280–1283. DOI:10.1016/j.bmcl.2008.01.034 |
| [12] | Brown AD, Bunnage ME, Glossop PA, et al. The discovery of indole-derived long acting β2-adrenoceptor agonists for the treatment of asthma and COPD[J]. Bioorg Med Chem Lett, 2007, 17 :6188–6191. DOI:10.1016/j.bmcl.2007.09.031 |
| [13] | Bonnert RV, Brown RC, Chapman D, et al. Dual D2-receptor and β2-adrenoceptor agonists for the treatment of airway diseases. 1. Discovery and biological evaluation of some 7-(2-aminoethyl)-4-hydroxybenzothiazol-2(3H)-one analogues[J]. J Med Chem, 1998, 41 :4915–4917. DOI:10.1021/jm980421f |
| [14] | Glossop PA, Price DA. Progress in the development of inhaled, long-acting β2-adrenoceptor agonists[J]. Annu Rep Med Chem, 2006, 41 :237–248. DOI:10.1016/S0065-7743(06)41015-0 |
| [15] | Stocks MJ, Alcaraz L, Bailey A, et al. Design driven HtL:the discovery and synthesis of new high efficacy β2-agonists[J]. Bioorg Med Chem Lett, 2011, 21 :4027–4031. DOI:10.1016/j.bmcl.2011.04.135 |
| [16] | Connolly S, Alcaraz L, Bailey A, et al. Design-driven LO:the discovery of new ultra long acting dibasic β2-adrenoceptor agonists[J]. Bioorg Med Chem Lett, 2011, 21 :4612–4616. DOI:10.1016/j.bmcl.2011.05.097 |
| [17] | Stocks MJ, Alcaraz L, Bailey A, et al. Discovery of AZD3199, an inhaled ultralong acting β2 receptor agonist with rapid onset of action[J]. ACS Med Chem Lett, 2014, 5 :416–421. DOI:10.1021/ml4005232 |
| [18] | Baur F, Beattie D, Beer D, et al. The identification of indacaterol as an ultralong-acting inhaled β2-adrenoceptor agonist[J]. J Med Chem, 2010, 53 :3675–3684. DOI:10.1021/jm100068m |
| [19] | Perez D, Crespo M, Sole L, et al. Discovery of substituted phenyl urea derivatives as novel long-acting β2-adrenoreceptor agonists[J]. Bioorg Med Chem Lett, 2011, 21 :1545–1548. DOI:10.1016/j.bmcl.2010.12.096 |
| [20] | Jacobsen JR, Aggen JB, Church TJ, et al. Multivalent design of long-acting β2-adrenoceptor agonists incorporating biarylamines[J]. Bioorg Med Chem Lett, 2014, 24 :2625–2630. DOI:10.1016/j.bmcl.2014.04.069 |
| [21] | McKinnell RM, Klein U, Linsell MS, et al. Discovery of TD-4306, a long-acting β2-agonist for the treatment of asthma and COPD[J]. Bioorg Med Chem Lett, 2014, 24 :2871–2876. DOI:10.1016/j.bmcl.2014.04.095 |
| [22] | Aparici M, Gavalda A, Ramos I, et al. In vitro and in vivo preclinical profile of abediterol (LAS100977), an inhaled longacting β2-adrenoceptor agonist, compared with indacaterol, olodaterol and vilanterol[J]. Eur J Pharmacol, 2016, 770 :61–69. DOI:10.1016/j.ejphar.2015.11.053 |
| [23] | Jacobsen JR, Choi SK, Combs J, et al. A multivalent approach to the discovery of long-acting β2-adrenoceptor agonists for the treatment of asthma and COPD[J]. Bioorg Med Chem Lett, 2012, 22 :1213–1218. DOI:10.1016/j.bmcl.2011.11.072 |
| [24] | Hoenke C, Bouyssou T, Tautermann CS, et al. Use of 5-hydroxy-4H-benzo[1, 4] oxazin-3-ones as β2-adrenoceptor agonists[J]. Bioorg Med Chem Lett, 2009, 19 :6640–6644. DOI:10.1016/j.bmcl.2009.10.013 |
| [25] | Bouyssou T, Hoenke C, Rudolf K, et al. Discovery of olodaterol, a novel inhaled β2-adrenoceptor agonist with a 24 h bronchodilatory efficacy[J]. Bioorg Med Chem Lett, 2010, 20 :1410–1414. DOI:10.1016/j.bmcl.2009.12.087 |
| [26] | Cui Y, Zhao X, Sun P, et al. Tolerability and pharmacokinetics of tranditerol hydrochloride tablets in healthy subjects after a single dose administration[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2008, 24 :25–28. |
| [27] | Kong L, Yuan Y, Shao Y, et al. Efficacy and tolerability of tratinterol hydrochloride tablets in bronchial asthma:a multicenter, randomized, double-blind, dose-finding clinical trial[J]. Clin Ther, 2014, 36 :1195–1204. DOI:10.1016/j.clinthera.2014.06.020 |
| [28] | Li K, Wang Y, Zhang L, et al. Simultaneous determination of trantinterol and its metabolites in rat urine and feces by liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2013, 934 :89–96. DOI:10.1016/j.jchromb.2013.06.033 |
| [29] | Kong L, Liu J, Gu G, et al. Randomized, multicenter clinical study of tratinterol hydrochloride tablets for the treatment of bronchial asthma[J]. Clin Ther, 2015, 37 :1248–1258. DOI:10.1016/j.clinthera.2015.03.013 |
| [30] | Anderson GP, Lindén A, Rabe KF. Why are long-acting β-adrenoceptor agonists long-acting?[J]. Eur Respir J, 1994, 7 :569–578. DOI:10.1183/09031936.94.07030569 |
| [31] | Patton JS, Byron PR. Inhaling medicines:delivering drugs to the body through the lungs[J]. Nat Rev Drug Discov, 2007, 6 :67–74. DOI:10.1038/nrd2153 |
| [32] | Whalen EJ, Rajagopal S, Lefkowitz RJ. Therapeutic potential of β-arrestin-and G protein-biased agonists[J]. Trends Mol Med, 2011, 17 :126–139. DOI:10.1016/j.molmed.2010.11.004 |
| [33] | Lefkowitz RJ. A brief history of G-protein coupled receptors (Nobel Lecture)[J]. Angew Chem Int Ed, 2013, 52 :6366–6378. DOI:10.1002/anie.201301924 |
| [34] | Woo AH, Jozwiak K, Toll L, et al. Tyrosine 308 is necessary for ligand-directed Gs protein-biased signaling of β2-adrenoceptor[J]. J Biol Chem, 2014, 289 :19351–19363. DOI:10.1074/jbc.M114.558882 |
| [35] | Soriano-Ursua MA, Trujillo-Ferrara JG, Correa-Basurto J, et al. Recent structural advances of β1 and β2 adrenoceptors yield keys for ligand recognition and drug design[J]. J Med Chem, 2013, 56 :8207–8223. DOI:10.1021/jm400471z |
 2016, Vol. 51
2016, Vol. 51


