2. 西南大学-西藏农牧学院药用植物联合研发中心, 重庆 400715 ;
3. 西南大学药学院, 重庆 400715 ;
4. 西藏农牧学院药用植物研究中心, 西藏 林芝 860000
2. SWU-TAAHC Medicinal Plant R & D Centre, Chongqing 400715, China ;
3. College of Pharmaceutical Sciences, Southwest University, Chongqing 400715, China ;
4. Medicinal Plant Research Centre, Tibet Agricultural and Animal Husbandry College, Nyingchi 860000, China
青蒿素 (artemisinin) 是从药用植物黄花蒿 (Artemisia annua L.) 中提取的一种含有过氧桥结构的倍半萜内酯, 是治疗疟疾首选药物[1]。植物MEP途径定位于质体中, 可为萜类合成提供基本前体IPP和DMAPP[2], 也可为青蒿素合成提供基本前体[3]。羟甲基丁烯基-4-磷酸还原酶 (hydroxymethylbutenyl 4-diphosphate reductase, HDR) 是MEP途径中最后一个酶, 催化羟甲基丁烯基-4-磷酸 (HMBPP) 生成异戊烯基焦磷酸 (IPP) 和IPP的同分异构体二甲基烯丙基焦磷酸 (DMAPP)[4]。同时, HDR被认为是MEP途径中的一个关键酶。在转基因拟南芥中, 双基因共转化(同时过表达HDR和紫杉二烯合成酶基因TXS) 材料中紫杉二烯含量比单基因转化 (仅过表达TXS) 材料中紫杉二烯含量高13倍, 表明HDR基因能够为下游萜类合成提供更多前体, 在萜类代谢工程中具有重要应用前景[5]。本研究从黄花蒿中克隆了HDR基因 (AaHDR2), 对AaHDR2和已报道的AaHDR1组 织表达谱和诱导表达谱进行研究以确定哪一条基因对青蒿素的生物合成影响更大, 从而进行后续的相关实验研究; 对AaHDR2进行了生物信息学分析, 并在大肠杆菌突变菌株MG1655 ara<>HDR中鉴定了AaHDR2的功能; 激光共聚焦观察确定了AaHDR2定位于叶绿体; 在拟南芥中过表达AaHDR2, 考察其对相关萜类代谢产物合成的影响。HDR克隆和功能研究有助于阐明MEP途径在萜类物质生物合成中的作用并为萜类物质代谢工程提供可能的候选功能基因。
材料与方法植物材料 黄花蒿、烟草和拟南芥种子, 由实验室保存并在25 ℃、光周期为16 h光照、8 h黑暗的条件下萌发成为实生苗。将长势一致的12株黄花蒿随机分为3组, 每组4个重复, 分别用于茉莉酸甲酯 (MeJA)、脱落酸 (ABA) 和赤霉酸(GA3) 处理, 处理方法参照Xiang等[2]的方法, 分别取样后, 冻于 -80 ℃冰箱备用。黄花蒿腺体的分离参照Teoh等[6]的方法。
菌株和质粒 大肠杆菌DH5α、根癌农杆菌LBA4404和GV3101、E. coli突变菌株MG1655ara<> HDR (由Dr. M. Masters惠赠), 保存于-80 ℃; 原核表达载体pQE30, 植物高效表达载体p1300-GFP和pHB由本实验室保存。
RNA提取及cDNA合成 取适量黄花蒿材料于液氮中研磨成粉后取100 mg, 并按照植物总RNA提取试剂盒 (Tiangen, China) 说明书提取RNA, 用1% 的琼脂糖凝胶电泳检测RNA的完整性, 紫外可见光光度计测定其浓度和纯度, 紫外可见光光度计测定其在260和280 nm处的吸光值, A260/A280均大于1.8小于2.1, 说明提取的RNA无蛋白和DNA污染[7, 8], 将质量合格的RNA用3', 5' RACE反转录试剂盒获得cDNA, 用于本实验研究的基因克隆。
基因克隆 根据AaHDR2基因Contig19910序列信息, 分别设计5' RACE引物和3' RACE巢式引物, 用于AaHDR2基因5' 端和3' 端序列的克隆, 将所得到3' RACE、5' RACE序列和AaHDR2基因Contig19910序列在Vector NTI 8.0软件中进行重叠群分析, 拼接得到AaHDR2全长cDNA的电子拼接全长。根据电子拼接全长设计物理全长引物, 扩增AaHDR2物理全长序列。本实验所用引物见 (表 1)。
| Table 1 Primers used in this study |
生物信息学分析 在Vector NTI Suite 8.0软件上进行编码区的查找和核苷酸的翻译; 用Vector NTI Suite8.0软件和Blast进行氨基酸序列比对分析; 用ClustalX[9]进行氨基酸多重序列比对, 用MEGA4.1的Neighbor-joining方法进行进化树的构建 (repeat 1000); 使用Expasy网站提供的相关生物信息学分析软件 (Compute pI/MW, SOPMA等) 进行蛋白质基本性质的预测及分析; ChloroP 1.1 Prediction Server进行转运肽分析。
AaHDR1和AaHDR2基因表达量检测 使用BIO-RAD公司的iScriptTM cDNA Synthesis Kit试剂盒将黄花蒿各组织 (根、茎、叶、花、腺体) 和各种处理的黄花蒿材料的RNA进行反转录, 得到cDNA作为实时荧光定量PCR (qPCR) 检测的模板, qPCR反应体系和程序, 参照本实验室之前的报道[4, 10]。以Actin作为qPCR的内参, 根据2-ΔΔCt方法计算基因的相对表达量[11]。
AaHDR2在大肠杆菌中的功能验证E. coli突变菌株MG1655 ara<>HDR能在含有0.2% 阿拉伯糖 (L-arabinose) 的LB培养基上生长, 而不能在仅含0.2% 葡萄糖 (D-glucose) 的LB培养基上生长[12]。为了验证克隆到的AaHDR2所编码蛋白质具有HDR功能, 用限制性酶BamHI和XmaI构建了携带AaHDR2的重组质粒pQE30-AaHDR2, 并将其转入MG1655 ara<>HDR。此外, 将携带pQE30的菌株作为对照菌株, 均37 ℃恒温箱培养后进行观察。培养基为LB固体培养基, 添加0.2% 葡萄糖、50 mg·L-1氨苄青霉素 (ampicillin, Amp)、50 mg·L-1卡那霉素 (kanamycin, Kan)、0.5 mmol·L-1异丙基-β-D-硫代半乳糖苷 (isopropyl-β-D-1-thiogalactopyranoside, IPTG)。
AaHDR2亚细胞定位 将AaHDR2用限制性 酶XmaI和XbaI构建到载体p1300-GFP上。构建 重组质粒p1300–AaHDR2-GFP, 并将其转入农杆菌LBA4404中, 获得工程菌。然后将p1300-GFP工程菌和p1300-AaHDR2-GFP工程菌分别瞬时转化烟草[13]。弱光培养48 h后, 取其叶片制成临时装片, 用激光共聚焦显微镜拍照, 观察其亚细胞定位部位。
转AaHDR2拟南芥的获得及叶绿素a、叶绿素b、类胡萝卜素的测定 将AaHDR2用限制性酶BamHI 和XbaI与pHB载体连接, 获得重组质粒pHB- AaHDR2。并将其转入农杆菌GV3101中, 获得工程菌。用蘸花法转化拟南芥[14], 并收集拟南芥种子播种于含250 mg·L -1头孢霉素和50 mg·L -1潮霉素的MS固体培养基上进行筛选, 并将筛选得到的拟南芥移栽到营养基质 (3泥炭土: 6蛭石: 1珍珠岩) 中, 在 25 ℃、光周期为16 h光照、8 h黑暗的条件下生长 2周后, 取其叶片进行基因组PCR检测, 进一步确认转基因拟南芥。按照Marr等[15]的方法测定生长2周的转基因拟南芥叶片中叶绿素a、叶绿素b和类胡萝卜素的含量。
结果 1 AaHDR2克隆和生物信息学分析AaHDR2的cDNA全长为1 548 bp, 包含1 362 bp的编码区、28 bp 5' UTR和131 bp 3' UTR, polyA长度为27 bp, 终止密码子为TAA。AaHDR2编码一个454氨基酸残基的多肽, 其分子质量为51.2 kDa, 等电点为5.66, 与已知的拟南芥、艾菊和葡萄的HDR相近。二级结构预测, 表明AaHDR2有37.89% α螺旋、22.69% β-片层、10.57% β-转角和28.85%无规则卷曲。亚细胞定位预测其定位于叶绿体中。序列相似性分析结果表明, AaHDR2与已报道的AaHDR1[16]的氨基酸序列相似性为89.0%, 一致性为81.8%; 与其他植物HDRs氨基酸序列也具有较高相似性: 如与 艾菊HDR相似性为90.1%, 一致性为84.6%; 与葡萄HDR相似性为84.5%, 一致性为78.5%。AaHDR2与已经报道的AaHDR1及其他植物HDR在氨基酸序列上有较高相似性表明, 该基因确实是黄花蒿HDR。因进化树上的距离与其所属类别的亲缘关系基本一致, 分子系统学分析结果表明, AaHDR2和同属菊科的艾菊和甜叶菊HDR亲缘关系最近 (图 1)。
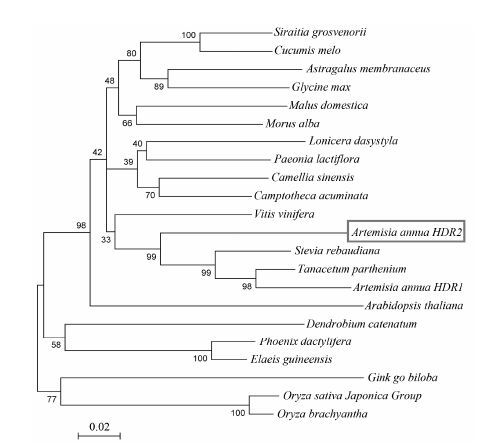
|
Figure 1 The phylogenetic tree of HDR from different organisms constructed by neighbor-joining method on MEGA 4.1 |
采用qPCR检测AaHDR2和上述提到的已报道的AaHDR1在黄花蒿各器官中表达水平, 发现它们在黄花蒿根、茎、叶、花和腺体中都有表达, 且在腺体中表达量最高, 两者的组织表达模式大致相同 (图 2)。这与之前报道的青蒿素合成途径上涉及的关键基因 (如: ADS、CYP71AV1、DBR2和ALDH1) 的表达模式具有较高的相似性[17]。另外, 还发现本文克隆到的AaHDR2在花中的表达水平要明显高于叶中, 而AaHDR1在花和叶中的表达水平无明显差异。根据之前的报道, 青蒿素的合成、分泌、贮存的部位是在黄花蒿花蕾或是成熟叶片的腺体中[18, 19], 且花蕾表面的腺体密度要高于叶表面的腺体密度[20] (图 2)。因此猜测AaHDR1和AaHDR2可能都与青蒿素的生物合成有关, 但是AaHDR2的作用可能要大于AaHDR1的作用。现有研究表明植物激素MeJA、ABA和GA3处理能够提高青蒿素的含量。进一步分析AaHDR1和AaHDR2对这3种激素的响应, 结果表明MeJA处理后, AaHDR1表达量有极显著提高; ABA处理后, AaHDR1表达量有显著提高; GA3处理后, AaHDR1表达量没有显著性变化 (图 3 A~C)。而MeJA、ABA和GA3处理后, AaHDR2表达量均有极显著提高 (图 3 D~F)。由此可见, AaHDR2基因表达受到MeJA、
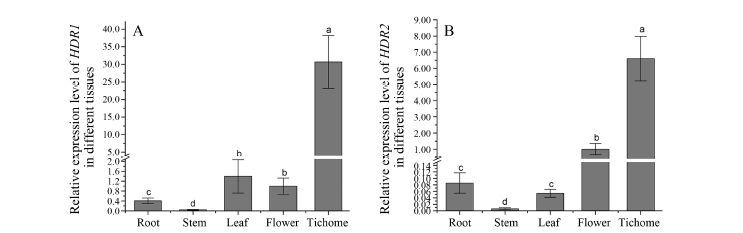
|
Figure 2 Expression profiles of AaHDR1 (A) and AaHDR2 (B) in different tissue. Trichome: Glandular secretory trichomes. Different letters indicate statistical differences among means by Duncan’s multiple rang test (P < 0.05) |
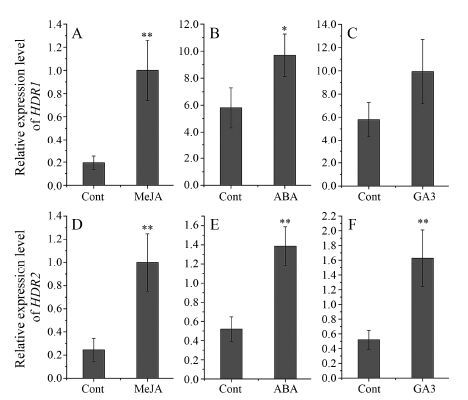
|
Figure 3 Gene expression of AaHDR1 and AaHDR2 in Artemisia annua L. with different treatment. A-C: Gene expression profiles of AaHDR1 in the treatment of MeJA, ABA and GA3 respectively; D-F: Gene expression profile of AaHDR2 in the treatment of MeJA, ABA and GA3 respectively. P < 0.05, **P < 0.01 vs Cont |
ABA和GA3的诱导更强, 更有利于青蒿素的生物合成。综合AaHDR1和AaHDR2组织表达和诱导表达分析, 认为AaHDR2对青蒿素的生物合成的贡献更大, 用来进行后续的相关实验研究。
3 AaHDR2在大肠杆菌中的功能验证MEP途径对细菌的生长是必需的, 经改造后大肠杆菌突变体MG1655 ara<>HDR突变菌株 (HDR功能缺失) 能在含有0.2% 阿拉伯糖 (Ara) 的LB固体培养基上生长, 却不能在仅含有0.2% 葡萄糖 (Glc) 的LB固体培养基上生长。当携带AaHDR2的pQE30-AaHDR2原核表达载体, 转入MG1655 ara<>HDR后, 重组菌株获得外源性的AaHDR2, 可以利用葡萄糖在LB + Amp + Kan + 0.2% Glc + 0.5 mmol·L-1 IPTG的固体培养基上生长, 而对照菌株 (仅携带pQE30质粒的菌株) 依然不能利用葡萄糖, 不能在LB + Amp + Kan + 0.2% Glc + 0.5 mmol·L-1 IPTG的固体培养基上生长 (图 4)。结果证明: AaHDR2编码的蛋白质互补了大肠杆菌缺失的HDR功能, 因此证实AaHDR2的确具有HDR活性, 也即AaHDR2编码的蛋白质就是羟甲基丁烯基-4-磷酸还原酶。

|
Figure 4 Functional demonstration of AaHDR2 in the E. coli HDR mutant. The E. coli mutant MG1655 ara<>HDR was able to grow on Luria-Bertani medium containing 0.2% Ara (top right), but not on medium containing 0.2% Glc (top left). After transformation with the AaHDR2 (pQE-30-AaHDR2) and, as a control, with the empty vector (pQE-30) alone, the resulting strains were tested for growth on medium containing 0.2% Glc and 0.5 mmol·L-1 IPTG. Expression of AaHDR2 protein successfully restored the growth of the E. coli mutant MG1655 ara<>HDR (below left), but the control can’t restore the growth of the E. coli mutant MG1655 ara<>HDR (below right) |
AaHDR2亚细胞定位结果表明, p1300-AaHDR2-GFP融合蛋白 (图 5 A~D), 在波长为488 nm的激发光下, GFP发出的绿色荧光和在波长为559 nm的激发光下烟草叶片中的叶绿体自发的红色荧光, 能够完全重叠。在波长为488 nm的激发光下, 对照p1300-GFP发出的绿色荧光分布在细胞膜、细胞质、细胞核、内质网等各个位置, 与在波长为559 nm的激发光下烟草叶片中叶绿体自发红色荧光, 不能够重叠 (图 5 E~H)。表明AaHDR2定位于叶绿体中, 这不仅与生物信息学预测结果吻合, 同时也符合MEP途径定位于质体的事实[21]。

|
Figure 5 Subcellular localization of AaHDR2. A-D: Subcellular localization of the p1300-AaHDR2-GFP protein; E-H: Subcellular localization of the GFP protein alone as control; A and E: GFP in green fluorescence; B and F: Bright-field; C and G: Chlorophyll in red fluorescence; D and H: The merged pictures of green (GFP), bright-field and red (chlorophyll fluorescence). Bar: 20 μm |
在T2代转AaHDR2拟南芥中能同时检测到特 异性的1 451 bp AaHDR2目的片段和753 bp潮霉素 (Hygr) 抗性基因片段; 在对照 (转空pHB质粒) 拟南芥中只能检测到753 bp潮霉素抗性基因片段 (图 6)。PCR检测结果表明获得了AaHDR2转基因拟南芥, 可用于后续分析。在过表达AaHDR2的转基因拟南芥植株中叶绿素a、叶绿素b及类胡萝卜素的含量与对照相比有显著性提高 (图 7)。对照拟南芥叶绿素a的含量为0.500 ± 0.010 mg·g-1, 转基因拟南芥3个株系的叶绿素a含量分别为0.567 ± 0.006、0.613 ± 0.024、0.607 ± 0.002 mg·g-1, 与对照相比分别提高了13.42%、22.58%、21.29% (图 7A); 对照拟南芥叶绿素b的含量为0.207 ± 0.003 mg·g-1, 转基因拟南芥3个株系的叶绿素b含量分别为0.222 ± 0.007、0.239 ± 0.002、0.235 ± 0.004 mg·g-1, 与对照相比分别提高了7.10%、15.16%、13.50% (图 7B); 对照拟南芥类胡萝卜素的含量为0.095 ± 0.002 mg·g-1, 转基因拟南芥3个株系的类胡萝卜素含量分别为0.109 ± 0.002、0.116 ± 0.002、0.120 ± 0.001 mg·g-1, 与对照相比分别提高了14.92%、22.75%、27.42% (图 7C)。虽然转基因拟南芥株系中这3种产物的含量提高程度不同, 但与对照相比都有显著性提高, 这可能是因为AaHDR2在拟南芥中超量表达为叶绿素a、叶绿素b和类胡萝卜素的生物合成提供更多的前体物质。

|
Figure 6 PCR detection of AaHDR2 and Hygr. M: DNA marker; P: Positive control; WT: Wide-type roots of Arabidopsis thaliana; V1-V3: Transgenic Arabidopsis thaliana with the empty plasmid pHB; T1-T3: Transgenic Arabidopsis thaliana lines with overexpression of AaHDR2 |

|
Figure 7 The content of chlorophyll a (A), chlorophyll b (B) and carotenoids (C). pHB: Transgenic Arabidopsis thaliana with the empty plasmid pHB; HDR2 1-HDR2 3: Transgenic Arabidopsis thaliana lines with overexpression of AaHDR2. P < 0.05, **P < 0.01 vs pHB |
羟甲基丁烯基-4-磷酸还原酶 (HDR) 是MEP途径中最后一个酶, 催化羟甲基丁烯基-4-磷酸生成异戊烯基焦磷酸 (IPP) 和其同分异构体二甲基烯丙基焦磷酸 (DMAPP)[4]。2005年, 拟南芥HDR基因的克隆以及酶蛋白质功能验证等研究[22], 使得植物中HDR基因研究得以深入。Hsieh等[23]证明了HDR基因确实在MEP整个代谢途径中起到一个关键酶基因的作用。紫杉醇代谢工程研究表明过表达HDR基因有利于紫杉醇前体紫杉二烯合成[5]; 丹参酮代谢工程研究证明, 过表达丹参HDR能够提高丹参酮含量[24]。因此HDR被认为是MEP途径中的关键酶, 是萜类代谢工程中一个重要的候选基因。
本研究成功克隆了黄花蒿AaHDR2基因, 并通过组织表达谱分析发现, AaHDR2与已报道的AaHDR1基因的表达模式大致相同, 在黄花蒿的根、茎、叶、花和腺体中均有表达且在腺体中的表达量与在其他组织中的表达量相比有显著性差异; 除此之外, 还发现本文克隆到的AaHDR2在花中的表达水平要明显高于叶中的表达水平, 而AaHDR1在花和叶中的表达水平无明显差异。据研究, 青蒿素的合成、分泌、贮存的部位是在黄花蒿花蕾或是成熟叶片的腺体中[18, 19], 且花蕾表面的腺体密度要高于叶表面的腺体密度[20]。因此推测: AaHDR1和AaHDR2可能都与青蒿素的生物合成有关, 但是AaHDR2对青蒿素生物合成贡献的作用可能要大于AaHDR1的作用。
MeJA、ABA和GA3作为常见的植物激素, 能 够影响多种植物的次生代谢产物的合成。研究证明: 外源的MeJA能使青蒿素生物合成途径基因 (DXS、DXR、HDR、ADS、CYP71AV1、DBR2和ALDH1) 及参与调控青蒿素合成的转录因子 (ORA、ERF1) 等的表达量大幅上调, 从而提高黄花蒿中青蒿素的含量[2]; 外源ABA能使青蒿素生物合成途径基因 (ADS、CYP71AV1、DBR2和ALDH1) 的表达量大幅上调, 从而提高黄花蒿中青蒿素的含量[25]; 外源GA3能使青蒿素生物合成途径基因 (FPS、ADS和CYP71AV1) 的表达量大幅上调及表达量的轻微上调, 从而提高黄花蒿中青蒿素的含量[26]。通过对AaHDR1和AaHDR2诱导表达分析, 发现AaHDR1受到MeJA的强烈诱导、ABA的较强诱导、GA3的轻微诱导; 而AaHDR2能分别受到MeJA、ABA和GA3的强烈诱导。因此, AaHDR2的诱导性更强、可调控性更大, 故而猜测AaHDR2基因与青蒿素等萜类化合物以及某些次生代谢产物的合成关系更密切, 对后续相关的实验研究意义更大。
在E. coli突变体MG1655 ara<>HDR (HDR功能缺失) 中, 重组质粒pQE30-AaHDR2产生的AaHDR2互补了大肠杆菌缺失的HDR功能[12, 16]。因此证实AaHDR2的确具有HDR催化功能, 也即AaHDR2编码的蛋白质就是羟甲基丁烯基-4-磷酸还原酶。
本研究还将AaHDR2在拟南芥中过表达, 从而提高了以异戊二烯为合成基本单元的相关代谢产物的含量, 与对照相比叶绿素a含量提高了13.42%~22.58%; 叶绿素b含量提高了7.10%~15.16%; 类胡萝卜素含量提高了14.92%~27.42%。转基因拟南芥中叶绿素a、叶绿素b和类胡萝卜素含量的显著提高, 表明过表达AaHDR2对萜类物质合成具有重要作用, 为后续在黄花蒿中过表达AaHDR2提高青蒿素含量提供线索。本研究对AaHDR2克隆和功能分析有助于阐明青蒿素依赖于MEP途径合成的分子机制, 并为通过遗传工程技术提高青蒿素次生代谢工程提供一个可能的候选靶点。
| [1] | Li Y, Yu PL, Chen YX, et al. Studies on analogs of artemisinine Ⅰ. The synthesis of ethers, carboxylic esters and carbonates of dihydroartemisinine[J]. Acta Pharm Sin (药学学报) , 1981, 16 (429) :439. |
| [2] | Xiang LE, Zhu SQ, Zhao TF, et al. Enhancement of artemisinin content and relative expression of genes of artemisinin biosynthesis in Artemisia annua by exogenous MeJA treatment[J]. Plant Growth Regul , 2015, 75 :435–441. DOI:10.1007/s10725-014-0004-z |
| [3] | Paiva NL. An introduction to the biosynthesis of chemicals used in plant-microbe communication[J]. J Plant Growth Regul , 2000, 19 :131–143. |
| [4] | Wang YX, Long SP, Zeng LX, et al. Enhancement of artemisinin biosynthesis in transgenic Artemisia annua L. by overexpressed HDR and ADS genes[J]. Acta Pharm Sin (药学学报) , 2014, 49 :1346–1352. |
| [5] | Botella-Pavía P, Besumbes O, Phillips MA, et al. Regulation of carotenoid biosynthesis in plants: evidence for a key role of hydroxymethylbutenyl diphosphate reductase in controlling the supply of plastidial isoprenoid precursors[J]. Plant J , 2004, 40 :188–199. DOI:10.1111/tpj.2004.40.issue-2 |
| [6] | Teoh KH, Polichuk DR, Reed DW, et al. Artemisia annua L. (Asteraceae) trichome-specific cDNAs reveal CYP71AV1, a cytochrome P450 with a key role in the biosynthesis of the antimalarial sesquiterpene lactone artemisinin[J]. FEBS Lett , 2006, 580 :1411–1416. DOI:10.1016/j.febslet.2006.01.065 |
| [7] | Qiang W, Hou YL, Li X, et al. Cloning and expression of the key enzyme hyoscyamine 6 beta-hydroxylase gene (DaH6H) in scopolamine biosynthesis of Datura arborea[J]. Acta Pharm Sin (药学学报) , 2015, 50 :1346–1355. |
| [8] | Shen T, Qiu F, Chen M, et al. Cloning and functional characterization of a cDNA encoding isopentenyl diphosphate isomerase involved in taxol biosynthesis in Taxus media[J]. Acta Pharm Sin (药学学报) , 2015, 50 :621–626. |
| [9] | Thompson JD, Gibson TJ, Plewniak F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Res , 1997, 25 :4876–4882. DOI:10.1093/nar/25.24.4876 |
| [10] | Long SP, Lu Y, Wang YX, et al. Enhancement of tropane alkaloids production in transgenic hair roots of Atropa belladonna by overexpressing endogenous genes AbPMT and AbH6H[J]. Acta Pharm Sin (药学学报) , 2013, 48 :243–249. |
| [11] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods , 2001, 25 :402–408. DOI:10.1006/meth.2001.1262 |
| [12] | McAteer S, Coulson A, McLennan N, et al. The lytB gene of Escherichia coli is essential and specifies a product needed for isoprenoid biosynthesis[J]. J Bacteriol , 2001, 183 :7403–7407. DOI:10.1128/JB.183.24.7403-7407.2001 |
| [13] | Kapila J, De Rycke R, Van Montagu M, et al. An Agrobacterium-mediated transient gene expression system for intact leaves[J]. Plant Sci , 1997, 122 :101–108. DOI:10.1016/S0168-9452(96)04541-4 |
| [14] | Clough SJ, Bent AF. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J]. Plant J , 1998, 16 :735–743. DOI:10.1046/j.1365-313x.1998.00343.x |
| [15] | Marr IL, Suryana N, Lukulay P, et al. Determination of chlorophyll a and b by simultaneous multi-component spectrophotometry[J]. Fresen J Anal Chem , 1995, 352 :456–460. DOI:10.1007/BF00323366 |
| [16] | Peng MF, Chen M, Chen R, et al. The last gene involved in the MEP pathway of Artemisia annua: cloning and characterization and functional identification[J]. J Med Plants Res , 2011, 5 :223–230. |
| [17] | Maes L, Van Nieuwerburgh FC, Zhang Y, et al. Dissection of the phytohormonal regulation of trichome formation and biosynthesis of the antimalarial compound artemisinin in Artemisia annua plants[J]. New Phytol , 2011, 189 :176–189. DOI:10.1111/j.1469-8137.2010.03466.x |
| [18] | Duke SO, Paul RN. Development and fine structure of the glandular trichomes of Artemisia annua L[J]. Int J Plant Sci , 1993, 154 :107–118. DOI:10.1086/297096 |
| [19] | Ferreira JFS, Janick J. Floral morphology of Artemisia annua with special reference to trichomes[J]. Int J Plant Sci , 1995, 156 :807–815. DOI:10.1086/297304 |
| [20] | Olofsson L, Engström A, Lundgren A, et al. Relative expres-sion of genes of terpene metabolism in different tissues of Artemisia annua L[J]. BMC Plant Biol , 2011, 11 :45. DOI:10.1186/1471-2229-11-45 |
| [21] | Towler MJ, Weathers PJ. Evidence of artemisinin production from IPP stemming from both the mevalonate and the nonme-valonate pathways[J]. Plant Cell Rep , 2007, 26 :2129–2136. DOI:10.1007/s00299-007-0420-x |
| [22] | Guevara-García A, San Román C, Arroyo A, et al. Charac-terization of the Arabidopsis clb6 mutant illustrates the impor-tance of post transcriptional regulation of the methyl-D-erythritol 4-phosphate pathway[J]. Plant Cell , 2005, 17 :628–643. DOI:10.1105/tpc.104.028860 |
| [23] | Hsieh M, Goodman H. The Arabidopsis IspH homolog is involved in the plastid nonmevalonate pathway of isoprenoid biosynthesis[J]. Plant Physiol , 2005, 138 :641–653. DOI:10.1104/pp.104.058735 |
| [24] | Hao G, Shi R, Tao R, et al. Cloning, molecular characteriza-tion and functional analysis of 1-hydroxy-2-methyl-2-(E)-butenyl-4-diphosphate reductase (HDR) gene for diterpenoid tanshinone biosynthesis in Salvia miltiorrhiza Bge. f. alba[J]. Plant Physiol Bioch , 2013, 70 :21–32. DOI:10.1016/j.plaphy.2013.05.010 |
| [25] | Zhang FY, Fu XQ, Lv ZY, et al. A basic leucine zipper transcription factor, AabZIP1, connects abscisic acid signaling with artemisinin biosynthesis in Artemisia annua[J]. Mol Plant , 2015, 8 :163–175. DOI:10.1016/j.molp.2014.12.004 |
| [26] | Waleerat B, Masahiro M, Kanyaratt S. Enhancement of ar-temisinin content and biomass in Artemisia annua by exogenous GA3 treatment[J]. Plant Growth Regul , 2011, 63 :45–54. DOI:10.1007/s10725-010-9510-9 |
 2016, Vol. 51
2016, Vol. 51


