2. 武汉大学生命科学学院, 湖北 武汉 430072
2. College of Life Sciences, Wuhan University, Wuhan 430072, China
组蛋白是人类染色体的基本组成单位, 组蛋白乙酰化和去乙酰化是调节基因表达的决定性因素[1]。组蛋白的乙酰化程度是由组蛋白转移酶 (HAT) 和组蛋白去乙酰化酶 (HDAC) 协调控制。大量的研究表明, 在癌细胞中HDAC过量表达, 使得组蛋白过 度乙酰化, 并增强了组蛋白与DNA的结合能力, 造成核小体结构变得紧密, 使得转录过程中一些调节因子无法与DNA结合, 导致转录受到抑制, 从而引发肿瘤[2-4], 尤其是HDAC1、HDAC6、HDAC8在多种肿瘤细胞中过表达[5-8]。因此, 抑制HDAC能够很好地抑制肿瘤细胞增殖。随着人们对HDAC的不断研究, 组蛋白去乙酰化酶抑制剂 (HDACi) 已成为抗肿瘤药物研究的热点。自2006年, 美国批准的第一个HDACi-Vorinostat (SAHA, 图 1) 用于治疗皮肤 T细胞淋巴癌 (CTCL) 后[9], 已经有数十个HDACi进入了临床试验来治疗各种癌症。目前HDACi大致可以分为异羟肟酸类 [如vorinostat (SAHA)]、不含环氧酮的环四肽类 (如FK228)、含环氧酮的环肽类 (如t rapoxin A)、短链脂肪酸类 (如丁酸钠)、苯甲酰胺类 (如MS-275) 和杂环类 (如SB939) 这6种结 构类型[10, 11]。尽管目前报道了大量的不同类型结构HDACi, 但是现有的HDACi普遍存在HDAC亚型选择性低、生物利用度低等缺点。因此, 开发出结构新颖、亚型选择性高的HDACi具有重要的意义。

|
Figure 1 Structures of SAHA, compounds 1A and 1B |
最近有研究报道, 二氢吡啶酮类化合物是一类结构新型的HDACi, 其二氢吡啶酮基团在HDAC1和HDAC6活性口袋与氨基酸残基有较强的相互作用, 使得这类HDACi展现出了较强的HDAC1和HDAC6抑制活性和选择性, 并对多种肿瘤细胞有抑制活性[12]; 同时, 通过对二氢吡啶酮骨架上氮原子进行取代能够提高HDAC抑制活性和抗肿瘤活性, 其中化合物1A展现出了最强的HDACs抑制活性[13]。但是, 化 合物1A对HDACs的抑制活性弱于阳性药物SAHA。另一方面, 通过研究文献发现, 三氮唑也是HDACi的一个活性基团, 例如将SAHA的苯甲酰胺修饰成三氮唑 (化合物1B) 能够显著地提高HDACs的抑制活性[14]; 此外, 三氮唑类HDACi对HDAC1和HDAC6也有选择性[15]。因此, 为了得到对HDACs抑制活性更强、亚型选择性更高的二氢吡啶酮类HDACi, 本研究以化合物1A为先导化合物, 通过点击化学合成了一系列结构新型的具有三氮唑基团的二氢吡啶酮类HDACi (化合物15~19, 合成路线1)。通过HDACs活性测试发现, 目标化合物对HDAC1和HDAC6具有不同程度的抑制活性并强于HDAC8, 而在三氮唑苯环上引入吸电子基 (F, CN) 比给电子基 (Me, OMe) 活性更强, 其中4-氰基取代、侧链为5个亚甲基 (n = 3) 连接的化合物18e对HDAC1的抑制活性较好, 并强于先导化合物1A和阳性药物SAHA。接着以化合物18e为先导化合物, 探讨了氰基在苯环上的位置对活性的影响, 结果表明氰基在苯环的C3位 (化合物18g) 对HDAC1抑制活性最强; 在随后的抗肿瘤活性实验中, 化合物18g对PC-3和HepG2也展现出了最强的抑制活性。所合成的27个新化合物均未见文献报道。
结果与讨论 1 目标化合物的合成目标化合物15~19的合成过程见路线1。以2-羰基-1, 2-二氢-3-醛基吡啶1为起始原料, 与磷叶立德2发生Wittig反应, 制得3-(2-羰基-1, 2-二氢吡啶 基) 丙烯酸甲酯3, 接着与叠氮化合物4反应, 制得具有不同长度侧链的叠氮化合物5~9, 随后在碘化亚铜的催化与各种芳香炔发生Huisgen环加成反应, 得到三氮唑类化合物10~14, 最后通过羟胺将甲酯转化为相应的异羟肟酸目标化合物15~19。目标化合物的结构经1H NMR及HR-MS分析确证, 其收率、理化常数及波谱数据见表 1、2。
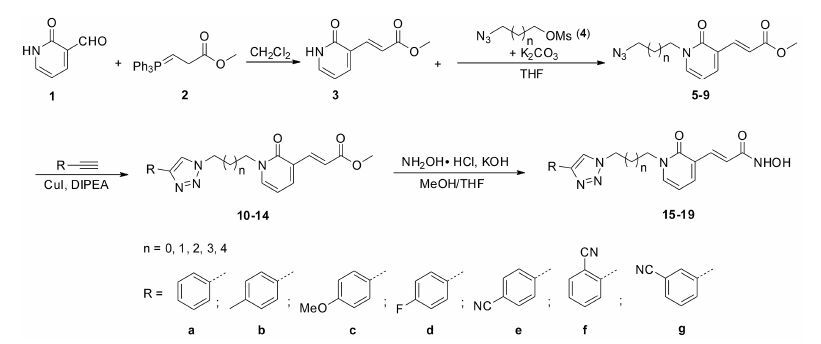
|
Scheme1 Synthetic route of pyridone-based HDAC inhibitors |
| Table 1 Physical contants and HR-MS of synthesized compounds 15-19 |
| Table 2 The 1H NMR data of target compounds |
目标化合物对HDACs的抑制活性结果见表 3。所合成的27个目标化合物对HDAC1和HDAC6有较强的抑制活性, 尤其是对HDAC1展现出了更强的抑制活性 (如化合物18e、18g), 而对HDAC8仅展现出了中等的抑制活性。这些结果说明合成的二氢吡 啶酮类HDACi对HDAC1有较强的选择性和抑制 活性; 此外, 化合物中苯环上的取代基对活性影响较大, 例如化合物15a对HDAC1和HDAC6均展现出了纳摩尔抑制水平, 但是在其苯环上引入给电子甲基 (化合物15b) 和甲氧基 (化合物15c) 后均降低了对HDAC1和HDAC6的抑制活性 (表 3), 而将化合物15a的苯环上用吸电子基氟 (化合物15d) 和氰基 (化合物15e) 取代, 对HDAC1和HDAC6的抑 制活性增加, 这个趋势随着侧链碳的延长 (化合物16~19) 仍然存在, 尤其是3-氰基化合物18g对HDACs的抑制活性明显地强于先导化合物1A, 其对HDAC1 (IC50 = 35 ± 1.5 nmol·L-1) 的抑制活性甚至是阳性药物SAHA的1.2倍 (IC50 = 45 ± 1.2 nmol·L-1)。另外, 侧链的链长对HDAC1的抑制活性也有较大的影响, 其中以5个亚甲基 (n = 3) 连接活性较好。
| Table 3 In vitro inhibition of HDAC1, HDAC6 and HDAC8 (IC50/nmol·L-1). IC50 values are an average of three independent experiments ± standard deviation (mean ± SD) |
通过酶抑制活性研究发现, 这些目标化合物对HDAC1和HDAC6有较强的抑制活性, 本研究通过Autodock4.2D分子模拟软件对HDAC1和HDAC6抑制活性最强的化合物18进行结构分析, 并将得到的最佳对接构象分子用Pymol进行绘图, 其对接结果如图 2所示。与传统的HDACi (如SAHA) 一样, 二氢吡啶酮类化合物的结构也是由表面识别区、连接基团、疏水连接区和锌离子结合区组成。在HDAC1和HDAC6中, 化合物18的表面识别区苯环和连接基团三氮唑均位于活性口袋的入口处 (图 2A、B)。研究表明, HDACi的表面识别区可与酶活性边缘氨基酸残基相互作用, 不仅影响抑制剂对酶的抑制效果, 也能影响抑制剂对酶的选择性[16]。在HDAC1中, 化合物18苯环上的氰基 (3-CN) 能够与酶氨基酸残基Gly25和Gly26形成氢键 (图 2C); 尽管在HDAC6中氰基(3-CN) 没有形成氢键, 但连接基团三氮唑的N原子却与Tyr782形成了氢键 (图 2C), 因此化合物18g对HDAC1和HDAC6有明显地选择性。此外, 化合物18的脂肪链占据了酶活性口袋通道并与口袋壁形成较强的疏水作用 (图 2A、B); 一端的异羟肟酸基团不仅能够与活性口袋底部的氨基酸残基相互作用, 而且还能与活性口袋底部的Zn2+形成配位, 因此化合物18g对HDAC1和HDAC6均有较强的抑制活性。但是化合物18g的异羟肟酸基团在HDAC1和HDAC6活性口袋底部与氨基酸残基和锌离子作用方式不同, 在HDAC1中异羟肟酸基团与Asp176、Asp264、Gly301和Tyr303氨基酸残基相互作用形成了4个氢键, 并且异羟肟酸基团羰基氧 (2.1Å) 能够与氨基酸残基Asp176 (2.0Å)、Asp178 (2.3Å)、Asp264 (1.9Å) 一起与Zn2+形成四配位; 而在HDAC6中, 异羟肟酸基团与Asp649和Tyr782氨基酸残基相互作用只形成了两个氢键, 但是异羟肟酸基团羰基氧 (2.9Å) 和羟基氧 (2.6Å) 能够与氨基酸残基Asp 649 (2.1Å)、Asp 742 (2.7Å)、His651 (1.9Å) 一起与Zn2+形成五配位。
4 目标化合物的抗肿瘤活性选择对HDAC1和HDAC6抑制活性较强的化合物15d~15e、16d~16e、17d~17e、18d~18g和19d~19e进行抗肿瘤活性测试。从表 4结果可知, 这些苯环上具有吸电子基团的化合物对5种肿瘤细胞均有较强的抑制活性, 尤其对前列腺癌PC-3展现出了更强的抑制活性, 部分化合物(如18e、18g) 对PC-3的抑制活性强于先导化合物1A和阳性药物SAHA。在HDACs的抑制活性中, 以5个亚甲基的侧链 (n = 3) 展现出了最强的HDAC1抑制活性; 同样, 其他化合物对PC-3的抑制活性也有着类似的趋势, 即具有5个亚甲基侧链的化合物的活性最佳, 延长或缩短侧链均降低抗癌活性; 此外, 氰基的位置对PC-3抑制活性也有较大的影响, 以C3位取代的化合物18g抗癌活性最佳。事实上, 化合物18g (IC50 = 0.6 ± 0.09 μmol·L-1) 在所有化合物中展现出了最强的PC-3抑制活性, 并强于先导化合物化合物1A (IC50 = 0.9 ± 0.18 μmol·L-1), 甚至是阳性药物SAHA (IC50 = 2.6 ± 0.17 μmol·L-1) 的4倍。在HepG2中, 化合物也展现出了以5个亚甲基 (n = 3, 化合物18d~18f) 具有最佳抗癌活性的规律, 其中化合物18g (IC50 = 1.7 ± 0.99 μmol·L-1) 对HepG2也有最强的抑制活性, 是阳性药物SAHA (IC50 = 7.3 ± 0.67 μmol·L-1) 的4.3倍; 但是, 化合物在MDA-MB-231、BGC-3和A549的抑制活性中却没有类似的规律。
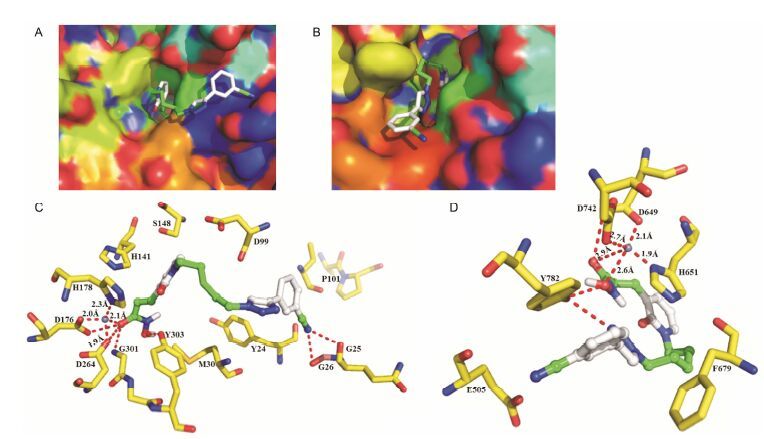
|
Figure 2 The predicted binding modes of compound 18-HDAC1 and HDAC6. (A) Molecular surface of the HDAC1 binding pocket with docked inhibitor 18g. (B) Molecular surface of the HDAC6 binding pocket with docked inhibitor 18g. (C) Docking poses of HDAC1-18g, which can form hydrogen bonds with residues D176, D264, G301, Y303, and which can coordinate the zinc ion with residues D176, D178, D264. (D) Docking poses of HDAC6-18g, which can form hydrogen bonds with residues D649, Y782, and which can coordinate the zinc ion with residues D649, D742, H651. Distances are given in Å |
| Table 4 Whole cell antiproliferative activity of target compounds (IC50/μmol·L-1). IC50 values are an average of three independent experiments ± standard deviation (mean ± SD). IC50 not determinable up to highest concentr ations tested |
在表 4中, 目标化合物对前列腺癌有较强的抑制活性, 为了进一步考察这类化合物毒性, 用正常的前列腺上皮细胞RWPE-1和非洲绿猴肾细胞VERO做为对照细胞来检测这类目标化合物的毒性。如表 4所示, 总的来说这类化合物没有明显毒性, 而阳性药物SAHA却对两种正常细胞展现出了一定的毒性。
5 小结本研究基于二氢吡啶酮骨架展现出的HDACs抑制活性, 通过点击化学中代表性反应Husigen环加 成反应合成了5个系列不同侧链长度的二氢吡啶酮类HDACi。这些目标化合物对HDAC1和HDAC6展现出了较强的抑制活性, 但是链长和苯环上的取代基对活性均有较大的影响, 以链长为5个亚甲基 (n = 3)、苯环为吸电子基团的化合物具有较强的HDAC1和HDAC6抑制活性。其中3-氰基化合物 18g (35 ± 1.5 nmol·L-1) 对HDAC1的抑制活性最强, 分别是先导化合物1A (83 ± 2.6 nmol·L-1) 和SAHA (45 ± 1.2 nmol·L-1) 的2.3和1.2倍。在体外抗瘤活性中, 目标化合物对前列腺癌PC-3、乳腺癌MDA-MB- 231、胃癌BGC-3、肺癌A549和肝癌HepG2细胞均有抑制活性。尤其是对前列腺癌PC-3有较强的抑制活性和选择性, 并且化合物对PC-3的抑制趋势和HDAC1的趋势一致, 其中化合物18g对PC-3抑制活性最强, 分别是化合物1A和SAHA的1.5和4倍; 此外, 这类化合物对正常的RWPE-1和VERO细胞没有毒性。成功地利用Husigen环加成反应对二氢吡啶酮类HDACi进行结构修饰, 得到的化合物能够提高HDACs抑制活性和抗肿瘤活性, 这为今后发展新型、高效、低毒的HDACi提供了新的思路。
实验部分BrukerAM-400Hz型核磁共振仪 (TMS内标); C-MAG HS4数显加热磁力搅拌器(德国IKA公司); FA(N)/JA(N) 系列MINQI∧O电子天平 (上海民桥精密科学仪器有限公司); X-4熔点显微仪 (温度未校正, 北京泰克仪器有限公司); 超净工作台 (北京半导体设备一厂); BB16/BB5060仪器CO2培养箱 (上海力创科学仪器有限公司); CKX31型倒置显微镜 (奥林巴斯公司); ELx800通用酶标仪 (美国BioTek 公司)。合成使用的其他试剂均为市售分析纯 (质量分数 ≥ 99%); GF254硅胶薄层板 (青岛海洋化工厂); 200~300目柱色谱硅胶 (青岛海洋化工厂); 水为蒸馏水; HDAC试剂盒购自艾美捷科技有限公司; DMEM培养基、胎牛血清购自Hyclone公司; 前列腺癌PC-3、乳腺癌MDA-MB-231、胃癌BGC-3、肺癌A549和肝癌HepG2细胞株购自武汉大学细胞典藏中心, 本实验室冻存使用。
1 化学合成 1.1 3-(2-羰基-1,2-二氢吡啶基)丙烯酸甲酯 (3) 的合成将2-羰基-1, 2-二氢-3-醛基吡啶1 (1.645 g, 13.4 mmol) 和3-(三苯基磷) 丙酸甲酯2 (5.121 g, 14.7 mmol) 溶解到CH2Cl2 (30 mL) 中, 加热回流反应 8 h, 减压除去溶剂, 经硅胶柱纯化 (二氯甲烷-甲醇, 10∶1) 得到白色固体。产率26.5%, mp 145~146 ℃; 1H NMR (400 MHz, CDCl3): δ 7.84 (d, J= 7.2 Hz, 1H), 7.66 (m, 1H), 7.56 (d, J = 15.6 Hz, 1H), 7.05 (d, J = 15.2 Hz, 1H), 6.62 (t, J= 7.0 Hz, 1H), 3.81 (s, 3H)。
1.2 叠氮化合物(5~9) 的合成将化合物3 (1.223 g, 2.6 mmol)、相应的叠氮化合物4 (7.8 mmol) 和K2CO3 (1.117 g, 13.3 mmol) 依次加入到THF (30 mL) 中, 加热回流反应12 h, 减压除去溶剂, 残留物用二氯甲烷 (50 mL) 溶解, 饱和NaCl溶液 (20 mL) 洗涤, 无水Na2SO4干燥, 减压脱除溶剂, 经硅胶柱纯化(石油醚-乙酸乙酯, 6∶1~1∶1) 得到化合物5~9。
3-(1-叠氮乙基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (5) 白色油状物, 产率51.7%; 1H NMR (400 MHz, CDCl3): δ 7.98 (d, J = 6.8 Hz, 1H), 7.78 (m, 1H), 7.56 (d, J = 15.2 Hz, 1H), 7.02 (d, J = 15.2 Hz, 1H), 6.37 (t, J = 7.2 Hz, 1H), 3.91 (t, J = 6.8 Hz, 2H), 3.52 (m, 2H), 3.66 (s, 3H)。
3-(1-叠氮丙基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (6) 白色油状物, 产率43.2%; 1H NMR (400 MHz, CDCl3): δ 7.96 (d, J = 6.4 Hz, 1H), 7.72 (d, J = 6.0 Hz, 1H), 7.54 (d, J = 15.6 Hz, 1H), 7.01 (d, J = 15.2 Hz, 1H), 6.34 (t, J = 7.6 Hz, 1H), 3.84 (m, 2H), 3.28 (t, J = 6.8 Hz, 2H), 1.98 (m, 2H), 3.68 (s, 3H)。
3-(1-叠氮丁基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (7) 白色油状物, 产率46.6%; 1H NMR (400 MHz, CDCl3): δ 7.92 (d, J = 6.8 Hz, 1H), 7.75 (m, 1H), 7.56 (d, J = 15.2 Hz, 1H), 7.04 (d, J = 15.6 Hz, 1H), 6.36 (t, J = 6.8 Hz, 1H), 3.89 (t, J = 7.2 Hz, 2H), 3.27 (t, J = 6.8 Hz, 2H), 1.90 (m, 2H), 1.48 (m, 2H), 3.66 (s, 3H)。
3-(1-叠氮戊基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (8) 白色油状物, 产率52.3%; 1H NMR (400 MHz, CDCl3): δ 7.95 (d, J = 6.4 Hz, 1H), 7.74 (d, J = 6.4 Hz, 1H), 7.55 (d, J = 16.0 Hz, 1H), 7.05 (d, J = 15.2 Hz, 1H), 6.37 (t, J = 7.2 Hz, 1H), 3.85 (t, J = 6.8 Hz, 2H), 3.24 (t, J = 6.4 Hz, 2H), 1.91 (m, 2H), 1.54 (m, 2H), 1.32 (m, 2H), 3.67 (s, 3H)。
3-(1-叠氮己基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (9) 白色油状物, 产率48.7%; 1H NMR (400 MHz, CDCl3): δ 7.97 (d, J = 6.0 Hz, 1H), 7.74 (m, 1H), 7.54 (d, J = 15.2 Hz, 1H), 7.06 (d, J = 15.6 Hz, 1H), 6.35 (t, J = 7.2 Hz, 1H), 3.86 (m, 2H), 3.25 (t, J = 6.0 Hz, 2H), 1.92 (m, 4H), 1.58 (m, 2H), 1.40 (m, 2H), 3.68 (s, 3H)。
1.3 叠氮化合物(10~14) 的合成氩气保护下, 将取代苯乙炔 (8.35 mmol) 和相应的叠氮化合物5~9 (6.81 mmol) 溶解到THF (25 mL) 中, 室温搅拌10 min后依次加入CuI (50 mg, 0.35 mmol) 和N, N-二异丙基乙胺 (DIPEA, 0.5 mL), 室温下继续反应4 h, 用饱和NH4Cl溶液 (3 × 30 mL) 洗涤, 有机层用无水Na2SO4干燥, 减压除去溶剂, 经硅胶柱纯化 (石油醚- 乙酸乙酯, 3∶1~1∶2), 得到化合物10~14。
3-(苯基三唑基乙基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (10a) 白色油状物, 产率48.9%; 1H NMR (400 MHz, Acetone-d6): δ 7.96 (d, J = 6.0 Hz, 1H), 7.76 (m, 3H), 7.69 (s, 1H), 7.55 (d, J = 15.6 Hz, 1H), 7.38 (t, J = 8.0 Hz, 2H), 7.23 (m, 1H), 7.10 (d, J = 15.6 Hz, 1H), 6.40 (t, J = 7.2 Hz, 1H), 4.51 (m, 2H), 4.21 (t, J = 6.8 Hz, 2H), 3.68 (s, 3H)。
3-[(4-甲基苯基) 三唑基乙基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (10b) 白色油状物, 产率48.7%; 1H NMR (400 MHz, Acetone-d6): δ 7.92 (d, J = 6.8 Hz, 1H), 7.74 (d, J = 5.6 Hz, 1H), 7.69 (s, 1H), 7.58 (m, 3H), 7.17 (d, J = 8.0 Hz, 2H), 7.08 (d, J = 16.0 Hz, 1H), 6.42 (t, J = 6.8 Hz, 1H), 4.55 (m), 4.21 (t, J = 6.0 Hz, 2H), 3.70 (s, 3H), 2.22 (s, 3H)。
3-[(4-甲氧基苯基) 三唑基乙基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (10c) 白色油状物, 产率44.6%; 1H NMR (400 MHz, Acetone-d6): δ 7.93 (d, J = 6.8 Hz, 1H), 7.66 (m, 2H), 7.52 (d, J = 15.6 Hz, 1H), 7.24 (d, J = 8.4 Hz, 2H), 7.09 (d, J = 15.2 Hz, 1H), 6.92 (d, J = 8.0 Hz, 2H), 6.39 (t, J = 5.6 Hz, 1H), 4.50 (m, 2H), 4.23 (t, J = 7.6 Hz, 2H), 3.73 (s, 3H), 3.69 (s, 3H)。
3-[(4-氟苯基) 三唑基乙基-2-羰基-1, 2-二氢吡 啶基] 丙烯酸甲酯 (10d) 白色固体, 产率39.2%, mp 122~125 ℃; 1H NMR (400 MHz, Acetone-d6): δ 8.06 (d, J = 8.8 Hz, 2H), 7.94 (d, J = 7.6 Hz, 1H), 7.70 (m, 2H), 7.62 (d, J = 8.8 Hz, 2H), 7.56 (d, J = 16.0 Hz, 1H), 7.05 (d, J = 15.6 Hz, 1H), 6.42 (t, J = 6.0 Hz, 1H), 4.54 (t, J = 6.8 Hz, 2H), 4.26 (t, J = 6.0 Hz, 2H), 3.70 (s, 3H)。
3-[(4-氰基) 三唑基乙基-2-羰基-1, 2-二氢吡啶基]丙烯酸甲酯 (10e) 黄色固体, 产率40.2%, mp 116~118 ℃; 1H NMR (400 MHz, Acetone-d6): δ 7.90 (d, J = 8.0 Hz, 1H), 7.84 (d, J = 8.0 Hz, 2H), 7.72 (d, J = 6.8 Hz, 1H), 7.69 (s, 1H), 7.57 (d, J = 14.8 Hz, 1H), 7.50 (d, J = 8.4 Hz, 2H), 7.06 (d, J = 15.2 Hz, 1H), 6.39 (t, J = 5.6 Hz, 1H), 4.52 (t, J = 7.2 Hz, 2H), 4.25 (t, J = 8.0 Hz, 2H), 3.74 (s, 3H)。
3-(苯基三唑基丙基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (11a) 白色油状物, 产率39.9%, 1H NMR (400 MHz, Acetone-d6): δ 7.85 (d, J = 4.8 Hz, 1H), 7.78 (d, J = 8.0 Hz, 2H), 7.71 (m, 2H), 7.68 (m, 2H), 7.56 (d, J = 15.2 Hz, 1H), 7.47 (t, J = 8.0 Hz, 2H), 7.06 (d, J = 15.6 Hz, 1H), 6.39 (t, J = 6.8 Hz, 1H), 4.45 (t, J = 6.0 Hz, 2H), 3.97 (t, J = 5.6 Hz, 2H), 3.70 (s, 3H), 2.25 (m, 2H)。
3-[(4-甲基苯基) 三唑基丙基-2-羰基-1, 2-二氢 吡啶基] 丙烯酸甲酯 (11b) 白色油状物, 产率43.3%; 1H NMR (400 MHz, Acetone-d6): δ 7.86 (d, J = 6.0 Hz, 1H), 7.71 (s, 1H), 7.68 (d, J = 5.2 Hz, 1H), 7.56 (d, J = 8.0 Hz, 2H), 7.54 (d, J = 15.6 Hz, 1H), 7.07 (d, J = 15.6 Hz, 1H), 7.03 (d, J = 8.0 Hz, 2H), 6.40 (t, J = 5.2 Hz, 1H), 4.41 (t, J = 6.8 Hz, 2H), 4.05 (t, J = 8.0 Hz, 2H), 3.70 (s, 3H), 2.27 (m, 2H), 2.24 (s, 3H)。
3-[(4-甲氧基苯基) 三唑基丙基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (11c) 白色油状物, 产率34.9%; 1H NMR (400 MHz, Acetone-d6): δ 7.89 (d, J = 6.4 Hz, 1H), 7.72 (m, 2H), 7.56 (d, J = 16.0 Hz, 1H), 7.25 (d, J = 8.4 Hz, 2H), 7.10 (d, J = 15.2 Hz, 1H), 7.04 (d, J = 8.4 Hz, 2H), 6.41 (t, J = 5.6 Hz, 1H), 4.48 (t, J = 7.2 Hz, 2H), 4.03 (t, J = 8.4 Hz, 2H), 3.71 (s, 3H), 3.66 (s, 3H), 2.25 (m, 2H)。
3-[(4-氟苯基) 三唑基丙基-2-羰基-1, 2-二氢吡 啶基] 丙烯酸甲酯 (11d) 白色油状物, 产率37.2%; 1H NMR (400 MHz, Acetone-d6): δ 8.07 (d, J = 8.8 Hz, 2H), 7.88 (d, J = 6.4 Hz, 1H), 7.76 (m, 1H), 7.71 (s, 1H), 7.65 (d, J = 8.0 Hz, 2H), 7.55 (d, J = 15.2 Hz, 1H), 7.09 (d, J = 15.6 Hz, 1H), 6.41 (t, J = 6.4 Hz, 1H), 4.49 (t, J = 6.8 Hz, 2H), 4.02 (m, 2H), 3.74 (s, 3H), 2.26 (m, 2H)。
3-[(4-氰基苯基) 三唑基丙基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (11e) 黄色固体, 产率28.9%, mp 126~129 ℃; 1H NMR (400 MHz, Acetone-d6): δ 7.85 (d, J = 6.8 Hz, 1H), 7.83 (d, J = 8.4 Hz, 2H), 7.70 (m, 1H), 7.68 (s, 1H), 7.62 (d, J = 8.8 Hz, 2H), 7.57 (d, J = 15.6 Hz, 1H), 7.07 (d, J = 16.0 Hz, 1H), 6.42 (t, J = 7.6 Hz, 1H), 4.53 (t, J = 7.2 Hz, 2H), 4.04 (t, J = 6.8 Hz, 2H), 3.70 (s, 3H), 2.31(m, 2H)。
3-(苯基三唑基丁基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (12a) 白色油状物, 产率56.6%;1H NMR (400 MHz, Acetone-d6): δ 7.88 (d, J = 5.2 Hz, 1H), 7.82 (d, J = 8.0 Hz, 2H), 7.71 (m, 2H), 7.69 (s, 1H), 7.55 (d, J = 16.0 Hz, 1H), 7.38 (t, J = 8.0 Hz, 2H), 7.04 (d, J = 16.0 Hz, 1H), 6.41 (t, J = 7.2 Hz, 1H), 4.50 (t, J = 5.6 Hz, 2H), 4.02 (m, 2H), 3.73 (s, 3H), 2.01 (m, 2H), 1.85 (m, 2H)。
3-[(4-甲基苯基) 三唑基丁基-2-羰基-1, 2-二氢 吡啶基] 丙烯酸甲酯 (12b) 白色油状物, 产率48.9%; 1H NMR (400 MHz, Acetone-d6): δ 7.86 (d, J = 5.6 Hz, 1H), 7.74 (m, 2H), 7.57 (d, J = 8.0 Hz, 2H), 7.52 (d, J = 16.0 Hz, 1H), 7.20 (d, J = 8.4 Hz, 2H), 7.05 (d, J = 16.0 Hz, 1H), 6.41 (t, J = 7.6 Hz, 1H), 4.43 (t, J = 6.8 Hz, 2H), 4.05 (t, J = 6.4 Hz, 2H), 3.71 (s, 3H), 1.97 (m, 2H), 1.86 (m, 2H), 2.25 (s, 3H)。
3-[(4-甲氧基苯基) 三唑基丁基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (12c) 白色油状物, 产率35.7%; 1H NMR (400 MHz, Acetone-d6): δ 7.88 (d, J = 6.0 Hz, 1H), 7.75 (d, J = 6.4 Hz, 1H), 7.69 (s, 1H), 7.53 (d, J = 15.6 Hz, 1H), 7.24 (d, J = 8.0 Hz, 2H), 7.05 (d, J = 16.0 Hz, 1H), 6.94 (d, J = 8.4 Hz, 2H), 6.41 (t, J = 6.4 Hz, 1H), 4.42 (t, J = 6.4 Hz, 2H), 4.02 (t, J = 7.0 Hz, 2H), 3.72 (s, 3H), 3.67 (s, 3H), 2.03 (m, 2H), 1.85 (m, 2H)。
3-[(4-氟苯基) 三唑基丁基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (12d) 白色油状物, 产率33.2%; 1H NMR (400 MHz, Acetone-d6): δ 8.08 (d, J = 8.4 Hz, 2H), 7.84 (d, J = 7.6 Hz, 1H), 7.74 (m, 3H), 7.71 (s, 1H), 7.58 (d, J = 16.0 Hz, 1H), 7.06 (d, J = 15.2 Hz, 1H), 6.39 (m, 1H), 4.43 (m, 2H), 4.01 (t, J = 6.4 Hz, 2H), 3.73 (s, 3H), 2.04 (m, 2H), 1.85 (m, 2H)。
3-[(4-氰基苯基) 三唑基丁基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (12e) 黄色固体, 产率34.6%, mp 119~121 ℃; 1H NMR (400 MHz, Acetone-d6): δ 7.85 (t, J = 6.8 Hz, 1H), 7.81 (d, J = 8.0 Hz, 2H), 7.70 (m, 2H), 7.66 (d, J = 8.0 Hz, 2H), 7.56 (d, J = 16.0 Hz, 1H), 7.04 (d, J = 15.6 Hz, 1H), 6.41 (t, J = 6.0 Hz, 1H), 4.42 (m, 2H), 4.00 (t, J = 6.8 Hz, 2H), 3.72 (s, 3H), 1.99 (m, 2H), 1.83 (m, 2H)。
3-(苯基三唑基戊基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (13a) 白色油状物, 产率47.6%; 1H NMR (400 MHz, Acetone-d6): δ 7.92 (t, J = 5.6 Hz, 1H), 7.72 (m, 3H), 7.68 (s, 1H), 7.56 (d, J = 15.6 Hz, 1H), 7.38 (m, 3H), 7.06 (d, J = 15.6 Hz, 1H), 6.38 (t, J = 8.0 Hz, 1H), 4.42 (t, J = 6.8 Hz, 2H), 3.99 (m, 2H), 3.70 (s, 3H), 1.97 (m, 2H), 1.85 (m, 2H), 1.41 (m, 2H)。
3-[(4-甲基苯基) 三唑基戊基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (13b) 白色油状物, 产率52.4%; 1H NMR (400 MHz, Acetone-d6): δ 7.89 (d, J = 7.0 Hz, 1H), 7.72 (m, 1H), 7.69 (s, 1H), 7.58 (d, J = 15.6 Hz, 1H), 7.47 (d, J = 8.4 Hz, 2H), 7.06 (m, 3H), 6.40 (t, J = 7.6 Hz, 1H), 4.41 (m, 2H), 3.95 (t, J = 7.6 Hz, 2H), 3.73 (s, 3H), 2.22 (s, 3H), 2.01 (m, 2H), 1.85 (m, 2H), 1.39 (m, 2H)。
3-[(4-甲氧基苯基) 三唑基戊基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (13c) 白色油状物, 产率38.7%; 1H NMR (400 MHz, Acetone-d6): δ 7.89 (d, J = 7.4 Hz, 1H), 7.75 (m, 2H), 7.56 (d, J = 15.8 Hz, 1H), 7.23 (d, J = 8.4 Hz, 2H), 7.05 (d, J = 16.0 Hz, 1H), 6.88 (d, J = 8.0 Hz, 2H), 6.39 (t, J = 7.2 Hz, 1H), 4.42 (t, J = 6.8 Hz, 2H), 4.02 (m, 2H), 3.71 (s, 3H), 3.68 (s, 3H), 1.99 (m, 2H), 1.86 (m, 2H), 1.39 (m, 2H)。
3-[(4-氟苯基) 三唑基戊基-2-羰基-1, 2-二氢吡 啶基] 丙烯酸甲酯 (13d) 白色油状物, 产率32.5%; 1H NMR (400 MHz, Acetone-d6): δ 8.08 (d, J = 8.4 Hz, 2H), 7.91 (d, J = 7.0 Hz, 1H), 7.74 (t, J = 6.8 Hz, 1H), 7.71 (s, 1H), 7.68 (d, J = 8.4 Hz, 2H), 7.56 (d, J = 15.6 Hz, 1H), 7.06 (d, J = 14.8 Hz, 1H), 6.39 (t, J = 6.8 Hz, 1H), 4.39 (t, J = 6.0 Hz, 2H), 3.99 (m, 2H), 3.73 (s, 3H), 2.03 (m, 2H), 1.86 (m, 2H), 1.40 (m, 2H)。
3-[(4-氰基苯基) 三唑基戊基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (13e) 黄色固物, 产率35.2%, mp 131~133 ℃; 1H NMR (400 MHz, Acetone-d6): δ 7.85 (d, J = 7.6 Hz, 1H), 7.82 (d, J = 8.0 Hz, 2H), 7.73 (m, 2H), 7.65 (d, J = 8.0 Hz, 2H), 7.56 (d, J = 16.0 Hz, 1H), 7.06 (d, J = 15.2 Hz, 1H), 6.43 (m, 1H), 4.38 (t, J = 6.4 Hz, 2H), 3.99 (m, 2H), 3.70 (s, 3H), 2.01 (m, 2H), 1.85 (m, 2H), 1.38 (m, 2H)。
3-[(2-氰基苯基) 三唑基戊基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (13f) 黄色油状物, 产率37.8%; 1H NMR (400 MHz, Acetone-d6): δ 7.90 (d, J = 5.2 Hz, 1H), 7.76 (t, J = 8.0 Hz, 1H), 7.73 (m, 2H), 7.69 (s, 1H), 7.65 (t, J = 8.4 Hz, 1H), 7.55 (d, J = 15.6 Hz, 1H), 7.51 (m, 1H), 7.06 (d, J = 16.0 Hz, 1H), 6.39 (t, J = 7.6 Hz, 1H), 4.42 (t, J = 6.4 Hz, 2H), 4.02 (t, J = 6.8 Hz, 2H), 3.74 (s, 3H), 2.02 (m, 2H), 1.85 (m, 2H), 1.41 (m, 2H)。
3-[(3-氰基苯基) 三唑基戊基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (13g) 黄色固物, 产率35.2%, mp 126~128 ℃; 1H NMR (400 MHz, Acetone-d6): δ 7.88 (m, 2H), 7.75 (m, 1H), 7.73 (s, 1H), 7.69 (s, 1H), 7.63 (d, J = 7.2 Hz, 1H), 7.59 (d, J = 16.0 Hz, 1H), 7.39 (d, J = 8.4 Hz, 1H), 7.07 (d, J = 16.0 Hz, 1H), 6.39 (m, 1H), 4.41 (t, J = 7.6 Hz, 2H), 4.03 (t, J = 7.2 Hz, 2H), 3.71 (s, 3H), 1.98 (m, 2H), 1.85 (m, 2H), 1.40 (m, 2H)。
3-(苯基三唑基己基-2-羰基-1, 2-二氢吡啶基) 丙烯酸甲酯 (14a) 白色油状物, 产率48.1%; 1H NMR (400 MHz, Acetone-d6): δ 7.87 (m, 1H), 7.81 (d, J = 8.0 Hz, 2H), 7.72 (m, 1H), 7.69 (s, 1H), 7.57 (t, J = 16.0 Hz, 1H), 7.41 (m, 3H), 7.08 (d, J = 16.0 Hz, 1H), 6.41 (t, J = 6.8 Hz, 1H), 4.43 (t, J = 7.2 Hz, 2H), 3.99 (t, J = 6.8 Hz, 2H), 3.70 (s, 3H), 1.99 (m, 2H), 1.83 (m, 2H), 1.41 (m, 4H)。
3-[(4-甲基苯基) 三唑基己基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (14b) 白色油状物, 产率41.7%; 1H NMR (400 MHz, Acetone-d6): δ 7.90 (m, 1H), 7.74 (t, J = 5.6 Hz, 1H), 7.70 (s, 1H), 7.55 (m, 3H), 7.10 (d, J = 8.0 Hz, 2H), 7.08 (d, J = 15.6 Hz, 1H), 6.41 (t, J = 7.2 Hz, 1H), 4.43 (t, J = 7.2 Hz, 2H), 4.02 (t, J = 6.8 Hz, 2H), 3.71 (s, 3H), 2.21 (s, 3H), 2.01 (m, 2H), 1.85 (m, 2H), 1.41 (m, 2H), 1.39 (m, 2H)。
3-[(4-甲氧基苯基) 三唑基己基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (14c) 白色油状物, 产率38.8%; 1H NMR (400 MHz, Acetone-d6): δ 7.91 (t, J = 5.2 Hz, 1H), 7.71 (m, 2H), 7.55 (d, J = 15.6 Hz, 1H), 7.26 (t, J = 8.8 Hz, 2H), 7.09 (d, J = 15.2 Hz, 1H), 7.03 (t, J = 8.0 Hz, 2H), 6.42 (m, 1H), 4.38 (m, 2H), 3.99 (t, J = 6.0 Hz, 2H), 3.72 (s, 3H), 3.67 (s, 3H), 1.99 (m, 2H), 1.86 (m, 2H), 1.42 (m, 2H), 1.39 (m, 2H)。
3-[(4-氟苯基) 三唑基己基-2-羰基-1, 2-二氢吡 啶基] 丙烯酸甲酯 (14d) 黄色油状物, 产率38.8%; 1H NMR (400 MHz, Acetone-d6): δ 8.06 (d, J = 8.4 Hz, 2H), 7.89 (d, J = 6.4 Hz, 1H), 7.72 (t, J = 7.6 Hz, 1H), 7.69 (s, 1H), 7.67 (d, J = 8.4 Hz, 2H), 7.58 (d, J = 15.6 Hz, 1H), 7.05 (d, J = 15.6 Hz, 1H), 6.45 (t, J = 6.8 Hz, 1H), 4.43 (t, J = 7.2 Hz, 2H), 3.98 (t, J = 6.4 Hz, 2H), 3.70 (s, 3H), 2.01 (m, 2H), 1.85 (m, 2H), 1.40 (m, 2H), 1.38 (m, 2H)。
3-[(4-氰基苯基) 三唑基己基-2-羰基-1, 2-二氢吡啶基] 丙烯酸甲酯 (14e) 黄色固物, 产率29.4%, mp 133~136 ℃; 1H NMR (400 MHz, Acetone-d6): δ 7.90 (d, J = 5.2 Hz, 1H), 7.86 (d, J = 8.0 Hz, 2H), 7.72 (t, J = 6.4 Hz, 1H), 7.69 (s, 1H), 7.65 (d, J = 8.4 Hz, 2H), 7.54 (d, J = 15.2 Hz, 1H), 7.04 (d, J = 15.2 Hz, 1H), 6.39 (m, 1H), 4.39 (t, J = 7.6 Hz, 2H), 4.00 (t, J = 6.8 Hz, 2H), 3.73 (s, 3H), 1.99 (m, 2H), 1.85 (m, 2H), 1.41 (m, 2H), 1.39 (m, 2H)。
1.4 目标化合物(15~19) 的合成 氩气保护下, 0 ℃下将叠氮化合物10~14 (0.16 mmol) 溶解到THF (15 mL) 中, 搅拌10 min后, 向反应液中加入15 mL新制备的羟胺溶液, 缓慢升至室温后继续反应12 h, 减压除去溶剂, 经硅胶柱纯化 (二氯甲烷-甲醇= 30∶1~10∶1) 得到了异肟酸化合物15~19 (理化光谱数据见表 1)。羟胺溶液的制备: 将盐酸羟胺 (333.6 mg, 4.8 mmol) 和氢氧化钾 (268.8 mg, 4.8 mmol) 加入到甲醇 (15 mL) 中, 升温至40 ℃反应15 min后析出大量的沉淀, 冷却反应液, 滤除沉淀, 所得滤液即是新制备的羟胺溶液。
2 HDACs抑制活性实验使用HDAC试剂盒测试合成的目标化合物对HDAC1、6、8的抑制活性, 以SAHA为阳性对照药。按照试剂盒操作说明书在测试板中每孔加入BSA、HDAC 荧光底物、HDAC酶(HDAC1、HDAC6、HDAC8)和待测化合物, 其浓度梯度为1×10-10、1×10-9、1×10-8、1×10-7、1×10-6、1×10-5 mol·L-1。将测试板在37℃下反应30 min后, 每孔再加入HDAC Developer, 并继续在37 ℃下放置15 min, 使用酶标仪在359 nm和440 nm波长测定每孔的荧光 值, 计算IC50值。
3 分子对接参照文献[8], HDAC1晶体结构 (PDB code: 4BKX) 由Protein Data Bank下载, HDAC6的晶体 结构目前还未解析出来, 以HDAC8晶体结构 (PDB code: 1T69) 为模板对HDAC6进行同源建模[8, 17-19]。通过ChemBio 3D ultra 12.0和Autodock4.2D中的Ligand模块进行小分子结构的预处理。对接软件使 用Autodock4.2D[20], 利用晶体结构中的配体定义口袋盒子, 对接盒子边长设置为30 Å, 使用半经验自由能进行评价, 拉马克遗传算法循环100次, 其余参数保持默认。
4 抗增殖活性测试选取前列腺癌PC-3、乳腺癌MDA-MB-231、胃癌BGC-3、肺癌A549和肝癌HepG2细胞为测试细胞株, 正常的前列腺上皮细胞RWPE-1和非洲绿猴肾细胞VERO为对照细胞。以SAHA为阳性对照药, 采用MTT法对合成的化合物进行抗肿瘤活性评价。取对数生长期的测试细胞株悬浮于含10% 胎牛血清的无酚红DMEM培养基中, 铺至96孔培养板中。待 细胞完全贴壁后, 弃去原培养液, 加入100 µL的含有测试药物的培养液培养3天后, 每孔加入30 μL 5 mg·mL-1 MTT, 在培养箱中继续孵育4 h, 然后每孔加入100 μL二甲亚砜 (DMSO) 溶解, 使用酶标仪在490 nm波长测定每孔的吸收度值, 分析实验结果, 并计算出IC50。
| [1] | Yao YW, Yao HQ, Jiang S, et al. Progress in clinical study of histone deacetylases inhibitors as anticancer agents[J]. Chin New Drugs J (中国新药杂志) , 2013, 22 :294–299. |
| [2] | Jonestone RW. Histone-deacetylase inhibitors: novel drugs for the treatment of cancer[J]. Nat Rev Drug Discov , 2002, 1 :287–299. DOI:10.1038/nrd772 |
| [3] | Mai A, Rotili D, Tarantino D, et al. Identification of 4-hy-droxyquinolines inhibitors of p300/CBP histone acetyltrans-ferases[J]. Bioorg Med Chem Lett , 2009, 19 :1132–1135. DOI:10.1016/j.bmcl.2008.12.097 |
| [4] | Hidehiko K, Tatsuo N. GCN5 and BCR signaling collabo-rate to induce pre-mature B cell apoptosis through depletion of ICAD and IAP2 and activation of caspase activities[J]. Gene , 2008, 419 :48–55. DOI:10.1016/j.gene.2008.04.014 |
| [5] | Wang HS, Yu NF, Chen DZ, et al. Discovery of (2E)-3-{2-butyl-1-[2-(diethylamino)ethyl]-1H-benzimidazol-5-yl}-N-hydroxyacrylamide (SB939), an orally active histone deacety-lase inhibitor with a superior preclinical profile[J]. J Med Chem , 2011, 54 :4694–4720. DOI:10.1021/jm2003552 |
| [6] | Gryder BE, Akbashev MJ, Rood MK, et al. Selectively targeting prostate cancer with antiandrogen equipped histone deacetylase inhibitors[J]. ACS Chem Biol , 2013, 8 :2550–2560. DOI:10.1021/cb400542w |
| [7] | Gryder BE, Rood MK, Johnson KA, et al. Histone deacetylase inhibitors equipped with estrogen receptor modulation activity[J]. J Med Chem , 2013, 56 :5782–5796. DOI:10.1021/jm400467w |
| [8] | Senger J, Melesina J, Marek M, et al. Synthesis and biological investigation of oxazole hydroxamates as highly selective histone deacetylase 6(HDAC6) inhibitors[J]. J Med Chem , 2016, 59 :1545–1555. DOI:10.1021/acs.jmedchem.5b01493 |
| [9] | Marks PA. Discovery and development of SAHA as an anticancer agent[J]. Oncogene , 2007, 26 :1351–1356. DOI:10.1038/sj.onc.1210204 |
| [10] | Tang YM, Huang WY, Yu NF. Structure-activity relation-ships of histone deacetylase inhibitors[J]. Acta Pharm Sin (药学学报) , 2009, 44 :1072–1083. |
| [11] | Zhang ZP, Li DH, Gu QQ, et al. The research progress of selective histone deacetylase inhibitors[J]. Chin J Med Chem (中国药物化学学报) , 2013, 23 :321–330. |
| [12] | Cho M, Choi E, Yang JS, et al. Discovery of pyri-done-based histone deacetylase inhibitors: approaches for metabolic stability[J]. Chem Med Chem , 2013, 8 :272–279. DOI:10.1002/cmdc.201200529 |
| [13] | Yang JS, Lee CL, Cho M, et al. Discovery of orally avail-able runt-related transcription factor 3(RUNX3) modulators for anticancer chemotherapy by epigenetic activation and protein stabilization[J]. J Med Chem , 2015, 58 :3512–3521. DOI:10.1021/acs.jmedchem.5b00062 |
| [14] | Chen PC, Patil V, Guerrant W, et al. Synthesis and struc-ture-activity relationship of histone deacetylase (HDAC) inhibitors with triazole-linked cap group[J]. Bioorg Med Chem , 2008, 16 :4839–4853. DOI:10.1016/j.bmc.2008.03.050 |
| [15] | Chen YF, Lopez-Sanchez M, Savoy DN, et al. A series of potent and selective, triazolylphenyl-based histone deacety-lases inhibitors with activity against pancreatic cancer cells and plasmodium falciparum[J]. J Med Chem , 2008, 51 :3437–3448. DOI:10.1021/jm701606b |
| [16] | Itoh Y, Suzuki T, Miyata N. Isoform-selective histone deace-tylase inhibitors[J]. Curr Pharm Des , 2008, 14 :529–544. DOI:10.2174/138161208783885335 |
| [17] | UniProt C. Activities at the universal protein resource (UniProt)[J]. Nucleic Acids Res , 2014, 42 :D191–198. DOI:10.1093/nar/gkt1140 |
| [18] | Altschul SF, Gish W, Miller W, et al. Basic local alignment search tool[J]. J Mol Biol , 1990, 215 :403–410. DOI:10.1016/S0022-2836(05)80360-2 |
| [19] | Sievers F, Wilm A, Dineen D, et al. Fast, scalable genera-tion of high-quality protein multiple sequence alignments using Clustal Omega[J]. Mol Syst Biol , 2011, 7 :539. |
| [20] | Audie J. Development and validation of an empirical free energy function for calculating protein-protein binding free energy surfaces[J]. Biophys Chem , 2009, 139 :84–91. DOI:10.1016/j.bpc.2008.10.007 |
 2016, Vol. 51
2016, Vol. 51




