2. 昆明医科大学药学院暨云南省天然药物药理重点实验室, 云南 昆明 650500 ;
3. 大连医科大学药学院, 辽宁 大连 116044
2. School of Pharmaceutical Science and Yunnan Key Laboratory of Pharmacology for Natural Products, Kunming Medical University, Kunming 650500, China ;
3. College of Pharmacy, Dalian Medical University, Dalian 116044, China
艾滋病又称获得性免疫缺陷综合征 (acquired immunodeficiency syndrome,AIDS) 是由人类免疫缺陷病毒 (human immunodeficiency virus,HIV) 引起的一种致死性传染病[1]。自1983年首次从艾滋病患者体内分离到HIV[2],艾滋病在世界范围内迅速扩散。据联合国艾滋病规划署最新统计: 截止2014年底全球约有3 690万人感染HIV,新增感染约200万人,然而仅有1 580万AIDS/HIV感染者接受了抗病毒治疗[3]。截至2015年12月31日,在我国存活的约57.7万AIDS/HIV感染者中,有47.1万人接受了抗病毒治疗,约占总数的86%[4]。
非核苷类逆转录酶抑制剂 (non-nucleoside reverse transcriptase inhibitors,NNRTIs) 是HIV-1治疗中一个重要的组成部分[5],是一类通过与HIV-1逆转录酶聚合位点附近的疏水口袋结合而发生作用的小分 子[6]。到目前为止,共有5个NNRTIs在临床中应用,分别为奈韦拉平 (nevirapine,NVP)[7]、地拉夫定(delavirdine,DLV)[8]、依法韦仑 (efavirenz,EFV)[9]、依曲韦林 (etravirine,ETR)[10]和利匹韦林 (rilpivirine,RPV)[11],它们在HIV-1高效抗逆转录病毒疗法 (highly active antiretroviral therapy,HARRT) 治疗中有着举足轻重的作用。HIV-1患者在HAART治疗过程中,耐药病毒株的出现会导致药物抑制病毒复制能力大幅度下降[12],最终导致药物失效,病毒逃逸,病情恶化[13]。因此,伴随着HIV-1感染人数的不断增加,寻找具有新靶点、廉价、高效、低毒且不易产生耐药性的药物已成为一个日益迫切的需求。
逆转录酶抑制剂一直是抗HIV-1药物研发的重点,已有文献报道很多化合物对HIV-1逆转录酶有很好的抑制作用[14-16]。二苯甲酮衍生物 (benzophenones,BPs) 是一类对野生型和突变型HIV-1病毒株均具有极强抑制活性的NNRTIs,且作用谱广,毒副作用小。其中,GW695634具有更良好的药代动力学性质,已完成临床Ⅰ期试验 (临床编号: NCT00090077)[17-19]。此类化合物普遍表现出突出的抗HIV变异株活性,使其备受瞩目,对其结构改造也一直方兴未艾。基于长期对二苯甲酮类HIV-1逆转录酶 (RT) 抑制剂的结构优化基础[20-24],本文就新发现的5个二苯甲酮类似物 (图 1) 对不同细胞的毒性、不同病毒株的活性 (包括实验株、耐药株和临床分离株) 及逆转录酶活性进行了检测,并对其体外抗HIV-1活性评价及作用机制进行了初步研究。
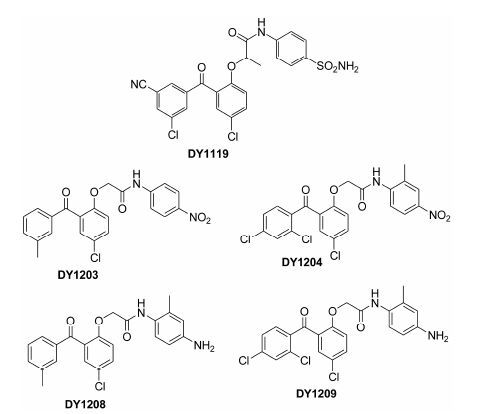
|
Figure 1 The chemical structures of benzophenones compounds |
试剂 十二烷基硫酸钠 (sodium dodecyl sulfate,SDS)、二硝基亚砜 (dimethyl sulfoxide,DMSO)、噻唑蓝 [3,(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide,MTT]、N,N-二甲基甲酰胺 (N,N'-dimethyl formamine,DMF)、Triton X-100、PHA-P、牛血清白蛋白、抗IgG Fc抗体均购自Sigma公司; RPMI 1640和胎牛血清为Gibco公司产品; Reverse Transcriptase Assay试剂盒 (colorimetric) 购自Roche公司; 抗HIV-1 p24单克隆抗体和兔抗HIV-1 p24多克隆抗体由中国科学院昆明动物研究所分子免疫药理实验室制备[25]。辣根过氧化物酶 (HRP) 标记的羊抗兔IgG 抗体购自华美生物工程公司。白细胞介素-2 (IL-2) 购自上海华新生物高技术有限公司。
化合物 DY系列化合物由大连医科大学马晓 东博士实验室合成,样品溶解于DMSO中,分装后 4 ℃避光保存。阳性药物齐多夫定 (zidovudine,AZT) 购自Sigma公司,EFV购自美国药典 (United States Pharmacopoeia,USP),均溶解于完全培养基中,0.22 μm过滤除菌,分装后-20 ℃保存。
细胞与病毒 人T淋巴细胞系 (C8166、MT-4和H9) 均来自美国国立卫生研究院 (National Institutes of Health,NIH)。人外周血单个核细胞 (peripheral blood mononuclear cells,PBMC) 自健康献血者浓缩白细胞中分离。细胞按常规方法进行复苏和传代,使所用细胞处于对数生长期。HIV-1实验株HIV-1ⅢB、核苷类逆转录酶抑制剂(NRTIs) 耐药株 HIV-174V、NNRTIs耐药株HIV-1A17 (K103N和Y181C耐药突变)、融合抑制剂 (FIs) 耐药株HIV-1NL4-3 gp41(36G)N42S和蛋白酶抑制剂 (PIs) 耐药株HIV-1RF/V82F/184V均来自NIH。临床分离株HIV-1KM018 (R5嗜性)、HIV-1TC-1 (X4嗜性) 和HIV-1Wan (X4嗜性) 自3名云南省HIV/ AIDS患者体内分离培养获得[26]。HIV-1病毒培养和滴定按常规方法进行。病毒小量分装于冻存管,-80 ℃保存。本研究所有涉及HIV操作的实验按照国际和国家有关生物安全操作规程进行。
化合物对人T淋巴细胞系的细胞毒性 采用MTT比色法检测化合物对人淋巴细胞系C8166、H9和MT-4细胞的毒性作用[27, 28]。将每毫升4×105个细胞悬液接种到含有5倍稀释化合物的96孔细胞培 养板上,每个稀释度3个重复孔,同时设置不含药物的对照和阳性药物对照。培养3天后,用MTT法以ELx800酶标仪测定吸收度值 (A570/630 nm),计算半数细胞毒性浓度值(50% cytotoxic concentration,CC50)[29]。
化合物对PBMC的细胞毒性 将每毫升5×106个PHA-P刺激转化的PBMC悬液接种到含有5倍 稀释药物的96孔细胞培养板上培养,第4天每孔补 加100 μL含IL-2的新鲜完全细胞培养基,继续培养3天后用MTT法测定细胞活性,计算CC50值[26]。
化合物对HIV-1重组逆转录酶的抑制实验 每孔加入HIV-1 RT、稀释药物和反应混合液各20 μL,混匀后37 ℃反应2 h。设置不含化合物的阳性对照 孔及空白对照孔,阳性对照药为EFV。洗液洗涤后 每孔加入偶联抗-地高辛-过氧化物酶 (anti-DIG- HRP) 200 μL,37 ℃反应1 h。洗涤后每孔加ABTS底物反应液200 μL,37 ℃室温反应,ELx800酶标仪测 定吸收度值 (A405/490 nm),计算出抑制HIV-1 RT活性50% 的化合物浓度 (IC50)[30]。
化合物对实验株HIV-1ⅢB急性感染人T淋巴细胞系C8166细胞和MT-4细胞的抑制实验 将调好 细胞密度的细胞与HIV-1ⅢB (MOI = 0.07) 在37 ℃、5% CO2感染2 h,离心去除游离病毒后,磷酸盐缓冲液 (PBS) 清洗,将细胞接种到每孔含有100 μL倍比稀释药物的96孔板上,设置3个重复孔。同时设置不含药物的对照孔和AZT阳性药物对照孔。培养3天后离心收集培养上清,Triton X-100灭活。p24抗原ELISA方法检测药物对HIV-1复制的抑制作用[31, 32],计算抗原表达抑制率和半数最大效应浓度 (EC50)。
化合物对实验株HIV-1ⅢB急性感染H9细胞的 抑制实验 用HIV-1ⅢB感染H9细胞2 h后离心清 洗去除游离病毒,调细胞数为每毫升2×105个。在96孔细胞培养板上,加100 μL细胞悬液至100 μL含有不同稀释浓度的待测化合物中。培养至第4天,每孔补加100 μL新鲜细胞培养基,第7天收集培养上清并裂解灭活。采用捕捉p24抗原ELISA方法检测化合物对HIV-1复制的抑制作用。
化合物对耐药株急性感染C8166细胞的抑制 实验 用NRTIs耐药株HIV-174V、NNRTIs耐药株HIV-1A17、FIs耐药株HIV-1NL4-3 gp41(36G)N42S和PIs耐药株HIV-1RF/V82F/184V分别感染C8166细胞,4 h后 离心洗去游离病毒后,以培养基调细胞数至每毫升4×105个。在96孔细胞培养板上,将100 μL病毒感染细胞悬液与100 μL不同稀释浓度的药物混合。培养4天后收集上清,Triton X-100裂解病毒,ELISA方法测定HIV-1 p24抗原水平。计算出药物对各耐药株在C8166细胞中复制表达p24抗原的抑制率和EC50。
化合物对临床分离株急性感染PBMC的抑制实验 收集刺激好的PBMC,用含IL-2的完全细胞培养基重悬细胞,分别加入临床分离株后37 ℃感染4 h,离心去除游离病毒后,用含IL-2完全培养基重悬细胞,调细胞数为每毫升5×106个。在96孔细胞培养板上,加100 μL PBMC悬液至100 μL含有不同稀释浓度的待测化合物中。培养至第4天,每孔补加100 μL含有IL-2的新鲜细胞培养基,第7天收集培养上清并裂解灭活。采用捕捉HIV-1 p24抗原ELISA方法检测化合物对各HIV-1临床分离株复制的抑制作用[26]。
结果 1 化合物对细胞的毒性作用MTT法测定了5个化合物对C8166、MT-4、H9和PBMC等细胞的体外毒性作用,以AZT为阳性对照。结果如表 1所示,DY1203和DY1204对各细胞的毒性很小,CC50均大于200 μg·mL-1; DY1119、DY1208和DY1209对各细胞均表现出不同的毒性 作用。
| Table 1 Cytotoxicities of DY-series compounds to 4 different cells. n = 3,x± s. CC50: 50% cytotoxic concentration; AZT: Zidovudine |
5个化合物对RNA依赖的DNA聚合酶活性均表现出不同的抑制活性,以EFV (IC50 = 0.03 ± 0.25 μg·mL-1) 为对照,其中DY1119、DY1208和DY1209的抑制作用较强,IC50分别为0.49 ± 10.96、0.04 ± 3.80和0.07 ± 6.89 μg·mL-1; DY1203和DY1204的抑制效应较弱,IC50分别为1.71 ± 3.94和15.14 ± 7.02 μg·mL-1。
2.2 化合物对实验株HIV-1ⅢB急性感染细胞中病毒复制的抑制作用5个化合物对HIV-1ⅢB急性感染C8166、MT-4、H9细胞的抑制曲线见图 2,AZT为阳性对照。图 2A为化合物在C8166细胞中对HIV-1ⅢB的抑制活性,DY1119、DY1208和DY1209的EC50 分别为6.50 ± 1.86、5.12 ± 0.33和6.50 ± 0.43 ng·mL-1,均表现出显著的抗病毒活性,相对应的治疗指数 (CC50/EC50) 分别为15554、17511和6432; 而DY1203和DY1204的活性较差,EC50分别为510.40 ± 86.50和338.22 ± 54.79 ng·mL-1; AZT的EC50为12.37 ± 5.13 ng·mL-1。图 2B为化合物在MT-4细胞中对HIV-1ⅢB的抑制活性,它们的EC50在10~40 ng·mL-1内,治 疗指数均大于2 000。图 2C为化合物在H9细胞中对HIV-1ⅢB的抑制活性,DY1203、DY1208和DY1209的EC50分别为5.86 ± 1.51、4.87 ± 2.70和1.37 ± 0.26 ng·mL-1,表现出很强的抑制效应,治疗指数分别为34 124、32 017和47 297; DY1119和DY1204的EC50分别为40.22 ± 2.81和27.36 ± 0.71 ng·mL-1,比其他 3个化合物活性略差; AZT的EC50为27.34 ± 2.09 ng·mL-1。

|
Figure 2 Anti-HIV-1ⅢB activity of 5 compounds on 3 different cells in vitro. n = 3,x± s. A: Inhibition of p24 antigen production on HIV-1ⅢB in C8166; B: Inhibition of p24 antigen production on HIV-1ⅢB in MT-4; C: Inhibition of p24 antigen production on HIV-1ⅢB in H9 |
HIV-1病毒在RNA复制和逆转录时存在较高的突变率,比较5个化合物对不同类型耐药株的活性见图 3。由图 3看见,每个化合物对HIV-174V、HIV-1RF/V82F/184V和HIV-1NL4-3 gp41(36G)N42S均表现出明显的抑制作用,EC50均在0.1 μg·mL-1左右; 而对HIV-1A17的抑制作用较差,EC50在15~160 μg·mL-1内,说明HIV-1A17对5个化合物有不同程度的耐药。
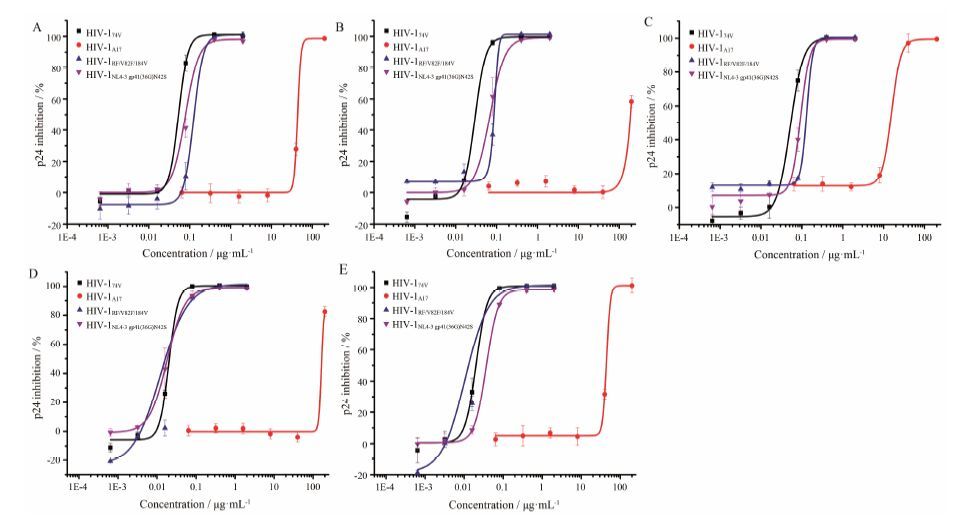
|
Figure 3 Inhibition of 5 compounds on 4 drug-resistant strains replication in C8166 cells. n = 3,x± s. HIV-174V: Nucleoside reverse transcriptase inhibitor resistant strain; HIV-1A17: Non-nucleoside reverse transcriptase inhibitor resistant strain; HIV-1RF/V82F/184V: Protease inhibitor resistant strain; HIV-1NL4-3 gp41 (36G) N42S: Fusion inhibitor resistant strain. A: DY1119; B: DY1203; C: DY1204; D: DY1208; E: DY1209 |
检测了化合物抗HIV-1实验株和耐药株的活性后,还须检测化合物对HIV-1临床分离株的抑制作用。图 4为5个化合物对临床分离株HIV-1KM018、HIV-1TC-1和HIV-1Wan的抑制曲线,结果发现,化合物对HIV-1KM018和HIV-1Wan均表现出很好的抑制效应,EC50在8~200 ng·mL-1内,AZT的EC50分别为9.84 ± 3.59 ng·mL-1 (HIV-1KM018) 和1.12 ± 0.23 ng·mL-1 (HIV-1Wan); 而对HIV-1TC-1的抑制活性更显著,除了DY1119外,DY1203、DY1204、DY1208和DY1209的EC50分别为4.66 ± 1.56、8.99 ± 3.45、1.58 ± 1.05和4.59 ± 1.43 ng·mL-1,相对应的治疗指数也很高,分别为42 946、22 243、126 783和16 182; AZT的EC50为18.36 ± 0.59 ng·mL-1。

|
Figure 4 Inhibition of 5 compounds on 3 primary isolated strains replication in PBMCs. n = 3,x± s. A: inhibition of p24 antigen production on HIV-1KM018 in PBMC; B: inhibition of p24 antigen production on HIV-1TC-1 inPBMC; C: inhibition of p24 antigen production on HIV-1Wan in PBMC |
本文所研究的二甲苯酮类化合物是一类对HIV-1抑制活性极强的NNRTIs,且由于作用谱广、毒副作用小和抗耐药性显著等特点,受到了广泛的关注。
作者评价了5个化合物对不同HIV-1毒株的抗病毒活性,涵盖了不同实验株、耐药株和临床分离株。结果发现,在C8166细胞中,DY1119、DY1208和DY1209对实验株HIV-1ⅢB表现出很强的抑制作用,EC50均低于10 ng·mL-1,治疗指数均大于6 000,表明这3个化合物的安全性较大。在MT-4细胞中,化合物对HIV-1ⅢB表现出一定的抑制作用,EC50在10~50 ng·mL-1之间,治疗指数均大于2 000。而在H9细胞中,DY1203、DY1208和DY1209对细胞的毒性较大,但抗HIV-1ⅢB活性较好,治疗指数均大于30 000,安全性较高。由此可见,化合物对不同细胞表现出不同毒性,其抗病毒活性也有所差异。
在比较化合物对不同类型耐药株的活性时,选取了4种不同类型的耐药株进行检测。结果发现,化合物对NRTIs耐药株HIV-174V、PI耐药株HIV-1RF/V82F/184V和FI耐药株HIV-1NL4-3 gp41(36G)N42S均有明显的抑制作用,表现出很好的抗病毒活性; 而对NNRTIs耐药株HIV-1A17的抑制作用较弱,说明HIV-1A17对化合物有一定程度的耐药。对HIV-1临床分离株的抑制实 验中,5个化合物对HIV-1KM018和HIV-1Wan均表现出很好的抑制效应,EC50在8~200 ng·mL-1内; 而它们对HIV-1TC-1的抑制活性更显著,均处于10 ng·mL-1以下,治疗指数在上万的水平,说明其安全性较好。
目前已上市的NNRTI都是抑制RT的RNA依 赖的DNA聚合酶活性[33, 34],作者也检测了化合物对HIV-1重组逆转录酶的抑制活性。结果发现,DY1119、DY1208和DY1209表现出很好的抑制RT作用,EC50均小于1 μg·mL-1。
综上所述,DY系列化合物对不同细胞株和不同病毒株表现出不同的细胞毒性和抗病毒活性,尤其是DY1119、DY1208和DY1209相对于其他化合物表现出很强的体外抗HIV-1活性,对实验株、NRTI耐药株、PI耐药株、FI耐药株和临床分离株均有很强的抑制作用,具有广谱的抗HIV-1活性。而DY1119、DY1208和DY1209中,DY1208在不同实验中得到的治疗指数都是相对较高的,安全性最高,所以可将DY1208作为先导化合物,对其进行化学结构改造和优化,为获得耐药屏障更高、毒性更小的化合物提供研发思路,促进抗HIV-1药物的发展。
| [1] | Sharp PM, Hahn BH. Origins of HIV and the AIDS pan-demic[J]. Cold Spring Harb Perspect Med , 2011, 1 :a006841. |
| [2] | Barre-Sinoussi F, Chermann JC, Rey F, et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)[J]. Science , 1983, 220 :868–871. DOI:10.1126/science.6189183 |
| [3] | UNAIDS. World AIDS Day Rport[R]. 2015. |
| [4] | China CDC. Update on the AIDS/STD epidemic in China and main response in control and preventon in December, 2015[J]. Chin J AIDS STD (中国艾滋病性病) , 2016, 22 :69. |
| [5] | de Béthune MP. Non-nucleoside reverse transcriptase inhibitors (NNRTIs), their discovery,development, and use in the treatment of HIV-1 infection: a review of the last 20 years (1989-2009)[J]. Antiviral Res , 2010, 85 :75–90. DOI:10.1016/j.antiviral.2009.09.008 |
| [6] | Esnouf R, Ren JS, Ross C, et al. Mechanism of inhibition of HIV-1 reverse transcriptase by non-nucleoside inhibitors[J]. Nat Struct Biol , 1995, 2 :303–308. DOI:10.1038/nsb0495-303 |
| [7] | Koup RA, Merluzzi VJ, Hargrave KD, et al. Inhibition of human immunodeficiency virus type 1(HIV-1) replication by the dipyridodiazepinone BI-RG-587[J]. J Infect Dis , 1991, 163 :966–970. DOI:10.1093/infdis/163.5.966 |
| [8] | Freimuth WW. Delavirdine mesylate, a potent non-nucleoside HIV-1 reverse transcriptase inhibitor[J]. Adv Exp Med Biol , 1996, 394 :279–289. DOI:10.1007/978-1-4757-9209-6 |
| [9] | Young SD, Britcher SF, Tran LO, et al. L-743, 726(DMP-266): a novel, highly potent nonnucleoside inhibitor of the human immunodeficiency virus type 1 reverse transcriptase[J]. Antimicrob Agents Chemother , 1995, 39 :2602–2605. DOI:10.1128/AAC.39.12.2602 |
| [10] | Johnson LB, Saravolatz LD. Etravirine, a next-generation nonnucleoside reverse-transcriptase inhibitor[J]. Clin Infect Dis , 2009, 48 :1123–1128. DOI:10.1086/599079 |
| [11] | Moreno S, Lopez AJ, Arribas JR, et al. The future of antiret-roviral therapy: challenges and needs[J]. J Antimicrob Chemother , 2010, 65 :827–835. DOI:10.1093/jac/dkq061 |
| [12] | Grant RM, Hecht FM, Warmerdam M. Time trends in primary HIV-1 drug resistance among recently infected persons[J]. JAMA , 2002, 288 :181–188. DOI:10.1001/jama.288.2.181 |
| [13] | Zhang XQ. The newest developments in anti-HIV-1 drugs[J]. Acta Pharm Sin (药学学报) , 2010, 45 :194–204. |
| [14] | Liu H, Zhan P, Liu XY. Research progress of dual inhibi-tors targeting HIV-1 reverse transcriptase and integrase[J]. Acta Pharm Sin (药学学报) , 2013, 48 :466–476. |
| [15] | Dong B, Ma T, Zhang T, et al. Anti-HIV-1 activity and structure-activity relationship of pyranocoumarin analogs[J]. Acta Pharm Sin (药学学报) , 2011, 46 :35–38. |
| [16] | Long J, Zhang DH, Zhang GH, et al. The anti-HIV activity of three 2-alkylsulfanyl-6-benzyl-3,4-dihydropyrimidin-4(3H)-one derivatives acting as non-nucleoside reverse transcriptase inhibitor in vitro[J]. Acta Pharm Sin (药学学报) , 2010, 45 :228–234. |
| [17] | Ferris RG, Hazen RJ, Roberts GB, et al. Antiviral activity of GW678248, a novel benzophenone nonnucleoside reverse transcriptase inhibitor[J]. Antimicrob Agents Chemother , 2005, 49 :4046–4051. DOI:10.1128/AAC.49.10.4046-4051.2005 |
| [18] | Romines KR, Freeman GA, Schaller LT, et al. Structure-activity relationship studies of novel benzophenones leading to the discovery of a potent, next generation HIV nonnucleoside reverse transcriptase inhibitor[J]. J Med Chem , 2006, 49 :727–739. DOI:10.1021/jm050670l |
| [19] | Ren JS, Chamberlain PP, Stamp A, et al. Structural basis for the improved drug resistance profile of new generation benzophenone non-nucleoside HIV-1 reverse transcriptase inhibitors[J]. J Med Chem , 2008, 51 :5000–5008. DOI:10.1021/jm8004493 |
| [20] | Ma XD, Zhang X, Yang SQ, et al. Synthesis and biological evaluation of (±)-benzhydrol derivatives as potent non-nucleoside HIV-1 reverse transcriptase inhibitors[J]. Bioorg Med Chem , 2011, 19 :4704–4709. DOI:10.1016/j.bmc.2011.07.003 |
| [21] | Ma XD, Zhang X, Dai HF, et al. Synthesis and biological activity of naphthyl-substituted (B-ring) benzophenone deriva-tives as novel non-nucleoside HIV-1 reverse transcriptase inhibitors[J]. Bioorg Med Chem , 2011, 19 :4601–4607. DOI:10.1016/j.bmc.2011.06.007 |
| [22] | Gu SX, Zhang X, He QQ, et al. Synthesis and biological evaluation of naphthyl phenyl ethers (NPEs) as novel nonnu-cleoside HIV-1 reverse transcriptase inhibitors[J]. Bioorg Med Chem , 2011, 19 :4220–4226. DOI:10.1016/j.bmc.2011.05.060 |
| [23] | Ma XD, He QQ, Zhang X, et al. Synthesis, struc-ture-activity relationships, and docking studies of N-phenylarylformamide derivatives (PAFAs) as non-nucleoside HIV reverse transcriptase inhibitors[J]. Eur J Med Chem , 2012, 58 :504–512. DOI:10.1016/j.ejmech.2012.03.032 |
| [24] | Sun Y, Lu CL, Wang CY, et al. Identification of the novel N-phenylbenzene sulfonamide derivatives as potent HIV inhibitors[J]. Chin Chem Lett , 2015, 26 :243–247. DOI:10.1016/j.cclet.2014.11.004 |
| [25] | Liu GJ, Wang JP, Xiao JC, et al. Preparation and characteri-zation of three monoclonal antibodies against HIV-1 p24 capsid protein[J]. Cell Mol Immunol , 2007, 4 :203–208. |
| [26] | Zhang GH, Wang Q, Chen JJ, et al. The anti-HIV-1 effect of scutellarin[J]. Biochem Biophys Res Commun , 2005, 334 :812–816. DOI:10.1016/j.bbrc.2005.06.166 |
| [27] | Pannecouque C, Daelemans D, De Clercq E. Tetrazolium-based colorimetric assay for the detection of HIV replication inhibitors: revisited 20 years later[J]. Nat Protoc , 2008, 3 :427–434. DOI:10.1038/nprot.2007.517 |
| [28] | Wang RR, Yang LM, Wang YH, et al. Sifuvirtide, a potent HIV fusion inhibitor peptide[J]. Biochem Biophys Res Commun , 2009, 382 :540–544. DOI:10.1016/j.bbrc.2009.03.057 |
| [29] | Zheng YT, Zhang WF, Ben KL, et al. In vitro immunotoxicity and cytotoxicity of trichosanthin against human normal immunocytes and leukemia-lymphoma cells[J]. Immuno-pharmacol Immunotoxicol , 1995, 17 :69–79. DOI:10.3109/08923979509052721 |
| [30] | Wang JH, Tam SC, Huang H, et al. Site-directed PEGyla-tion of trichosanthin retained its anti-HIV activity with reduced potency in vitro[J]. Biochem Biophys Res Commun , 2004, 317 :965–971. DOI:10.1016/j.bbrc.2004.03.139 |
| [31] | Zheng YT, Ben KL, Jin SW. Anti-HIV-1 activity of trichobitacin, a novel ribosome-inactivating protein[J]. Acta Pharmacol Sin , 2000, 21 :179–182. |
| [32] | Wang RR, Yang QH, Luo RH, et al. Azvudine, a novel nucleoside reverse transcriptase inhibitor showed good drug combination features and better inhibition on drug-resistant strains than lamivudine in vitro[J]. PLoS One , 2014, 9 :e105617. DOI:10.1371/journal.pone.0105617 |
| [33] | Azijn H, Tirry I, Vingerhoets J, et al. TMC278, a next-generation nonnucleoside reverse transcriptase inhibitor (NNRTI), active against wild-type and NNRTI-resistant HIV-1[J]. Antimicrob Agents Chemother , 2010, 54 :718–727. DOI:10.1128/AAC.00986-09 |
| [34] | Andries K, Azijn H, Thielemans T, et al. TMC125, a novel next-generation nonnucleoside reverse transcriptase inhibitor active against nonnucleoside reverse transcriptase inhibitor-resistant human immunodeficiency virus type 1[J]. Anti-microb Agents Chemother , 2004, 48 :4680–4686. DOI:10.1128/AAC.48.12.4680-4686.2004 |
 2016, Vol. 51
2016, Vol. 51


