2. 中国医学科学院、北京协和医学院医药生物技术研究所, 北京 100050 ;
3. 河北医科大学新药药理和毒理重点实验室, 河北 石家庄 050017
2. Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China ;
3. The Key Laboratory of New Drug Pharmacology and Toxicology, Hebei Medical University, Shijiazhuang 050017, China
延迟整流钾电流的快激活成分IKr是心肌细胞 动作电位复极3期的主要复极电流。hERG (human ether-a-go-go-related gene) 编码心脏IKr的孔区亚单位[1, 2]。hERG基因突变导致IKr通道功能异常,引起 3相复极延长,是遗传性长QT综合症2 (LQT2) 的分子基础[2, 3],同时,许多化学结构不同的药物也可阻断该通道[4],延迟心脏复极,延长体表心电图的QT间期,QT间期延长易发生尖端扭转型室性心律失常 (Tdp),具有心源性猝死的的潜在危险[5, 6]。
文献[7-9]报道,多数Ⅲ类和Ⅰ类抗心律失常药物由于抑制hERG通道而延长QT间期、具有潜在致心律失常风险。利多卡因属Ib类Na+通道阻断剂,是临床常用的局部麻药,也是目前急性心肌梗死所致室性快速性心律失常包括室性心动过速、室颤的主要药物[10],临床使用具有较高的安全性。然而,有文献[9]报道利多卡因具有抑制hERG通道作用,而临床确有报道[11]利多卡因治疗新生儿惊厥发作时,有发生心律失常的危险。利多卡因是否因抑制hERG通道引 发QT间期延长而具潜在心律失常风险尚不明确。为此,本实验利用全细胞膜片钳技术和Western blot技术,观察利多卡因对hERG-HEK 293细胞上hERG电流和蛋白表达的影响,同时观察利多卡因对家兔离体心脏ECG的影响,为利多卡因临床安全用药提供理论依据。
材料与方法细胞 稳定表达hERG钾通道的HEK 293细胞株 (hERG-HEK 293稳态细胞)。
药品和试剂 HEPES、EGTA、Mg-ATP、KCl、NaCl、CaCl2、G418和利多卡因购自Sigma公司; 高糖DMEM、胎牛血清购自Gibco公司; 其他试剂均为国产分析纯。
溶液 细胞外液 (台式液,mmol·L-1): NaCl 140、KCl 5.4、MgCl2 1、CaCl2 2、葡萄糖10、HEPES 10,用NaOH调至pH 7.4。电极内液 (mmol·L-1): KCl 140、Mg-ATP 4、MgCl2 1、EGTA 5、HEPES 10,用KOH调至pH 7.2。
主要仪器 膜片钳,Axopatch 200B (USA); 数模转换器,Digi Data 1232 (Axon,USA); 倒置显微镜(Olympus,Japan); 三维微电极操纵器 (Axon,USA),Model P-97电机拉制器 (Sutter,USA); Lengendorff 灌流系统 (Radnoti,USA); Biopac多导生理记录仪 (Biopac Systems. Inc,USA); Odyssey双色红外激光成像系统 (LI. COR,USA)。
细胞培养 稳定表达hERG基因的HEK 293细胞株接种于盛有200 μg·mL-1 G418、10% 胎牛血清的高糖DMEM培养液的培养瓶中,置于37 ℃、5% CO2的培养箱中培养,细胞传代培养至85% 融合度,用0.25% 胰酶消化得到单个细胞,接种到小玻片上,24 h后进行全细胞膜片钳记录; 接种到35 mm培养皿用于Western blot实验 。
hERG电流的记录 选择表面清洁、折光性好 的单个细胞在室温下进行实验。使用电极尖端约0.5~1 μm,充以电极内液后阻抗为1~3 MΩ。高阻封接形成后,进行串联电阻和电容电流补偿,形成全细胞记录模型,实验过程由计算机软件pCLAM 9.0 (Axon,USA) 控制数模转换器完成刺激信号的产生,反馈信号的采集以及数据分析。用电压钳模式进行刺激和记录hERG电流。信号输入经过1 KHz的滤波,数据存于计算机硬盘以便分析。正常细胞外液持续灌流条件下,观察不同浓度的利多卡因对hERG电流的作用,采用累积加药的方法记录不同浓度的利多卡因对hERG电流的作用。采用pCLAM软件对单个全细胞记录进行图形和数据转换,采用Origin 7.0来拟合曲线和制图。
Western blot测定hERG蛋白 将处于对数生 长期的hERG-HEK 293细胞分别以空白培养基和含利多卡因 (终浓度为1、10、100、1 000 μmol·L-1) 的培养基孵育24 h,用预冷的PBS收集细胞并提取总蛋白,BCA法进行蛋白定量。取等量样品,加入等 体积的2×上样缓冲液后,煮样,电泳,转膜,封闭,加入一抗 (1∶200),室温孵育1.5 h,用PBS-T缓冲液洗膜3次,每次10 min,然后用红外荧光标记二抗 (Alexa Fluor 700,1∶4 000) 对膜避光孵育1 h,用PBS-T缓冲液洗膜3次,每次15 min,再用PBS洗膜15 min,洗去Tween 20以降低背景,以上过程均需避光。Odyssey红外荧光扫描成像系统对膜上蛋白质进行检测,用Odyssey图像分析软件进行光密度积分值分析,对所得数据利用Microsoft Excel软件进行成双样本异方差t-检验。
兔离体心脏心电图 (ECG) 记录 健康新西兰兔5只,体质量2.0~2.5 kg,雌雄不限,动物使用 许可证: SCXX (冀) 2013-1-003。常规经耳缘静脉注 射0.3 mL肝素钠注射液抗凝,采用5% 异戊巴比妥钠1 mL·kg-1麻醉后,快速开胸取出心脏,置于0~4 ℃的无钙台式液中使之停博,修剪分离主动脉,行主动脉插管后,结扎固定。采用Langendorff装置,正常台式液持续进行逆向灌流,温度37 ± 1 ℃,灌流压80 cmH2O。同时将2个电极分别置于心尖和主动脉根部,记录离体心脏的心电图,经生理记录仪采样并存入计算机。按照利多卡因10 → 100→ 1 000 μmol·L-1顺序灌流。上一浓度灌流结束后再灌流下一个浓度,每组灌流持续10 min,分别记录各浓度组给药10 min后的心电图,分析心率、PR间期、QRS、QT和心率矫正的QT (QTc) 间期。
统计学处理 所有数据以x± s表示,采用Student’s t检验和单因素方差分析,P < 0.05为有显著性差异。
结果 1 利多卡因对hERG-HEK 293稳态细胞上hERG电流的作用 1.1 利多卡因对hERG电流的抑制作用形成全细胞模型后,在电压钳模式下记录hERG钾电流,将保持电压固定于-80 mV,以10 mV为步阶,施以-60~+50 mV,4 s去极化脉冲记录hERG时间依赖性电流 (图 1A); 实验电压保持在-50 mV,脉冲持续5 s记录hERG尾电流; 刺激间隔15 s。hERG通道的时间依赖性电流-电压曲线呈倒钟形,具有内向整流特性,在0 mV左右脉冲刺激下达到最大值 (图 1B); 尾电流-电压曲线呈“S”形 (图 1C)。以电压为横坐标,相应的电流值为纵坐标,分别得出3和100 μmol·L-1利多卡因灌流前后时间依赖性电流-电压曲线和尾电流-电压曲线 (I-V) 的变化 (图 1B,C)。结果可见,在大部分指令电压下利多卡因均可抑制hERG时间依赖性电流和尾电流 (图 1B,C)。由Origin 6.0拟合得出量-效关系曲线 (图 1D)。利多卡因抑制hERG的IC50值为88.63 ± 7.99 μmol·L-1,Hill系数为1.19± 0.02。
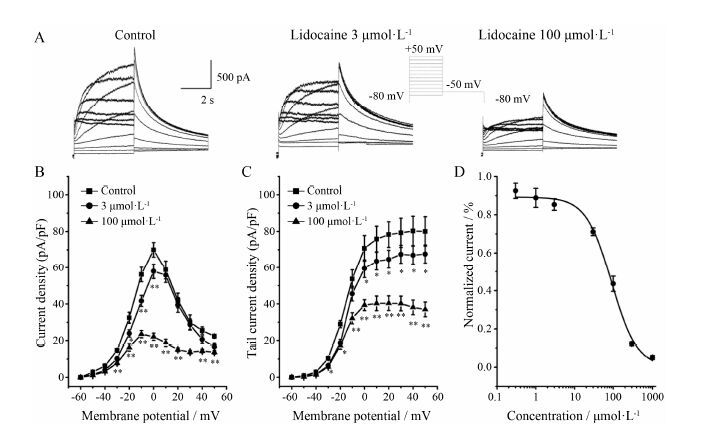
|
Figure 1 Effects of lidocaine on hERG current on a HEK 293 cell stablely expressed hERG. A: Current traces from hERG expressed HEK 293 cell were recorded in control condition and 3 and 100 μmol·L-1 lidocaine. Using the pulse protocol are shown insert; B and C: Normalized I-V relationships for current measured at the end of depolarizing step and tail currents in the presence of lidocaine; D: Concentration-response curve of the hERG tail current blocked by lidocaine. n = 5-8,x± s. P < 0.05,**P < 0.01 vs control group |
以电压为横坐标,在相应电压下电流值与尾电流的最大值的比值为纵坐标,标准化hERG尾电流后,数据 经过Boltzman方程拟合,得hERG的稳态激活曲线 (图 2A)。结果显示,加药前的半数激活电压 (V1/2) 为-15.70 ± 0.58 mV,激活斜率 (k) 为7.74 ± 0.51 mV; 加入3 μmol·L-1利多卡因后V1/2为-15.19 ± 0.62 mV,k为8.46 ± 0.55 mV; 而加入100 μmol·L-1利多卡因后V1/2为-18.68 ± 0.47 mV,k为8.07 ± 0.42 mV,三者相比差异无显著性 (P >0.05),说明利多卡因对hERG钾通道的激活曲线无影响。以电压为横坐标,相应标准化的尾电流为纵坐标作图,结果显示利多卡因抑制hERG电流具有电压依赖性 (图 2B)。
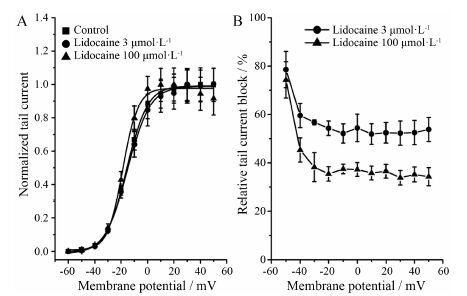
|
Figure 2 Effects of lidocaine on voltage-dependent activation and voltage-dependent blocked. A: Voltage-dependent activetion relations for hERG channel in control,3 and 100 μmol·L-1 lidocaine; B: Voltage-dependent blocked by 3 and 100 μmol·L-1 lidocaine. n = 6-8,x± s |
形成全细胞模型后,在电压钳模式下记录hERG钾电流,从保持电压-80 mV去极化电压到+20 mV,持续0.5 s,复极化电压到-50 mV记录hERG的尾电流。不同刺激间隔3、12和36 s对hERG电流的抑制不同 (图 3)。结果显示,100 μmol·L-1利多卡因在长的刺激间隔 (36 s) 对hERG电流的抑制作用最强,即利多卡因在慢频率刺激下,具有更强的hERG通道抑制作用,具有反向使用依赖性。
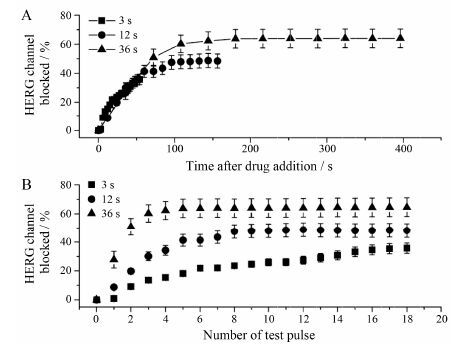
|
Figure 3 Blocking use-dependent hERG channel by lidocaine. A: Tail currents were recorded at -50 mV after a 0.5 s depolarizing pre-pulse to +20 mV from a holding potential of -80 mV,every 3 s (■),12 s (●),or 36 s (▲) after exposure to 100 μmol·L-1 lidocaine. B: The hERG-channel blocked data from A are plottedagainst the number of test pulse. n = 5-8,x± s |
利用动作电位钳记录了整个动作电位时程中的hERG电流。由于通道的门控特征,hERG电流在动作电位的2期和3期得到最大值 (图 4)。利多卡因在动作电位钳的记录模式下同样抑制hERG电流,在电压-24.9 ± 3.2 mV时抑制作用达到最大。
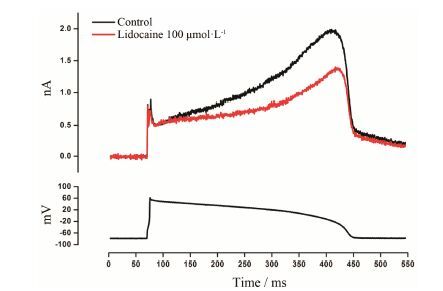
|
Figure 4 Inhibition of hERG current under action potential patch-clamp model by lidocaine. Upper traces showed representative records of hERG current elicited by the action potential showd below,in control and after the application of 100 μmol·L-1 lidocaine |
以hERG钾通道蛋白C末端的抗体作为一抗,Western blot结果显示,hERG-HEK细胞中hERG钾通道蛋白表达两条带,一条带的分子质量约为155 kDa,另一条带的分子质量在135 kDa附近 (图 5A)。分别用1、10、100和1 000 μmol·L-1利多卡因处理hERG- HEK细胞24 h后进行Western blot检测,结果发现不同浓度的利多卡因均不影响hERG钾通道蛋白的表达 (图 5B)。
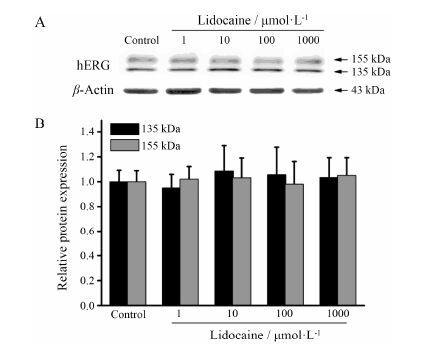
|
Figure 5 Effect of lidocaine on the expression of hERG channel protein. A: The effect of lidocaine on hERG channel expression detected by Western blot method; B: Image densities on Western blot were analyzed directly on an Image J |
图 6为灌流利多卡因 (10、100和1 000 μmol·L-1) 对家兔离体心电图作用的代表性曲线。10 μmol·L-1利多卡因对家兔离体心脏心率、PR间期、QRS和QTc间期没有明显的影响; 100 μmol·L-1浓度下显著延长QRS间期; 1 000 μmol·L-1浓度下显著减慢心率,延长PR间期和QRS间期。表 1总结了不同条件下心电图各参数。由表 1可见,利多卡因在高达1 000 μmol·L-1浓度下不影响QTc间期。
| Table 1 Effects of lidocaine on ECG in the isolated rabbit hearts. n = 5,x± s. **P < 0.01 vs control group |

|
Figure 6 Effect of lidocaine on ECG of the isolated rabbit heart. Representative traces of ECG before and after application of lidocaine (10,100 and 1000 μmol·L-1) |
利多卡因作为经典的抗心律失常药应用多年,其主要作用是抑制Na+内流,但对K+外流的影响在药理学教科书中一直没有明确的描述。在早期的“药理学”中的描述是促进K+外流 (高等医药院校教材: 药理学第四版),但近年的教材中去掉了促进K+外流的表述 (高等医药院校教材: 药理学第六版)。有研究表明利多卡因抑制hTREK1[12]和hERG[9]。本研究结果表明,利多卡因抑制hERG钾通道呈浓度依赖性,其IC50值为88.63 ± 7.99 μmol·L-1,比以前报道[9]的数值小,这可能是实验中采用不同的温度导致的[13]。本研究还表明其抑制作用呈电压依赖性,但对hERG通道的激活曲线无影响; 利多卡因抑制hERG电流具有反向使用依赖性,表明在低频率时更易结合到hERG通道上,也表明利多卡因在慢心率时对hERG的影响较大。另外,研究结果还显示,利多卡因对hERG蛋白的表达无影响。
利用动作电位钳记录hERG电流显示,利多卡因在 -24.9 ± 3.2 mV时对hERG电流的抑制作用最大。由于IKr是心室肌动作电位复极3期的主要离子流,利多卡因对hERG钾通道的抑制可能会引起动作电位时程延长。家兔心脏的心肌细胞具有较大的IKr,因而作者利用家兔离体心脏灌流系统检测了利多卡因对离体心脏心电图各参数的影响,结果显示不同浓度的利多卡因 (10~1 000 μmol·L-1) 对离体心脏心电图的QTc间期无影响。利多卡因主要是阻断Na+通道,抑制心肌细胞的峰Na+电流和晚Na+电流[14]。心脏电生理的平衡取决于外向电流和内向电流之间的精细平衡。尽管利多卡因抑制hERG,但同时又抑制晚Na+电流,对外向电流抑制被对内向电流抑制抵消,因而利多卡因不会引起QT间期延长。最近研究表明,药物对hERG电流抑制会由于同时具备的内向电流的抑制,如L-型Ca2+电流和晚Na+电流的抑制而显著降低QT延长引发TdP的风险[15]。抑制hERG钾通道的化合物不一定引起QT间期延长及Tdp,还要看化合物是否以心脏多离子通道为靶点及对整个心脏电生理(ECG) 的影响。
临床上采用利多卡因抗心律失常时,其血药浓度一般为10 μmol·L-1[16]。但亦有报道其血药浓度可达20~30 μmol·L-1,有时甚至可超过1 mmol·L-1[17]。研究结果显示,利多卡因10 μmol·L-1对家兔离体心脏心电图各参数无影响; 100 μmol·L-1时并不延长QT/QTc间期,但可引起PR间期和QRS波群延长,即房室传导减慢和心脏除极减慢。由此可见,高浓度的利多卡因诱发心律失常可能主要与其阻断Na+通道有关。
综上所述,本研究结果表明,尽管利多卡因在较高浓度时可以抑制hERG通道,但由于其同时具有晚Na+电流抑制作用使其在较高浓度 (100 μmol·L-1) 时并不延长QT/QTc间期。高浓度下心律失常的发生可能主要由其阻断Na+通道减慢心脏除极和房室传导所致。
| [1] | Trudeau MC, Warmke JW, Ganetzky B, et al. HERG, a human inward rectifier in the voltage-gated potassium channel family[J]. Science , 1995, 269 :92–95. DOI:10.1126/science.7604285 |
| [2] | Sanguinetti MC, Jiang C, Curran ME, et al. A mechanistic link between an inherited and an acquired cardiac arrhythmia: HERG encodes the IKr potassium channel[J]. Cell , 1995, 81 :299–307. DOI:10.1016/0092-8674(95)90340-2 |
| [3] | Curran ME, Splawski I, Timothy KW, et al. A molecular basis for cardiac arrhythmia: HERG mutations cause long QT syndrome[J]. Cell , 1995, 80 :795–803. DOI:10.1016/0092-8674(95)90358-5 |
| [4] | Vandenberg JI, Perry MD, Perrin MJ, et al. hERG K+ channels: structure, function, and clinical significance[J]. Physiol Rev , 2012, 92 :1393–1478. DOI:10.1152/physrev.00036.2011 |
| [5] | Keating MT, Sanguinetti MC. Molecular and cellular mecha-nisms of cardiac arrhythmias[J]. Cell , 2001, 104 :569–580. DOI:10.1016/S0092-8674(01)00243-4 |
| [6] | Schwartz PJ. The congenital long QT syndromes from genotype to phenotype: clinical implications[J]. J Intern Med , 2006, 259 :39–47. DOI:10.1111/JIM.2006.259.issue-1 |
| [7] | Sanguinetti MC, Jurkiewicz NK. Two components of car-diac delayed rectifier K+ current. Differential sensitivity to block by class Ⅲ antiarrhythmic agents[J]. J Gen Physiol , 1990, 96 :195–215. DOI:10.1085/jgp.96.1.195 |
| [8] | Yang T, Snyders DJ, Roden DM. Inhibition of cardiac potassium currents by the vesnarinone analog OPC-18790: comparison with quinidine and dofetilide[J]. J Pharmacol Exp Ther , 1997, 280 :1170–1175. |
| [9] | Paul AA, Witchel HJ, Hancox JC. Inhibition of the current of heterologously expressed HERG potassium channels by flecainide and comparison with quinidine, propafenone and lignocaine[J]. Br J Pharmacol , 2002, 136 :717–729. DOI:10.1038/sj.bjp.0704784 |
| [10] | Haverkamp W. Which drugs are useful during resuscita-tion? Which are not?[J]. Herzschrittmacherther Elektrophysiol , 2016, 27 :15–19. DOI:10.1007/s00399-016-0417-7 |
| [11] | van Rooij LG, Toet MC, Rademaker KM, et al. Cardiac arrhythmias in neonates receiving lidocaine as anticonvulsive treatment[J]. Eur J Pediatr , 2004, 163 :637–641. DOI:10.1007/s00431-004-1513-y |
| [12] | Nayak TK, Harinath S, Nama S, et al. Inhibition of human two-pore domain K+ channel TREK1 by local anesthetic lidocaine: negative cooperativity and half-of-sites saturation kinetics[J]. Mol Pharmacol , 2009, 76 :903–917. DOI:10.1124/mol.109.056838 |
| [13] | Kauthale RR, Dadarkar SS, Husain R, et al. Assessment of temperature-induced hERG channel blockade variation by drugs[J]. J Appl Toxicol , 2015, 35 :799–805. DOI:10.1002/jat.v35.7 |
| [14] | Moreno JD, Clancy CE. Pathophysiology of the cardiac late Na current and its potential as a drug target[J]. J Mol Cell Cardiol , 2012, 52 :608–619. DOI:10.1016/j.yjmcc.2011.12.003 |
| [15] | Crumb WJ, Jr Vicente J, Johannesen L, et al. An evalua-tion of 30 clinical drugs against the comprehensive in vitro proar-rhythmia assay (CiPA) proposed ion channel panel[J]. J Pharmacol Toxicol Methods , 2016, 81 :251–262. DOI:10.1016/j.vascn.2016.03.009 |
| [16] | Lei B, Cottrell JE, Kass IS. Neuroprotective effect of low-dose lidocaine in a rat model of transient focal cerebral ischemia[J]. Anesthesiology , 2001, 95 :445–451. DOI:10.1097/00000542-200108000-00029 |
| [17] | Johnson ME, Uhl CB, Spittler KH, et al. Mitochondrial injury and caspase activation by the local anesthetic lidocaine[J]. Anesthesiology , 2004, 101 :1184–1194. DOI:10.1097/00000542-200411000-00019 |
 2016, Vol. 51
2016, Vol. 51


