Ⅱ相代谢又称结合反应,是药物在体内发生生物转化的主要方式之一,也是自体内清除、解毒的主要形式。多种酶类参与内外源物的Ⅱ相代谢,包括尿苷二磷酸-葡萄糖醛酸转移酶 (UDP-glucuronosyl-transferases,UGT)、磺基转移酶 (sulfotransferase,SULT)、甲基转移酶、乙酰基转移酶和谷胱甘肽S转移酶等。其中,UGT介导的葡萄糖醛酸化参与多种药物的代谢过程。近年来,随着新药物理化学性质的改变,如分子量变大、亲脂性增强、结构类型更为复杂以及含有更多的氢键供体与受体等,其通过葡萄糖醛酸化途径发生Ⅱ相代谢的可能性增加[1, 2]。此外,越来越多的研究表明,某些葡糖醛酸化产物具有抗炎、抗氧化、抗肿瘤等药理学活性,是药物发挥药效的物质基础[3, 4]。在中枢神经系统,某些靶向于脑组织的药物是UGT的底物如镇痛药吗啡、抗癫痫药拉莫三嗪、抗精神病药三氟拉嗪等; 而脑组织中也存在某些UGT亚型,如UGT1A4、UGT1A6等[5, 6],因此葡萄糖醛酸化将影响这些药物的脑内代谢、分布及疗效。本文将综述UGT亚型、脑内分布、诱导和抑制,与细胞色素P450 (cytochrome P450,CYP) 和转运蛋白的相互作用等的研究进展,并举例介绍说明某些药物脑内葡萄糖醛酸化过程、产物、临床意义,旨在为靶向中枢神经系统药物的设计、应用提供研究思路。
1 UGT的脑组织亚型、分布、诱导和抑制 1.1 UGT亚型UGT为多基因酶家族,可催化多种类型化合物葡萄糖醛酸化,迄今为止,人体多达22种UGT亚型已被鉴定,分别属于UGT1A、2A、2B、3A和8A亚家族,其中UGT1A、2A和2B在外源物的生物转化中尤为活跃。已知肝脏涵盖数量最多、种类最广的UGT亚型,而肾脏和肠道只表达某些亚型,表现出明显的组织专一性。目前人脑组织UGT亚型在mRNA水平表达的报道尚不一致。Ohno等[7]认为,人脑组织中只存在UGT1A5和UGT2B17,而Court等[8]则检测到UGT1A1、1A3、1A4、1A6、1A7、1A10、2A2、2A3、2B7、2B11和2B17,Jones等[9]发现存在UGT2B家族成员,如UGT2B4、2B10、2B11、2B15和2B17。提示人脑组织UGT的表达类型可能存在个体或种族差异,而mRNA的测定结果只能间接反映酶的表达水平,尚需蛋白水平的检测加以确认。
1.2 UGT分布啮齿类动物脑组织研究表明,脑微血管内皮细胞、神经元、星型胶质细胞中均存在UGT,但表达量与活性远低于肝脏及其他器官。雄性C57BL/6J小鼠不同脑区UGT的分布对比研究发现[10],UGT基因的总表达量嗅球最高,其次为脑桥、髓质、皮层、海马等区域,纹状体和丘脑的表达量较低。Ugt1a2和Ugt1a6a两种亚型在皮层、嗅觉区、脑桥、丘脑和下丘脑的表达量占该区UGT总表达量的50%以上,为C57BL/6J小鼠脑组织的主要亚型。
1.3 UGT诱导和抑制UGT的基因调控与CYP基因家族相似,诱导和抑制CYP的调节元件同样存在于UGT基因。酶的诱导抑制是引起药物代谢性相互作用的原因之一,然而对脑组织或中枢神经系统UGT诱导和抑制的相关研究十分有限。对UGT1人源化 小鼠脑组织的mRNA水平定量测定发现,UGT1A1、1A3和1A6可在脑内表达,尼古丁可诱导脑UGT1A3的mRNA表达,脑微粒体生成鹅去氧胆酸葡萄糖醛酸苷的活性增加,但对肝脏UGT1A3无影响[11]。另有研究发现,β-萘黄酮可使大鼠小脑和海马Ugt1a6和Ugt1a7 mRNA水平升高,对底物的葡萄糖醛酸化活性也相应增加,这与β-萘黄酮激活大鼠脑内芳烃受体 (aryl hydrocarbon receptor,AhR) 信号通路有 关; 苯巴比妥也可提高大鼠纹状体和丘脑Ugt1a6和Ugt1a7 mRNA水平及酶活性,诱导机制涉及相应脑区的氧化应激和组蛋白甲基化水平的改变,从而促进Ugt1a6和Ugt1a7基因的转录激活[12, 13]。
此外,也有研究报道脑内UGT存在抑制作用。长期给予低剂量雌二醇可引起ACI小鼠海马区UGT活性降低,而SULT1A1活性升高,因此研究者认为UGT对雌二醇慢性刺激的响应机制应不同于SULT[14]。在一项体外研究中发现,甲萘醌造成的氧化应激可导致大鼠星型胶质细胞UGT酶活性快速降低,且可被N-乙酰-L-半胱氨酸所抑制,因此推测UGT酶活性的降低由活性氧直接作用于酶蛋白所引起[15]。
以上研究初步证实脑组织中的UGT可被诱导或抑制,但这种改变能否影响中枢神经系统药物的脑内代谢动力学过程及临床意义有待证实,药物代谢酶某些亚型的脑组织选择性诱导或抑制机制也需要进一步阐明。
2 UGT与CYP和转运蛋白的相互作用中枢神经系统是治疗癫痫、神经退行性疾病、神经胶质瘤等脑部疾病的主要靶位,而血脑屏障是药物进入中枢神经系统的主要屏障。促进药物有效跨 越血脑屏障进入脑组织发挥治疗作用,或阻止外周药物跨越血脑屏障进入脑组织产生不良反应一直是有待解决的问题。已知多种转运蛋白位于血脑屏障,如多药耐药蛋白1 (multidrug resistance protein 1,MDR1)、乳腺癌耐药蛋白 (breast cancer-resistance protein,BCRP)、多药耐药相关蛋白4 (multidrug resistance-associated protein4,MRP4)、L型氨基酸转运体 (large neutral amino acid transporter 1,LAT1) 和有机阴离子转运多肽 (organic anion transporting polypeptides,OATPs) 等[16]。以往的研究主要集中于转运蛋白对血脑屏障的影响,认为外排转运蛋白在限制药物进入脑组织的过程中发挥作用,并试图通过干预外排转运蛋白而改变药物的脑内分布。虽然 该尝试在动物实验中取得了良好效果,但在人体,由于临床可用的转运体抑制剂在中枢神经系统的浓 度不能达到有效的Ki值,因此药物在脑组织的增加幅度并不显著[16]。有研究者提出血脑屏障上也存在CYPs,与转运蛋白协同作用,共同调节药物的渗透性以及脑组织分布[17-19]。加之UGT在血脑屏障上的发现及逐步认识使得研究者可以初步建立起三者之间的相互关系。
已知UGT、CYP和转运蛋白均为膜结合蛋白,存在于血脑屏障和脑实质细胞的膜结构上。转运蛋白是跨膜蛋白,CYP和UGT则分别位于内质网膜的胞质侧和腔内侧,如图 1所示,这种结构的空间联系是三者产生相互作用的结构基础。CYP和UGT是体内最重要的Ⅰ相与Ⅱ相酶,二者存在明显的底物交叉性,CYP介导的Ⅰ相反应产物也多是UGT的底物,如镇痛药可待因由CYP2D6代谢生成吗啡,吗啡进一步由UGT2B7代谢为吗啡-6-葡萄糖醛酸苷 (morphine- 6-glucuronide,M6G),在上述依次进行的代谢过程中镇痛活性逐步增强。除药物代谢酶外,某些药物的葡萄糖醛酸化产物也是转运蛋白的底物,如M6G是葡萄糖转运蛋白 (glucose transporter 1,GLUT-1) 和OATP2的底物,依达拉奉的葡萄糖醛酸化产物是MRP4的底物,17β-雌二醇的葡萄糖醛酸化产物是OATP2的底物等[20-22]。尽管对UGT与转运蛋白相关性研究的报道很少,但对于MDR1和CYP3A4的研究较多。目前认为,CYP3A4和MDR1有共同的底物、抑制剂和诱导剂,MDR1可通过控制底物与CYP的接触共同影响药物代谢[23, 24]。
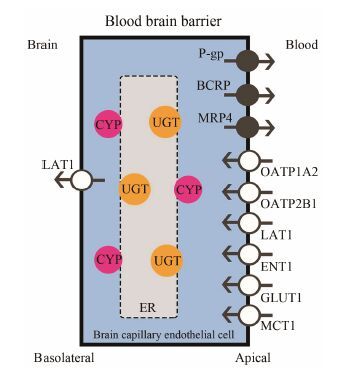
|
Figure 1 Distribution of CYPs,UGTs and transporters in blood brain barrier. P-gp: P-glycoprotein; BCRP: Breast cancer- resistance protein; MRP4: Multidrug-resistance protein 4; OATP: Organic anion transporting polypeptide; LAT1: Large neutral amino acid transporter 1; ENT1: Equilibrative nucleoside trans-porter 1; GLUT1: Glucose transporter 1; MCT1: Monocarboxy-late transporter 1 |
UGT、CYP和转运蛋白的表达调控也存在密切 联系。Sakakibara等[12]发现,作为AhR配体的β-萘 黄酮在诱导大鼠脑组织Ugt1a6和Ugt1a7的同时,也 上调脑内Cyp1a1、Cyp1a2和Cyp1b1的mRNA水平。由于以上基因均受AhR调控,且脑中也有AhR表达,因此脑内UGT与CYP存在被同一信号通路调控的 可能性。另有报道,CYP1A1表达和酶活性的增加可导致细胞内的氧化应激,使核转录因子e2相关因子 2 (nuclear factor erythroid 2-related factor 2,Nrf2) 激活,从胞浆转位至细胞核,激活Ugt1a6的转录,导致UGT1A6的表达改变[25, 26]。脑内也有Nrf2表达,因此脑内UGT表达的改变也可能是CYP改变的连锁 反应。此外,在外周组织如肝脏和肠道中,CYP3A4和MDR1在转录水平被共同调节[27, 28]。采用免疫荧光技术也可检测到癫痫患者脑血管内皮细胞和神经元上CYP3A4和MDR1的共定位与过表达,存在于脑微血管上的孕烷X受体可能介导该诱导过程[29]。
作为血脑屏障的重要组成部分,UGT、CYP和转运蛋白结构空间与功能的相关性能够确保有效而逐步地完成药物的生物转化和转运,共同抵御外源物的入侵,并通过协同与拮抗作用之间的平衡保持脑内微环境的稳态,影响药物的脑内动力学过程,从而影响药物对疾病的疗效。
3 脑内药物的葡萄糖醛酸化产物 3.1 进入中枢神经系统的方式与母药相比,葡萄糖醛酸化产物极性增加,被动扩散能力下降,在理论上不易进入脑组织。但目前已在脑组织中发现部分 已上市药物和潜在药物如吗啡、槲皮素的葡萄糖醛酸化产物,其进入中枢神经系统的方式可分为两种,即以原形透过血脑屏障,于脑内发生葡萄糖醛酸化反应; 或在外周系统发生葡萄糖醛酸化反应,以Ⅱ相结合物的形式在转运体的参与下透过血脑屏障,进入脑组织。
3.2 生物学效应脑组织中的葡萄糖醛酸化产物可产生不同的生物学效应: 因极性变大渗透性下降而滞留于细胞间隙,持续作用于受体而发挥较为持久的生物学效应; 被分解为原形药,发挥药理学活性; 因葡萄糖醛酸化而失活,使药效降低或毒性下降; 或因葡萄糖醛酸化而产生毒性等。
3.3 病理状态下的改变在病理状态下,药物在中枢神经系统的葡萄糖醛酸化过程也将发生改变。在 产生药物抵抗的头与颈部癌细胞系中,利巴韦林和阿糖胞苷的葡萄糖醛酸化作用加强,这一新的药物抵抗形式由音猬因子神经胶质瘤相关蛋白1通过稳定UGT蛋白所介导[30]。在体外培养的大鼠星型胶质细胞中加入脂多糖导致炎症反应,可诱导细胞UGT1A6的表达上调,对羟甲香豆素的葡萄糖醛酸化作用加强[31]。氧化应激状态也可引起大鼠星型胶质细胞对1-萘酚葡萄糖醛酸化活性的改变,呈现先下降后上升的现象,以及氧化应激后期UGT1A6、1A7表达的上调[6]。总之,病理状态药物的葡萄糖醛酸化水平、分布以及效应将发生改变,因此在病理模型上考察药物的代谢过程有助于了解中枢神经系统药物药效的发挥。
4 脑内葡萄糖醛酸化产物检测示例 4.1 吗啡吗啡是强效镇痛药,可通过作用于脑内的阿片受体而产生镇痛作用。吗啡在体内主要在肝 脏以葡萄糖醛酸化方式代谢,生成两种代谢产物,即吗啡-3-葡萄糖醛酸苷 (morphine-3-glucuronide,M3G) 和M6G。M3G为主要代谢产物,无止痛活性; 而M6G的生成量虽相对较小,但作为阿片受体的强效激动剂参与吗啡的镇痛过程[32, 33]。
M6G在血脑屏障的透过性显著低于吗啡[34, 35],针对M6G如何跨越血脑屏障在中枢神经系统发挥作用这一问题,相关深入研究发现,大鼠皮下分别注射吗啡和M6G后,吗啡主要分布于脑实质细胞内,而M6G则滞留于细胞外液中,其浓度是细胞内的125倍,从而可以比吗啡更加持久地作用于细胞膜上的阿片受体[36]。M6G转运机制的研究提示,M6G可通过与摄取转运蛋白GLUT-1相结合从而透过血脑屏障[37]。Bourasset等[20]的研究不仅支持上述观点,同时发现一种地高辛敏感性转运体 (可能是OATP2) 也参与M6G的主动转运。除经血脑屏障进入中枢外,吗啡在人脑组织匀浆和大鼠原代小胶质细胞中均可生成纳摩尔水平的M3G和M6G ,表明吗啡可在中枢神经系统中直接生成葡萄糖醛酸苷,导致局部M6G浓度的升高[38, 39]。虽然肝脏UGT2B参与吗啡代谢的作用已经明确,但此亚型的脑内分布和作用鲜有报道,因此吗啡在脑组织中的代谢特性以及代谢酶的亚型都有待继续研究。
4.2 拉莫三嗪拉莫三嗪为广谱抗癫痫药,易透过血脑屏障。动物与临床实验均显示,给药后其脑组织浓度高于血药浓度[40, 41]。拉莫三嗪主要作用于中枢 神经系统的神经元膜受体,通过阻断电压依赖性钠通道发挥抗癫痫作用[42]。该药物主要经肝脏UGT1A4和UGT2B7代谢,代谢产物为2-N-拉莫三嗪葡萄糖醛酸苷 (2-N-lamotrigine glucuronide,MET-1)[43]。
针对癫痫病人的临床实验发现,患者血脑屏障的内皮细胞和神经元中也有UGT1A4的表达,给予拉莫三嗪后脑内可检测到MET-1。同时,体外正常人脑微血管内皮细胞和产生药物抵抗的癫痫患者脑内皮细胞中均可检测到UGT1A4的表达,加入拉莫三嗪后可生成MET-1。与正常人脑微血管内皮细胞相比,UGT1A4在癫痫患者脑内皮细胞中的表达较高,MET-1的生成也呈比例增加[5]。上述研究提示,脑内UGT1A4参与拉莫三嗪的代谢,药物在到达靶组织之前即可在血脑屏障被代谢或在靶组织中被神经元本身代谢,从而影响其在脑组织的分布和药效的发挥,也提示癫痫病人脑内的葡萄糖醛酸酶过表达可能是产生耐药的原因之一。此外,拉莫三嗪的代谢产物是否有活性或者神经毒性,是否对药效产生影响尚有待揭示。由此可见,虽然肝脏是药物的Ⅰ相与Ⅱ代谢的主要场所,但药物在靶器官的原位代谢亦不可忽视。
4.3 白藜芦醇白藜芦醇属于多酚类化合物,富 含于葡萄、虎杖等植物。以往研究报道,白藜芦醇可透过血脑屏障进入中枢神经系统,发挥神经保护作用[44, 45]。动物与临床实验显示,该化合物可在体内经Ⅱ相代谢酶生成3-和4'-葡萄糖醛酸苷、3-和4'-硫酸酯等多个代谢产物[46, 47]。代谢场所主要为肠道、肝脏和肾脏。Sabolovic等[48]发现,白藜芦醇也可在脑组织中发生Ⅱ相代谢,但代谢速率显著低于肝脏。在脑微粒体中加入白藜芦醇,可检测到3-O-葡萄糖醛酸苷的生成,其中反式白藜芦醇的葡萄糖醛酸化速率是顺式异构体的6倍,表现出酶对底物的立体选择性。由于未检测到4'-葡萄糖醛酸苷,推测参与白藜芦醇葡萄糖醛酸化的脑内UGT亚型应与肝肾有所不同。体外培养的原代大鼠星形胶质细胞也可将白藜芦醇代谢为3-葡萄糖醛酸苷,并在脂多糖导致的炎性刺激下,加强对反式白藜芦醇的葡萄糖醛酸化作用,表现出病理状态下药物代谢水平的改变。
4.4 槲皮素槲皮素是一种广泛存在于中药材中的黄酮类化合物,在防治心血管疾病、肿瘤、神经退行性疾病方面具有潜在价值。槲皮素在血液循环中主要以Ⅱ相结合产物的形式存在,其中槲皮素-3-葡萄糖苷酸 (quercetin-3-O-β-D-glucuronide,Q3GA) 是人和大鼠血液中主要的代谢产物之一,具有抗氧化、抑制癌细胞浸润、神经保护等多种药理活性[49-51]。
Ishisaka等[52]报道,大鼠口服槲皮素后其代谢产物Q3GA可透过血脑屏障,改善脑内氧化应激,发挥神经保护作用。采用Q3GA单克隆抗体脑组织定位研究发现,正常人脑组织中Q3GA主要分布于血-脑脊液屏障的脉络丛上皮细胞,而脑缺血病人的脑组织中Q3GA主要在坏死中心区域的泡沫状巨噬细胞中堆积。Q3GA可在体外培养的巨噬细胞样细胞中被水解为槲皮素,也可进一步代谢为甲基槲皮素。其代谢机制可具体解释为,β-葡萄糖醛酸水解酶在巨噬细胞的溶酶体中大量表达,在病理条件所致酸性环境的刺激下可释放于细胞外液中,水解结合于细胞膜表面蛋白的Q3GA。体外实验还显示,Q3GA本身并无抗炎活性,而槲皮素和甲基化槲皮素有抗炎活性。以上研究提示,巨噬细胞介导的Q3GA水解反应在槲皮素脑组织抗炎过程中发挥作用[53]。因此认为,槲皮素葡萄糖醛酸苷 (可能包括其他代谢产物如硫酸结合物) 在血液中以类似前药的形式存在[53, 54]。
4.5 依法韦仑依法韦仑是抗艾滋病病毒感染的特效药物,属于非核苷逆转录酶抑制剂。以往对其代谢产物的研究主要集中于Ⅰ相代谢,即依法韦仑主要由CYP2B6代谢为8-羟基-依法韦仑,少量由CYP2A6代谢为7-羟基-依法韦仑,此外还有微量的依法韦仑- N-葡萄糖醛酸苷的生成。近期临床研究发现,患者血液循环中Ⅰ相代谢产物的含量较低,而Ⅱ相代谢产物8-羟基-依法韦仑葡萄糖醛酸苷、7-羟基-依法韦仑葡萄糖醛酸苷、8-羟基-依法韦仑硫酸酯与依法韦仑的水平相当或更高。脑脊液中亦可检测到依法韦仑及其代谢产物,且以Ⅱ相代谢物为主,其中8-羟基-依法韦仑葡萄糖醛酸苷含量高于依法韦仑[55]。依法韦仑的Ⅱ相代谢产物如何跨越血脑屏障进入中枢神经系统,是否有转运蛋白和原位代谢的参与以及代谢物在脑组织不同区域的分布情况有待进一步阐明。
依法韦仑常因中枢神经系统不良反应而中断治疗。采用原代神经元进行的体外研究显示,0.1 μmol·L-1依法韦仑和7-羟基依法韦仑、0.01 μmol·L-1 8-羟基 依法韦仑具有神经毒性。采用依法韦仑治疗的艾滋 病毒感染者脑脊液中,8-羟基依法韦仑的浓度已达到上述毒性水平[56]。因此,相关研究人员提出依法韦仑的Ⅱ相代谢产物对中枢神经系统是否具有毒性也应予以研究。
5 结语药物的脑内代谢过程正被逐步认识。脑组织中存在UGT的表达,虽然表达量与活性较低,但其参与药物脑内分布与代谢的功能不容忽视。药物的葡萄糖醛酸化产物也可通过血脑屏障进入中枢发挥生物学活性,或增强疗效、或终止药理效应、或产生毒性,在局部对脑内微环境的平衡状态进行精细调控,从而影响药物对疾病的疗效。目前这一领域的研究仍有待深入进行,如UGT亚型在脑组织的准确定位及定性定量评价,其脑组织分布特异性与肝、肾、胃肠道等组织的差异,内外源物、遗传变异以及病理状态对脑组织UGT含量和活性的影响以及脑组织UGT能 否引起神经系统药物相互作用等。值得注意的是,由于血脑屏障的低通透性和代谢酶的弱表达,单一因素可能很难产生有临床意义的脑内药物动力学改变,对各种代谢酶和转运体之间相互作用的深入认识,应是设计靶向于中枢神经系统理想药物的前提。
| [1] | Walters WP, Green J, Weiss JR, et al. What do medicinal chemists actually make? A 50-year retrospective[J]. J Med Chem , 2011, 54 :6405–6416. DOI:10.1021/jm200504p |
| [2] | Rowland A, Miners JO, Mackenzie PI, et al. The UDP-glucuronosyltransferases: their role in drug metabolism and detoxification[J]. Int J Biochem Cell Biol , 2013, 45 :1121–1132. DOI:10.1016/j.biocel.2013.02.019 |
| [3] | Wang ML, Xia YL, Yang ML, et al. Advances in study on biosynthsis of O-glucuronides[J]. Chin Tradit Herb Drugs (中草药) , 2015, 46 :1065–1073. |
| [4] | Tang H, Tang LL, Xu RJ, et al. Phase Ⅱ metabolites of several flavonoids and their pharmacological activities[J]. Chin J New Drugs (中国新药杂志) , 2012, 21 :144–150. |
| [5] | Ghosh C, Hossain M, Puvenna V, et al. Expression and functional relevance of UGT1A4 in a cohort of human drug-resistant epileptic brains[J]. Epilepsia , 2013, 54 :1562–1570. DOI:10.1111/epi.12318 |
| [6] | Gradinaru D, Minn AL, Artur Y, et al. Effect of oxidative stress on UDP-glucuronosyltransferases in rat astrocytes[J]. Toxicol Lett , 2012, 213 :316–324. DOI:10.1016/j.toxlet.2012.07.014 |
| [7] | Ohno S, Nakajin S. Determination of mRNA expression of human UDP-glucuronosyltransferases and application for localization in various human tissues by real-time reverse transcriptase-polymerase chain reaction[J]. Drug Metab Dispos , 2009, 37 :32–40. DOI:10.1124/dmd.108.023598 |
| [8] | Court MH, Zhang X, Ding X, et al. Quantitative distribution of mRNAs encoding the 19 human UDP-glucuronosyltransferase enzymes in 26 adult and 3 fetal tissues[J]. Xenobiotica , 2012, 42 :266–277. DOI:10.3109/00498254.2011.618954 |
| [9] | Jones NR, Lazarus P. UGT2B gene expression analysis in multiple tobacco carcinogen-targeted tissues[J]. Drug Metab Dispos , 2014, 42 :529–536. DOI:10.1124/dmd.113.054718 |
| [10] | Heydel JM, Holsztynska EJ, Legendre A, et al. UDP-glucuronosyltransferases (UGTs) in neuro-olfactory tissues: expression, regulation, and function[J]. Drug Metab Rev , 2010, 42 :74–97. DOI:10.3109/03602530903208363 |
| [11] | Sakamoto M, Itoh T, Tukey RH, et al. Nicotine regulates the expression of UDP-glucuronosyltransferase (UGT) in humanized UGT 1 mouse brain[J]. Drug Metab Pharma-cokinet , 2015, 30 :269–275. DOI:10.1016/j.dmpk.2015.04.004 |
| [12] | Sakakibara Y, Katoh M, Kondo Y, et al. Effects of β-naphthoflavone on Ugt1a6 and Ugt1a7 expression in rat brain[J]. Biol Pharm Bull , 2016, 39 :78–83. DOI:10.1248/bpb.b15-00578 |
| [13] | Sakakibara Y, Katoh M, Kondo Y, et al. Effects of phenobar-bital on expression of UDP-glucuronosyltransferase 1a6 and 1a7 in rat brain[J]. Drug Metab Dispos , 2016, 44 :370–377. DOI:10.1124/dmd.115.067439 |
| [14] | Stakhiv TM, Mesia-Vela S, Kauffman FC. Phase Ⅱ antioxi-dant enzyme activities in brain of male and female ACI rats treated chronically with estradiol[J]. Brain Res , 2006, 1104 :80–91. DOI:10.1016/j.brainres.2006.05.093 |
| [15] | Heurtaux T, Benani A, Bianchi A, et al. Redox state alteration modulates astrocyte glucuronidation[J]. Free Radic Biol Med , 2004, 37 :1051–1063. DOI:10.1016/j.freeradbiomed.2004.06.020 |
| [16] | Kalvass JC, Polli JW, Bourdet DL, et al. Why clinical modulation of efflux transport at the human blood-brain barrier is unlikely: the ITC evidence-based position[J]. Clin Pharmacol Ther , 2013, 94 :80–94. DOI:10.1038/clpt.2013.34 |
| [17] | Dutheil F, Jacob A, Dauchy S, et al. ABC transporters and cytochromes P450 in the human central nervous system: influence on brain pharmacokinetics and contribution to neurodegenerative disorders[J]. Expert Opin Drug Metab Toxicol , 2010, 6 :1161–1174. DOI:10.1517/17425255.2010.510832 |
| [18] | DeclevesX, Jacob A, Yousif S, et al. Interplay of drug metabolizing CYP450 enzymes and ABC transporters in the blood-brain barrier[J]. Curr Drug Metab , 2011, 12 :732–741. DOI:10.2174/138920011798357024 |
| [19] | Ghosh C, Puvenna V, Gonzalez-Martinez J, et al. Blood-brain barrier P450 enzymes and multidrug transporters in drug resistance: a synergistic role in neurological diseases[J]. Curr Drug Metab , 2011, 12 :742–749. DOI:10.2174/138920011798357051 |
| [20] | Bourasset F, Cisternino S, Temsamani J, et al. Evidence for an active transport of morphine-6-β-D-glucuronide but not P-glycoprotein-mediated at the blood-brain barrier[J]. J Neurochem , 2003, 22 :1423–1430. |
| [21] | Mizuno N, Takahashi T, Kusuhara H, et al. Evaluation of the role of breast cancer resistance protein (BCRP/ABCG2) and multidrug resistance-associated protein 4(MRP4/ABCC4) in the urinary excretion of sulfate and glucuronide metabolites of edaravone (MCI-186; 3-methyl-1-phenyl-2-pyrazolin-5-one)[J]. Drug Metab Dispos , 2007, 35 :2045–2052. DOI:10.1124/dmd.107.016352 |
| [22] | Noé B, Hagenbuch B, Stieger B, et al. Isolation of a multispecific organic anion and cardiac glycoside transporter from rat brain[J]. Proc Natl Acad Sci U S A , 1997, 94 :10346–10350. DOI:10.1073/pnas.94.19.10346 |
| [23] | Yasuda K, Lan LB, Sanglard D, et al. Interaction of cytochrome P4503A inhibitors with P-glycoprotein[J]. J Pharmacol Exp Ther , 2002, 303 :323–332. DOI:10.1124/jpet.102.037549 |
| [24] | Pal D, Mitra AK. MDR-and CYP3A4-mediated drug-drug interactions[J]. J Neuroimmune Pharmacol , 2006, 1 :323–339. DOI:10.1007/s11481-006-9034-2 |
| [25] | Morel Y, Mermod N, Barouki R. An autoregulatory loop controlling CYP1A1 gene expression: role of H2O2 and NFI[J]. Mol Cell Biol , 1999, 19 :6825–6832. DOI:10.1128/MCB.19.10.6825 |
| [26] | Shertzer HG, Nebert DW, Puga A, et al. Dioxin causes a sustained oxidative stress response in the mouse[J]. Biochem Biophys Res Commun , 1998, 253 :44–48. DOI:10.1006/bbrc.1998.9753 |
| [27] | Cerveny L, Svecova L, Anzenbacherova E, et al. Valproic acid induces CYP3A4 and MDR1 gene expression by activation of constitutive androstane receptor and pregnane X receptor pathways[J]. Drug Metab Dispos , 2007, 35 :1032–1041. DOI:10.1124/dmd.106.014456 |
| [28] | Chen Y, Tang Y, Wang MT, et al. Human pregnane X receptor and resistance to chemotherapy in prostate cancer[J]. Cancer Res , 2007, 67 :10361–10367. DOI:10.1158/0008-5472.CAN-06-4758 |
| [29] | Ghosh C, Marchi N, Desai NK, et al. Cellular localization and functional significance of CYP3A4 in the human epileptic brain[J]. Epilepsia , 2011, 52 :562–571. DOI:10.1111/j.1528-1167.2010.02956.x |
| [30] | Zahreddine HA, Culjkovic-Kraljacic B, Assouline S, et al. The sonic hedgehog factor GLI1 imparts drug resistance through inducible glucuronidation[J]. Nature , 2014, 511 :90–93. DOI:10.1038/nature13283 |
| [31] | Heurtaux T, Benani A, Moulin D, et al. Induction of UGT1A6 isoform by inflammatory conditions in rat astrocytes[J]. Neuropharmacology , 2006, 50 :317–328. DOI:10.1016/j.neuropharm.2005.09.007 |
| [32] | Frolich N, Dees C, Paetz C, et al. Distinct pharmacological properties of morphine metabolites at Gi protein and β-ar-restin signaling pathways activated by the human mu-opioid receptor[J]. Biochem Pharmacol , 2011, 81 :1248–1254. DOI:10.1016/j.bcp.2011.03.001 |
| [33] | Klimas R, Mikus G. Morphine-6-glucuronide is responsible for the analgesic effect after morphine administration: a quantitative review of morphine, morphine-6-glucuronide, and morphine-3-glucuronide[J]. Br J Anaesth , 2014, 113 :935–944. DOI:10.1093/bja/aeu186 |
| [34] | Bouw MR, Xie R, Tunblad K, et al. Blood-brain barrier transport and brain distribution of morphine-6-glucuronide in relation to the antinociceptive effect in rats-pharmacokinetic/pharmacodynamic modelling[J]. Br J Pharmacol , 2001, 134 :1796–1804. DOI:10.1038/sj.bjp.0704406 |
| [35] | Yoshimura H, Ida S, Oguri K, et al. Biochemical basis for analgesic activity of morphine-6-glucuronide. I. Penetration of morphine-6-glucuronide in the brain of rats[J]. Biochem Pharmacol , 1973, 22 :1423–1430. DOI:10.1016/0006-2952(73)90320-1 |
| [36] | Stain-Texier F, Boschi G, Sandouk P, et al. Elevated concen-trations of morphine 6-beta-D-glucuronide in brain extracellu-lar fluid despite low blood-brain barrier permeability[J]. Br J Pharmacol , 1999, 128 :917–924. DOI:10.1038/sj.bjp.0702873 |
| [37] | Polt R, Porreca F, Szabo LZ, et al. Glycopeptide encephalin analogues produce analgesia in mice: evidence for penetration of the blood-brain barrier[J]. Proc Natl Acad Sci U S A , 1994, 91 :7114–7118. DOI:10.1073/pnas.91.15.7114 |
| [38] | Yamada H, Ishii K, Ishii Y, et al. Formation of highly analgesic morphine-6-glucuronide following physiologic concentration of morphine in human brain[J]. J Toxicol Sci , 2003, 28 :395–401. DOI:10.2131/jts.28.395 |
| [39] | Togna AR, Antonilli L, Dovizio M, et al. In vitro morphine metabolism by rat microglia[J]. Neuropharmacology , 2013, 75 :391–398. DOI:10.1016/j.neuropharm.2013.08.019 |
| [40] | Meyer FP, Banditt P, Schubert A, et al. Lamotrigine concen-trations in human serum, brain tissue, and tumor tissue[J]. Epilepsia , 1999, 40 :68–73. DOI:10.1111/epi.1999.40.issue-1 |
| [41] | Walker MC, Tong X, Perry H, et al. Comparison of serum, cerebrospinal fluid and brain extracellular fluid pharmacoki-netics of lamotrigine[J]. Br J Pharmacol , 2000, 130 :242–248. DOI:10.1038/sj.bjp.0703337 |
| [42] | Leach MJ, Marden CM, Miller AA. Pharmacological studies on lamotrigine, a novel potential antiepileptic drug: Ⅱ. Neurochemical studies on the mechanism of action[J]. Epilepsia , 1986, 27 :490–497. DOI:10.1111/epi.1986.27.issue-5 |
| [43] | Rowland A, Elliot DJ, Williams JA, et al. In vitro characteri-zation of lamotrigine N2-glucuronidation and the lamotrigine-valproic acid interaction[J]. Drug Metab Dispos , 2006, 34 :1055–1062. |
| [44] | Ramalingam P, Ko YT. Validated LC-MS/MS method for simultaneous quantification of resveratrol levels in mouse plasma and brain and its application to pharmacokinetic and brain distribution studies[J]. J Pharm Biomed Anal , 2016, 119 :71–75. DOI:10.1016/j.jpba.2015.11.026 |
| [45] | Quincozes-Santos A, Bobermin LD, Tramontina AC, et al. Oxidative stress mediated by NMDA, AMPA/KA channels in acute hippocampal slices: neuroprotective effect of resveratrol[J]. Toxicol In Vitro , 2014, 28 :544–551. DOI:10.1016/j.tiv.2013.12.021 |
| [46] | Aumont V, Krisa S, Battaglia E, et al. Regioselective and stereospecific glucuronidation of trans-and cis-resveratrol in human[J]. Arch Biochem Biophys , 2001, 393 :281–289. DOI:10.1006/abbi.2001.2496 |
| [47] | Sharan S, Iwuchukwu OF, Canney DJ, et al. In vivo-formed versus preformed metabolite kinetics of trans-resveratrol-3-sulfate and trans-resveratrol-3-glucuronide[J]. Drug Metab Dispos , 2012, 40 :1993–2001. DOI:10.1124/dmd.112.046417 |
| [48] | Sabolovic N, Heurtaux T, Humbert AC, et al. Cis-and trans-resveratrol areglucuronidated in rat brain, olfactory mucosa and cultured astrocytes[J]. Pharmacology , 2007, 80 :185–192. DOI:10.1159/000104149 |
| [49] | Shirai M, Yamanishi R, Moon JH, et al. Effect of quercetin and its conjugated metabolite on the hydrogen peroxide-induced intracellular production of reactive oxygen species in mouse fibroblasts[J]. Biosci Biotechnol Biochem , 2002, 66 :1015–1021. DOI:10.1271/bbb.66.1015 |
| [50] | Yamazaki S, Miyoshi N, Kawabata K, et al. Quercetin-3-O-glucuronide inhibits noradrenaline-promoted invasion of MDA-MB-231 human breast cancer cells by blocking b2-adrenergic signaling[J]. Arch Biochem Biophys , 2014, 557 :18–27. DOI:10.1016/j.abb.2014.05.030 |
| [51] | Ho L, Ferruzzi MG, Janle EM, et al. Identification of brain-targeted bioactive dietary quercetin-3-O-glucuronide as a novel intervention for Alzheimer's disease[J]. FASEB J , 2013, 27 :769–781. DOI:10.1096/fj.12-212118 |
| [52] | Ishisaka A, Ichikawa S, Sakakibara H, et al. Accumulation of orally administered quercetin in brain tissue and its antioxi-dative effects in rats[J]. Free Radical Biol Med , 2011, 51 :1329–1336. DOI:10.1016/j.freeradbiomed.2011.06.017 |
| [53] | Ishisaka A, Mukai R, Terao J, et al. Specific localization of quercetin-3-O-glucuronide in human brain[J]. Arch Bio-chem Biophys , 2014, 557 :11–17. DOI:10.1016/j.abb.2014.05.025 |
| [54] | Terao J, Murota K, Kawai Y, et al. Conjugated quercetin glucuronides as bioactive metabolites and precursors of aglycone in vivo[J]. Food Funct , 2011, 2 :11–17. DOI:10.1039/C0FO00106F |
| [55] | Aouri M, Barcelo C, Ternon B, et al. In vivo profiling and distribution of known and novel phase I and phase Ⅱ metabolites of efavirenz in plasma, urine, and cerebrospinal fluid[J]. Drug Metab Dispos , 2016, 44 :151–161. |
| [56] | Tovar-y-Romo LB, Bumpus NN, Pomerantz D, et al. Den-dritic spine injury induced by the 8-hydroxy metabolite of efavirenz[J]. J Pharmacol Exp Ther , 2012, 343 :696–703. DOI:10.1124/jpet.112.195701 |
 2016, Vol. 51
2016, Vol. 51


