2. 安徽中医药大学药学院, 安徽 合肥 230038 ;
3. 河南中医学院, 河南 郑州 450016
2. College of Pharmacy, Anhui University of Traditional Chinese Medicine, Hefei 230038, China ;
3. Henan University of Traditional Chinese Medicine, Zhengzhou 450016, China
茉莉酸(JA)及其衍生物茉莉酸甲酯(MeJA)统称为茉莉酸类物质(jasmonates, JAs), 是一类在植物界中广泛存在的由脂类自由基氧化而来的脂氧化物。JAs作为一种重要的内源性信号分子, 在植物防御生物和非生物胁迫反应及植物的生长和发育过程中扮演着重要的角色[1]。MeJA这种小分子脂类化合物具有挥发性, 可以通过空气传播而引起或激活未受损组织、器官和相邻植物间的防御反应[2], 所以在茉莉酸信号的传导过程中MeJA比JA更高效。从JA到MeJA只需要通过甲基化就能迅速转化而来, 而茉莉酸甲基转移酶(jasmonic acid carboxyl methyltransferase, JMT)是催化JA甲基化衍生为MeJA的关键酶[3]。
甲基转移酶类家族是近年来发现的在植物体内普遍存在的一类新家族, 常见的如JMT、水杨酸甲基转移酶(salicylic acid carboxyl methyltransferase, SAMT)和苯甲酸甲基转移酶(benzoic acid carboxyl methyltransferase, BAMT)等, 一些最新的研究成果表明该家族的酶能够以S-adenosyl-L-methionine为甲基供体将底物中的羧酸类基团作为受体从而催化形成小分子的甲酯类化合物, 这些化合物可作为激活植物体内抵抗外界侵食、调节细胞周期、诱导防御反应的信号分子[4, 5]。研究发现将JMT在马铃薯(Solanum tuberosum)中过表达, 会引起转基因的马铃薯块茎变大, 产量增加[6]; 在人参(Panax ginseng)中过表达, 会刺激人参根的生长及次生代谢产物人参皂苷的异质化等[7]。Qi等[8]还发现水稻(Oryza sativa)中的茉莉酸甲基转移酶(OsJMT1)可以通过改变JA水平及相关的代谢产物, 从而调控植物发育, 激活抵御食草动物侵食等防御反应。由此可见JMT在植物次生代谢产物的生物合成途径中起着非常重要的调控作用。
近年来研究表明, 丹参中的丹参酮和丹酚酸类物质的生物合成同样受JAs物质调节和控制, Ma等[9]发现丹参酮生物合成途径相关的40个基因大多在MeJA诱导24 h后表达量增加。Wang等[10]研究表明MeJA可以诱导丹参毛状根中的丹参酮类物质积累增加。Gao等[11]通过酵母和银离子诱导丹参毛状根转录组分析发现, 茉莉酸甲基转移酶基因在酵母和银离子诱导12 h后表达量大幅度增加, 且与丹参酮生物合成途径中相关基因的表达量增加呈正相关, 说明JMT在诱导丹参酮生物合成中起重要作用。
本研究将已克隆的丹参SmJMT cDNA构建到原核表达载体pGEX-4T-1上, 转化大肠杆菌BL21 (DE3), 选取阳性菌斑鉴定, 进行诱导表达, 并对其诱导条件进一步优化, 采用超声破碎的方式获得粗蛋白液, 利用Glutatione Agarose Beads进行亲和纯化, Western blotting验证SmJMT1在大肠杆菌中表达成功, Q-TOF检测分析表明, SmJMT1属于甲基转移酶亚家族成员。丹参SmJMT1基因在大肠杆菌中的成功表达纯化, 为探究该基因对JA生物合成途径及JA对植物次生代谢调控奠定了一定基础。
材料与方法材料 植物RNA提取试剂盒购自北京华越洋生物科技有限公司; 10 mmol·L-1 dNTP、RiboLock RNase Inhibitor、RevertAid Reverse Transcriptase购自赛默飞世尔科技(中国)公司; 原核表达载体pGEX-4T-1为本实验室所保存; T4 DNA连接酶购自Promega公司; 转化菌株E. coli DH5α和表达宿主细胞BL21 (DE3)购自北京全式金生物技术有限公司; 异丙基硫代半乳糖苷(IPTG)、氨苄青霉素(Amp)购自Sigma公司; 限制性核酸内切酶、预染蛋白Marker购自NEB公司; 原核表达所用的非预染蛋白Marker购自Fermentas公司; Glutathione Agarose Beads购自GE公司; GST-Tag单克隆抗体、HRP-羊抗小鼠二抗及ECL超敏发光液购自华兴博创公司; 其他试剂均为分析纯; 引物合成由上海生工生物工程股份有限公司完成。
pGEX-4T-SmJMT1原核表达载体的构建和鉴定 通过分析丹参转录组数据库序列, 设计带限制性内切酶位点的引物(上游引物: 5'-cgcggatccATGGAAG TTCAAGTGCTTC, 下游引物: 3'-acgcgtcgacATCCTC TCCGGATCACTG)。用植物RNA提取试剂盒提取RNA, 通过3' RACE获得丹参的cDNA模板, 克隆获得SmJMT1基因。以pGEM-T-SmJMT1质粒为模板进行扩增, 回收PCR产物, 用BamHⅠ和SalⅠ对PCR产物和pGEX-4T-1分别进行双酶切, 切胶回收目的片段与线性化pGEX-4T-1载体片段, 用T4 DNA连接酶22 ℃、15 min连接。将连接产物转化E. coli DH5α, 涂布在含Amp的LB固体培养基上37 ℃培养过夜。挑取单克隆进行菌液PCR检测。涉及到的实验技术均参考文献[12, 13]。用BamHⅠ和XhoⅠ双酶切鉴定分析, 1.5%的琼脂糖电泳检测插入片段的大小, 并对重组质粒pGEX-4T-SmJMT1进行测序鉴定。
重组蛋白SmJMT1的原核表达及条件优化 挑取阳性重组菌的单菌落, 接种于2 mL含Amp的LB液体培养基中, 37 ℃活化过夜后, 按照1:50比例接种, 250 r·min-1振摇至生长对数期A600约0.8, 加入终浓度为0.4 mmol·L-1的IPTG于20 ℃诱导表达。设置诱导时间、诱导温度、IPTG浓度及诱导时宿主菌的A600 4个因素, 保持其中的3个因素不变, 分别考察单一因素变化对重组蛋白SmJMT1表达的影响, 从而确定获得重组蛋白的最佳方法。诱导表达结束后, 取1 mL菌液, 4 ℃、12 000 r·min-1离心5 min, 收集菌体; 用去离子水洗涤两次; 加入60 μL 2 × SDS上样缓冲液, 煮沸10 min; 4 ℃、12 000 r·min-1离心1 min; 取上清10 μL上样。配制15%的分离胶和5%的浓缩胶, 进行SDS-PAGE凝胶电泳检测分析[14]。
重组蛋白SmJMT1的纯化 根据上述优化条件诱导重组蛋白SmJMT1表达, 收集菌体低温超声破碎提取粗蛋白, 取上清液, 用Glutathione Agarose Beads纯化粗蛋白, 用10 kDa的浓缩柱(Millipore公司)浓缩纯化后的样品, 最后进行SDS-PAGE凝胶电泳检测, 并在595 nm处利用Bradford方法检测其浓度。
重组蛋白SmJMT1的蛋白印迹 纯化蛋白经SDS-PAGE凝胶电泳分离后, 通过湿转法转到PVDF膜上, 转化完全的膜, 用100%的甲醇漂洗2次, 然后将膜转移至5%脱脂牛奶中, 孵育1 h, PBS-T含0.3% Tween 200冲洗3次; 5%脱脂牛奶加一抗的混合液孵育1 h, 接着用PBS-T冲洗3次; 再用5%脱脂牛奶加HRP标记的羊抗小鼠二抗孵育1 h, 最后用PBS-T漂洗3次。吸干水分后, 用ECL超敏发光液孵育, 进行显影。
重组蛋白SmJMT1的二级质谱分析[15] 纯化蛋白经SDS-PAGE凝胶电泳分离后, 考马斯亮蓝染色, 脱色, 选取目的条带切胶, 回收至1.5 mL的离心管中, 加ddH2O清洗10 min, 重复1次, 加入消化脱色液清洗10 min, 重复1次, 加入乙腈脱水至胶粒完全变白, 真空抽干乙腈, 加入10 mmol·L-1二硫苏糖醇孵育1 h, 加入碘乙酰胺孵育45 min, 加入25 mmol·L-1碳酸氢铵清洗10 min, 重复1次, 加入乙腈脱水至胶粒完全变白, 真空抽干乙腈, 加入酶储液消化过夜, 加0.1%的甲酸终止消化, 取10 μL的样品上机, 使用质谱仪MicrOTOF-QII (Bruker Daltonics)检测。
Q-TOF的条件:液相: prominence nano 2D (Shimazhu); 柱料: C18, 5 μm, 150 A (Eprogen); A液: 0.1%甲酸水溶液, B液: 0.1%甲酸乙腈溶液; 梯度洗脱(0~4 min 5% B, 4~30 min 5%~40% B, 30~35 min 40%~80% B, 35~45 min 80% B, 45~45.1 min 5% B, 45.1~60 min 5% B), 流速: 400 nL·min-1。质谱仪器: MicroTOF-QII (Bruker Daltonics); 数据采集软件: Bruker Daltonics MicrOTOF control; MS-MS扫描范围: 50~2 200 m/z, 碰撞气体:氩气; 毛细管电压: 1 500 V; 干燥气体温度: 150 ℃。
数据库检索:数据分析软件: Data Analysis Soft ware; 数据搜索: Mascot search engine version 2.3.01;提取质谱数据, 利用Data Analysis软件标峰后, 进行MASCOT搜索, 获取结果。
结果与分析 1 pGEX-4T-SmJMT1原核表达载体的构建用分别带有限制性内切酶BamHⅠ和SalⅠ的SmJMT基因上下游引物, 扩增丹参SmJMT1 cDNA (GenBank登录号: KX433005), PCR扩增产物经1%琼脂糖凝胶电泳分离, 在1 000 bp附近有一条清晰的条带(图 1a), 与预期的目的条带1 083 bp大小一致。
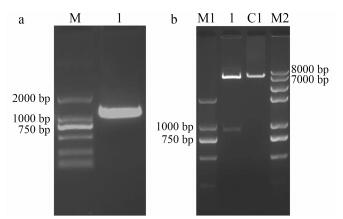
|
Figure 1 a: The construction of pGEX-4T-SmJMT1 expression vector. M: DNA Marker 2000; 1: SmJMT1 PCR production. b: pGEX-4T-SmJMT1 and pGEX-4T-1 digested with BamHⅠ and XhoⅠ. M1: DNA Marker 2000; M2: 2 kb DNA Marker; 1: pGEX-4T-SmJMT1; C1: pGEX-4T-1 |
用BamHⅠ和SalⅠ对带有酶切位点的PCR产物和原核表达载体pGEX-4T-1分别进行双酶切, 切胶回收目的片段与线性化pGEX-4T-1载体片段, 用T4 DNA连接酶连接, 转化E. coli DH5α, 挑单克隆菌体摇菌, 进行PCR检测, 提取阳性重组质粒。
将重组质粒pGEX-4T-SmJMT1用BamHⅠ和XhoⅠ进行双酶切鉴定, 出现两条带, 泳道1中第二条条带的大小约1 000 bp (图 1b), 与SmJMT1基因的大小相近。测序结果显示与目的基因的序列一致, 说明已经成功将SmJMT1基因构建到原核表达载体pGEX-4T-1上。
2 重组蛋白SmJMT1的诱导表达将构建好的pGEX-4T-SmJMT1质粒转化到表达菌株BL21 (DE3), 加入适宜浓度的IPTG诱导表达。取1.0 mL的诱导菌液, 离心弃上清, 加入60 μL的2 × SDS Loading Buffer混匀煮沸10 min, 冰浴2 min, 离心, 取上清5 μL点样进行SDS-PAGE凝胶电泳分析。在约66 kDa处出现目的条带, SmJMT1基因的cDNA编码361个氨基酸, 推测蛋白分子质量为40.43 kDa, 而原核表达载体pGEX-4T-1的GST-Tag标签的大小为26 kDa, 所以重组蛋白大小约为66.43 kDa。但是阴性对照空载体pGEX-4T-1诱导表达后在26 kDa有条带, 而在66.43 kDa处没有条带出现(图 2)。以上结果表明含有SmJMT1基因的重组质粒, 在大肠杆菌中已成功表达。
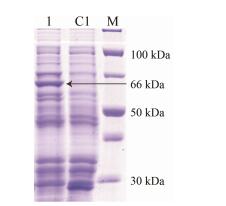
|
Figure 2 SDS-PAGE of analysis for recombinant SmJMT1 protein expression. M: Protein Marker; C1: pGEX-4T-1; 1: SmJMT1 |
改变取样的时间, 保持诱导温度20 ℃, IPTG的诱导浓度0.2 mmol·L-1及诱导前菌液的浓度不变, 探究诱导时间对SmJMT1蛋白表达的影响, 在加入IPTG诱导后不同时间点0、2、4、6、8、10、12 h分别取样, 结果显示诱导时间对该蛋白的表达有较为明显的影响, 在2 h时该蛋白已有很明显的表达, 其表达量随着时间增加而呈现逐渐增加的趋势, 在8 h时蛋白的表达量达到最大, 随后蛋白的表达量有减少的趋势(图 3)。
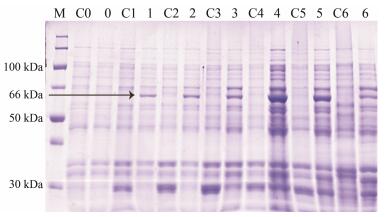
|
Figure 3 SDS-PAGE of analysis for recombinant SmJMT1 protein expression in different induction times. M: Protein Marker; C0-C6: pGEX-4T-1 with induction 0, 2, 4, 6, 8, 10, 12 h, respectively; 0-6: SmJMT1 with induction 0, 2, 4, 6, 8, 10, 12 h, respectively |
改变诱导温度, 保持诱导时间8 h, IPTG的诱导浓度0.2 mmol·L-1及诱导前菌液的浓度不变, 探究诱导温度对SmJMT1蛋白表达的影响, 即在20、25、30、37 ℃分别诱导蛋白表达, 观察到诱导温度对蛋白表达的影响不明显, 在这4个不同的温度下重组蛋白均可以得以很好地表达, 而低温20 ℃的情况下该蛋白的表达量相对较好(图 4)。
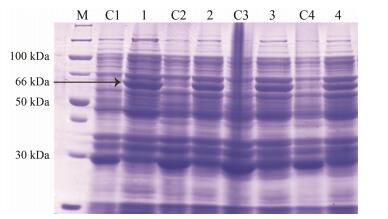
|
Figure 4 SDS-PAGE of analysis for recombinant SmJMT1 protein expression in different induction temperatures. M: Protein Marker; C1-C4: pGEX-4T-1 at 20 ℃, 25 ℃, 30 ℃, 37 ℃, respectively; 1-4: SmJMT1 at 20 ℃, 25 ℃, 30 ℃, 37 ℃, respectively |
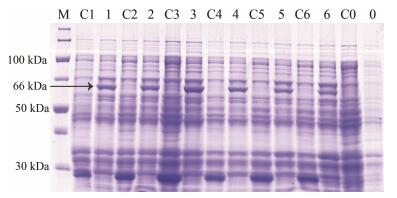
改变IPTG的浓度, 保持诱导温度20 ℃, 诱导时间8 h及诱导前菌液的浓度不变, 探究IPTG浓度对SmJMT1蛋白表达的影响, 加入IPTG的终浓度分别为0.1、0.2、0.4、0.6、0.8、1.0 mmol·L-1, 从实验结果可以观察到IPTG在低浓度0.1 mmol·L-1时, SmJMT1蛋白的表达已经很明显, 随着IPTG浓度的增加其蛋白的表达量呈现先增后减的趋势, 当终浓度为0.4 mmol·L-1时蛋白的表达量最高(图 5)。
|
Figure 5 SDS-PAGE of analysis for recombinant SmJMT1 protein expression in different IPTG induction concentrations. M: Protein Marker; C0-C6: pGEX-4T-1 induced in 0.1, 0.2, 0.4, 0.6, 0.8, 1.0 mmol·L-1, respectively; 0-6: SmJMT1 induced in 0.1, 0.2, 0.4, 0.6, 0.8, 1.0 mmol·L-1, respectively |
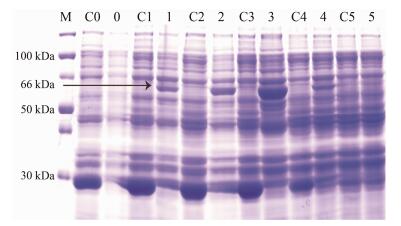
依据3.1~3.3的实验结果, 保持诱导温度20 ℃, 诱导时间8 h, IPTG的诱导浓度0.4 mmol·L-1不变, 将过夜培养的菌液按照1:50的比例转接后, 分别在0、1、1.5、2、4、6 h测其在600 nm处的吸光度, 并且添加IPTG诱导表达, 从实验结果可以观察到不同的诱导前菌液浓度对SmJMT1蛋白的表达量有很明显的影响。刚转接0 h时测得其菌液的A600仅0.180, 此时添加IPTG诱导该蛋白几乎不表达, 但随着培养时间的增加, 随后添加IPTG诱导, 其蛋白的表达量也呈现先增后减的趋势, 尤其是转接2 h时添加IPTG蛋白的表达最明显, 此时A600是0.885, 当转接1、1.5、4、6 h时测得其菌液的A600分别为0.255、0.406、1.936、2.236, 这表明诱导前菌液的A600在0.8附近时蛋白的表达量较高(图 6)。
|
Figure 6 SDS-PAGE of analysis for recombinant SmJMT1 protein expression in different culture densities before IPTG induction. M: Protein Marker; C0-C5: pGEX-4T-1 was diluted at 0, 1, 1.5, 2, 4, 6 h, respectively; 0-5: SmJMT1 was diluted at 0, 1, 1.5, 2, 4, 6 h, respectively |
根据上述优化条件, 诱导适量的菌液, 收集菌体, 加入一定量的PBS缓冲液洗涤2~3遍, 将获得的菌体称重, 按1:5比例加入PBS缓冲液重悬菌体, 低温超声裂解破碎至菌体呈透明状, 离心, 取上清液进行SDS-PAGE凝胶电泳检测, 发现该蛋白在上清液中表达, 表明SmJMT1重组蛋白可溶。
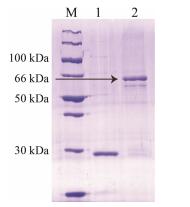
对上述所提取的蛋白, 用Glutathione Agarose Beads纯化, 用10 kDa的浓缩柱浓缩纯化后的蛋白, 然后进行SDS-PAGE凝胶电泳检测和浓度测量, 结果如图 7所示, 可见纯化后的杂蛋白含量明显减少, 说明纯化效果良好。
|
Figure 7 SDS-PAGE of analysis for the purified recombinant SmJMT1 protein. M: Protein Marker; 1: pGEX-4T-1; 2: SmJMT1 |
取上述纯化的蛋白, 进行SDS-PAGE凝胶电泳分离, 接着冰浴转膜, 用GST-Tag一抗和HRP-标记的羊抗小鼠二抗孵育后, 显影, 如图所示(图 8), anti-GST抗体可以特异性地识别重组蛋白SmJMT1, 说明SmJMT1蛋白在大肠杆菌中已成功的表达。

|
Figure 8 Western blotting analysis of the recombinant SmJMT1 with anti-GST antibody. M: Protein Marker; 1: pGEX-4T-1; 2: SmJMT1 |
切取SDS-PAGE凝胶电泳约66 kDa附近的胶粒, 通过Q-TOF检测, 提取质谱数据, 利用Data Analysis软件标峰后, 进行MASCOT搜索(Mascot search)。参考Q-TOF数据分析的文献[16], 按表 1和表 2的参数筛选检索结果, 发现数据库中存在两个已知的JMT的相似序列, 丝氨酸羟甲基转移酶(serine hydroxymethyltransferase)和氨甲基转移酶(ami nomethyltransferase), 序列号为A8GHZ4和A8GIS1。
| Table 1 The information of protein comparison |
| Table 2 The information of peptide comparison |
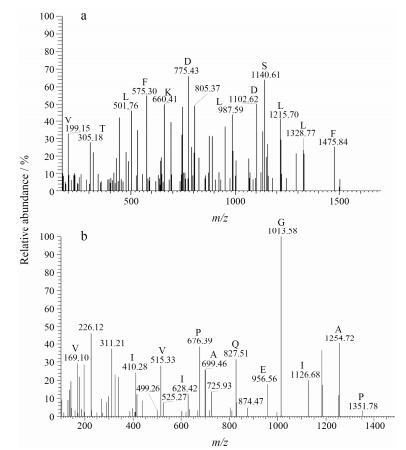
通过评估离子得分(ions score), 选取与其相匹配的肽段谱图(图 9)。从NCBI数据库中下载其氨基酸序列, Blast分析比对, 发现SmJMT1的氨基酸序列与其相似, 均属于甲基转移酶这一亚家族, 具有相同的活性位点。由此推测, 其可能具有相似的功能, 能够催化JA甲基化转化为MeJA。
|
Figure 9 Product-ion spectra of peptide using Q-TOF collision energy stepping dissociation method. a: Query of 5 250; b: Query of 2 761 |
2001年, Seo等[3]首次从拟南芥中克隆到了JMT基因, 并研究了该基因的功能, 结果表明JMT不仅可以催化JA形成MeJA, 同时还能接收或响应一些由外界刺激而引起的局部或系统信号, 而MeJA自身就是一种植物防御的内源性信号分子, 与植物体内的防御反应密切相关, 所以JMT是公认的植物体内茉莉酸生物合成过程的关键酶。目前已在许多植物中克隆得到了JMT基因, 并且在马铃薯[6]、人参[7]、水稻[8]、番茄(Solanum lycopersicon)[17]、欧洲大叶杨(Populus trichocarpa) [18]等几种植物体内过表达JMT基因, 结果表明, JMT可通过正反馈或负反馈来调控植物体内的次生代谢过程。
大肠杆菌作为外源基因表达的受体菌, 均具备遗传背景清楚、遗传稳定、基因克隆表达系统成熟完善、培养简单、繁殖迅速、操作方便等优势, 但其融合蛋白表达过程还受多种因素的影响, 如载体的类型、菌株的状态、诱导的条件等。在本次实验原核表达的载体构建过程中, 同时构建了pET-28a、pET-32a和pGEX-4T-1三种载体, 并转入到了E. coli BL21 (DE3)和E. coli Transetta (DE3)两种菌株中, 筛选了适合SmJMT1蛋白表达的载体和菌株, 结果发现将SmJMT1基因构建到pGEX-4T-1的载体上, 转化E. coli BL21 (DE3)是获得可溶性SmJMT1蛋白最有效的方法。
研究表明, 诱导温度对SmJMT1蛋白表达量的影响不是很明显, 但是为了在低温诱导下增加蛋白的溶解性, 最终选择20 ℃诱导[19, 20]。随着诱导时间的增加, 蛋白的表达量呈现先增后减的趋势, 在8 h时达到最大, 8 h后减弱但趋势并不明显, 这可能是由于蛋白表达局部浓度过高, 抑制了后续菌体自身的生长, 甚至使部分蛋白降解。IPTG的浓度对其表达量也有一定的影响, 相关文献[21, 22]报道IPTG在0.1~0.2 mmol·L-1时蛋白表达量相对较高, 本次实验过程中却发现IPTG浓度在0.4 mmol·L-1时, SmJMT1蛋白的表达量最高。诱导前菌液的浓度对蛋白的表达影响也较为明显, 菌液浓度过低或过高都不利于蛋白的大量表达[23]。这可能是因为菌体只有在对数生长期, 其生长状态才最好, 有利于蛋白的表达, 在停滞期和衰老期菌体自身的生长状态受限制, 所以蛋白的表达量明显较低。
获得SmJMT1可溶性蛋白是蛋白纯化的关键, 本次实验过程中采用低温超声破碎技术, 4 ℃离心, 在上清液中获得了SmJMT1蛋白。该蛋白质经纯化、浓缩、SDS-PAGE凝胶电泳检测, 结果如图 7所示, 在66 kDa附近存在一条单一且明显的目的条带, 但Western blotting结果(图 8)在66和26 kDa附近分别有SmJMT1、pGEX-4T-1的特异性条带, 与此同时还出现了其他与抗体非特异性结合的条带。这可能是由于Glutathione Agarose Beads受自身结构限制, 与目的蛋白结合的同时, 也会与重组蛋白菌液中的其他蛋白相结合, 想要获得完全纯化的单一蛋白, 后续还需要过蛋白凝胶阻滞分离柱。但由于这些非目的蛋白浓度较低, 条带不明显, 未影响实验结果, 所以未进行分离。
Mascot搜索是通过评估离子得分来鉴定其是否与数据库中特定的肽段离子光谱相匹配。本次数据分析时依据P值理论, 离子得分 > 34即可认为此肽段序列可鉴别, 反之则认为P < 0.05, 序列之间只存在广泛的同源性[24]。因此, 选取了实际检测到的肽段分子质量与期望分子质量和计算分子质量之间质量偏差小、肽段得分高、可信度评估好、肽段排名为1的特异性肽段, 通过a-型、b-型或y-型离子模型与数据库中已存在的离子光谱相比对来识别离子碎片, 探索其与已发现的蛋白质之间的关系或确认其是否为新的蛋白序列[25]。
丹参茉莉酸甲基转移酶(SmJMT1)在大肠杆菌中成功表达, 为进一步深入研究茉莉酸信号通路与丹参酮类化合物等次生代谢产物的生物合成相关性奠定了一定基础。
| [1] | Wasternack C. Jasmonates:an update on biosynthesis, signal transduction and action in plant stress response, growth and development[J]. Ann Bot , 2007, 100 :681–697. DOI:10.1093/aob/mcm079 |
| [2] | Tamogami S, Rakwal R, Agrawal GK. Interplant communication:airborne methyl jasmonate is essentially converted into JA and JA-Ile activating jasmonate signaling pathway and VOCs emission[J]. Biochem Biophys Res Commun , 2008, 376 :723–727. DOI:10.1016/j.bbrc.2008.09.069 |
| [3] | Seo HS, Song JT, Cheong JJ, et al. Jasmonic acid carboxyl methyltransferase:a key enzyme for jasmonate-regulated plant responses[J]. Proc Natl Acad Sci U S A , 2001, 98 :4788–4793. DOI:10.1073/pnas.081557298 |
| [4] | Frezza M, Pozzato G, Chiesa L, et al. Reversal of intrahepatic cholestasis of pregnancy in women after high dose S-adenosyl-L-methionine administration[J]. Hepatology , 1984, 4 :274–278. DOI:10.1002/hep.v4:2 |
| [5] | Zubieta C, Ross JR, Koscheski P, et al. Structural basis for substrate recognition in the salicylic acid carboxyl methyltransferase family[J]. Plant Cell , 2003, 15 :1704–1716. DOI:10.1105/tpc.014548 |
| [6] | Sohn HB, Han YL, Ju SS, et al. Overexpression of jasmonic acid carboxyl methyltransferase increases tuber yield and size in transgenic potato[J]. Plant Biotechnol Rep , 2011, 5 :27–34. DOI:10.1007/s11816-010-0153-0 |
| [7] | Kim YS, Han JY, Lim S, et al. Overexpressing Arabidopsis jasmonic acid carboxyl methyltransferase (AtJMT) results in stimulation of root growth and ginsenoside heterogeneity in Panax ginseng[J]. Plant Omics , 2012, 5 :28–32. |
| [8] | Qi JF, Li JC, Han X, et al. Jasmonic acid carboxyl methyltransferase regulates development and herbivory-induced defense response in rice[J]. J Integr Plant Biol , 2015, 58 :564–576. |
| [9] | Ma YM, Yuan LC, Wu B, et al. Genome-wide identification and characterization of novel genes involved in terpenoid biosynthesis in Salvia miltiorrhiza[J]. J Exp Bot , 2012, 63 :2809–2823. DOI:10.1093/jxb/err466 |
| [10] | Wang XY, Cui GH, Huang LQ, et al. Effects of methyl jasmonat on accumulation and release of tanshinones in suspension cultures of Salvia miltiorrhiza hairy root[J]. China J Chin Mater Med (中国中药杂志) , 2007, 32 :300–302. |
| [11] | Gao W, Sun HX, Xiao HB, et al. Combining metabolomics and transcriptomics to characterize tanshinone biosynthesis in Sa lvia miltiorrhiza[J]. BMC Genomics , 2014, 15 :1–14. DOI:10.1186/1471-2164-15-1 |
| [12] | Li DH, Xi H, Yu XB, et al. Molecular cloning and characterization of a subtilisin-like protease from Arabidopsis thaliana[J]. Gen Mol Res , 2015, 14 :16535–16545. DOI:10.4238/2015.December.9.25 |
| [13] | Wang WY, Li J, Wei QK, et al. Cloning, expression, purification and identification of Toxoplasma gondii SAG2 gene in Escherichia coli[J]. Chin J Schistosomiasis Control (中国血吸虫病防治杂志) , 2015, 27 :170–173. |
| [14] | Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning, a Laboratory Manual[M]. New York: Cold Spring Harbor Laboratory Press, 1989 : 16 . |
| [15] | Cottrell JS, London U. Probability-based protein identification by searching sequence databases using mass spectrometry data[J]. Electrophoresis , 1999, 20 :3551–3567. DOI:10.1002/(ISSN)1522-2683 |
| [16] | Hinneburg H, Stavenhagen K, Schweiger-Hufnagel U, et al. The art of destruction:optimizing collision energies in quadrupoletime of flight (Q-TOF) instruments for glycopeptide-based glycoproteomics[J]. J Am Soc Mass Spectrom , 2016, 27 :1–13. |
| [17] | Tieman D, Zeigler M, Schmelz E, et al. Functional analysis of a tomato salicylic acid methyl transferase and its role in synthesis of the flavor volatile methyl salicylate[J]. Plant J , 2010, 62 :113–123. DOI:10.1111/j.1365-313X.2010.04128.x |
| [18] | Zhao N, Yao J, Chaiprasongsuk M, et al. Molecular and biochemical characterization of the jasmonic acid methyltransferase gene from black cottonwood (Populus trichocarpa)[J]. Phytochemistry , 2013, 94 :74–81. DOI:10.1016/j.phytochem.2013.06.014 |
| [19] | Schein CH, Noteborn MHM. Formation of soluble recombinant proteins in Escherichia coli is favored by lower growth temperature[J]. Nat Biotechnol , 1988, 6 :291–294. DOI:10.1038/nbt0388-291 |
| [20] | San-Miguel T, Pérez-Bermúdez P, Gavidia I. Production of soluble eukaryotic recombinant proteins in E.coli is favoured in early log-phase cultures induced at low temperature[J]. Springer Plus , 2013, 2 :1–4. DOI:10.1186/2193-1801-2-1 |
| [21] | Yasukawa T, Kanei-Ishii C, Maekawa T, et al. Increase of solubility of foreign proteins in Escherichia coli by coproduction of the bacterial thioredoxin[J]. J Biol Chem , 1995, 270 :25328–25331. DOI:10.1074/jbc.270.43.25328 |
| [22] | Zhang TT, Ye BP. Progress in study on refolding and renaturation of inclusion body[J]. Pharm Biotechnol (药物生物技术) , 2007, 14 :306–309. |
| [23] | Baneyx F. Recombinant protein expression in Escherichia coli[J]. Curr Opin Biotechnol , 1999, 10 :411–421. DOI:10.1016/S0958-1669(99)00003-8 |
| [24] | Ding QX, Xiong SX, Liu J, et al. Mass changes in peptide mass fingerprint caused by various in vitro chemical modifications[J]. Bull Acad Mil Med Sci (军事医学科学院院刊) , 2006, 30 :6–10. |
| [25] | Eng JK, McCormack AL, Yates JR. An approach to correlate tandem mass spectral data of peptides with amino acid sequences in a protein database[J]. J Am Soc Mass Spectrom , 1994, 5 :976–989. DOI:10.1016/1044-0305(94)80016-2 |
 2016, Vol. 51
2016, Vol. 51


