珍珠明目液作为临床上最常用的眼科用药之一, 具有清肝、明目和止痛等功效。可用于早期老年性白内障、慢性结膜炎和视疲劳等[1]。目前上市的给药剂型是滴眼液, 由于眼睛存在特殊的保护机制, 如眨眼反射、泪液分泌和鼻泪管排出等, 使滴眼液只有极少量的药物发挥药效[2]。
温度敏感型原位凝胶(thermosensitive in situ gel)是利用高分子材料对环境温度的响应, 在给药部位发生相转变, 从溶液态转变为凝胶[3], 用于眼部时具有显著的优点:室温下为流体, 黏度较低, 分剂量准确; 与黏膜组织亲和力强, 在用药部位滞留时间长; 患者对制剂的顺应性好[4]。泊洛沙姆(poloxamer)因其无色、透明、安全性以及胶凝特性, 现已广泛用作眼用温敏型高分子凝胶材料[5]。但由于其相转变温度完全依赖浓度, 单独使用时浓度较大易引起眼部刺激。为了降低泊洛沙姆浓度, 提高流变行为和胶凝特性, 本文以一定比例的泊洛沙姆同系物为凝胶基质, 加入少量生物黏附性聚合物卡波姆934 (Carbopol 934), 采用星点设计-效应面法[6]优化处方, 对最优处方进行流变学性质评价, 同时考察凝胶的溶蚀和释药行为、离体角膜透过性及滞留时间。
材料与方法仪器 DF-101S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司); PHS-3D酸度计(上海雷磁仪器厂); SHA-C (数显)水浴恒温振荡器(常州国华电气有限公司); UV-9100紫外分光光度计(北京瑞利分析仪器公司); 卧式透皮仪(沈阳天美达科学仪器仪器有限公司); AR2000ex流变仪(美国TA公司)。
药品与试剂 泊洛沙姆407 (poloxamer 407, P407), 泊洛沙姆188 (poloxamer 188, P188) (德国BASF公司); 卡波姆934 (美国BFGoodrich公司); 珍珠明目滴眼液(武汉五景药业有限公司, 每瓶装15 mL); 珍珠水解液(pearl hydrolyzate, 湖州珍露药业有限公司, 批号140801);冰片(株洲松本药业有限公司, 批号130909);羟苯乙酯(湖南尔康制药股份有限公司, 批号103620130901);罗丹明B (天津博迪化工股份有限公司, 生物染色剂); 去离子水(实验室自制)。
实验动物 日本大耳白兔, 体重2.5~3.0 kg, 沈阳药科大学实验动物中心提供, 许可证号SKXK (辽) 2014-0002。
温敏凝胶的制备 采用冷溶法制备泊洛沙姆凝胶[7]。于4 ℃水浴搅拌下, 将P407、P188缓慢加入到溶有Carbopol 934的去离子水中至溶解, 体系于4 ℃冰箱放置24 h充分溶胀, 消泡后, 用0.1 mol·L-1 NaOH溶液调节pH, 得空白温敏凝胶。制备含药凝胶时, 先将珍珠水解液1% (v/v)、冰片0.1% (w/v)及羟苯乙酯0.05% (w/v)等成分溶解于去离子水中, 再按上述方法制备。
星点设计-效应面法优化处方
试验与拟合 采用星点设计法, 选择对评价指标影响较大的3个因素作为考察因素, 即凝胶基质P188 (x1)、Carbopol 934 (x2)的百分含量及系统的pH (x3)。以黏度(y1)、模拟泪液(simulated tear fluid, STF)混合前的相转变温度T1 (y2)及混合后的相转变温度T2 (y3)为评价指标。采用Design-Expert 8.0.6统计软件设计试验并优化处方, 对试验结果进行二次多项式方程拟合, 即得评价指标与自变量之间的函数关系。
处方优化与预测 根据效应面图和二次多项式回归方程求得各指标最优时的各因素量, 即得最优处方。将最优处方代入二次多项式拟合模型求得各指标的预测值, 再根据此处方制备温敏凝胶, 测定黏度和泪液混合前后的相转变温度, 计算理论值与测定值的相对偏差(RE)。
流体流型 比较贮存条件(25 ℃)和模拟生理环境下(35.5 ℃, 原位凝胶与STF按体积比40:7混合)的黏流性质。采用剪切速率模式, 剪切速率(γ)范围0.1~120 s-1, 应变幅度为0.1%, 测定γ与切变应力(τ)、黏度(η)的关系。
剪切应力扫描 选用40 mm平行板转子, 温度35.5 ℃、频率(frequency) 1 Hz、应力0.1~400 Pa, 将原位凝胶与STF按体积比为40:7混合, 取混合后的样品适量加至测试盘, 在动态振荡模式下测定样品的弹性模量G′ (storage modulus)、黏性模量G″ (loss modulus)及相角(δ)随应力的变化。
频率扫描 选用40 mm平行板转子, 温度35.5 ℃、应力10 Pa、频率0.1~10 Hz, 取STF混合后的样品适量加至测试盘, 在动态振荡模式下测定样品的G′、G″随频率的变化。
相转变温度 选用40 mm平行板转子, 应力10 Pa, 振荡频率1 Hz, 升温范围: 15~45 ℃, 升温速率1 ℃·min-1。分别取STF混合前、后的样品适量加至测试盘, 在动态振荡模式下测定样品G′、G″随温度(T)的变化。
胶凝时间 选用40 mm平行板转子, 应力10 Pa、应变幅度0.1%, 频率1 Hz、取STF混合后的样品适量加至测试盘, 将测试盘温度从20 ℃迅速升高到35.5 ℃, 温度达到35.5 ℃时立即开始测定, 并且恒温2 min。在动态振荡模式下测定样品的G′、G″随时间(t)的变化。
体外溶蚀及释药机制 采用无膜溶出模型(membrane-less models)模拟眼部泪液不断浸润和眼睑持续剪切环境下凝胶的溶蚀和药物释放行为[8]。取STF混合前、后的珍珠明目眼用原位凝胶各1 mL加入已称重的离心管中, 记录初始重量, 置于35 ℃恒温水浴振荡器中平衡10 min。应沿壁小心加入35 ℃的STF 2 mL作为释放介质, 避免将凝胶表面破坏。恒温振荡(100 r·min-1)并于20、40、60、80和100 min取出全部释放介质, 并迅速称量离心管重量, 如此反复操作, 直至剩余凝胶重量不足20%。相邻时间点的重量差为此时间段的凝胶溶蚀量, 以凝胶累积溶蚀量(Qc)对时间作图, 得到凝胶经时溶蚀曲线, 以茚三酮显色法将药物中总氨基酸衍生化, 使用紫外可见分光光度计, 检测波长为570 nm, 测定氨基酸衍生物的吸光度。以药物累积释放量(Qr)对时间作图, 得到药物经时释放曲线。将STF混合前与混合后的凝胶各时间点凝胶溶蚀百分率对药物释放百分率作图, 得线性回归方程。
离体角膜透过性 将日本大耳白兔新鲜离体角膜小心固定在卧式透皮仪上, 分别在接受池中加入新鲜配制的人工房水液4 mL, 在供给池中分别加入供试品溶液和市售滴眼液各4 mL, 超级恒温水浴控制温度在35 ℃, 分别于20、40、60、80、100、120、150、180和210 min从接受池中取出接受介质3 mL, 随后立即补充同体积同温度的新鲜GBR溶液。以茚三酮显色法将药物中总氨基酸衍生化, 使用紫外可见分光光度计, 检测波长为570 nm, 测定氨基酸衍生物的吸光度值。单位面积药物累积透过量(Qn)计算公式如(1), 以Qn对时间作图, 得到药物经时透过曲线。并考察市售制剂与自制凝胶的表观渗透系数(Papp)[9], 计算公式如(2);稳态流量(Jss)、时滞(lag-time, tlag)等系数的差异。
| $ Q = {V_0}\left[{{C_n} + \frac{V}{{{V_0}}}\sum {{C_i}} } \right] = {V_0}{C_0} + V\sum {{C_i}} $ | (1) |
其中, Cn为t时刻药物的测定浓度, Ci为t时刻前的测定浓度, V0为接受池中液体体积, V为取样体积。
| $ {P_{{\rm{app}}}} = \frac{{\Delta Q}}{{\Delta t \cdot {C_0} \cdot A \cdot 60}} $ | (2) |
其中, Papp为表观渗透系数(cm·s-1); C0为供给池初始药物质量浓度; A为有效透过面积; ΔQ/Δt由累积透过量-时间曲线稳态部分的斜率求得。
滞留时间 以鸡蛋壳膜模拟眼角膜, 以洗脱法测定物质黏膜滞留时间[10]。具体方法为:将新鲜剥离的蛋壳膜小心铺展于椭圆形容器表面上, 置于37 ℃水浴杯中, 蛋壳膜应浸在水浴中, 只暴露顶端部分(模拟眼部环境)。取水、市售滴眼液、自制凝胶(均含有10 mg·mL-1罗丹明B) 40 μL滴于蛋壳膜表面中心处, 35 ℃泪液冲洗速度为40 μL·min-1。直至蛋壳膜表面颜色褪尽, 于各时间点取出水浴杯中溶液, 并立即补加相同体积恒温水。采用紫外可见分光光度计, 检测波长为550 nm, 测定各时间点溶液中罗丹明B的吸光度值, 计算累积滞留率达到70%和90%时的时间。
结果与讨论 1 星点设计-效应面法优化处方 1.1 试验与拟合对试验结果进行二次多项式方程拟合, 即得评价指标与自变量之间的函数关系为:
| $ \begin{array}{l} {y_1} = 0.44 - 0.063{x_1} + 0.098{x_2} - 0.044{x_1}{x_2} - 0.035x_1^2\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\left( {{R^2} = 0.8403, P < 0.0001} \right) \end{array} $ |
| $ \begin{array}{l} {y_2} = 28.12 + 2.55{x_1} + 0.35{x_2} + 0.38{x_3} + 0.18{x_1}{x_2} + \\ \;\;\;\;\;\;\;0.39x_1^2 + 0.32x_2^2 + 0.46x_3^2\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\left( {{R^2} = 0.9956, P < 0.0001} \right) \end{array} $ |
| $ \begin{array}{l} {y_3} = 40.49 + 3.02{x_1} + 1.02{x_2} + 0.91{x_3} - 0.89{x_1}{x_2} - \\ \;\;\;\;\;\;0.52{x_1}{x_3} + 0.89{x_2}{x_3} - 0.85x_1^2\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\left( {{R^2} = 0.9863, P < 0.0001} \right) \end{array} $ |
综合评价后最佳处方为: P407 23% (w/v)、P188 1%、Carbopol 934 0.03%和pH 6.25。各评价指标的理论值与测定值的偏差见表 1。结果表明, 理论值与测定值偏差较小, 说明本试验得到的拟合方程可以较好地描述因素与指标的关系, 可用于预测和优化珍珠明目眼用温度敏感型原位凝胶的处方。
| Table 1 Comparison of the observed and predicted values of the response variables of the thermosensitive in situ gel prepared under the optimum formulation. y1: Viscosity; y2: Sol-gel transition temperature; y3: Sol-gel transition temperature of in situ gel diluted with simulated tear fluid (STF); RE: Relative deviation |
γ与τ、η的关系见图 1a, b。在25 ℃时, 该样品的τ随γ增加而发生先迅速升高后趋于平缓, 其η随γ增大基本保持不变, 属于牛顿流体。在35.5 ℃时, 该样品的τ不再随γ增加而发生线性改变, 其η随γ增大而减小, 具有剪切变稀的性能, 属于假塑性流体[11]。
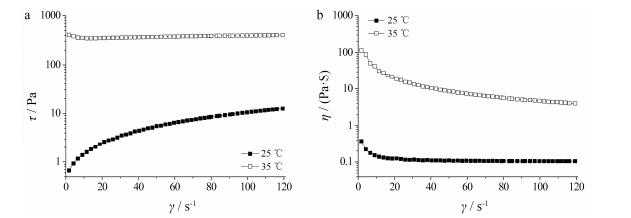
|
Figure 1 Shear stress (a) and viscosity (b) profiles of the optimized formulation at room temperature (25 ℃) without dilution by STF and at pre-corneal temperature (35.5 ℃) with dilution by STF |
凝胶体系的这种流变学特性不仅有利于延长凝胶在眼部接触时间, 提高药物的治疗效果, 还可以减轻患者的异物感, 提高患者的顺应性、舒适性。
2.2 剪切应力扫描样品G′、G″及δ随τ变化结果如图 2可知, 应力小于125 Pa时, G′ > G″, δ < 45°, 表现出稳定的凝胶性质; 应力大于125 Pa, G′ > G″, δ > 45°, 样品有黏度稀化的特点, 但仍以G′为主, 属于凝胶向溶胶转变的过程; 而应力超过130 Pa时, G′ < G″, δ为90°, 表现为液体特征。
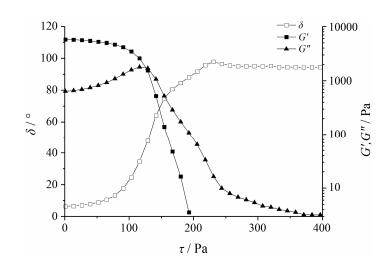
|
Figure 2 Storage modulus (G′), loss modulus (G″) and dental degree (δ) versus shrear stress of in situ gel at pre-corneal temperature (35.5 ℃) with dilution by STF |
弹性模量是固体材料的重要特性, 弹性模量越大, 凝胶强度越大, 适当的强度可以保证在体内的成型性[12]。弹性模量与黏性模量的变化, 是泊洛沙姆内部结构发生变化所致, 当温度升高至相转变温度时, 亲水性聚氧乙烯嵌段和疏水性聚丙乙烯嵌段相互作用形成球状胶束, 胶束间紧密堆砌和缠结[13], 固态特征显著; 当剪切应力增加至最大可耐受应力时, 凝胶内部结构被破坏, 即表现为液态[14]。说明凝胶最大可耐受应力为130 Pa, 凝胶强度适宜。
2.3 频率扫描样品G′、G″随频率的变化结果见图 3, 在振动频率为0.1~10 Hz内, G′明显高于G″且二者均保持恒定, δ维持在较低水平, 表现出同时具备黏性和弹性的介于液体和固体间的半固体凝胶的流变学性质。
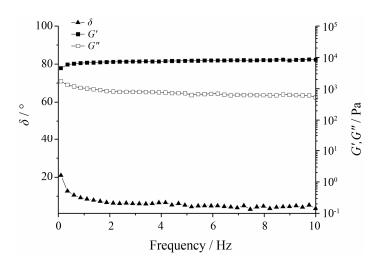
|
Figure 3 Rheological properties of in situ gel diluted with STF as a function of frequency at 35.5 ℃ |
样品G′、G″随温度的变化结果见图 4, 随着温度的升高, 凝胶存在3种状态, 分别为G′ < G″, 黏性液体性质占主导, 体系为液态; G′=G″, 由液体开始转变为半固体凝胶状态; G′ > G″, 体系完成由液体到半固体凝胶状态的转变, 进入平台期, 弹性固体性质占主导。通常将固定频率下G′和G″与温度曲线中二者的交点确定为相转变温度(Tsol-gel)[15]。结果可见, 最优处方的相转变温度为27.2 ℃, 高于室温; 泪液混合后的相转变温度为35 ℃, 相转变温度适宜, 可作为眼用原位凝胶制剂的基质。
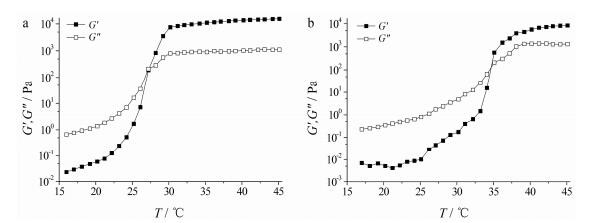
|
Figure 4 The sol-gel transition temperature of in situ gel formulation with (a) or without (b) diluted with STF |
样品G′、G″随时间的变化结果见图 5, 在35.5 ℃条件下, 经过泪液混合的样品可以在13 s内发生胶凝, 胶凝时间适宜。胶凝时间是原位凝胶制剂的重要参数, 适宜的胶凝时间既可保证凝胶顺利地铺展, 又可较快胶凝, 防止其被泪液冲刷, 延长眼部滞留时间[16]。
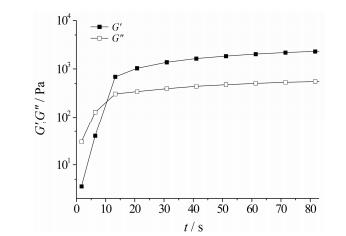
|
Figure 5 Gelation time of in situ gel at pre-corneal temperature (35.5 ℃) with dilution by STF |
凝胶经时溶蚀曲线如图 6a, 药物经时释放曲线如图 6b。由图可见, STF混合后凝胶溶蚀和药物释放较混合前加快, 累积溶蚀量和累积释放量与时间均呈现良好的线性关系, 显示零级动力学特征。将STF混合前与混合后的凝胶各时间点凝胶溶蚀百分率对药物释放百分率作图, 最小二乘法拟合得到线性回归方程, 其斜率分别为0.960 5、1.055, 均约等于1, 表明药物的释放由凝胶溶蚀控制。
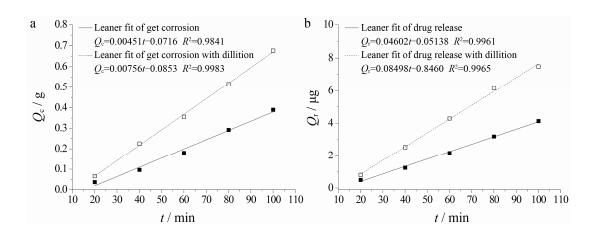
|
Figure 6 The corrosion (a) and drug release (b) profiles of gel at pre-corneal temperature (35.5 ℃) |
泊洛沙姆温度敏感原位凝胶的溶蚀及药物释放是水分子由凝胶表面逐渐进入内部使其溶解的过程[17]。小分子药物包裹于紧密的凝胶内部, 限制药物的释放; 经过泪液混合后, 胶束未紧密堆积, 结构相对疏松, 水分子更容易进入, 使凝胶表面缠结和堆积的胶束扩散进入释放介质的速度加快, 即凝胶的溶蚀速率增加, 药物释放加快。
4 离体角膜透过性药物经时透过曲线如图 7可见, 药物累积透过量与时间呈现良好的线性关系, 显示零级动力学释药特征, 市售滴眼液的累积透过量略高于凝胶组。
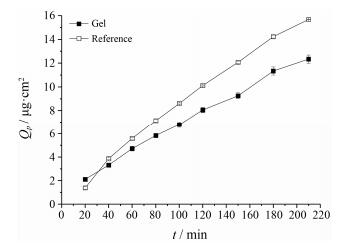
|
Figure 7 The permeation of gel through the isolated cornea in contrast with commercial reference |
表观渗透系数及稳态流量等系数见表 2。与市售滴眼液相比, 眼用凝胶的角膜透过性较低, 这可能与药物被包埋于载体中, 瞬时浓度没有市售滴眼液高有关。滴眼液中药物释放快, 但每次滴眼一般只能作用1~2 min既被消除; 凝胶在眼部释放较慢, 但滞留时间长, 药物在角膜滞留时间越长, 透过角膜进入眼房水中的药物浓度越高, 治疗效果越好, 从另一方面也说明延长眼部滞留时间的重要性。
| Table 2 Pharmacokinetic parameters for in vitro transcorneal transit of in situ gel and commercial reference |
计算溶液中罗丹明B的累积滞留率达到70%和90%时的时间, 结果如图 8。因蛋壳膜与眼角膜形状类似, 组成成分相近, 因此选择蛋壳膜进行体外滞留时间评价。由于实验时模型药物混合倍数较大, 已达不到检测限, 而罗丹明B具有颜色鲜亮、溶解度大和检测方法简便等优点, 为了便于实验观察和检测, 选择罗丹明B代替模型药物。一般滴眼剂为直接作用于眼部的外用液体制剂, 滴眼后约有70%药液直接从眼部溢出, 若出现眨眼反射可导致90%药液损失[18], 因此本文以70%和90%作为评判标准。

|
Figure 8 Retention time histograms of gel contrast with water and reference. A: Retention percentage at 70%; B: Retention percentage at 90% |
其中, 给予水和市售滴眼液后, 其在鸡蛋壳膜上停留时间较短, 1 min后70%药液从鸡蛋壳膜上流下, 2 min后罗丹明B浓度达90%;眼用原位凝胶滴入蛋壳膜上可形成块状凝胶, 不断给予泪液冲洗后仍可见持久、完整的凝胶膜, 7 min后从鸡蛋壳膜上流下70%药液; 10 min时, 罗丹明B浓度达90%, 与市售滴眼液相比, 原位凝胶明显延长了罗丹明B标记物在鸡蛋壳膜的滞留时间, 是市售滴眼液滞留时间的7倍(以70%计)或5倍(以90%计)。由此可以假设, 原位凝胶以液体形式给药后, 在眼部可形成半固体凝胶药物储库, 可延长药物的作用时间。
结论本实验建立的数学模型预测性良好, 所制备的珍珠明目眼用温敏凝胶具有适宜的相转变温度、胶凝时间、流变学性质和良好的膜透过性, 在患者顺应性提高的前提下, 可延长药物作用时间, 有效控制药物释放。
| [1] | Almeida H, Amaral MH, Lobão P, et al. In situ gelling systems:a strategy to improve the bioavailability of ophthalmic pharmaceutical formulations[J]. Drug Discov Today , 2014, 19 :400–412. DOI:10.1016/j.drudis.2013.10.001 |
| [2] | Li Z, Li HY, Wang CF, et al. Sodium dodecyl sulfate/β-cyclodextrin vesicles embedded in chitosan gel for insulin delivery with pH-selective release[J]. Acta Pharm Sin B , 2016, 6 :344–351. DOI:10.1016/j.apsb.2016.03.003 |
| [3] | Bonacucina G, Cespi M, Mencarelli G, et al. Thermosensitive self-assembling block copolymers as drug delivery systems[J]. Polymers , 2011, 3 :779–811. DOI:10.3390/polym3020779 |
| [4] | Du YK, Shinde UP, Yeon B, et al. Recent progress of in situ fo rmed gels for biomedical applications[J]. Prog Polym Sci , 2013, 38 :672–701. DOI:10.1016/j.progpolymsci.2012.08.002 |
| [5] | Li JF, Gao MY, Wang HM, et al. Optimization and in vitro characterization of resveratrol-loaded poloxamer 403/407 mixed micelles[J]. Acta Pharm Sin (药学学报) , 2015, 50 :1045–1051. |
| [6] | Li Z, Cao JX, Li HR, et al. Self-assembled drug delivery system based on low-molecular-weight bis-amide organogelator:synthesis, properties and in vivo evaluation[J]. Drug Deliv , 2016 . DOI:10.3109/10717544.2016.1157841 |
| [7] | Lu CC, Liu MJ, Fu HL, et al. Novel thermosensitive in situ, gel based on poloxamer for uterus delivery[J]. Eur J Pharm Sci , 2015, 77 :24–28. DOI:10.1016/j.ejps.2015.05.014 |
| [8] | James HP, John R, Alex A, et al. Smart polymers for the controlled delivery of drugs-a concise overview[J]. Acta Pharm Sin B , 2014, 4 :120–127. DOI:10.1016/j.apsb.2014.02.005 |
| [9] | Karavasili C, Fatouros DG. Smart materials:in situ gelfo rming systems for nasal delivery[J]. Drug Discov Today , 2016, 21 :157–166. DOI:10.1016/j.drudis.2015.10.016 |
| [10] | Tiyaboonchai W, Rodleang I, Ounaroon A. Mucoadhesivepolyethylenimine-dextran sulfate nanoparticles containing Punicagranatum peel extract as a novel sustained-release antimicrobial[J]. Pharm Dev Technol , 2015, 20 :426–432. DOI:10.3109/10837450.2013.879884 |
| [11] | Nagaprabha P, Bhattacharya S. Rheological characterisation of sol-gel phenomenon and stability of green gram and foxtail millet flour gels[J]. LWT-Food Sci Technol , 2016, 65 :917–923. DOI:10.1016/j.lwt.2015.08.066 |
| [12] | Hu J, Chen DW, Quan DQ. Rheological properties of poloxamer 407 aqueous solutions[J]. Acta Pharm Sin (药学学报) , 2011, 46 :227–231. |
| [13] | Rencber S, Karavana SY, Şenyiğit ZA, et al. Mucoadhesive in situ gel formulation for vaginal delivery of clotrimazole:fo rmulation, preparation, and in vitro/in vivo evaluation[J]. Pharm Dev Technol , 2016 . DOI:10.3109/10837450.2016.1163385 |
| [14] | Alam MM, Sugiyama Y, Watanabe K, et al. Phase behavior and rheology of oil-swollen micellar cubic phase and gel emulsions in nonionic surfactant systems[J]. J Colloid Interface Sci , 2010, 341 :267–272. DOI:10.1016/j.jcis.2009.09.047 |
| [15] | Hou YL, Li HR, Gao YN, et al. The rheology properties of common hydrophilic gel excipients[J]. Acta Pharm Sin (药学学报) , 2014, 49 :1181–1187. |
| [16] | Song JK, Bi HS, Xie XF, et al. Preparation and evaluation of sinomenine hydrochloride in situ gel for uveitis treatment[J]. Int Immunopharmacol , 2013, 17 :99–107. DOI:10.1016/j.intimp.2013.05.020 |
| [17] | El-Bagory IM, Bayomi MA, Mahrous GM, et al. Effect of gamma irradiation on pluronic gels for ocular delivery of ciprofloxacin:in vitro evaluation[J]. Aust J Basic Appl Sci , 2010, 4 :4490–4498. |
| [18] | Gratieri T, Gelfuso GM, Rocha EM, et al. A poloxamer/chitosan in situ forming gel with prolonged retention time fo r ocular delivery[J]. Eur J Pharm Biopharm , 2010, 75 :186–193. DOI:10.1016/j.ejpb.2010.02.011 |
 2016, Vol. 51
2016, Vol. 51


