阿尔兹海默症(Alzheimer’s disease, AD)是一种最常见的老年性中枢神经系统退行性疾病, 临床表现为渐进性记忆障碍、认知功能障碍和日常生活能力丧失[1]。随着人口老龄化的加剧, AD患者呈现每4分钟新增1个病例的指数式增长[2], 预计到2050年患者人数将达到1.15亿[3]。因此阿尔兹海默症严重降低了老年人的生活质量, 为家庭和社会带来沉重的经济及社会负担。但由于血-脑屏障和血-脑脊液屏障的存在, 几乎100%大分子药物及大于98%小分子药物无法穿过层层生理屏障到达脑组织[4]。许多神经系统药物全身给药时也因无法靶向脑组织而产生不同程度的外周不良反应, 降低了药物的有效性和安全性。
随着医药领域的快速发展, 通过鼻腔给药实现脑靶向引起科研工作者的广泛关注。有研究表明[5], 鼻腔给药后药物可通过直接或间接途径吸收入脑, 显著提高药物分布的脑靶向性。其中鼻腔内嗅区通路可使药物通过细胞外途径或沿嗅神经转运进入脑组织, 成为鼻脑直接通路的主要途径, 而位于鼻腔呼吸区和嗅区的三叉神经通路也是药物吸收入脑的一条直接途径。除此之外, 药物也可被鼻黏膜内淋巴系统和丰富的毛细血管吸收进入全身循环而间接进入中枢神经系统。同时经鼻给药可避免口服首过效应, 提高药物的生物利用度, 降低胃肠道不良反应。因此, 经鼻脑靶向给药系统为中枢神经系统疾病的治疗提供了新思路, 具有良好的发展前景。
酒石酸卡巴拉汀(rivastigmine hydrogen tartrate, RHT)是一种非竞争性胆碱酯酶抑制剂, 可选择性作用于中枢神经系统的乙酰胆碱酯酶及丁酰胆碱酯酶, 抑制酶活性达10 h[6]。因其可显著改善患者的临床表现, 被FDA批准用于治疗轻、中度阿尔兹海默症。目前上市剂型主要为片剂及胶囊剂, 但由于其严重的首过效应, 口服绝对生物利用度只有35%左右, 且伴有恶心、呕吐和食欲不振等一系列胃肠道不良反应[7]。RHT易溶于水, 相对分子质量为400.43, 分子质量小于1 000 Da的药物易于通过水溶性通道鼻腔吸收[8], 且该药物对鼻黏膜形态及纤毛运动无显著影响[9]。
因此, 研究酒石酸卡巴拉汀的鼻腔递药系统, 不仅可有效提高其生物利用度, 更有望增加药物在脑组织的分布, 提高其治疗效果。为验证该研究设想, 本文首先采用大鼠鼻腔在体循环方法研究了影响酒石酸卡巴拉汀鼻腔吸收的因素, 以静脉注射为对照, 考察了鼻腔给药后药物在大鼠体内的药代动力学行为, 并评价了其脑组织分布及脑靶向行为, 为酒石酸卡巴拉汀鼻腔递药系统研究奠定理论基础。
材料与方法材料 酒石酸卡巴拉汀(江苏盛世泰科生物医药技术有限公司); 乌拉坦(国药集团化学试剂有限公司); 甲醇为色谱纯, 其他试剂为分析纯。
仪器 HC-2062高速离心机(安徽中科中佳科学仪器有限公司); LC-6A岛津液相色谱仪(日本岛津公司); 雷磁pHSJ-2F pH计(上海精密科学仪器有限公司)。
动物 健康Sprague-Dawley (SD)雄性大鼠, 体重(200±20) g, 由辽宁长生生物科技有限公司提供, 动物合格证号: SCXK (辽) 2015-0001。
RHT的鼻黏膜吸收根据本实验室前期研究基础, 采用大鼠鼻腔在体循环法考察了影响药物鼻腔吸收的因素[10, 11]。将大鼠腹腔注射乌拉坦(1.0 g·kg-1)麻醉, 仰位固定在鼠板上, 颈部做一切口暴露气管与食管, 气管内插入聚乙烯管。另一聚乙烯管通过食管插至鼻腔后部, 将鼻颚通道封闭, 以防药液从鼻腔流入口腔。该聚乙烯管另一端同电子蠕动泵上的硅胶管相连, 硅胶管另一端插入RHT的生理盐水溶液中, 启动电子蠕动泵使药液循环。将药液5 mL置于带有刻度的流通池内, 控制循环液流速为2 mL·min-1, 循环温度为37 ℃[12]。分别于0、3、5、10、15、20、30、45、60、90和120 min读取池内剩余药液体积Vn, 并从池中吸取药液100 μL, 同时补加同体积生理盐水。药液经适当稀释后, 按欧盟药典EP7.7用HPLC方法测定药物浓度。
流通池内剩余药量(Qn)的计算方法(体积校正法)为
式中VD为循环死体积, 即循环管路内药液体积, 其计算方法为VD=5 -V0。Qn为n时刻流通池内剩余药物质量(mg), Vn + VD为n时刻循环药液的总体积(mL), Cn为n时刻流通池中药物浓度(mg·mL-1)。根据X=Qn/Q0计算不同时间点的剩余药量百分比, 取对数后对时间进行线性回归。回归直线的斜率即为对应条件下的吸收速率常数(K), 其大小反映药物的鼻黏膜吸收速度。
血浆及脑组织中RHT分析方法的建立 参考文献[14, 15], 以液-液萃取法处理生物样品。取空白血浆200 μL, 加入0.5 mol·L-1 NaOH 50 μL、RHT系列标准甲醇溶液30 μL及内标卡巴西平(4 μg·mL-1) 25 μL, 涡旋混匀。然后加入甲基叔丁基醚2 mL, 涡旋振荡10 min, 10 000 r·min-1离心10 min。分离有机层, 水相用2 mL正己烷-二氯甲烷-异丙醇(2:1:0.1)同法再次萃取。合并两次有机相, 40 ℃水浴下氮气吹干。所得富集物以100 μL甲醇涡旋复溶2 min, 10 000 r·min-1离心10 min, 采用HPLC测定药物含量。
将大鼠处死后立即取脑, 小心去除表面血管, 并用冷生理盐水冲洗。精密称重后加入2倍重量的冷生理盐水, 冰浴匀浆。取匀浆液500 μL, 按血浆处理方法处理后测定药物含量。
色谱条件 色谱柱: Sepax C18色谱柱(150 mm × 4.6 mm, 5 μm); 保护柱:通用型保护柱(广州菲罗门科学仪器有限公司); 流动相:十二水合磷酸氢二钠(17.907 g·L-1, 稀磷酸调pH至7.0)-甲醇(53:47, v/v); 流速: 1.0 mL·min-1; 进样量: 20 μL; 检测波长: 214 nm; 柱温: 40 ℃。
RHT静脉注射及鼻腔给药的药代动力学 体内药动学研究 将雄性SD大鼠分成2组, 每组5只, 实验前禁食12 h。第1组尾静脉注射(iv) pH 6.0 RHT生理盐水溶液, 给药剂量为5 mg·kg-1; 第2组先腹腔注射20%乌拉坦(剂量为1.0 g·kg-1)麻醉, 仰位固定于鼠板上。将前端带有软管的微量进样器缓慢插入大鼠鼻腔内, 插入深度控制在7 mm左右[16], 双侧鼻孔分别在2~3 s内缓慢推入pH 6.0 RHT生理盐水溶液20 μL, 给药剂量为5 mg·kg-1。分别于给药后5、10、15、30、60、120和180 min于眼眶下静脉丛取血0.5 mL, 离心, 取上层血浆, 按血浆样品处理办法处理样品, 采用HPLC法测定药物含量。
脑内药动学研究 将雄性SD大鼠分成2组, 每组25只, 实验前禁食12 h。第1组为静脉注射组(iv), 第2组为鼻腔给药组(intranasal, in), 给药方法与剂量同上。分别于15、30、60、120和240 min后处死大鼠, 取脑组织并按脑组织生物样品处理办法处理样品后, 采用HPLC测定药物含量。
用DAS 2.0软件计算药物在血浆及脑组织匀浆中的药动学参数。将鼻腔给药所得血浆AUC与静脉注射的血浆AUC相比, 得到RHT鼻腔给药的绝对生物利用度。用下面的公式分别计算药物脑靶向指数(drug targeting index, DTI)和脑中药物鼻腔直接转运百分比(nose-to-brain direct transport percentage, DTP)。当DTI > 100%时认为药物分布有脑靶向性。当DTP > 0时, 认为相比于药物通过体循环穿过血脑屏障入脑, 鼻脑间的直接通路是一种更有效的入脑途径[17]。
| $ \begin{array}{l} {\rm{DTI = }}\left[{\frac{{{{\left( {{\rm{AU}}{{\rm{C}}_{{\rm{brain}}}}/{\rm{AU}}{{\rm{C}}_{{\rm{plasma}}}}} \right)}_{in}}}}{{{{\left( {{\rm{AU}}{{\rm{C}}_{{\rm{brain}}}}/{\rm{AU}}{{\rm{C}}_{{\rm{plasma}}}}} \right)}_{iv}}}}} \right] \times 100{\rm{DTP}}\\ \;\;\;\;\;\;{\rm{ = }}\left( {\frac{{{B_{in}} - {B_x}}}{{{B_{in}}}}} \right) \times 100{B_x} = \left( {\frac{{{B_{iv}}}}{{{P_{iv}}}}} \right) \times {P_{in}} \end{array} $ |
其中Biv、Piv分别代表静注给药后脑组织和血浆内的AUC, Bin、Pin分别代表鼻腔给药后脑组织和血浆内的AUC。Bx表示鼻腔给药后药物吸收入体循环穿过血脑屏障进入脑中药物的比例。
数据处理 实验所得数据均采用x±s表示, 组间数据采用t-检验进行统计学分析, P < 0.05即认为有显著性差异。
结果与讨论 1 RHT的鼻腔吸收研究本课题组曾考察在体循环实验中管路对药物的潜在吸附作用, 结果显示平衡吸附量占总药物量的0.83%, 可忽略不计。同时, 研究了药物在鼻洗出液中的稳定性, 4 h内药物浓度的RSD值小于2.0%。因此认为实验中药物质量的损失是源于鼻腔的吸收, 而非药物的管路吸附或鼻腔内降解[8]。有文献报道, 在体循环实验中鼻腔对水分的分泌及重吸收可忽略不计[18]。但近期也有文献指出[19, 20], 大鼠在2 h时吸收1 mL左右的循环液, 这会影响药物吸收量的准确计算。因此, 本实验中选用体积校正法对循环液体积进行实时监控记录, 以保证实验数据的可靠性及准确性。
1.1 循环液pH对鼻腔吸收的影响结合鼻腔内生理环境, 固定RHT溶液浓度为0.1 mg·mL-1, 本研究考察了pH分别为5.0、6.0和7.0时RHT的鼻黏膜吸收行为, 结果见图 1。不同pH条件下的吸收速度常数(K)与相关系数(r)列于表 1。结果表明, RHT在鼻腔内的吸收符合一级动力学, 模型拟合度良好。pH值不同时, 药物的吸收速度常数存在显著性差异。当pH为6.0时, 药物吸收速率最大, 因此选择pH 6.0开展后续研究。
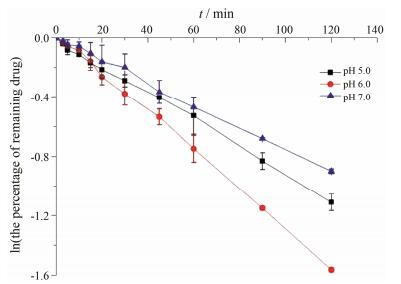
|
Figure 1 Effect of perfusate pH on intranasal absorption of 0.1 mg·mL-1 rivastigmine hydrogen tartrate (RHT). n=3, x±s |
| Table 1 Nasal absorption of RHT at different pH and perfusate concentration. n=3, x±s. P < 0.05 vs pH 7.0.K: Absorption rate constant; r: Coefficient |
固定循环液pH为6.0, 考察0.1、0.3和0.5 mg·mL-1 RHT溶液的鼻腔吸收情况, 其经时吸收结果见图 2A。由图 2A可知, RHT吸收量随时间的延长而增加, 表明在所考察的时间范围内, RHT的鼻腔吸收不存在饱和现象。由图 2B及表 1可知, 不同浓度的RHT大鼠鼻腔吸收速度常数无显著性差异, 平均K值为12.76×10-3 min-1。因此推测RHT在鼻腔内的吸收是基于浓度梯度的被动扩散。
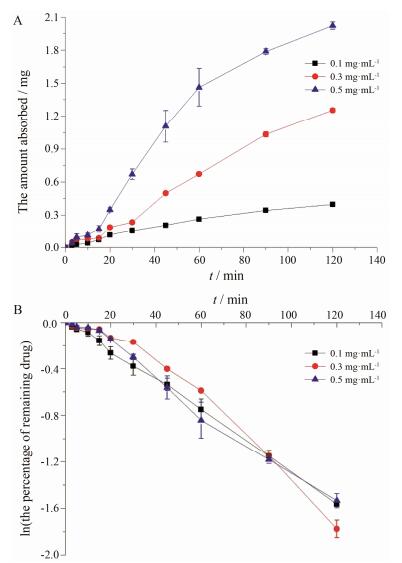
|
Figure 2 Effect of perfusate concentration on the amount of intranasal absorbed (A) and remained (B) RHT (pH 6.0). n=3, x±s |
分别将血浆与脑组织中RHT峰面积(As)和内标峰面积(Ai)的比值和RHT浓度进行线性回归, 得到血浆及脑组织中RHT的标准曲线分别为As/Ai=0.022 3 C + 0.011 8 (r=0.999 2), As/Ai=0.025 8 C + 0.004 7 (r=0.999 3), 均表明在2~40 μg·mL-1内, 血浆及脑组织中RHT浓度与峰面积比值间的线性关系良好。低、中、高3个浓度的萃取回收率和方法回收率见表 2, 24h内样品稳定性变异系数均 < 13%, 日内、日间精密度变异系数均 < 12%, 检测限均为0.5 μg·mL-1, 均符合生物样品的测定要求。
| Table 2 The recovery of RHT in plasma and brain. n=5 |
RHT静脉注射及鼻腔给药的血药浓度-时间曲线如图 3所示。由图可知, 与静脉注射相比, 鼻腔给药后药物吸收非常迅速, 给药5 min后即可检测到较高的药物浓度, 药物达峰时间为12 min。计算不同途径给药后血浆内的主要药动学参数, 结果见表 3。由表 3可知, 鼻腔给药后血浆内AUC为静脉注射的73.58%, 明显高于文献[7]报道的RHT的口服生物利用度(35%)。这说明, 鼻腔给药后药物不仅吸收迅速且吸收较口服更加完全。因此, 鼻腔给药可作为RHT静脉注射的替代给药途径。
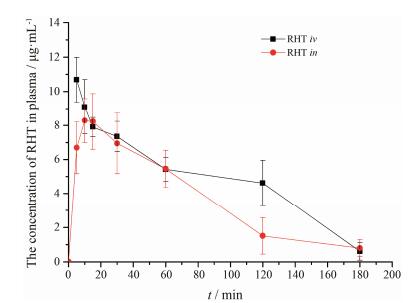
|
Figure 3 Concentration-time profiles of RHT in the plasma after intravenous (iv) and intranasal (in) administration of RHT solution at the dose of 5 mg·kg-1. n=5, x±s |
| Table 3 Parameters in plasma and brain after intravenous (iv) and intranasal (in) administration of RHT (5 mg·kg-1). n=5, x±s. aThe unit of AUC is μg·min·mL-1 in plasma and μg·min·g-1 in brain. *P < 0.05 vs RHT iv |
RHT静脉注射及鼻腔给药后的脑组织药物浓度-时间曲线如图 4所示。由图 4可知, 鼻腔给药后脑组织中药物浓度几乎一直大于静脉注射组, 即鼻腔给药后RHT入脑更加迅速且在脑内维持较高水平。计算不同途径给药后脑组织内主要药动学参数, 结果见表 3。由表 3可知, 与静脉注射相比, 经鼻给药后脑组织中RHT达峰更加迅速, tmax为27 min; 二者达峰浓度相当; 鼻腔给药后t1/2和MRT0-t分别较静脉注射延长了1.4和1.1倍。这说明鼻腔给药后, 药物不仅可快速且较完全地吸收入脑, 同时可延长药物在脑内的滞留时间, 将更有利于中枢神经系统疾病的治疗。
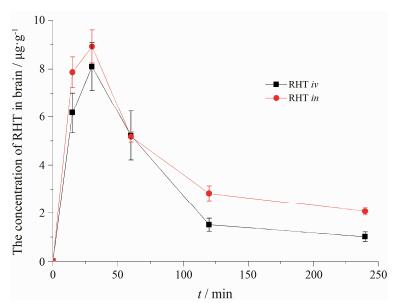
|
Figure 4 Concentration-time profiles of RHT in the brain after iv and in administration of RHT solution at the dose of 5 mg·kg-1. n=5, x±s |
另外, 与静脉注射相比, 鼻腔给药后脑内AUC增加了1.44倍, DTI为195.27%, 说明鼻腔给药可显著增加药物在脑组织的分布。同时, DTP为48.79%。这说明, 经鼻给药后RHT除通过体循环通路入脑外, 还可由鼻脑直接通路入脑且通过该途径入脑的药物占总入脑药物的48.79%, 进一步证实了RHT鼻腔给药后, 与静脉注射相比, 药物不仅入脑更加迅速, 而且在脑组织的分布可增加近1倍。
3 结论本文应用大鼠在体鼻腔循环法研究了影响RHT鼻腔吸收的因素, 确定了RHT最佳吸收条件为pH 6.0, 其吸收机制为被动吸收, 符合一级动力学过程。经鼻给药后, RHT在快速吸收入血的同时能有效靶向于脑组织, 显著提高了药物入脑的速度与程度, 并有效延缓了药物在脑组织内的清除, 增加了药物作用时间。因此可认为RHT鼻腔给药是一种较有前景的给药途径。同时, 应用鼻腔给药实现脑靶向在中枢神经系统疾病治疗领域具有广泛的应用前景。
| [1] | Zhou NN, Zhu R, Zhao XM, et al. Effect and mechanism of gastrodin inhibiting β-amyloid plaques in brain of mice[J]. Acta Pharm Sin (药学学报) , 2016, 51 :588–594. |
| [2] | Roney C, Kulkarni P, Arora V, et al. Targeted nanoparticles fo r drug delivery through the blood-brain barrier for Alzheimer's disease[J]. J Control Release , 2005, 108 :193–214. DOI:10.1016/j.jconrel.2005.07.024 |
| [3] | Christiane R, Richard M. Alzheimer disease:epidemiology, diagnostic criteria, risk factors and biomarkers[J]. Biochem Pharmacol , 2014, 88 :640–651. DOI:10.1016/j.bcp.2013.12.024 |
| [4] | Yuan DF, Zong TL, Gao HL, et al. Cell penetrating peptide TAT and brain tumor targeting peptide T7 dual modified liposome preparation and in vitro targeting evaluation[J]. Acta Pharm Sin (药学学报) , 2015, 50 :104–110. |
| [5] | Kozlovskaya L, Abou-Kaoud M, Stepensky D. Quantitative analysis of drug delivery to the brain via nasal route[J]. J Control Release , 2014, 189 :133–140. DOI:10.1016/j.jconrel.2014.06.053 |
| [6] | Williams BR, Nazarians A, Gill MA. A review of rivastigmine:a reversible cholinesterase inhibitor[J]. Clin Ther , 2003, 25 :1634–1653. DOI:10.1016/S0149-2918(03)80160-1 |
| [7] | Mohammad H, Stanford SJ, Thomas S, et al. Estimation of the absolute bioavailability of rivastigmine in patients with mild to moderate dementia of the Alzheimer's type[J]. Clin Pharmacokinet , 2002, 41 :225–234. DOI:10.2165/00003088-200241030-00006 |
| [8] | Tayebati SK, Nwankwo IE, Amenta F. Intranasal drug delivery to the central nerous system:present status and future outlook[J]. Curr Pharm Design , 2013, 19 :510–526. DOI:10.2174/138161213804143662 |
| [9] | Yang ZZ, Zhang YQ, Wang ZZ, et al. Enhanced brain distribution and pharmacodynamics of rivastigmine by liposomes following intranasal administration[J]. Int J Pharm , 2013, 452 :344–354. DOI:10.1016/j.ijpharm.2013.05.009 |
| [10] | Mei D, Mao SR, Sun W, et al. Effect of chitosan structure properties and molecular weight on the intranasal absorption of tetramethylpyrazine phosphate in rats[J]. Eur J Pharm Biopharm , 2008, 70 :874–881. DOI:10.1016/j.ejpb.2008.06.031 |
| [11] | Na LD, Mao SR, Wang J, et al. Comparison of different absorption enhancers on the intranasal absorption of isosorbide dinitrate in rats[J]. Int J Pharm , 2010, 397 :59–66. DOI:10.1016/j.ijpharm.2010.06.048 |
| [12] | Na LD, Wang J, Wang LL, et al. A novel permeation enhancer:N-succinyl chitosan on the intranasal absorption of isosorbide dinitrate in rats[J]. Eur J Pharm Sci , 2013, 48 :301–306. DOI:10.1016/j.ejps.2012.10.030 |
| [13] | Song X, Du SY, Lu Y, et al. Study on rat nasal absorption in situ of borneol based on single pass perfusion method[J]. Chin J Chin Mater Med (中国中药杂志) , 2011, 36 :2489–2492. |
| [14] | Yang ZZ, Zhang YQ, Wu K, et al. Tissue distribution and pharmacodynamics of rivastigmine after intranasal and intravenous administration in rats[J]. Curr Alzheimer Res , 2012, 9 :315–325. DOI:10.2174/156720512800107528 |
| [15] | Arumugam K, Chamallamudi MR, Mallayasamy SR, et al. High performance liquid chromatographic fluorescence detection method for the quantification of rivastigmine in rat plasma and brain:application to preclinical pharmacokinetic studies in rats[J]. J Young Pharm , 2011, 3 :315–321. DOI:10.4103/0975-1483.90244 |
| [16] | Li Y, Li JF, Zhang X, et al. Non-ionic surfactants as novel intranasal absorption enhancers:in vitro and in vivo characterization[J]. Drug Deliv , 2015, 21 :1–8. |
| [17] | Zhang QZ, Jiang XG, Jiang WM, et al. Preparation of nimodipine-loaded microemulsion for intranasal delivery and evaluation on the targeting efficiency to the brain[J]. Int J Pharm , 2004, 275 :85–96. DOI:10.1016/j.ijpharm.2004.01.039 |
| [18] | Olivier JC, Djilani M, Fahmy S, et al. In situ nasal absorption of midazolam in rats[J]. Int J Pharm , 2001, 213 :187–192. DOI:10.1016/S0378-5173(00)00668-2 |
| [19] | Lu Y, Chen XL, Du SY, et al. The in situ and in vivo study on enhancing effect of borneol in nasal absorption of geniposide in rats[J]. Arch Pharm Res , 2010, 33 :691–696. DOI:10.1007/s12272-010-0507-8 |
| [20] | Lu Y, Hao B, Wen R, et al. Comparative study on rat in situ nasal absorption of geniposide of Xingnaojing nasal drop and Xingnaojing microemulsion[J]. Chin J Chin Mater Med (中国中药杂志) , 2013, 38 :1510–1512. |
 2016, Vol. 51
2016, Vol. 51


