2. 天津天士力之骄药业有限公司, 天津 300410 ;
3. 天津医科大学, 天津 300070 ;
4. 辽宁天士力森涛参茸股份有限公司, 辽宁 本溪 117206
2. Tianjin Tasly Pride Pharmaceutical Co., Ltd., Tianjin 300410, China ;
3. Tianjin Medical University, Tianjin 300070, China ;
4. Liaoning Tasly Sentaoshenrong Co., Ltd., Benxi 117206, China
人参为五加科植物人参(Panax ginseng C. A. Mey.)的干燥根和根茎[1], 应用历史悠久, 具有多方面的医疗保健作用。人参中主要的活性成分是人参皂苷, 主根是其主要的药用部位。而人参皂苷在叶、侧根、芦头等其他部位的组成和含量各不相同[2-4], 各部位相应的药理活性也有差异[5, 6], 如人参根可“大补元气、复脉固脱、补脾益肺、生津养血、安神益智”[1], 人参叶具有“补气、益肺、祛暑、生津”的功效[1], 而人参芦头多作为涌吐祛痰药[7]。
目前, 主要采用HPLC[2, 3]和UHPLC[4]的方法对人参不同部位的差异性进行研究, 仅选用少数人参皂苷作为指标成分, 缺乏全面性, 无法找出差异标记物, 难以完成对人参不同药用部位的鉴别, 而且研究对象仅限于生长年限在6年以下的园参。林下山参为播种在山林野生状态下自然生长的五加科人参属草本植物, 一般在生长10年之后才采收, 因其生长环境和野山参相似, 其药用价值可以和野山参相媲美[8]。当前, 林下山参已成为高品质商品人参的主要来源, 而对其不同部位进行鉴别的研究还未见报道。
植物代谢组学技术是对植物代谢产物进行无差别代谢成分全分析的高通量分析技术, 为植物研究提供了一个整体全面的分析平台[9]。而超高效液相色谱串联四极杆飞行时间质谱(UHPLC-QTOF/MS)具有UHPLC快速高效的色谱分离能力和QTOF的高分辨率、高灵敏度。目前基于UHPLC-QTOF/MS的植物代谢组学技术已广泛应用于人参属植物不同物种[10, 11]、不同加工方式[12, 13]、不同生长年限[14, 15]的鉴别研究, 并取得了较好的分类效果, 为人参的质量评价提供了新的方法。因此, 本实验采用基于UHPLC-QTOF/MS的植物代谢组学技术从整体角度对林下山参叶、主根、侧根、芦头等4个部位之间代谢物的差异性进行研究, 并结合主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA)等分析方法, 找出区分林下山参叶和根茎(主根、侧根、芦头)以及林下山参主根和侧根、主根和芦头的差异标记物, 期望从新的角度为林下山参不同部位之间的鉴别提供参考。
材料与方法材料 14年生林下山参于2015年9月采自辽宁省桓仁县林下山参基地, 各样本均经南京农业大学郭巧生教授鉴定为五加科植物人参(Panax ginseng C. A. Mey.)。
仪器与试剂 Acquity UPLC-Synapt G2 Q-TOF色谱-质谱联用仪(美国Waters公司); MassLynx V4.1、MarkerLynx XS、Umetrics EZinfo 2.0软件(美国Waters公司); Biofuge primo R台式离心机(美国Thermo公司); xS105型电子分析天平(瑞士Mettler Toledo公司); Milli-Q超纯水制备仪(美国Millipore公司)。
甲醇、乙腈(质谱纯, 德国Omni公司); 甲酸(质谱纯, 美国Sigma公司); 三七皂苷R1、人参皂苷Rg1、Re、Rf、20(S)-Rg2、Rb1、Ro、Rc、20(S)-F1、Rb2、Rb3、Rd、20(S)-F2均购自中国食品药品检定研究院; 人参皂苷20(S)-Rh1、20(R)-Rg3均购自天津马克生物技术有限公司。
供试品溶液的制备 将9份林下山参样品分为叶、主根、侧根、芦头4部分, 分别粉碎后过80目筛。分别取各供试品粉末100 mg, 精密称定, 置于10 mL离心管中, 加入70%甲醇5 mL, 称重, 室温(25±1) ℃下超声提取60 min, 补足失重, 12 000 r·min-1离心10 min。上清液用0.22 μm的微孔滤膜滤过, 取续滤液, 即得。
混合对照品溶液的制备 分别取15个对照品适量, 精密称定, 加70%甲醇溶解制成约0.5 mg·mL-1的各对照品储备液。再分别取各对照品储备液适量, 置10 mL量瓶中, 加70%甲醇制成含各对照品约30 μg·mL-1的混合对照品溶液。
色谱条件 色谱柱: Waters Acquity UPLC HSS T3色谱柱(100 mm × 2.1 mm, 1.8 μm); 流动相: 0.1%甲酸水(A)-0.1%甲酸乙腈(B), 梯度洗脱: 0~1 min, 5%~15% B; 1~2 min, 15%~19% B; 2~11 min, 19%~31% B; 11~13 min, 31%~32% B; 13~16 min, 32%~35% B; 16~20 min, 35%~52% B; 20~25 min, 52%~70% B; 25~27 min, 70%~5% B并保持3 min; 流速: 0.5 mL·min-1; 柱温40 ℃; 进样量为3μL。
质谱条件 采用电喷雾电离离子源(ESI), 负离子模式, 毛细管电压为2.5 kV, 锥孔电压30 V, 提取锥孔电压4 V。离子源温度为120 ℃, 脱溶剂气体(氮气)温度为400 ℃, 脱溶剂气体流量为800 L·h-1, 锥孔气流量50 L·h-1。碰撞气为氩气, MSE扫描模式检测, 质量扫描范围m/z为100~1 500, 低能量扫描时trap电压为6 eV; 高能量扫描时trap CE电压为30~50 eV。用亮氨酸脑啡肽(m/z 554.261 5)进行质量实时校正, 浓度为200 pg·μL-1, 流速为2 μL·min-1。
数据分析 将采集的原始样品质谱数据采用MarkerLynx XS Application Manager软件进行峰提取、峰匹配、峰对齐、峰识别以及归一化等预处理, 得到的数据集矩阵再导入EZinfo 2.0软件中进行PCA、OPLS-DA等多元变量统计分析, 结合S-plot及VIP-plot筛选出林下山参不同部位之间的差异性标志物。其主要参数设置如下:保留时间范围为1~25 min; m/z100~1 500;保留时间和m/z允许偏差分别为0.2 min、0.05 Da; 噪音消除水平为6;响应强度阈值为100 counts; 去除同位素峰。
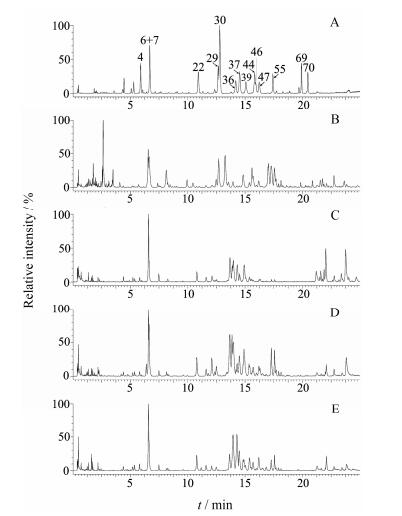
结果 1 林下山参不同部位的UHPLC-QTOF/MS图谱分析根据液相色谱及质谱分析条件, 取林下山参供试品溶液进行分析(每个部位均制备9份样品)。其中具有代表性的林下山参叶、主根、侧根、芦头的基峰离子流色谱图见图 1。将化合物的保留时间、精确质荷比及碎片离子与15个对照品及相关人参属文献报道的化合物进行匹配, 对检测到的81个主要代谢物进行指认, 共鉴定或推断指认出70个代谢物, 见表 1[11-13, 16-19]。对林下山参不同部位的BPI图(图 1)进行直观分析, 发现不同部位之间存在一定的差异, 林下山参叶、主根、侧根、芦头分别检测到63、47、53、47个主要色谱峰, 林下山参叶中的皂苷种类要多于主根、侧根和芦头。另外, 林下山参不同部位之间也存在许多相同的皂苷成分, 但它们在含量上存在明显的差异, 如人参皂苷Rg1 (6)在主根中的含量显著高于叶、侧根、芦头, 而人参皂苷Rd (55)在叶、侧根、芦头中的含量均高于主根。
|
Figure 1 Representative BPI chromatograms of different parts of mountain cultivated ginseng (MCG). A: Reference compounds; B: Leaves; C: Main root; D: Branch root; E: Rhizome |
| Table 1 Major components identified from different parts of Mountain Cultivated Ginseng. △Further confirmation in comparison with reference standard. Ac: Acetyl; Glc:β-D-Glucopyranosyl; Ma: Malonyl |
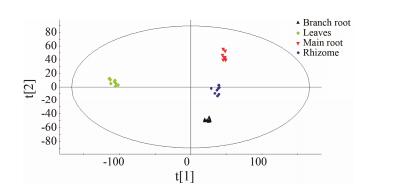
PCA是一种无监督的模式识别方法, 通过将原有的复杂数据进行降维处理, 可有效地找出数据中最主要的信息。采用PCA模式识别林下山参不同部位代谢物的差异, 所得PCA得分图见图 2。从图 2可看出, 林下山参叶、主根、侧根和芦头各自聚为一类且被明显分为4个区域, 表明林下山参不同部位之间化学成分差异显著, 所建立的植物代谢组学方法可良好地表征各部位的化学特征。其中, 林下山参叶与林下山参根茎(主根、侧根、芦头)被t[1]轴明显区分, 林下山参叶位于负半轴, 主根、侧根、芦头位于正半轴。而林下山参主根、侧根和芦头则由t[2]轴区分, 主根和侧根分别位于第一、第四象限, 芦头位于两者之间的t[2]轴上。
|
图 2 PCA scores plot of different parts of MCG using Pareto scaling with mean centering |
图 2表明林下山参根茎(主根、侧根、芦头)之间的差异小于与叶的差异, 因此将林下山参叶和根茎分别作为一组, 利用有监督的OPLS-DA的S-plot图确认林下山参叶和根茎之间的差异标志物。根据S-Plot图并结合变量权重重要性排序(variable importance in projection, VIP)值对差异性代谢成分进行筛选和指认, 得到9个差异标志物, 分别为:芦丁(A1, tR 2.63, m/z609.146 2)、20(R)-三七皂苷R2 (B1, tR 13.24, m/z 815.479 1)、人参皂苷F3 (C1, tR 12.69, m/z815.478 6)、Ac-F1 (D1, tR 17.01, m/z725.446 7)、20(S)-人参皂苷F1 (E1, tR 15.59, m/z 683.437 3)、人参皂苷Rg1 (F1, tR 6.59, m/z 845.488 6)、人参皂苷Rb1 (G1, tR 13.97, m/z1107.590 1)、丙二酰基人参皂苷Rb1 (H1, tR 14.51, m/z1193.595 3)、人参皂苷Rf (I1, tR 10.80, m/z799.483 5)。其中E1、F1、G1、I1等4个差异标志物通过对照品进行鉴定, 其余均通过文献进行初步推断。
对获得的差异标志物在林下山参叶和根茎中的分布进行比较, 结果显示, 芦丁(A1)、20(R)-三七皂苷R2 (B1)、人参皂苷F3 (C1)、Ac-F1 (D1)、20(S)-人参皂苷F1 (E1)仅存在于林下山参叶中, 在主根、侧根、芦头中没有检测到, 可作为关键的差异标志物鉴别林下山参叶和根茎。代谢物人参皂苷Rg1 (F1)、人参皂苷Rb1 (G1)、丙二酰基人参皂苷Rb1 (H1)、人参皂苷Rf (I1)在林下山参4个部位中都存在, 但是在林下山参主根、侧根、芦头中的含量远高于其在林下山参叶中的含量。
2.3林下山参主根和侧根之间的差异标志物分析 对林下山参主根和侧根之间的S-plot图分析共找出7个差异标志物:人参皂苷Rg1 (A2, tR 6.59, m/z 845.488 6)、B2 (tR 22.06, m/z 595.289 2)、C2 (tR 23.76, m/z 433.237 5)、人参皂苷Rd (D2, tR 17.32, m/z 991.548 6)、丙二酰基人参皂苷Rd (E2, tR 17.56, m/z 1031.543 1)、人参皂苷Re (F2, tR 6.63, m/z 991.546 4)、G2 (tR 6.39, m/z 447.223 6)。其中A2、D2、F2通过对照品进行鉴定, E2通过文献进行初步推断, B2、C2、G2因缺乏对照品及相关的文献报道暂未鉴定。
对筛选的7个差异标志物在林下山参主根和侧根中的分布进行比较分析, 结果显示人参皂苷Rg1 (A2)、B2 (tR 22.06, m/z 595.289 2)、C2 (tR 23.76, m/z 433.237 5)在主根中含量较高, 人参皂苷Rd (D2)、丙二酰基人参皂苷Rd (E2)、人参皂苷Re (F2)、G2 (tR 6.39, m/z 447.223 6)在侧根中含量较高。
2.4 林下山参主根和芦头之间的差异标志物分析结合OPLS-DA分析的S-plot图, 筛选出7个林下山参主根和芦头之间的差异标志物:人参皂苷Rg1 (A3, tR 6.59, m/z 845.488 6)、B3 (tR 23.76, m/z 433.237 5)、C3(tR 22.06, m/z 595.289 2)、20(R)-拟人参皂苷RT5 (D3, tR 21.88, m/z 677.374 2)、人参皂苷Ro (E3, tR 14.31, m/z 955.487 9)、丙二酰基人参皂苷Rd (F3, tR 17.56, m/z 1 031.543 1)、人参皂苷Re (G3, tR 6.63, m/z 991.546 4)。其中A3、E3、G3通过对照品进行鉴定, D3、F3通过文献进行初步推断, B3、C3因缺乏对照品及相关的文献报道暂未鉴定。
进一步对林下山参主根和芦头中7个差异标志物的变化趋势进行分析, 结果表明主根中人参皂苷Rg1 (A3)、B3 (tR 23.76, m/z 433.237 5)、C3 (tR 22.06, m/z 595.289 2)、20(R)-拟人参皂苷RT5 (D3)含量较高, 而人参皂苷Ro (E3)、Re (G3)和丙二酰基人参皂苷Rd (F3)在芦头中含量较高。特别是20(R)-拟人参皂苷RT5 (D3)在芦头中未检测到, 可作为主要差异标志物用于主根和芦头的鉴别。
讨论人参是重要的药用植物, 在国内外已被广泛应用。主根通常是主要的药用部位, 因化学组成的差异, 不同部位的药理活性也不尽相同。随着野山参资源的枯竭, 林下山参已作为主要商品人参在市场上流通, 而之前主要集中在对园参不同部位的差异性研究[2-4], 未见对林下山参不同部位的差异性研究报道。本研究采用基于UHPLC-QTOF/MS的植物代谢组学技术研究林下山参不同部位的差异, 从林下山参叶、主根、侧根和芦头中共检测到81个代谢物, 借助QTOF高分辨质谱提供的精确质荷比及碎片离子, 通过与15个对照品及人参属相关文献报道的化合物进行匹配, 共鉴定或初步推断出70个代谢物。与之前采用的HPLC[2, 3]、UHPLC[4]等研究方法相比, 本研究所建立的基于UHPLC-QTOF/MS的植物代谢组学方法能在较短时间内检测到更多的代谢产物, 更加全面地反映人参不同部位之间的差异程度。另外, 与前人研究的园参的代谢产物相比[10-13], 林下山参在皂苷类成分的组成上要优于园参, 与Choi等[20]对林下山参和园参的对比研究结果一致。Shi等[21]研究发现人参叶中总皂苷含量显著高于根, 而本研究同样显示林下山参叶中的皂苷种类明显多于主根、侧根和芦头, 而人参叶作为人参药材种植中伴生的产物一般任其掉落腐烂造成资源浪费。另外, 人参芦头中大多数皂苷的含量并不低于甚至高于(如人参皂苷Re、Rf、Ro)其在主根的含量, 因此应加强对林下山参不同部位的综合开发利用。
与此同时, 本研究结合PCA和OPLS-DA多变量统计分析方法, 可以更加直观地展示林下山参不同部位的差异, 并筛选出不同部位之间差异性较大的标志物。结果显示, 从林下山参叶和林下山参根茎(主根、侧根、芦头)中得到9个差异标志物, 其中芦丁、20(R)-三七皂苷R2、人参皂苷F3、Ac-F1、20(S)-人参皂苷F1仅存在于林下山参叶中, 可作为关键的差异标志物鉴别林下山参叶和根茎。相对芦头而言, 林下山参主根和侧根之间差异更大, 从主根和侧根、以及主根和芦头中均分别筛选出7个差异标志物。尤其是20(R)-拟人参皂苷RT5在芦头中未检测到, 可作为主要差异标志物用于主根和芦头的鉴别。另外, 鉴于MS在鉴定未知新化合物和同分异构体中的不足, 尚未鉴定的差异标志物需要借助NMR等其他技术手段来研究确定。
综上, 本研究从新的角度对林下山参不同部位进行鉴别评价, 对林下山参资源合理利用具有指导意义, 同时为其他中药材鉴别研究提供了新的思路。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 1. 2015 ed. Beijing:China Medical Science Press, 2015:8. http://pub.chinasciencejournal.com/article/getArticleRedirect.action?doiCode=10.3724/SP.J.1123.2015.07027 |
| [2] | Li C, Wang Y, Zhang MP, et al. Investigation of ginsenosides in different parts of Panax ginseng by HPLC[J]. Jilin J Tradit Chin Med (吉林中医药) , 2010, 30 :347–349. |
| [3] | Zhou WS. Composition analysis of ginsenoside from different fractions of ginseng[J]. World Sci Technol Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化) , 2014, 16 :834–838. |
| [4] | Pang SF, Li YL, Xu SQ, et al. Investigation of ginsenosides in different parts of Panax ginseng[J]. Ginseng Res (人参研究) , 2015 (01) :5–8. |
| [5] | Jiao L, Li B, Wang M, et al. Antioxidant activities of the oligosaccharides from the roots, flowers and leaves of Panax ginseng CA Meyer[J]. Carbohydr Polym , 2014, 106 :293–298. DOI:10.1016/j.carbpol.2014.02.035 |
| [6] | Chung IM, Lim JJ, Ahn MS, et al. Comparative phenolic compound profiles and antioxidative activity of the fruit, leaves, and roots of Korean ginseng (Panax ginseng Meyer) according to cultivation years[J]. J Ginseng Res , 2016, 40 :68–75. DOI:10.1016/j.jgr.2015.05.006 |
| [7] | Liu B, Chen QM, Chen WP, et al. Analysis on polysaccharide in Ginseng Radix et Rhizoma[J]. Chin Tradit Herb Drugs (中草药) , 2011, 42 :2422–2423. |
| [8] | Hao CY, Li Y. Research progress on ginseng in forest[J]. J Jilin Med Coll (吉林医药学院学报) , 2011, 32 :105–108. |
| [9] | Dan M, Gao XF, Xie GX, et al. Application of metabolomics in research of plant metabolites[J]. China J Chin Mater Med (中国中药杂志) , 2007, 32 :2337–2341. |
| [10] | Xie G, Plumb R, Su M, et al. Ultra-performance LC/TOF MS analysis of medicinal Panax herbs for metabolomic research[J]. J Sep Sci , 2008, 31 :1015–1026. DOI:10.1002/jssc.v31:6/7 |
| [11] | Mao Q, Bai M, Xu JD, et al. Discrimination of leaves of Panax ginseng and P. quinquefolius by ultra high performance liquid chromatography quadrupole/time-of-flight mass spectrometry based metabolomics approach[J]. J Pharm Biomed Anal , 2014, 97 :129–140. DOI:10.1016/j.jpba.2014.04.032 |
| [12] | Zhang HM, Li SL, Zhang H, et al. Holistic quality evaluation of commercial white and red ginseng using a UPLC-QTOFMS/MS-based metabolomics approach[J]. J Pharm Biomed Anal , 2012, 62 :258–273. DOI:10.1016/j.jpba.2012.01.010 |
| [13] | Li SL, Shen H, Zhu LY, et al. Ultra-high-performance liquid chromatography-quadrupole/time of flight mass spectrometry based chemical profiling approach to rapidly reveal chemical transformation of sulfur-fumigated medicinal herbs, a case study on white ginseng[J]. J Chromatogr A , 2012, 1231 :31–45. DOI:10.1016/j.chroma.2012.01.083 |
| [14] | Kim N, Kim K, Choi BY, et al. Metabolomic approach for age discrimination of Panax ginseng using UPLC-Q-TOF MS[J]. J Agric Food Chem , 2011, 59 :10435–10441. DOI:10.1021/jf201718r |
| [15] | Kim N, Kim K, Lee D, et al. Nontargeted metabolomics approach for age differentiation and structure interpretation of age-dependent key constituents in hairy roots of Panax ginseng[J]. J Nat Prod , 2012, 75 :1777–1784. DOI:10.1021/np300499p |
| [16] | Yang W, Ye M, Qiao X, et al. A strategy for efficient discovery of new natural compounds by integrating orthogonal column chromatography and liquid chromatography/mass spectrometry analysis:its application in Panax ginseng, Panax quinquefolium and Panax notoginseng to characterize 437 potential new ginsenosides[J]. Anal Chim Acta , 2012, 739 :56–66. DOI:10.1016/j.aca.2012.06.017 |
| [17] | Sun TT, Liang XL, Zhu HY, et al. Rapid separation and identification of 31 major saponins in Shizhu ginseng by UHPLC-ESI-MS/MS[J]. J Ginseng Res , 2016, 40 :1–9. DOI:10.1016/j.jgr.2015.03.003 |
| [18] | Liang Z, Chen Y, Xu L, et al. Localization of ginsenosides in the rhizome and root of Panax ginseng by laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J]. J Pharm Biomed Anal , 2015, 105 :121–133. DOI:10.1016/j.jpba.2014.12.005 |
| [19] | Chu C, Xu S, Li X, et al. Profiling the ginsenosides of three ginseng products by LC-Q-TOF/MS[J]. J Food Sci , 2013, 78 :C653–C659. DOI:10.1111/1750-3841.12102 |
| [20] | Choi YE, Kim YS, Yi MJ, et al. Physiological and chemical characteristics of field-and mountain-cultivated ginseng roots[J]. J Plant Biol , 2007, 50 :198–205. DOI:10.1007/BF03030630 |
| [21] | Shi W, Wang YT, Li J, et al. Investigation of ginsenosides in different parts and ages of Panax ginseng[J]. Food Chem , 2007, 102 :664–668. DOI:10.1016/j.foodchem.2006.05.053 |
 2016, Vol. 51
2016, Vol. 51


