2. 南京中医药大学江苏省中药炮制重点实验室, 江苏 南京 210023
2. Jiangsu Provincial Key Laboratory of Chinese Medicine Processing, Nanjing University of Chinese Medicine, Nanjing 210023, China
五味子为木兰科植物五味子[Schisandra chinensis (Turcz.) Baill]的干燥成熟果实, 习称“北五味子”, 始载于《神农本草经》, 是我国传统的常用中药。因其酸、苦、甘、辛、咸五味俱全, 故具有收敛固涩、益气生津、补肾宁心之功效, 用于久咳虚喘、梦遗滑精、遗尿尿频、久泻不止、自汗、盗汗、津伤口渴、短气脉虚、内热消渴、心悸失眠等症[1]。五味子物质基础研究[2-5]显示其主要含有的成分包括木脂素、挥发油、萜类、皂苷、多糖等, 其中木脂素为最主要活性成分。同时, 药理实验研究及临床用药表明五味子木脂素具有抗炎、抗肿瘤、抗病毒、调节心血管系统、保肝等作用[6-9]。研究中药在体内的代谢产物, 可逆向鉴定被吸收或者发生疗效的成分, 大大加快有效成分群的确定, 更加深入地揭示药物作用的物质基础及作用机制。
研究表明, 五味子醇提取物中主要成分为木脂素, 通过对照品验证及含量测定的木脂素有五味子甲素(deoxyschizandrin)、五味子乙素(schisandrin B)、五味子丙素(schisandrin C)、五味子醇甲(schizandrol)、五味子醇乙(schizandrol B)、五味子酯甲(schisantherin)、五味子酯乙(schisantherin B)、五味子酚(schisan henol)、戈米辛J (gomisin J)及戈米辛G (gomisin G)等, 其中前8种木脂素含量较高。近年来, 五味子木脂素代谢产物研究还局限于单体成分[10], 提取物给药后体内的代谢研究还未见详尽的报道。
目前中药的代谢产物研究一般多采用柱色谱分离, 通过代谢物对照品或高效液相制备色谱得到代谢物单体或组群并分析确定其相对分子质量及结构, 虽然准确性高, 但存在生物样品量少、内源性代谢物质干扰多、研究周期长、对照品难以获得等缺陷。高分辨率的UHPLC-QTOF/MS仪在进行物质定性分析时可提供较为可靠的多种结构相关信息, 结合基于质量亏损滤过(MDF)为基础的代谢物寻找软件可快速寻找目标代谢物, 进一步对药物目标代谢物进行MS/MS分析, 能较为可靠地快速推测复杂生物基质中的代谢产物[10-14]。本文采用UHPLC-QTOF/MS技术对生、醋五味子醇提取物中的主要活性成分木脂素在大鼠体内代谢产物进行差异性比较研究, 为进一步探讨五味子醋制增强保肝效果的物质基础和机制提供依据。
材料与方法仪器、试剂与药材 UHPLC系统(岛津公司, 日本), Triple TOF 5600串联飞行时间质谱仪(SCIEX公司, 美国); 电喷雾离子源(ESI), Analyst® TF 1.6工作站软件(SCIEX公司, 美国); Milli-Q超纯水净化系统(Millipore, Intagral-3, USA)。高效液相色谱纯的乙腈和甲酸分别购买自EMD Millipore公司(USA)、上海凌峰化学试剂股份有限公司; 分析纯的甲醇由上海申博化学试剂股份有限公司(上海, 中国)提供; 化学纯的羧甲基纤维素钠(CMC-Na)购自国药集团(上海, 中国)。五味子甲素、五味子乙素、五味子丙素、五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、戈米辛G、戈米辛J及五味子酚均购自上海源叶生物科技有限公司(含量≥98%)。五味子药材由安徽丰原铜陵中药饮片有限公司提供, 经南京中医药大学陆兔林教授鉴定。
实验动物 SPF级雄性SD大鼠, 约8周龄, 体重(200~220) g, 由上海斯莱克实验动物有限责任公司提供, 合格证号SCXK (沪) 2015-0005。
色谱检测条件 色谱分离采用C18反向色谱柱(Agilent ZorBax SB-C18 50 mm × 2.1 mm, 1.8 μm), 柱温控制在25 ℃; 流动相: 0.1%甲酸水(A)-乙腈(B), 梯度洗脱(血浆: 0~3 min, 23% B; 3~5 min, 23% → 34% B; 5~7 min, 34% → 40% B; 7~8 min, 40% → 42% B; 8~11.5 min, 42%~55% B; 11.5~13 min, 55% → 65% B; 13~14.5 min, 65% → 75% B; 14.5~19 min, 75% → 100% B; 19~24 min, 100% B; 24~26 min, 100% → 23% B; 26~28 min, 23% B。胆汁: 0~2 min, 15% → 21% B; 2~4 min, 21% B; 4~5 min, 21% → 23% B; 5~8 min, 23% B; 8~9 min, 23% → 30% B; 9~13 min, 30% B; 13~16 min, 30% → 37% B; 16~20 min, 37% B; 20~22 min, 37% → 100% B; 22~25 min, 100% B; 25~27 min, 100% → 15% B。尿液: 0~2 min, 15% → 21% B; 2~4 min, 21% B; 4~5 min, 21% → 23% B; 5~8 min, 23% B; 8~13 min, 23% → 34% B; 13~16 min, 34% → 40% B; 16~17 min, 40% → 80% B; 17~19 min, 80% → 100% B; 19~23 min, 100% B; 23~26 min, 100% → 15% B; 26~28 min, 15% B); 流速1.0 mL·min-1, 进样体积2 μL。
质谱检测条件 离子化模式为电喷雾正、负离子模式(ESI+/-), 正负离子源电压分别为5 kV/-4.5 kV, 离子源温度为550 ℃, 裂解电压(DP)分别为60 V/ -55 V, 碰撞能量(CE)分别为45 eV/-40 eV, 碰撞能量扩展(CES)分别为15 eV/-20 eV。雾化气体为氮气(N2), 雾化气(gas1)、辅助气(gas2)压力均设定为55 psi (1 psi ≈ 6.9 kPa), 气帘气(CUR)为35 psi。一级质谱母离子扫描范围为m/z 100~1 000, 子离子扫描范围为m/z 50~1 000, 开启动态背景扣除(DBS)。数据采集所用软件为Analyst® TF 1.6 software (AB SCIEX, Foster City, CA)。
生、醋五味子提取物的制备 生、醋五味子以《中国药典》2015版一部五味子【炮制】项下收载的炮制方法, 加工炮制即得:生品除去杂质, 用时捣碎。醋品:取净五味子, 加入20%醋拌匀, 润透, 置适宜的容器内, 用蒸汽加热至黑色, 取出, 晾凉, 干燥。加工炮制所得五味子饮片加85%乙醇回流提取2次, 合并提取液, 减压回收乙醇, 得五味子稠浸膏, 最后将浸膏加0.5% CMC-Na溶液研磨制成生、醋五味子醇提取液, 生药比浓度为1.5 g·mL-1。所得实验药物4 ℃条件下保存, 备用。
对照品溶液的制备 分别取各对照品5 mg, 精密称定, 置10 mL量瓶中, 加甲醇溶解, 定容制成对照品溶液。再分别量取各对照品溶液0.2 mL, 置10 mL量瓶中, 加甲醇定容制成混合对照品溶液。
生物样品的采集与供试液的制备 取实验环境下适应一周后的SD大鼠24只, 体重200~220 g; 将大鼠随机分为4组:空白组、模型组、生五味子组和醋五味子组; 此后的12天, 模型组、生五味子组、醋五味子组大鼠每日上午9时灌胃给予56°二锅头, 每次给药剂量为10 mL·kg-1体重, 空白组给予等剂量的生理盐水, 直至急性酒精性肝损伤模型建立(于造模过程的第0、4、8、12天取大鼠肝脏做病理切片, 进行肝损伤病理评价)。造模成功后, 给药前禁食12 h, 自由饮水, 按2.8 g·kg-1生药量给大鼠灌胃, 分别给予CMC-Na溶液和生、醋五味子醇提液, 连续给药2天, 于代谢笼中收集第2次给药后24 h内的大鼠尿液及粪便(粪便加5倍量水制成粪匀浆), 二者分别于12 000 r·min-1离心5 min (粪便样品需经过超声处理3 min), 取上清液, 于-80 ℃冻存备用。所有大鼠再次分别灌胃给予CMC-Na溶液和五味子醇提取物, 并于5 h后眼眶取血于预先涂有1%肝素钠生理盐水的EP管中, 离心10 min (12 000 r·min-1), 取上清液, 得到血浆样品。同时进行胆管插管引流术, 收集1~12 h的胆汁。以上生物样本均于-80 ℃条件下保存备用。
大鼠血浆样品供试液的制备 精密吸取血浆300 μL, 加入乙酸-水(20:80) 3 μL, 涡旋30 s, 加入甲醇1.2 mL沉淀蛋白, 涡旋混匀30 s, 离心10 min (12 000 r·min-1), 取上清液于EP管中, 4 ℃条件下氮气吹干, 上述方法重复操作一次, 最后以初始流动相150 μL复溶, 涡旋30 s, 离心5 min (12 000 r·min-1), 取上清液作为血浆样品供试液。
大鼠尿液、粪便、胆汁样品供试液的制备 精密吸取胆汁、尿液或粪便(匀浆上清液)样品400 μL, 置5 mL离心管中, 分别加甲醇3.6 mL, 涡旋30 s, 离心10 min (12 000 r·min-1), 取上清液于EP管中, 4 ℃条件下氮气吹干, 再次分别加入甲醇3.6 mL, 涡旋30 s, 离心10 min (12 000 r·min-1), 取上清液于EP管中, 4 ℃条件下氮气吹干, 最后以初始流动相200 μL复溶, 涡旋30 s, 离心5 min (12 000 r·min-1), 取上清液作为尿液、粪便或胆汁样品供试液。
数据采集 实验者预先通过文献研究及在线数据库检索, 建立五味子木脂素可能的代谢产物数据库, 然后将其输入Peak View软件中, 质谱数据检测误差范围设为 < 5 ppm, 并将质量亏损过滤(mass defect filter, MDF)应用于数据处理。
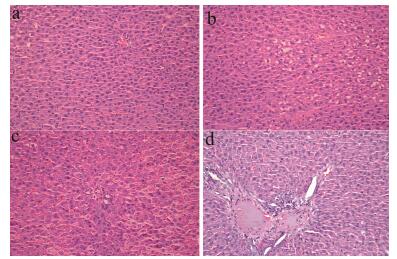
结果与讨论 1 肝损伤模型建立肝损伤病理评价结果可见, 急性酒精性肝损伤模型建立成功(图 1)。
|
Figure 1 Pathological photographs of rat liver (H & E). a: Day 0 (control group); b: Day 4; c: Day 8; d: Day 12 |
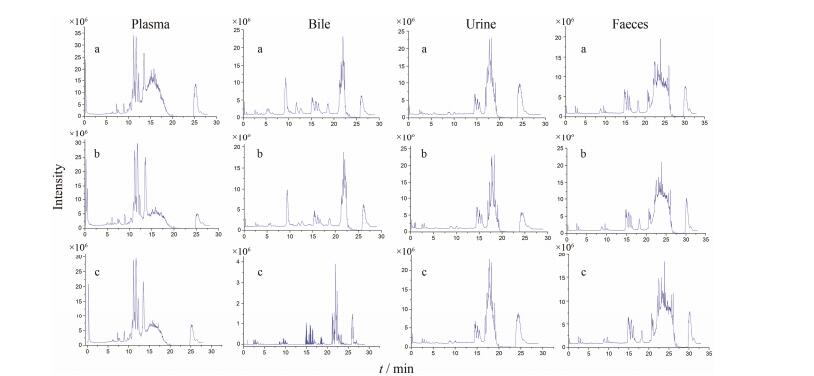
将空白血浆、胆汁、尿液、粪便和给药血浆、胆汁、尿液、粪便样品进行UHPLC-QTOF/MS分析, 正离子模式下的总离子流图如图 2 (由于负离子模式下, 给药血浆、胆汁、尿液、粪便样品中得到的信号响应值相对较低, 故未在图中列出)。在负离子模式下, 原形成分虽未全部检测到, 但木脂素代谢产物有较好的响应值。由于总离子流图是反应中涉及的所有离子的叠加图, 且生物样品中成分复杂, 木脂素成分峰之间的差异易被掩盖, 很难直观地从各组的总离子流图中看出显著差异。因此, 数据分析时要对总离子流图进行一系列处理, 包括背景扣除、基线校准、质量过滤、目标成分提取等。
|
Figure 2 The TIC chromatograms of plasma, bile, urine and faeces samples in positive ion mode. a: Blank group; b: Schisandra chinensis (SC) group; c: Vinegar Schisandra chinensis (VSC) group |
采用UHPLC-QTOF/MS分析, 得到一系列图 2中的总离子流图(TIC), 运用Peak View软件中的XIC Manager、BPC、DBS、EPL及MDF等功能对其进行处理, 然后与相同色谱、质谱条件下得到的对照品信息进行原形成分比对以及代谢产物分析。对初步匹配到的可能代谢物进行MS/MS分析, 以进一步确认代谢产物。本文中原形成分的鉴定都已经过对照品进行了验证, 所有代谢产物的鉴定结果是通过将化学空间结构导入软件进行验证的。
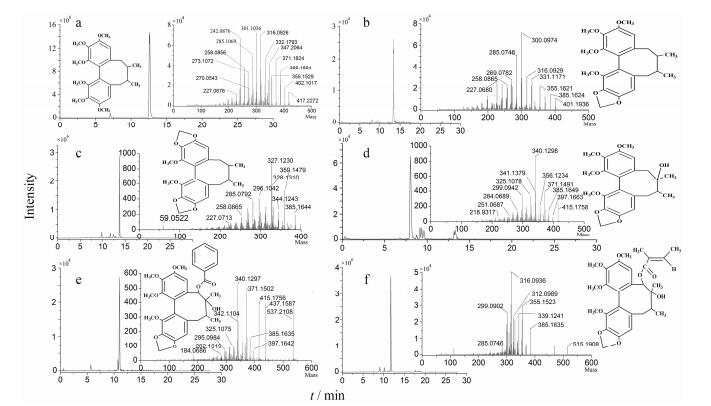
3.1 木脂素原形成分的结构鉴定本实验室前期研究已明确五味子醇提物中的主要成分为木脂素, 因此本实验将五味子总木脂素作为提取对象进行分析。通过网络数据库或文献检索, 如PubMed、SciFinder、CNKI等, 自建了五味子木脂素成分的相关信息数据库, 利用Analyst® TF 1.6软件的Peak View和Formula-finder等数据处理功能, 经过峰提取和解析, 并与对照品进行比对(图 3), 在大鼠血浆、胆汁、尿液及粪便中有6种五味子木脂素被初步鉴定出来, 分别是五味子甲素、五味子乙素、五味子丙素、五味子醇乙、五味子酯甲及五味子酯乙, 它们的提取离子流图(XIC)、二级质谱图(MS/MS)以及化学结构如图 4所示, 质谱等相关信息总结如表 1。

|
Figure 3 The extract ion chromatograms of Schisandra lignans mixed standard sample. 1: Gomisin G; 2: Schizandrol; 3: Gomisin J; 4: Schizandrol B; 5: Schisanhenol; 6: Schisantherin; 7: Schisantherin B; 8: Deoxyschizandrin; 9: Schizandrin B; 10: Schizandrin C |
|
Figure 4 The extract ion chromatograms, MS/MS spectra and chemical structure of deoxyschizandrin (a), schizandrin B (b), schizandrin C (c), schizandrol B (d), schisantherin (e), and schisantherin B (f) |
| Table 1 Summary information of 6 Schisandra lignans in rat plasma, bile, urine and faeces |
五味子木脂素具有共同的母核结构, 即联苯环辛二烯型木脂素, 因此它们的色谱行为及质谱信息都很相似, 在相同质谱条件下存在类似裂解规律, 可能出现相似的碎片离子。如m/z 285 [M+H]+这个碎片离子几乎在6种木脂素都出现了, 而五味子甲素、乙素及丙素均有m/z 227 [M+H]+的碎片离子; 除了五味子甲素及五味子丙素外, 其余4种木脂素成分都有m/z 385 [M+H]+这个碎片离子, 可能是由于它们的结构中都含有一个亚甲二氧基所致。以五味子甲素的鉴定为例, 其提取精确分子量为417.227 38, 二级质谱提供的主要碎片离子: m/z 402.101 7、386.180 4、371.182 4、355.152 9、347.206 4、332.179 3、316.092 6、285.106 9、273.107 2, 根据木脂素元素组成、相关裂解规律[15, 16]以及质量亏损过滤策略和数据库在线比对, 推测其分子式为C24H32O6, 从而进一步推断该成分为五味子甲素。采用上述相同方法一一解析鉴定并且与对照品进行, 最终确定了其余5种木脂素成分分别为五味子乙素、五味子丙素、五味子醇乙、五味子酯甲和五味子酯乙。
3.2 木脂素代谢产物的解析代谢物和母体药物一般都有类似的核心结构, 根据核心结构的性质和一般代谢物的生物转化方法, 预先收集整理了五味子木脂素可能代谢物的相关信息。木脂素在体内主要发生Ⅰ相代谢转化, 即水解、氧化、去甲基化或羟基化等。同时, 动态背景扣除法(dynamic background subtract, DBS)可以有效地从背景离子和混合矩阵的MS2谱中区分相关化合物碎片离子。通过提取离子流色谱(extract ion chromatogram, XIC)方法构建增强峰值列表(enhance peak list, EPL)、筛选精确的分子质量和碎片离子质量可以较为容易地预测代谢产物的元素组成。最后, 在准确分子质量、相关的药物的生物转化知识以及母体药物的碎片裂解模式的基础上鉴定代谢物结构。
本研究采用了Analyst® TF 1.6软件中的在线数据采集以及Peak View中MDF和DBS等多个采集后的数据前处理技术用以五味子木脂素代谢物系统的筛选和鉴定。在线数据采集是第一步, 独特和新颖的MDF和DBS数据采集方法获得完整的全波长扫描下准确的MS/MS谱图数据集。同时, 结合MetabolitepilotTM 1.5软件(AB SCIEX公司)的数据提取功能进行代谢物的识别, 使用的方法包括XIC、MDF、碎片离子过滤(product ion filter, PIF)和中性丢失过滤(neutral loss filter, NLF)。
五味子甲素、五味子乙素、五味子丙素、五味子醇乙、五味子酯甲和五味子酯乙的结构中取代基主要是甲基、甲氧基或者羟基, 所以甲基、甲氧基和羟基的损失是主要的碰撞诱导解离途径。为了便于分析, 作者根据其代谢产物的母体药物结构将木脂素成分大致分为两类, 五味子甲素、乙素和丙素三者结构相似, 归为一类, 五味子乙素、丙素是五味子甲素分别脱去1个CH4和2个CH4所得; 而五味子醇乙、酯甲、酯乙的结构中C8位上都含有一个-OH, 并且五味子酯甲、酯乙均可以由五味子醇乙结构中的C9位被羟基化后发生酯化反应所得, 因此归为另一类(这样分类的目的, 是为了分析与解释的合理性及严谨性, 并非严格地界定了这两组木脂素之间的关系, 因为从化学结构上, 联苯环辛烯木脂素理论上都有可能发生相互转化, 比如五味子乙素的C8位若直接发生羟基化就会转变成五味子醇乙, 但目前并没有相关研究明确证明这一体内转化反应的存在)。
采用上述方法, 作者在大鼠血浆、胆汁、尿液和粪便样本中最终确定了20种可能的代谢产物。从提取的质谱图可以看出, 五味子提取物经口服给药后在大鼠生物样品中能得到较好的分离, 根据保留时间、质谱信息及其误差值可以确定在大鼠生物样品中的成分。通过预先设定的代谢物模式, 以及对大鼠血浆、胆汁、尿液、粪便样品和空白样品进行筛选和解析, 最后确定了匹配度极高的20个峰:峰M1~M13是五味子甲素、乙素和丙素的代谢物群; 峰M14~M20是五味子醇乙、五味子酯甲或五味子酯乙的代谢物群, 各代谢产物详细的质谱数据、鉴定结果及可能的代谢转化途径如表 2所示。
| Table 2 Summary information of proposed metabolites of 6 lignans in rat plasma, bile, urine and faeces |
大鼠体内共鉴定出五味子甲素、乙素和丙素相关的代谢物群13种, 主要碎片离子等信息见表 2中M1~M13。在复杂的机体内环境下, 五味子甲素、乙素和丙素三者之间可能存在相互转化, 从它们的结构可以看出, 五味子乙素及五味子丙素分别是五味子甲素脱去1个CH4和2个CH4的产物。因此, M1~M13可能是它们三者的共同代谢产物。
在负离子模式下, 提取出了m/z 385 [M-H]-的分子离子峰, 较五味子甲素的分子质量损失了约30 Da, 推测M1可能是五味子甲素结构中的C-1和C-2或者C-13和C-14上的-OCH3被脱去以及C-7或C-8上的-CH3被氧化成-COOH (羧基)所得的产物。提取获得的m/z 401 [M+H]+分子离子峰(正离子模式), 较五味子甲素的分子质量减少了约16 Da, 结合其二级质谱行为及裂解规律, 研究人员推测M2极有可能是五味子甲素结构中的C-1、C-2、C-13或C-14上的-OCH3被脱去以及C-7或C-8上的-CH3被氧化成-CHO (醛基)所得的产物。同样, 提取获得的m/z 415 [M+H]+分子离子峰(正离子模式), 较五味子甲素的分子质量减少了约2 Da, 结合其二级质谱行为及裂解规律, 推测M3极有可能是五味子甲素结构中的C-5和C-9被氧化为羰基, 继而C-1、C-2、C-13或C-14上脱去一个-OCH3得到的代谢产物。采用上述相同的思路和方法, 研究人员随后又推测了M4~M13这10个潜在的五味子甲、乙、丙素的代谢产物。
3.2.2 五味子醇乙、五味子酯甲和五味子酯乙的代谢产物五味子醇乙、酯甲、酯乙三者的结构特征相似, 五味子酯甲和五味子酯乙分别是五味子醇乙的C-9位被羟基取代后与苯甲酸、3-甲基-2-丁烯酸的酯化物。因此, 推测它们可能存在共同的或者类似代谢产物。如M15就可能是五味子酯甲和五味子酯乙的水解产物, 而且也可能是五味子醇乙C-9位被羟基化的产物。值得指出的是, M15这一代谢产物存在几种同分异构体, 它也可能是五味子醇乙的C-4或C-11羟基化所得, 运用3.2.1项下的方法未成功区分, 推测了五味子醇乙、五味子酯甲及五味子酯乙的7种可能代谢产物, 即表 2中的M14~M20。
结果可知, 木脂素主要发生脱甲氧基、脱亚甲基及氧化反应, 几乎所有的代谢产物共享一些相同的碎片离子, 表明它们来自类似的化学结构。此外, 与原形化合物相比, 相应的代谢产物的保留时间有所缩短。从表 2的结果来看, 绝大多数木脂素代谢产物在生、醋五味子组的血浆、胆汁、尿液或粪便样品中都有分布, 然而醋五味子组的代谢物除了M17外, 其余的在胆汁中都有分布, 而生五味子组近一半的代谢物未在胆汁中被检出。相关研究结果表明, 五味子经不同方法炮制后并未发现有新的木脂素成分产生, 仅仅在含量上存在诸多差异[17, 18]。因此, 本研究推测五味子经醋制后的确改变了总木脂素的组成配比, 从而导致一些木脂素成分的吸收、分布及代谢差异。另外, 结果还显示五味子木脂素都能通过尿液和粪便排出体外, 且尿液是主要的排泄途径, 生、醋组间无显著性差异。
小结本研究首次将UHPLC-QTOF/MS分析技术应用于五味子总木脂素在大鼠血浆、胆汁、尿液及粪便中的定性研究, 并结合了质量亏损过滤、动态背景扣除、加强峰提取等先进的数据处理方法。通过峰提取、峰匹配、质谱解析以及在线数据检索, 最终鉴定出了正离子模式下6种木脂素成分及它们的20种代谢产物(正、负离子模式下)。限于现有实验条件, 某些代谢物存在的同分异构体未能一一区分出来, 这有待于借助更精确的技术和方法进行深层次的研究和分析。但本实验首次在动物病理模型基础上进行药物代谢研究, 这点更加符合实际临床用药的特点, 以期证明药物在正常机体内的代谢水平是有别于病理状态下的, 这一观点需要后续研究的进一步验证。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 ed. Vol 2. Beijing:China Medical Science Press, 2010:61-62. |
| [2] | He FC, Li SX, Zhao ZQ, et al. Simultaneous quantitative analysis of four lignanoids in Schisandra chinensis by quantitative analysis of multicomponents by single marker[J]. Acta Pharm Sin (药学学报) , 2012, 47 :930–933. |
| [3] | Lu TL, Hu JY, Mao CQ, et al. Quality analysis of raw and processed Schisandra chinensis fructus by simultaneous determination of eleven bioactive lignans using RP-HPLC method[J]. J Food Drug Anal , 2012, 20 :561–568. |
| [4] | Cheng ZY, Yang YJ, Liu Y, et al. Two-steps extraction of essential oil, polysaccharides and biphenyl cyclooctene lignans from Schisandra chinensis Baill fruits[J]. J Pharm Biomed Anal , 2014, 96 :162–169. DOI:10.1016/j.jpba.2014.03.036 |
| [5] | Zhu LJ, Li B, Liu XY, et al. Purification of six lignans from the stems of Schisandra chinensis by using high-speed counter-current chromatography combined with preparative high-performance liquid chromatography[J]. Food Chem , 2015, 186 :146–152. DOI:10.1016/j.foodchem.2014.09.008 |
| [6] | Hu D, Yang ZY, Yao XC, et al. Dibenzocyclooctadiene lignans from Schisandra chinensis and their inhibitory activity on NO production in lipopolysaccharide-activated microglia cells[J]. Phytochemistry , 2014, 104 :72–78. DOI:10.1016/j.phytochem.2014.04.014 |
| [7] | Chun JN, Cho M, So I, et al. The protective effects of Schisandra chinensis fruit extract and its lignans against cardiovascular disease:a review of the molecular mechanisms[J]. Fitoterapia , 2014, 97 :224–233. DOI:10.1016/j.fitote.2014.06.014 |
| [8] | Zhong S, Nie YC, Gan ZY, et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure[J]. J Ethnopharmacol , 2015, 165 :73–82. DOI:10.1016/j.jep.2015.02.009 |
| [9] | Xue YB, Li XF, Du X, et al. Isolation and anti-hepatitis B virus activity of dibenzocyclooctadiene lignans from the fruits of Schisandra chinensis[J]. Phytochemistry , 2015, 116 :253–261. DOI:10.1016/j.phytochem.2015.03.009 |
| [10] | Liu MY, Zhao SH, Wang ZQ, et al. Identification of metabolites of deoxyschizandrin in rats by UPLC-Q-TOF-MS/MS based on multiple mass defect filter data acquisition and multiple data processing techniques[J]. J Chromatogr B , 2014, 949-950 :115–126. DOI:10.1016/j.jchromb.2013.12.022 |
| [11] | Seip KF, Bjerknes KC, Johansen HT, et al. Bradykinin analysis revived-a validated method for determination of its stable metabolite in whole blood by LC-MS/MS[J]. J Chromatogr B , 2014, 947-948 :139–144. DOI:10.1016/j.jchromb.2013.12.033 |
| [12] | Wei BB, Li Q, Su D, et al. Development of a UFLC-MS/MS method for simultaneous determination of six lignans of Schisandra chinensis (Turcz.) Baill. in rat plasma and its application to a comparative pharmacokinetic study in normal and insomnic rats[J]. J Pharm Biomed Anal , 2013, 77 :120–127. DOI:10.1016/j.jpba.2013.01.029 |
| [13] | Liang J, Xu F, Zhang YZ, et al. The profiling and identification of the absorbed constituents and metabolites of Paeoniae Radix Rubra decoction in rat plasma and urine by the HPLC-DAD-ESI-IT-TOF-MSn technique:a novel strategy for the systematic screening and identification of absorbed constituents and metabolites from traditional Chinese medicines[J]. J Pharm Biomed Anal , 2013, 83 :108–121. DOI:10.1016/j.jpba.2013.04.029 |
| [14] | Zhong XL, Guo J, Wang LY, et al. Analysis of the constituents in rat serum after oral administration of Fufang Zhenzhu Tiaozhi capsule by UPLC-Q-TOF-MS/MS[J]. Chromatogr B , 2012, 75 :111–129. DOI:10.1007/s10337-011-2164-6 |
| [15] | Huang X, Song FR, Liu ZQ, et al. Structural characterization and identification of dibenzocyclooctadiene lignans in Fructus Schisandrae using electrospray ionization ion trap multiplestage tandem mass spectrometry and electrospray ionization Fourier transform ion cyclotron resonance multiple-stage tandem mass spectrometry[J]. Anal Chim Acta , 2008, 615 :124–135. DOI:10.1016/j.aca.2008.03.056 |
| [16] | Huang X, Song FR, Liu ZQ, et al. Studies on lignan constituents from Schisandra chinensis (Turcz.) Baill. fruits using high-performance liquid chromatography/electrospray ionization multiple-stage tandem mass spectrometry[J]. J Mass Spectrom , 2007, 42 :1148–1161. DOI:10.1002/(ISSN)1096-9888 |
| [17] | Pang SF, Zheng PH, Xu SQ, et al. Influence of processing on lignans of Schisandra chinensis[J]. Chin Tradit Pat Med (中成药) , 2011, 33 :284–286. |
| [18] | Tian JH. The influence of different processing methods on content of lignanoids in Schisandra chinensis[J]. Prog Pharm Sci (药学进展) , 2009, 33 :267–270. |
 2016, Vol. 51
2016, Vol. 51


