毛鸡骨草为豆科相思子属植物毛相思子(Abrus mollis Hance)的全草, 味甘淡, 性凉, 归心肝经, 功效舒肝止痛、清热利湿、活血散瘀, 用于治疗急慢性肝炎、肝胆实热、肝硬化腹水、咽喉肿痛、胃痛、风湿痹痛等症[1], 常作鸡骨草的替代品使用, 主产我国广东、广西、福建和海南等地[1, 2]。现代研究表明毛鸡骨草富含黄酮类、皂苷类、生物碱、有机酸、色原酮、木脂素类等生物活性成分[3-9], 具有保肝、抗炎、抗菌、抗病毒、抗肿瘤、免疫调节、降血糖、降血脂等作用[10-18]。作者前期研究发现毛鸡骨草叶富含吐昔酰胺酸类衍生物[9], 通过进一步研究, 分离得到了6个化合物: 1个生物碱类成分:葫芦巴碱(1); 4个酰胺酸类成分:丙氨酸酐(3)、顺式-N-(4-羟基桂皮酰)酪氨酸(4)、反顺式-N-(4-羟基桂皮酰)酪氨酸(5)、鸡骨草丙素(6); 一个氨基酸:脯氨酸(2)。化合物6为新化合物, 化合物1~4均是首次从该植物中分离得到。
化合物6白色至浅黄色无定形结晶粉末, 易溶于甲醇、乙醇、乙腈和热水, 其紫外吸收光谱表明含有苯环(226、275 nm)。由高分辨质谱(Negative-ESI-MS m/z: 653.200 6 [M-H]-, 654.223 6 [M]+)推测该化合物分子式为C36H34N2O11 (相对分子质量为654.221 3)。由1H NMR (500 MHz, DMSO-d6)分析可知, δ9.15推断为苯环的羟基, 由δ6.85 (2H, d, J=8.5 Hz, H-2'', 6'')、6.59 (2H, d, J=8.5 Hz, H-3'', 5'')、2.44 (1H, dd, J=7.0, 13.5 Hz, H-7'')、2.54 (1H, dd, J=7.0, 13.5 Hz, H-7'')、3.96 (1H, dd, J=6.5, 14 Hz, H-8'')和δ6.78 (2H, d, J=8.5 Hz, H-2''', 6''')、6.59 (2H, d, J=8.5 Hz, H-3''', 5''')、2.63 (1H, dd, J=7.5, 13.5 Hz, H-7''')、2.83 (1H, dd, J=7.5, 13.5 Hz, H-7''')、3.96 (1H, dd, J=6.5, 14 Hz, H-8'''), 结合其相应的13C NMR、HMBC和HSQC谱推断应为两个天然L-酪氨酸基团; 再由δ7.00 (2H, d, J=8.5 Hz, H-2, 6)、6.65 (2H, d, J=8.5 Hz, H-3, 5)、3.92 (1H, d, J=10.5 Hz, H-7)、3.71 (1H, d, J=4.5 Hz, H-8)和δ6.81 (2H, d, J=8.5 Hz, H-2', 6')、6.55 (2H, d, J=8.5 Hz, H-3', 5')、3.90 (1H, d, J=4.5 Hz, H-7')、3.71 (1H, dd, J=4.5, 11.0 Hz, H-8'), 结合其相应的13C NMR、HMBC和HSQC谱推断该基团应为吐昔酰。根据该化合物和文献中鸡骨草甲素和乙素的波谱数据[9]情况分析, 该化合物应该也是1个4, 4'-二羟基吐昔酸和两个酪氨酸的酰胺化物, 属构型异构的同分异构体化合物, 其中关键不同之处在于吐昔酸的环丁烷构象方面, 鸡骨草甲素和乙素的吐昔酸构型分别为α-和ε-构型[9], α-构型中环丁烷[7(7'), 8(8')]位氢质子存在两个偶合常数(J=5.5, 9.0 Hz), ε-构型的氢质子只有1个偶合常数(J=9.0 Hz)[9], 而化合物6中环丁烷的4个氢质子的化学位移值和偶合常数均不同(图 1): H-7为(δ3.92, d, J=10.5 Hz)、H-7'为(δ 3.90, d, J=4.5 Hz)、H-8为(δ 3.71, d, J=4.5 Hz)、H-8'为(δ 3.71, dd, J=4.5, 11.0 Hz), 由HMBC谱可观察到H质子与周围C质子的相关情况(图 2), 结合13C NMR、HSQC数据, 并与文献数据对比分析[19], 推断化合物6的吐昔酸构象为γ-构型。由于γ-构型吐昔酸与两个L-酪氨酸通过酰胺键连接, 形成了完全不对称化合物, 从化合物的1H NMR和13C NMR谱中各个峰的化学位移值的发生分裂可以看出, 两个酪氨酸基中的7''与7'''位的H质子的化学位移值(7''-H, δ 2.44, 2.54; 7'''-H, δ2.63, 2.83)均不相同, 主要受化合物空间位阻不同所致。δH 7.83 (s)为NH的H质子位移, δH 9.15为-OH上的H质子位移。综合上述分析, 结合NMR、HSQC和HMBC谱的结果, 推断化合物6的结构为(2S, 2'S)-2, 2'-(((1R, 2R, 3S, 4S)-2, 4-双(4-羟基苯基)环丁烷二羰基)双(脲二基))双(3-(4-羟基苯基)丙酸), [(2S, 2'S)-2, 2'-(((1R, 2R, 3S, 4S)-2, 4-bis(4-hydroxyphenyl)cyclobutanedicarbonyl) bis(azanediyl))bis(3-(4-hydroxyphenyl)propanoic acid)], 经Scifinder检索, 化合物6为新的γ-构型双酪氨酸吐昔酰胺化合物, 命名为鸡骨草丙素(abrusamide C)。化合物6的结构见图 3, 其氢谱碳谱数据见表 1。
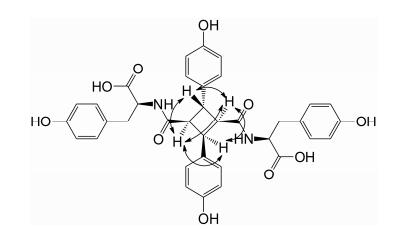
|
Figure 1 The H-H correlation of compound 6 (part of cyclobutane) |

|
Figure 2 The HMBC of compound 6 (part of cyclobutane) |
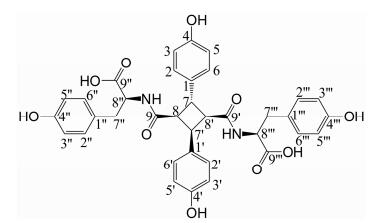
|
Figure 3 The structure of compound 6 |
| 表 1 1H NMR (DMSO-d6, 500 MHz) and 13C NMR (DMSO-d6, 125 MHz) data of compound 6 |
快速制备色谱仪(Biotage Isolera 1); Agilent 1100高效液相色谱仪(美国安捷伦公司); UV-1700紫外可见分光光度仪(日本岛津); 1H NMR (500 MHz)、13C NMR (125 MHz)和2D核磁谱用Bruker 500 MHz数字化核磁共振仪测定, 正负离子高分辨质谱(HR-ESI-MS)用Waters液质联用仪测定, 化合物纯度用Agilent 1100高效液相色谱仪(二极管阵列检测器)测定。
反相C18硅胶填料(YMC GEL ODS-A-HG12 nm S-50 μm AAG12S50);柱色谱硅胶(100~200目, 青岛海洋化工厂); 大孔树脂、聚酰胺(100~200目, 浙江台州路桥四甲化生厂); LH-20型葡聚糖凝胶(北京春达科技有限公司); 薄层色谱硅胶板(青岛海洋化工厂); 甲醇和乙腈为色谱纯, 水为纯水; 氯仿、正丁醇、乙醇、甲醇等试剂均为分析纯。
1 提取分离毛鸡骨草叶2 kg, 用水、50% (体积分数)乙醇提取2次, 每次1 h, 合并提取液, 浓缩至1 L, 依次用氯仿、乙酸乙酯、水饱和正丁醇萃取, 各萃取液减压浓缩, 分别得氯仿部位50 g、乙酸乙酯部位65 g、正丁醇部位286 g。
将正丁醇部位用少量溶剂溶解, 硅胶拌匀, 水浴蒸干, 再过80目筛, 上硅胶柱(直径15 cm, 长40 cm), 分别用氯仿1 L、正丁醇3 L、正丁醇-乙醇(10:3)5 L、正丁醇-乙醇(10:10) 3 L洗脱, 收集各部分洗脱液, 回收溶剂至干, 合并正丁醇和正丁醇-乙醇(10:3)两部分, 用少量水溶解, 再上聚酰胺柱(直径8 cm, 长30 cm)层析, 分别用水(500、500 mL)、10%乙醇(500、500、500、500 mL)、20%乙醇(500、500、500、500 mL)、30%乙醇(500、500、500、500 mL)、40%乙醇(500、500、500、500 mL)、50%乙醇(500、500、500、500 mL)、95%乙醇3 L洗脱, 分别回收溶剂至干, 用高效液相色谱仪检测, 合并相同主成分流份, 分别得到水洗部分(Ⅰ)、30%~50%乙醇洗部分(Ⅱ)、95%乙醇洗部分(Ⅲ) 3部分洗脱液。
将Ⅰ部分水洗液分成两部分, 一部分上阴离子交换树脂, 用水洗脱至无色, 收集洗脱液, 减压浓缩后用甲醇或纯水反复重结晶, 得到化合物1 (30 mg)。另一部分回收浓缩至干, 乙醇少量溶解, 用少量柱色谱硅胶拌匀, 水浴蒸干, 80目过筛, 上硅胶柱(直径10 cm, 长50 cm), 分别用氯仿、正丁醇、正丁醇-甲醇10:1变化到10:10, 每部分1 L。各部分用薄层色谱检测, 合并相同主成分流份, 再分别用硅胶柱反复柱色谱纯化, 回收溶剂, 甲醇重结晶, 最后分离得到化合物2 (38 mg)和化合物3 (12 mg)。
将Ⅱ部分乙醇洗脱液上中压制备C18柱, 20%~40%甲醇梯度洗脱, 收集洗脱液(每100 mL为一流份), 共收集19个流分, HPLC检测, 合并相同流份, 减压浓缩后用甲醇或水反复重结晶, 流份6~8得到化合物4 (20 mg)和流份14~15得到化合物5 (80 mg)。
将Ⅲ部分洗脱液减压浓缩后上硅胶柱(100~200目)洗脱, 用乙酸乙酯-正丁醇(体积比5:0~5:5)梯度洗脱, 收集洗脱液(500 mL为一流份), 共收集到25个流份, 将流份21再用C18色谱柱纯化分离, 用20%~90%乙醇梯度洗脱, 收集洗脱液(200 mL为一流份), HPLC检测, 合并相同流份, 减压浓缩后用甲醇及纯水反复重结晶, 得化合物6 (32 mg)。
2 结构鉴定化合物1 白色针状结晶(甲醇), 易溶于水、热甲醇, 分子式为C7H7NO2。1H NMR (500 MHz, DMSO-d6) δ 9.14 (1H, s, H-2), 8.84 (1H, d, J=8.0 Hz, H-4), 8.85 (1H, d, J =5.5 Hz, H-6), 8.10 (1H, d, J=7.0 Hz, H-5), 4.45 (3H, s, CH3); 13C NMR (125 MHz, DMSO-d6) δ 144.945 (C-2), 127.851 (C-3), 146.117 (C-4), 127.851 (C-5), 146.011 (C-6), 48.452 (C-7)。以上1H NMR、13C NMR数据与文献[20]一致, 鉴定化合物1为葫芦巴碱(trigonelline)。
化合物2 桔黄色油状物, 溶于水和甲醇; TLC薄层色谱以1%茚三酮乙醇溶液显色结果呈一亮黄色斑点, 提示为氨基酸类化合物。分子式为C5H9O2N。1H NMR (500 MHz, MeOD) δ8.53 (1H, s, N-H), 4.00 (1H, dd, J=9.0, 6.5 Hz, H-2), 3.37 (1H, m, H-5a), 3.26 (1H, m, H-5b), 2.28 (1H, m, H-3a), 2.10 (1H, m, H-3b), 1.96 (2H, m, H-4a, 4b); 13C NMR (125 MHz, MeOD) δ 174.385 (COOH), 62.579 (C-2), 47.014 (C-5), 30.492 (C-3), 25.195 (C-4)。以上1H NMR、13C NMR数据与文献[21]一致, 鉴定化合物2为脯氨酸(proline)。
化合物3 白色粉末, 易溶于甲醇, 不溶于水, 分子式为C6H10N2O2。1H NMR (500 MHz, MeOD) δ 4.24 (1H, d, J= 6.5 Hz), 1.41 (3H, d, J=7.0 Hz); 13C NMR (125 MHz, MeOD)δ 181.447 (s, C-2, 5), 69.944 (d, C-3, 6), 21.065 (d, C-7, 8)。以上1H NMR、13C NMR数据与文献[22]一致, 鉴定化合物3为丙氨酸酐(alanine anhydride), 即3, 6-二甲基-2, 5-哌嗪二酮(3, 6-dimethyl-2, 5-piperazinedione)。
化合物4 淡黄色粉末, 溶于甲醇, 微溶于水; 分子式为C18H17NO5。1H NMR (500 MHz, DMSO-d6)δ 7.70 (NH), 7.54 (2H, d, J=8.5 Hz, H-2, 6), 6.97 (2H, d, J=8.5 Hz, H-2', 6'), 6.66 (2H, d, J=8.5 Hz, H-3', 5'), 6.59 (2H, d, J=8.5 Hz, H-3, 5), 6.42 (1H, d, J=13.0 Hz, H-7), 5.78 (1H, d, J=13.0 Hz, H-8), 4.26 (1H, m, H-8'), 3.01 (1H, d, J=11.5 Hz, H-7'), 2.76 (1H, dd, J=11.0, 7.5 Hz, H-7'); 13C NMR (125 MHz, DMSO-d6) δ 165.280 (C-9, 9'), 157.940 (C-4), 155.573 (C-4'), 136.700 (C-7), 132.058 (C-2, 6), 130.087 (C-2', 6'), 128.944 (C-1'), 126.156 (C-1), 120.971 (C-8), 114.696 (C-3, 5, 3', 5'), 55.200 (C-8'), 36.750 (C-7')。以上1H NMR、13C NMR数据与文献[23]比较, 鉴定化合物4为顺式-N-(4-羟基桂皮酰)酪氨酸[(Z)-N-(4-hydroxycinnamoyl)tyrosine]。
化合物5 淡黄色粉末, 溶于甲醇, 微溶于水; 分子式为C18H17NO5。1H NMR (500 MHz, DMSO-d6) δ 9.25 (2 Ar-OH, OH-4, 4'), 7.86 (NH), 7.36 (2H, d, J=8.5 Hz, H-2, 6), 7.24 (1H, d, J=16.0 Hz, H-7), 7.00 (2H, d, J=8.5 Hz, H-2', 6'), 6.77 (2H, d, J =8.5 Hz, H-3, 5), 6.60 (2H, d, J=8.5 Hz, H-3', 5'), 6.53 (1H, d, J =16.0 Hz, H-8), 4.38 (1H, m, H-8'), 3.03 (1H, d, J=10.5 Hz, H-7'), 2.81 (1H, dd, J =10.5, 14.5 Hz, H-7'); 13C NMR (125 MHz, DMSO-d6) δ 173.586 (C-9'), 165.105 (C-9), 158.930 (C-4), 155.795 (C-4'), 138.930 (C-7), 130.064 (C-2', 6'), 129.259 (C-2, 6), 127.326 (C-1'), 125.853 (C-1), 118.544 (C-8), 115.758 (C-3, 5), 114.904 (C-3', 5'), 54.486 (C-8'), 36.383 (C-7')。化合物5的1H NMR和13C NMR波谱数据与化合物4具有相似性, 其主要差异在于双键位置C-7和C-8的H质子相互之间的偶合常数上, 由7.24 (1H, d, J=16.0 Hz, H-7)、6.53 (1H, d, J=16.0 Hz, H-8)推断化合物5中应连接的是反式-对香豆酰基团, 结合以往所得1H NMR和13C NMR波谱数据, 并与文献[22]一致, 鉴定化合物5为反式-N-(4-羟基桂皮酰)酪氨酸[(E)-N-(4-hydroxycinnamoyl) tyrosine]。
化合物6 白色至浅黄色不定形结晶粉末, 易溶于甲醇、乙醇、乙腈和热水, 分子式为C36H34N2O11。UV λmax 226、275 nm, Negative-ESI-MS m/z 653.200 6 [M-H]- (计算值654.221 3)。1H NMR和13C NMR数据见表 1。
| [1] | China Pharmaceutical University. Thesaurus of Chinese Materia Medica (中药辞海)[M]. Beijing: China MedicoPharmaceutical Science and Technology Publishing House, 1996 . |
| [2] | Editorial Committee of Flora of China of Chinese Academy of Sciences. Flora of China (中国植物志)[M]. Beijing: Science Press, 1994 : 123 . |
| [3] | Wen J, Shi HM, Tu PF. Chemical constituents of Abrus mollis[J]. Chin Tradit Herb Drugs (中草药) , 2006, 37 :658–660. |
| [4] | Yuan XJ, Zhang P, Wu YH, et al. Determination of total flavonoids in Abrus mollis[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志) , 2015, 21 :80–84. |
| [5] | Yuan XJ, Li CY, Zhang P. Simultaneous determination of three flavones C-glycosides in leaves of Herba abri by quantitative analysis of multicomponents by single marker[J]. Tradit Chin Drug Res Clin Pharm (中药新药与临床药理) , 2014, 25 :493–497. |
| [6] | Liu ZW, Que ZL, Ye ZW, et al. Chemical constituents from the aerial parts of Abrus mollis[J]. Chin J Nat Med (中国天然药物) , 2008, 6 :415–417. |
| [7] | Lu WJ, Chen JY, Wei H, et al. Isoflavones from Abrus mollis[J]. Chin Tradit Herb Drugs (中草药) , 2004, 35 :1331–1333. |
| [8] | Lu WJ, Tian XY, Chen JY, et al. Study on the chemical constituents in Abrus mollis[J]. West China J Pharm Sci (华西药学杂志) , 2003, 18 :406–408. |
| [9] | Yuan XJ, Lin L, Zhang XQ, et al. Abrusamide A and B, two hepatoprotective isomeric compounds from Abrus mollis Hance[J]. Phytochem Lett , 2014, 7 :137–142. DOI:10.1016/j.phytol.2013.11.003 |
| [10] | Zhou F, Li AY. Anti-inflammatory and immune experiment of Abrus cantoniensis and Abrus mollis[J]. Yunnan J Tradit Chin Med Mater Med (云南中医中药杂志) , 2005, 26 :33–34. |
| [11] | Chen XB, Wang XP, Wei M. Effect of Abrus mollis Hance on HBsAg and HBeAg in the HepG2.2.15 Cells[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志) , 2011, 17 :184–186. |
| [12] | Miyao H, Arao T, Udayama M, et al. Kaikasapnin Ⅲ and soyasaponin Ⅰ, major triterpene saponins of Abrus cantoniensis, act on GOT and GPT:influence on transamlnase elevation of rat liver cells coneomitantlv exposed to CCl4 for one hour[J]. Planta Med , 1998, 64 :5–7. DOI:10.1055/s-2006-957355 |
| [13] | Li AY, Zhou F, Cheng CX. Protective effect of Herba abri and semi-finished Herba abri on acute liver lesion[J]. Yunnan J Tradit Chin Med Mater Med (云南中医中药杂志) , 2006, 27 :35–36. |
| [14] | Zhang Z, Lu L, Liu Y, et al. Comparing and authenticating on anatomical aspects of Abrus cantoniensis and Abrus mollis by microscopy[J]. Pharmacognosy Res , 2015, 7 :148–155. DOI:10.4103/0974-8490.150526 |
| [15] | Yang M, Shen Q, Li LQ, et al. Phytochemical profiles, antioxidant activities of functional herb Abrus cantoniensis and Abrus mollis[J]. Food Chem , 2015, 177 :304–312. DOI:10.1016/j.foodchem.2015.01.054 |
| [16] | Wang Y, Jiang ZZ, Chen M, et al. Protective effect of total flavonoid C-glycosides from Abrus mollis extract on lipopolysaccharide-induced lipotoxicity in mice[J]. Chin J Nat Med (中国天然药物) , 2014, 12 :461–468. |
| [17] | Chen M, Wang T, Jiang ZZ, et al. Anti-inflammatory and hepatoprotective effects of total flavonoid C-glycosides from Abrus mollis extracts[J]. Chin J Nat Med (中国天然药物) , 2014, 12 :590–598. |
| [18] | Chen XB, Mo ZX, Cao XL. Effects of Abrus mollis Hance on blood lipids and hemorrheology in hyperlipidemia rats[J]. Pharm Clin Chin Mater Med (中药药理与临床) , 2009, 25 :40–42. |
| [19] | Ojima I, Deutsch D, Kaczocha M, et al. Alpha-and gammatruxillic acid derivatives and pharmaceutical compositions thereof:US, 20150183715[P]. 2015-07-02. |
| [20] | Zhang YY, Guo YZ, Ageta H, et al. Studies on the constituents of aerial parts of Scutellaria planipes[J]. J Chin Pharm Sci , 1998, 7 :100–102. |
| [21] | Fang SD, Zhu RH. The chemical constituents of leaves of hih-chun-tze, Quisqualis indica L[J]. Acta Chim Sin (化学学报) , 1964, 30 :226–229. |
| [22] | Abate L, Palecz B, Giancola C, et al. Heat capacities, and enthalpies and entropies of fusion of some uncharged small peptides (N-acetylamino acid amides and 2, 5-diketopiperazines)[J]. J Chem Thermodyn , 1997, 29 :359–368. DOI:10.1006/jcht.1996.0161 |
| [23] | Stask T, Hofmannt T. Isolation, structure determination, synthesis, and sensory activity of N-phenylpropenoyl-L-amino acids from cocoa (Theobroma cacao)[J]. J Agric Food Chem , 2005, 53 :5419–5428. DOI:10.1021/jf050458q |
 2016, Vol. 51
2016, Vol. 51


