2. 北京大学药学院分子与细胞药理学系, 北京大学IDG麦戈文脑科学研究所, 北京 100191 ;
3. 江苏恩华药物研究院, 江苏 徐州 221116
2. Department of Molecular and Cellular Pharmacology, PKU-IDG/McGovern Institute for Brain Research, School of Pharmaceutical Sciences, Peking University, Beijing 100191, China ;
3. Jiangsu Nhwa Pharmaceutical Co., Ltd., Xuzhou 221116, China
烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor, nAChR)是配体门控型离子通道, 属于半胱氨酸环受体超家族[1], 广泛分布在中枢神经系统[2]和外周神经系统[3]。目前已经克隆出α1~α10、β1~β4、γ、δ和ε十七种亚单位[4, 5]。结构和功能多样的nAChR与许多疾病有关, 如阿尔茨海默症、精神分裂症、帕金森症、抑郁[6]和炎症[7]。α7烟碱型乙酰胆碱受体(α7 nAChR)是由5个α7亚单位组成的同源五聚体, 在大脑中高度表达, 特别是在与认知和记忆功能密切相关的大脑皮层和海马区[8]。大量研究表明, α7 nAChR功能下降与神经精神疾病认知障碍相关, 暗示α7 nAChR可以作为潜在的治疗靶点[9, 10]。
α7 nAChR激动剂的研究取得了大量的成果[11], 其中一些激动剂如GTS-21[12, 13]、AQW051[14]和EVP-6124[15-18] (图 1)已经进入临床试验, 用于治疗阿尔茨海默症或精神分裂症相关的认知障碍[19]。然而, 不良的药代动力学性质、心血管或胃肠道严重不良反应、或临床治疗无效等问题阻碍了多个激动剂的进一步研究。因此, 开发新的活性高、安全性好的α7 nAChR激动剂具有重要意义。
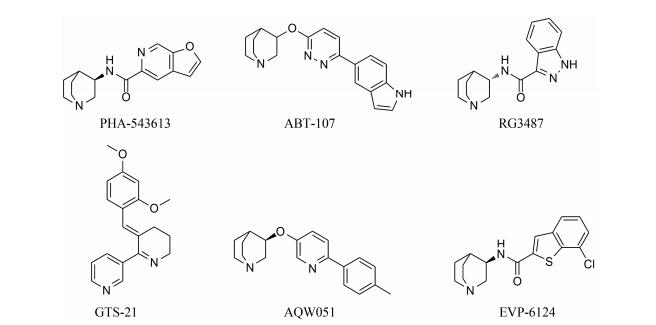
|
Figure 1 Examples of α7 nAChR agonists |
药效团模型显示, α7 nAChR激动剂基本包含1个正电荷中心、1个氢键受体和1个疏水中心[20]。奎宁环是最常见的正电荷中心骨架, 其桥头氮原子可以保证在较小的体积空间需求下提供与受体较大的静电相互作用, 是一个理想的正电荷中心[21], 因此奎宁环被应用到本研究的化合物设计中。通过将中氮茚环作为疏水基团引入到α7 nAChR激动剂中, 探讨疏水基团性质对于化合物激动活性的影响。前期的研究发现, 将中氮茚环作为疏水基团是合理的, 中氮茚类化合物具有不同程度的激动活性, 在中氮茚六元环引入卤素能够提高活性[22], 而在5-位以外的位置引入芳香环导致活性下降[23] (图 2)。因此, 中氮茚类化合物的构效关系值得进一步的探究。

|
Figure 2 Initial SAR results and Br-IQ17B in our previous work |
在本研究中, 对中氮茚环的结构修饰分别为:在5-位和8-位引入含炔基的基团, 在5-位引入取代氨基, 以及在6-位和8-位引入小的疏水基团。采用双电极电压钳方法评价所合成的化合物在表达人类α7 nAChR的非洲爪蟾卵母细胞上是否具有激动活性。通过剂量-效应实验测量化合物的半数最大效应浓度(EC50)和最大效应(Emax)。
结果与讨论 1 化合物的合成所有化合物都是从溴代中氮茚羧酸甲酯(化合物4a~4c)这一关键中间体出发, 经过类似的3步反应合成。化合物4a~4c的合成以商业购买的试剂为原料, 参照前期研究中的路线[23] (合成路线1)。在本研究中, 首先通过钯催化的偶联反应等合成方法, 将溴代中氮茚羧酸甲酯的溴原子替代为不同类型的取代基, 得到羧酸甲酯类中间体5、10和14。随后在碱性条件下水解、经盐酸酸化得到羧酸衍生物, 然后与(R)-3-氨基奎宁二盐酸盐缩合得到目标化合物。
含取代乙炔基类衍生物7a~7j、8a~8b和9的合成参照合成路线2。化合物衍生的关键步骤是中间体4a~4c和各种含炔基试剂发生Sonogashira偶联反应。在5-位引入取代氨基化合物12a~12e和13的合成参照合成路线3。化合物衍生的关键步骤是中间体4a和4c与各种胺发生Buchwald偶联反应。在6-位和8-位引入小疏水基团的化合物16a~16c和17a~17c的合成参照合成路线4。化合物衍生的关键步骤为Heck反应(16a和17a)和Suzuki反应(16b、16c和17b、17c)。
2 活性评价采用双电极电压钳方法评价所有合成的化合物在表达人类α7 nAChR的非洲爪蟾卵母细胞上是否具有激动活性。通过单一剂量评价进行初步筛选, 通过剂量-效应实验测量化合物的EC50和Emax值。
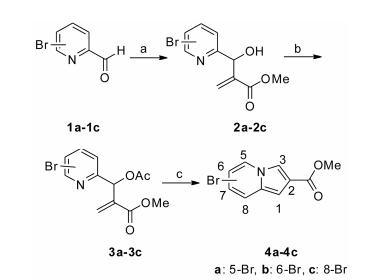
|
Scheme1 Synthetic routes of 4a-4c. Reagents and conditions: a) Methyl acrylate, DABCO, 1, 4-dioxane/H2O, r.t., 3 h; b) Ac2O, 140 ℃, 2 h; c) 140 ℃, 2 h |
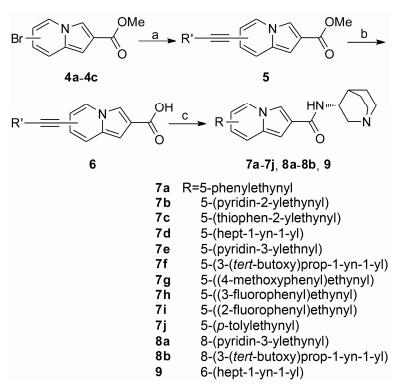
|
Scheme2 Synthetic routes of 7a-7j, 8a-8b, and 9. Reagents and conditions: a) Alkyne, Pd(dppf)2Cl2, CuI, trimethylamine, DMF, 60-80 ℃, Ar, 6-12 h; b) 1) KOH, THF/MeOH/H2O, reflux, 2-6 h; 2) 1 mol·L-1 HCl (aq), 0 ℃; c) (R)-3-aminoquinuclidine dihydrochloride, HATU, DIPEA, DCM, 0 ℃-r.t., 3-6 h |

|
Scheme3 Synthetic routes of 12a-12e and 13. Reagents and conditions: a) Amide, Pd(OAc)2, BINAP, Cs2CO3, Ar, 60-80 ℃, 8-12 h; b) 1) KOH, THF/MeOH/H2O, reflux, 2-6 h; 2) 1 mol·L-1 HCl (aq), 0 ℃; c) (R)-3-aminoquinuclidine dihydrochloride, HATU, DIPEA, DCM, 0 ℃-r.t., 3-6 h |
在初筛实验中, 以100 μmol·L-1乙酰胆碱为阳性参照, 测量10 μmol·L-1化合物激动起的电流值, 若化合物引起的电流值超过参照值的120%, 则进行下一步实验。
含炔基类衍生物7a~7j、8a~8b和9的初筛结果如表 1所示。这些化合物具有不同程度的激动活性。其中, 5个化合物7b、7e、7f、8a和8b活性较好, 与中氮茚环相连的片段依次为5-(吡啶-2-乙炔基)、5-(吡啶-3-乙炔基)、5-(3-叔丁氧基-1-丙炔-1-)、8-(吡啶-3-乙炔基)和8-(3-叔丁氧基-1-丙炔-1-)。结果表明在中氮茚环的5-位或8-位存在一个较大的结合空间, 可容纳大的片段。此外, 这5个化合物的共同特征是, 距中氮茚环的C5或C8原子4或5个原子的位置含有N (7b、7e和8a)或O原子(7f和8b), 提示可能在该位置存在新的配体与氨基酸残基的相互作用。
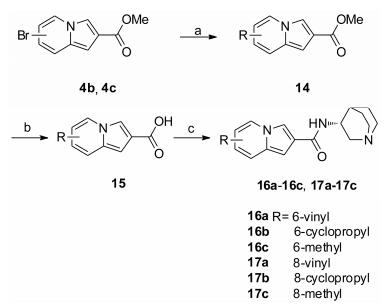
|
Scheme4 Synthetic routes of 16a-16c and 17a-17c. Reagents and conditions: a) Potassium vinyltrifluroborate, Pd(dppf)2Cl2, trimethylamine, EtOH, Ar, 80 ℃, 8 h; or trimethylboroxine, Pd(PPh3)4, K2CO3, 1, 4-dioxane/H2O, Ar, 80 ℃, 8 h; or cyclopropylboronic acid, Pd(OAc)2, PCy3, toluene/H2O, Ar, 100 ℃, 6 h; b) 1) KOH, THF/MeOH/H2O, reflux, 2-6 h; 2) 1 mol·L-1 HCl (aq), 0 ℃; c) (R)-3-aminoquinuclidine dihydrochloride, HATU, DIPEA, DCM, 0 ℃-r.t., 3-6 h |
| Table 1 Preliminary screening results of synthesized compounds. /: No activity; +: < 60% current of 100 μmol·L-1 ACh; ++: 60%-120% current of 100 μmol·L-1 ACh; +++: > 120% current of 100 μmol·L-1 ACh |
为了研究给电子取代基对中氮茚类化合物的活性的影响, 在5-位和8-位引入取代氨基, 得到化合物12a~12e和13, 初筛结果如表 1所示。这类化合物活性较差, 未能得到活性较好的激动剂, 5-位引入吗啉环、哌啶、取代哌啶等基团导致活性下降或消失, 8-位引入吗啉环也使得活性下降。推测可能是氨基的N原子对中氮茚的电子云排布有影响进而影响活性。5-(3, 5-二甲基哌啶-1-)取代的化合物12c几乎没有激动活性, 可能是空间位阻所致。值得注意的是, 5-(4-羟基-哌啶-1-)取代的化合物12e比其他5个化合物活性略好。12e在哌啶环对位有一个O原子, 这类似于含炔基类化合物中观察到的O或N原子对活性的影响。
在前期研究中, 6-溴取代化合物有活性而6-苯基取代化合物无活性, 而8-溴或苯基取代化合物均有活性。为了进一步理解取代基的大小、电性和疏水能力对活性的影响, 本研究在6-位和8-位引入小的疏水基团, 包括甲基、乙烯基、环丙基, 合成了化合物16a~16c和17a~17c。初筛结果显示, 这6个化合物表现出很好的活性(表 1), 表明引入小的疏水基团, 能够增强中氮茚环疏水能力, 进而提高化合物的激动活性。这一类化合物成为关注的重点, 可能帮助找到活性更好、更安全的激动剂。
11个化合物在初筛的单一剂量评价中表现出较好的活性, 10 μmol·L-1化合物引起的电流值大于100 μmol·L-1乙酰胆碱引起的电流值的120%, 进入到下一步的剂量-效应实验。通过测量同一化合物在6个梯度浓度引起的电流值, 绘制剂量-效应曲线, 数据用Hill方程拟合, 计算得出EC50值(图 3)。以3 mmol·L-1乙酰胆碱为参照, 计算化合物引起的电流最大值与3 mmol·L-1乙酰胆碱引起的电流值的比值, 得出Emax值, 以此数值来描述激动剂的最大效应。
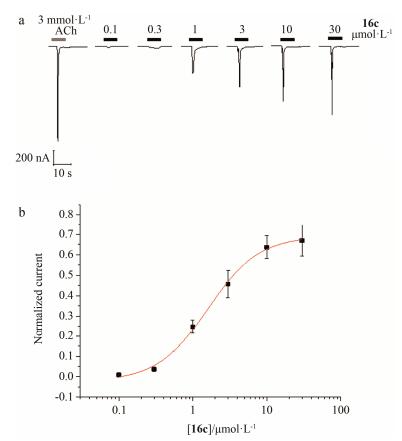
|
Figure 3 Confirmation of compound activity by TEVC. (a) Dose-dependent activation of α7 nAChR current by 16c. (b) Concentration-response curve and EC50 for compound 16c. Emax evoked by 16c is 69.0%±2.8% of 3 mmol·L-1 ACh with an EC50 of 1.60±0.19 μmol·L-1 and a Hill coefficient of 1.27±0.21 (n=5 for all data points) |
数据显示, 化合物的EC50在微摩尔水平, 而Emax值均高于EVP-6124 (表 2)。其中, 中氮茚6-甲基取代化合物16c活性突出, EC50为1.60±0.19 μmol·L-1, Emax为69.0%±2.8%;中氮茚8-环丙基取代的化合物17b的Emax达到81.1%±9.3%, EC50为2.74±0.74 μmol·L-1。因此, 化合物16c和17b被选为最有潜力的两个激动剂, 用于将来的深入研究。
| Table 2 EC50 and Emax tested by concentration-response experiments. n=4-6 |
构效关系研究表明: ①在5-位引入含炔基的化合物具有激动活性, 说明在该位置有较大的结合空间能容纳大的片段, 但是这类化合物的活性水平并不高, EC50 > 5 μmol·L-1, Emax < 55%, 可能与化合物的刚性过大有关, 其中化合物7e活性最好, EC50=5.05±0.26 μmol·L-1, Emax=46.7%±1.1%。相同取代基在5位和8位活性有差异, 说明中氮茚环的N原子对活性有一定影响, 这也证明了中氮茚环作为疏水基团中心具有结构修饰、优化的价值; ② 5-位引入吗啉环、哌啶、取代哌啶导致活性下降或消失, 8-位引入吗啉环也使得活性下降。这类化合物中未能得到活性较好的激动剂。推测可能是氨基的N原子对中氮茚的电子云排布有影响进而影响活性; ③在6-位和8-位引入小的疏水基团, 如甲基、乙烯基、环丙基, 活性结果证明这是一种有效的改造方式, 在这一类中得到两个活性最好的化合物16c和17b。在6-位和8-位上, 含不同取代基的化合物活性不同, 环丙基的活性最好, 甲基其次, 乙烯基略差。相同的取代基在6-位的效价(EC50)优于8-位。8-位取代的3个化合物17a~17c的Emax都超过了80%, 而EVP-6124的Emax仅为30.6%±1.8%, 非常值得关注。
3 小结本研究通过在中氮茚的5-位、6-位和8-位分别引入不同类型的取代基, 设计合成了一系列中氮茚类衍生物, 并用双电极电压钳的方法测量化合物的活性。一些化合物活性较好, EC50在微摩尔水平, 而Emax高于EVP-6124。化合物16c的EC50为1.60±0.19 μmol·L-1, Emax为69.0%±2.8%。化合物17b的EC50与16c水平相当, 为2.74±0.74 μmol·L-1, 但Emax高达81.1%±9.3%。构效关系研究表明, 在中氮茚环的6-位和8-位引入小的疏水基团分别能够提高化合物的效价和最大效应。本研究为新型α7 nAChR激动剂的设计提供了方向。
2 实验部分1H NMR和13C NMR由Bruker Avance III 400型核磁共振仪测定, 化合物溶解于CDCl3, 内标为四甲基硅(TMS), 数据由MestReNova (Ver.6.1.0, mesrelab Research S.L.)处理。高分辨质谱(HR-MS)由FT-MS-Bruker Apex IV测定。薄层色谱硅胶板由上海上邦实业有限公司提供。柱色谱硅胶为200~300目, 由上海上邦实业有限公司提供。所有原料和试剂均为商业购买, 若无说明则直接使用。N, N-二甲基甲酰胺(DMF)、二氯甲烷(DCM)和甲苯按照标准流程干燥处理。
1 化合物的合成(R)-5-苯乙炔基-N-(奎宁-3-)中氮茚-2-甲酰胺(7a) 127 mg (0.50 mmol, 1.0 eq.) 5-溴中氮茚-2-羧酸甲酯、77 mg (0.75 mmol, 1.5 eq.)苯乙炔、152 mg (1.50 mmol, 3.0 eq.)三乙胺溶于6 mL DMF中, 加入18 mg (0.025 mmol, 0.05 eq.) Pd(dppf)2Cl2和10 mg (0.05 mmol, 0.1 eq.) CuI, Ar保护, 加热至80 ℃, 反应12 h。反应液冷却至室温, 用硅藻土过滤, 滤液溶于乙酸乙酯(EA)中, 水洗, 饱和氯化钠溶液洗, 有机相用无水硫酸钠干燥, 过滤, 滤液减压浓缩, 硅胶柱色谱分离(PE:EA=5:1)得120 mg黄色固体产物, 收率为87.1%。
120 mg上步得到的产物(0.44 mmol, 1.0 eq.)和73 mg (1.31 mmol, 3.0 eq.) KOH溶于混合溶剂(THF:MeOH:H2O=1:1:1 mL)中, 加热回流, TLC (PE:EA=5:1)监测反应进程。反应结束后, 将反应液冷却至室温, 冰浴条件下, 逐滴加入1 mol·L-1盐酸调节至pH 4, 有固体析出, 抽滤, 干燥, 得102 mg黄色固体, 收率为88.7%。
78 mg (0.3 mmol, 1.0 eq.)上步得到的产物和171 mg (0.45 mmol, 1.5 eq.) HATU溶于10 mL DCM中, 冰浴条件下, 加入232 mg (1.8 mmol, 6.0 eq.) DIPEA, 搅拌20 min, 再加入66 mg (0.33 mmol, 1.1 eq.) (R)-3-氨基奎宁二盐酸盐, 体系自然升至室温, 反应6 h。减压蒸馏除去溶剂, 硅胶柱色谱纯化分离(DCM:MeOH:NH3·H2O=90:10:1)得85 mg黄色油状化合物7a, 收率为76.8%。1H NMR (400 MHz, CDCl3) δ 8.22 (s, 1H), 7.64~7.58 (m, 2H), 7.43~7.36 (m, 4H), 6.91 (d, J=6.7 Hz, 1H), 6.79 (s, 1H), 6.73 (dd, J=8.7, 7.1 Hz, 1H), 6.43 (d, J=6.6 Hz, 1H), 4.25~4.16 (m, 1H), 3.47~3.38 (m, 1H), 2.95~2.80 (m, 4H), 2.70~2.63 (m, 1H), 2.10~2.05 (m, 1H), 1.84~1.76 (m, 1H), 1.73~1.66 (m, 2H), 1.55~1.46 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.8, 132.8, 131.8, 129.4, 128.6, 123.7, 121.6, 120.3, 119.5, 117.9, 117.7, 114.4, 99.2, 97.9, 81.8, 56.0, 47.5, 46.8, 46.7, 25.8, 25.8, 20.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C24H24N3O: 370.191 9, found: 370.191 8。
(R)-5-(吡啶-2-乙炔基)-N-(奎宁-3-)中氮茚-2-甲酰胺(7b) 合成步骤同7a, 收率为32.7%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.70~8.62 (m, 1H), 8.28 (d, J=1.2 Hz, 1H), 7.72 (td, J=7.8, 1.7 Hz, 1H), 7.61 (d, J=7.8 Hz, 1H), 7.43 (d, J=9.0 Hz, 1H), 7.34~7.29 (m, 1H), 7.02~6.97 (m, 1H), 6.84 (d, J=1.6 Hz, 1H), 6.73 (dd, J=9.0, 6.9 Hz, 1H), 6.54 (d, J=6.1 Hz, 1H), 4.23~4.14 (m, 1H), 3.45~3.40 (m, 1H), 2.99~2.78 (m, 4H), 2.71~2.64 (m, 1H), 2.07 (dd, J=5.9, 2.9 Hz, 1H), 1.86~1.77 (m, 1H), 1.73~1.66 (m, 2H), 1.53~1.45 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.7, 150.3, 142.1, 136.5, 132.7, 127.6, 124.0, 123.7, 121.3, 119.0, 118.5, 117.7, 114.2, 100.1, 96.6, 81.4, 55.9, 47.5, 46.9, 46.8, 25.9, 20.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C23H23N4O: 371.187 2, found: 371.187 2。
(R)-N-(奎宁-3-)-5-(噻吩-2-乙炔基)中氮茚-2-甲酰胺(7c) 合成步骤同7a, 收率为35.7%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.17 (s, 1H), 7.43~7.38 (m, 3H), 7.06 (dd, J=4.9, 3.8 Hz, 1H), 6.90 (d, J=6.3 Hz, 1H), 6.79 (d, J=1.0 Hz, 1H), 6.73 (dd, J=8.9, 7.0 Hz, 1H), 6.42 (d, J=6.6 Hz, 1H), 4.23~4.16 (m, 1H), 3.46~3.40 (m, 1H), 2.98~2.78 (m, 4H), 2.70~2.63 (m, 1H), 2.07 (d, J=2.9 Hz, 1H), 1.85~1.76 (m, 1H), 1.74~1.67 (m, 2H), 1.55~1.47 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.7, 133.5, 132.8, 129.0, 127.4, 123.8, 121.4, 120.5, 119.2, 117.9, 114.4, 99.3, 91.2, 85.3, 56.0, 47.5, 46.8, 46.7, 25.9, 25.8, 20.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C22H22N3OS: 376.148 4, found: 376.147 1。
(R)-5-(1-庚炔-1-)-N-(奎宁-3-)中氮茚-2-甲酰胺(7d) 合成步骤同7a, 收率为61.1%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.11 (s, 1H), 7.32 (d, J=8.9 Hz, 1H), 6.77~6.72 (m, 2H), 6.66 (dd, J=8.7, 7.0 Hz, 1H), 6.39 (d, J=6.8 Hz, 1H), 4.22~4.11 (m, 1H), 3.41 (dd, J=12.4, 9.8 Hz, 1H), 2.98~2.75 (m, 4H), 2.64 (dd, J=14.1, 3.7 Hz, 1H), 2.52 (t, J=7.1 Hz, 2H), 2.05 (d, J=2.8 Hz, 1H), 1.84~1.75 (m, 1H), 1.72~1.62 (m, 4H), 1.51~1.33 (m, 5H), 0.92 (t, J=7.2 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ 164.8, 132.8, 123.5, 120.0, 119.5, 117.9, 116.6, 114.2, 99.9, 98.7, 73.5, 56.1, 47.5, 46.7, 31.1, 28.1, 25.9, 25.8, 22.2, 20.3, 19.6, 14.0; HR-MS (ESI-TOF+)m/z [M+H]+ Calcd. for C23H30N3O: 364.238 9, found: 364.238 3。
(R)-5-(吡啶-3-乙炔基)-N-(奎宁-3-)中氮茚-2-甲酰胺(7e) 合成步骤同7a, 收率为20.5%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.83 (s, 1H), 8.60 (d, J=3.9 Hz, 1H), 8.21 (s, 1H), 7.88 (d, J=7.8 Hz, 1H), 7.42 (d, J=9.0 Hz, 1H), 7.32 (dd, J=7.6, 5.0 Hz, 1H), 6.95 (d, J=6.7 Hz, 1H), 6.81 (s, 1H), 6.74 (dd, J=8.6, 7.3 Hz, 1H), 6.53 (d, J=6.3 Hz, 1H), 4.25~4.16 (m, 1H), 3.48~3.39 (m, 1H), 3.01~2.93 (m, 1H), 2.92~2.78 (m, 3H), 2.76~2.67 (m, 1H), 2.08 (d, J=2.4 Hz, 1H), 1.86~1.77 (m, 1H), 1.74~1.66 (m, 2H), 1.56~1.47 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.7, 152.2, 149.5, 138.7, 132.8, 123.9, 123.2, 121.0, 119.0, 118.8, 118.5, 117.8, 114.5, 110.0, 99.4, 94.3, 84.9, 55.8, 47.4, 46.8, 46.7, 25.8, 25.6, 20.2; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C23H23N4O: 371.187 2, found: 371.187 7。
(R)-5-(3-叔丁氧-1-丙炔-1-)-N-(奎宁-3-)中氮茚-2-甲酰胺(7f)合成步骤同7a, 收率为17.0%, 淡黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.15 (s, 1H), 7.40 (d, J=9.0 Hz, 1H), 6.85 (d, J=6.7 Hz, 1H), 6.79 (s, 1H), 6.70 (dd, J=8.9, 7.0 Hz, 1H), 6.32 (d, J=5.7 Hz, 1H), 4.46 (s, 2H), 4.25~4.20 (m, 1H), 3.51~3.44 (m, 1H), 3.07~2.99 (m, 1H), 2.95~2.85 (m, 3H), 2.76~2.71 (m, 1H), 2.13~2.10 (m, 1H), 1.86~1.72 (m, 3H), 1.60~1.52 (m, 1H), 1.33 (s, 9H); 13C NMR (101 MHz, CDCl3) δ 164.7, 132.7, 123.5, 120.5, 119.1, 117.9, 117.8, 114.3, 99.1, 96.2, 75.0, 56.0, 51.1, 47.5, 46.7, 46.6, 27.6, 25.8, 25.6, 20.2; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C23H30N3O2: 380.233 8, found: 380.233 2。
(R)-5-(4-甲氧基苯乙炔基)-N-(奎宁-3-)中氮茚-2-甲酰胺(7g) 合成步骤同7a, 收率为25.3%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.22 (s, 1H), 7.55 (d, J=7.9 Hz, 2H), 7.38 (d, J=8.8 Hz, 1H), 6.95~6.86 (m, 3H), 6.78~6.69 (m, 2H), 6.35 (d, J=5.7 Hz, 1H), 4.18 (s, 1H), 3.85 (s, 3H), 3.48~3.40 (m, 1H), 2.96~2.78 (m, 4H), 2.65 (d, J=11.6 Hz, 1H), 2.07 (s, 1H), 1.79 (s, 1H), 1.70 (s, 2H), 1.51 (s, 1H); 13C NMR (101 MHz, CDCl3) δ 164.8, 160.5, 133.4, 132.9, 123.6, 119.9, 119.9, 118.0, 117.2, 114.4, 114.2, 113.6, 98.9, 98.1, 80.7, 56.2, 55.4, 47.5, 46.8, 46.8, 25.9, 20.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C25H26N3O2: 400.202 5, found: 400.202 1。
(R)-5-(3-氟苯乙炔基)-N-(奎宁-3-)中氮茚-2-甲酰胺(7h)合成步骤同7a, 收率为17.8%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.21 (s, 1H), 7.46~7.36 (m, 3H), 7.32 (d, J=8.4 Hz, 1H), 7.17~7.10 (m, 1H), 6.95 (d, J=6.8 Hz, 1H), 6.80~6.73 (m, 2H), 6.30 (d, J=5.9 Hz, 1H), 4.25~4.17 (m, 1H), 3.50~3.42 (m, 1H), 3.01~2.83 (m, 4H), 2.70~2.61 (m, 1H), 2.10 (d, J=3.0 Hz, 1H), 1.85~1.77 (m, 1H), 1.76~1.69 (m, 2H), 1.58~1.50 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.6, 162.4 (d, JC3'-F=248.5 Hz, C3'), 132.8, 130.2 (d, JC1'-F=9.1 Hz, C1'), 127.7 (d, JC5'-F=3.0 Hz, C5'), 123.9, 120.7, 119.1, 118.5 (d, JC6'-F=23.2 Hz, C6'), 118.0 (d, JC2'-F=27.3 Hz, C2'), 116.8 (d, JC4'-F=21.2 Hz, C4'), 114.5, 99.1, 96.4, 82.5, 56.2, 47.5, 46.8, 46.7, 25.8, 20.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C24H23FN3O: 388.182 5, found: 388.182 7。
(R)-5-(2-氟苯乙炔基)-N-(奎宁-3-)中氮茚-2-甲酰胺(7i)合成步骤同7a, 收率为31.4%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.24 (s, 1H), 7.61 (td, J=7.4, 1.4 Hz, 1H), 7.47~7.39 (m, 2H), 7.23~7.15 (m, 2H), 6.97 (d, J=6.7 Hz, 1H), 6.82 (d, J=1.3 Hz, 1H), 6.77 (dd, J=8.9, 6.9 Hz, 1H), 6.25 (d, J=6.7 Hz, 1H), 4.24~4.17 (m, 1H), 3.51~3.44 (m, 1H), 2.99~2.82 (m, 4H), 2.66 (dd, J=14.1, 3.7 Hz, 1H), 2.09 (dd, J=5.8, 2.9 Hz, 1H), 1.85~1.77 (m, 1H), 1.76~1.70 (m, 2H), 1.58~1.51 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.6, 162.8 (d, JC2'-F=253.5 Hz, C2'), 133.2, 132.8, 131.2 (d, JC4'-F=9.1 Hz, C4'), 124.3 (d, JC6'-F=4.0 Hz, C6'), 124.0, 120.8, 119.1, 117.8 (d, JC5'-F=9.1 Hz, C5'), 115.8 (d, JC3'-F=21.2 Hz, C3'), 114.1, 110.5 (d, JC1'-F=16.1 Hz, C1'), 110.0, 99.6, 91.5, 86.8, 56.4, 47.6, 46.8, 25.9, 25.9, 20.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C24H23FN3O: 388.182 5, found: 388.182 0。
(R)-N-(奎宁-3-)-5-对甲苯乙炔基中氮茚-2-甲酰胺(7j)合成步骤同7a, 收率为26.6%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.22 (s, 1H), 7.53(d, J=7.9 Hz, 2H), 7.41 (d, J=9.0 Hz, 1H), 7.23 (d, J=7.8 Hz, 2H), 6.92 (d, J=6.8 Hz, 1H), 6.80~6.72 (m, 2H), 6.25 (d, J=6.7 Hz, 1H), 4.24~4.16 (m, 1H), 3.51~3.43 (m, 1H), 3.02~2.80 (m, 4H), 2.65 (dd, J=14.1, 3.9 Hz, 1H), 2.42 (s, 3H), 2.09 (d, J=2.6 Hz, 1H), 1.85~1.77 (m, 1H), 1.76~1.69 (m, 2H), 1.58~1.49 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.8, 139.8, 132.9, 131.7, 129.4, 123.7, 120.1, 119.7, 118.6, 118.0, 117.5, 114.4, 98.9, 98.2, 81.2, 56.3, 47.5, 46.8, 46.7, 25.8, 21.7, 20.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C25H26N3O: 384.207 6, found: 384.206 9。
(R)-8-(吡啶-3-乙炔基)-N-(奎宁-3-)中氮茚-2-甲酰胺(8a) 合成步骤同7a, 收率为21.8%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 8.84 (s, 1H), 8.59 (d, J=2.9 Hz, 1H), 7.96~7.82 (m, 3H), 7.35~7.30 (m, 1H), 7.02 (d, J=6.3 Hz, 1H), 6.91 (s, 1H), 6.66~6.49 (m, 2H), 4.22 (s, 1H), 3.48~3.41 (m, 1H), 3.03 (s, 1H), 2.94~2.73 (m, 4H), 2.10 (s, 1H), 1.84 (s, 1H), 1.73 (s, 2H), 1.54 (s, 1H); 13C NMR (101 MHz, CDCl3) δ 164.5, 152.3, 149.0, 138.6, 132.4, 126.2, 124.1, 123.5, 123.1, 120.0, 115.5, 114.3, 111.5, 97.6, 90.6, 88.6, 55.6, 47.4, 46.7, 46.7, 25.8, 25.6, 20.1; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C23H23N4O: 371.187 2, found: 371.187 5。
(R)-8-(3-叔丁氧-1-丙炔-1-)-N-(奎宁-3-)中氮茚-2-甲酰胺(8b) 合成步骤同7a, 收率为42.9%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.84 (d, J=7.1 Hz, 1H), 7.82 (d, J=1.3 Hz, 1H), 6.90 (d, J=6.8 Hz, 1H), 6.81 (s, 1H), 6.50 (t, J=6.9 Hz, 1H), 6.39 (d, J=6.8 Hz, 1H), 4.41 (s, 2H), 4.23~4.16 (m, 1H), 3.44 (dd, J=12.2, 9.9 Hz, 1H), 3.00~2.96 (m, 1H), 2.87 (dt, J=18.5, 7.7 Hz, 3H), 2.69 (dd, J=14.1, 3.5 Hz, 1H), 2.10~2.05 (m, 1H), 1.87~1.79 (m, 1H), 1.76~1.68 (m, 2H), 1.57~1.49 (m, 1H), 1.31 (s, 9H); 13C NMR (101 MHz, CDCl3) δ 164.5, 132.9, 125.6, 123.8, 123.2, 115.3, 114.7, 111.5, 97.4, 92.1, 80.8, 74.7, 55.9, 51.2, 47.4, 46.7, 27.6, 25.8, 25.7, 20.2. HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C23H30N3O2: 380.233 8, found: 380.233 6。
(R)-6-(1-庚炔-1-)-N-(奎宁-3-)中氮茚-2-甲酰胺(9)合成步骤同7a, 收率为25.2%, 黄色油状物。1H NMR (400 MHz, CDCl3) δ7.98 (s, 1H), 7.74 (s, 1H), 7.28 (s, 1H), 6.68 (d, J=9.4 Hz, 1H), 6.62 (s, 1H), 6.29 (d, J=6.0 Hz, 1H), 4.24~4.15 (m, 1H), 3.50~3.40 (m, 1H), 3.04~2.82 (m, 4H), 2.69 (dd, J=14.1, 2.9 Hz, 1H), 2.41 (t, J=7.1 Hz, 2H), 2.10~2.05 (m, 1H), 1.85~1.70 (s, 3H), 1.65~1.53 (m, 3H), 1.47~1.34 (m, 4H), 0.94 (t, J=7.1 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ164.5, 131.6, 128.1, 124.4, 121.7, 119.2, 114.3, 109.3, 97.8, 91.4, 56.1, 47.5, 46.7, 46.6, 31.1, 28.4, 25.8, 25.7, 22.2, 20.2, 19.4, 14.0; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C23H30N3O: 364.238 9, found: 364.238 3。
(R)-5-吗啡啉-N-(奎宁-3-)中氮茚-2-甲酰胺(12a) 254 mg (1.0 mmol, 1.0 eq.) 5-溴中氮茚-2-羧酸甲酯、261 mg (3.0 mmol, 3.0 eq.)吗啡啉、22 mg (0.1 mmol, 0.1 eq.) Pd(OAc)2、125 mg (0.2 mmol, 0.2 eq.) BINAP和977 mg (3.0 mmol, 3.0 eq.)碳酸铯溶于10 mL甲苯中, Ar保护, 加热至80 ℃, 反应10 h。反应液冷却至室温, 硅藻土过滤, 滤液减压浓缩。残渣溶于EA中, 水洗, 饱和氯化钠溶液洗, 有机相合并, 无水硫酸钠干燥。过滤, 滤液减压浓缩, 硅胶柱色谱分离(PE:EA=10:1)得215 mg产物, 收率为82.7%。水解与成酰胺反应同7a, 收率分别为82.8%和71.6%, 得浅黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.90 (s, 1H), 7.19 (d, J=8.6 Hz, 1H), 6.83~6.75 (m, 1H), 6.66 (s, 1H), 6.30~6.23 (m, 1H), 6.16 (d, J=6.6 Hz, 1H), 4.25~4.17 (m, 1H), 3.95 (s, 4H), 3.53~3.44 (m, 1H), 3.12 (s, 4H), 3.02~2.83 (m, 4H), 2.74~2.64 (m, 1H), 2.13~2.07 (m, 1H), 1.95~1.85 (m, 1H), 1.80~1.73 (m, 2H), 1.61~1.52 (m, 1H); 13C NMR (101 MHz, CDCl3)δ 165.0, 144.4, 134.5, 123.4, 119.3, 115.2, 111.2, 99.1, 97.5, 66.9, 56.0, 50.2, 47.5, 46.7, 46.7, 25.8, 25.7, 20.2; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C20H27N4O2: 355.213 4, found: 355.213 7。
(R)-5-(哌啶-1-)-N-(奎宁-3-)中氮茚-2-甲酰胺(12b) 合成步骤同12a, 收率为71.2%, 浅黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.86 (s, 1H), 7.11 (d, J=8.9 Hz, 1H), 6.76~6.70 (m, 2H), 6.62 (d, J=6.9 Hz, 1H), 6.07 (d, J=6.8 Hz, 1H), 4.30~4.23 (m, 1H), 3.46~3.41 (m, 1H), 3.27~3.20 (m, 1H), 3.15~2.87 (m, 8H), 2.15 (dd, J=5.9, 2.9 Hz, 1H), 1.93~1.85 (m, 1H), 1.82~1.73 (m, 6H), 1.72~1.47 (m, 3H); 13C NMR (101 MHz, CDCl3) δ 165.3, 145.9, 134.5, 122.9, 119.4, 114.4, 111.3, 98.7, 97.4, 55.3, 51.2, 47.3, 46.6, 46.4, 26.0, 25.7, 25.3, 24.4, 19.9; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C21H29N4O: 353.234 1, found: 353.233 9。
5-(3, 3-二甲基哌啶-1-)-N-((R)-奎宁-3-)中氮茚-2-甲酰胺(12c)合成步骤同12a, 收率为37.1%, 浅黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.84 (s, 1H), 7.14 (d, J=8.9 Hz, 1H), 6.77 (dd, J=8.6, 7.2 Hz, 1H), 6.65 (s, 1H), 6.28 (d, J=6.8 Hz, 1H), 6.11 (d, J=6.9 Hz, 1H), 4.26~4.19 (m, 1H), 3.52~3.45 (m, 1H), 3.37~3.31 (m, 2H), 3.02~2.85 (m, 4H), 2.74~2.67 (m, 1H), 2.25~2.18 (m, 2H), 2.11 (dd, J=5.8, 2.9 Hz, 1H), 2.05~1.90 (m, 4H), 1.85~1.80 (m, 1H), 1.78~1.72 (m, 2H), 1.58~1.54 (m, 1H), 0.95 (d, J=6.5 Hz, 6H); 13C NMR (101 MHz, CDCl3) δ 165.2, 145.4, 134.5, 123.0, 119.6, 114.4, 111.3, 99.0, 97.0, 57.7, 56.3, 47.5, 46.7, 46.6, 42.3, 31.3, 25.8, 20.3, 19.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C23H33N4O: 381.265 4, found: 381.265 2。
(R)-5-(4-甲基哌啶-1-)-N-(奎宁-3-)中氮茚-2-甲酰胺(12d)合成步骤同12a, 收率为26.0%, 浅黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.82 (d, J=1.0 Hz, 1H), 7.13 (d, J=8.9 Hz, 1H), 6.76 (dd, J=8.8, 7.1 Hz, 1H), 6.63 (d, J=1.4 Hz, 1H), 6.24 (d, J=6.9 Hz, 1H), 6.10 (d, J=6.9 Hz, 1H), 4.24~4.16 (m, 1H), 3.51~3.37 (m, 3H), 2.97~2.82 (m, 4H), 2.74~2.61 (m, 3H), 2.08 (d, J=5.9, 2.9 Hz, 1H), 1.83~1.70 (m, 5H), 1.64~1.45 (m, 4H), 1.05 (d, J=6.3 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ 165.2, 145.7, 134.5, 123.1, 119.5, 114.3, 111.3, 98.7, 97.0, 56.4, 50.5, 47.6, 46.8, 46.7, 34.3, 31.0, 25.9, 25.9, 21.9, 20.4; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C22H31N4O: 367.249 8, found: 367.249 5。
(R)-5-(4-羟基哌啶-1-)-N-(奎宁-3-)中氮茚-2-甲酰胺(12e)合成步骤同12a, 收率为37.8%, 浅黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.87 (s, 1H), 7.09 (d, J=8.9 Hz, 1H), 6.88 (d, J=6.3 Hz, 1H), 6.75 (s, 1H), 6.70 (dd, J=8.6, 7.3 Hz, 1H), 6.06 (d, J=6.9 Hz, 1H), 4.26~4.19 (m, 1H), 4.04~3.72 (m, 2H), 3.43~3.36 (m, 1H), 3.28 (s, 2H), 3.06~2.98 (m, 1H), 2.92~2.68 (m, 6H), 2.10 (d, J=2.5 Hz, 1H), 2.05~1.96 (m, 2H), 1.92~1.84 (m, 1H), 1.81~1.66 (m, 4H), 1.54~1.46 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 165.4, 145.1, 134.4, 123.0, 119.4, 114.6, 111.3, 98.9, 97.8, 55.3, 47.3, 46.7, 46.6, 40.2, 34.5, 25.8, 25.5, 20.0; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C21H29N4O2: 369.229 1, found: 369.228 6。
(R)-5-吗啡啉-N-(奎宁-3-)中氮茚-2-甲酰胺(13)合成步骤同12a, 收率为23.6%, 浅黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.74 (s, 1H), 7.63 (d, J=6.7 Hz, 1H), 6.64 (s, 1H), 6.50 (t, J=6.9 Hz, 1H), 6.25 (d, J=6.4 Hz, 1H), 6.17 (d, J=7.1 Hz, 1H), 4.23~4.15 (m, 1H), 4.00~3.88 (m, 4H), 3.49~3.41 (m, 1H), 3.25~3.13 (m, 4H), 2.98~2.80 (m, 4H), 2.64 (dd, J=14.0, 3.6 Hz, 1H), 2.08 (s, 1H), 1.83~1.67 (m, 3H), 1.57~1.48 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.8, 144.1, 129.5, 122.9, 120.6, 114.7, 112.1, 103.6, 96.6, 67.1, 56.1, 51.3, 47.5, 46.7, 25.8, 20.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C20H27N4O2: 355.213 4, found: 355.213 4。
(R)-N-(奎宁-3-)-6-乙烯基中氮茚-2-甲酰胺(16a)合成步骤同7a, 收率为13.5%, 淡黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.81 (s, 1H), 7.79 (s, 1H), 7.33 (d, J=9.5 Hz, 1H), 6.97 (d, J=8.9 Hz, 1H), 6.64 (s, 1H), 6.58 (dd, J=17.4, 11.1 Hz, 1H), 6.34 (d, J=6.7 Hz, 1H), 5.69 (d, J=17.5 Hz, 1H), 5.28 (d, J=10.9 Hz, 1H), 4.26~4.19 (m, 1H), 3.51~3.42 (m, 1H), 3.08~2.99 (m, 1H), 2.96~2.84 (m, 3H), 2.79~2.72 (m, 1H), 2.11 (d, J=2.8 Hz, 1H), 1.86~1.82 (m, 1H), 1.79~1.73 (m, 2H), 1.60~1.53 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.6, 133.0, 132.3, 124.3, 124.1, 123.1, 119.6, 116.0, 114.8, 113.6, 97.8, 55.9, 47.4, 46.7, 46.5, 25.8, 25.5, 20.1; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C18H22N3O: 296.176 3, found: 296.176 8。
(R)-6-环丙基-N-(奎宁-3-)中氮茚-2-甲酰胺(16b)合成步骤同7a, 收率为26.7%, 淡黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.69 (s, 1H), 7.66 (s, 1H), 7.24 (d, J=9.3 Hz, 1H), 6.56 (s, 1H), 6.46 (d, J=9.3 Hz, 1H), 6.26 (d, J=6.9 Hz, 1H), 4.20~4.14 (m, 1H), 3.47~3.40 (m, 1H), 2.96~2.78 (m, 4H), 2.63 (dd, J=14.2, 4.4 Hz, 1H), 2.05 (d, J=2.5 Hz, 1H), 1.83~1.67 (m, 4H), 1.55~1.47 (m, 1H), 0.91 (q, J=5.4 Hz, 2H), 0.65 (q, J=5.2 Hz, 2H); 13C NMR (101 MHz, CDCl3) δ 164.9, 132.0, 127.4, 123.4, 121.9, 119.3, 118.9, 113.8, 96.7, 56.2, 47.5, 46.7, 46.6, 25.9, 20.3, 12.9, 6.8; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C19H24N3O: 310.191 9, found: 310.192 5。
(R)-6-甲基-N-(奎宁-3-)中氮茚-2-甲酰胺(16c)合成步骤同7a, 收率为18.4%, 淡黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.73 (s, 1H), 7.66 (s, 1H), 7.25 (d, J=9.3 Hz, 1H), 6.62~6.54 (m, 2H), 6.37 (d, J=6.3 Hz, 1H), 4.24~4.17 (m, 1H), 3.48~3.41 (m, 1H), 3.06~2.98 (m, 1H), 2.94~2.83 (m, 3H), 2.76~2.71 (m, 1H), 2.21 (s, 3H), 2.11~2.07 (m, 1H), 1.86~1.79 (m, 1H), 1.77~1.70 (m, 2H), 1.58~1.50 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 165.0, 131.8, 123.2, 122.8, 121.9, 121.3, 119.2, 113.7, 96.8, 55.9, 47.4, 46.7, 46.5, 25.8, 25.6, 20.1, 18.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C17H22N3O: 284.176 3, found: 284.176 8。
(R)-N-(奎宁-3-)-8-乙烯基中氮茚-2-甲酰胺(17a) 合成步骤同7a, 收率为24.5%, 淡黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.85 (d, J=6.9 Hz, 1H), 7.81 (s, 1H), 6.95~6.79 (m, 3H), 6.58 (t, J=6.9 Hz, 1H), 6.24 (d, J=5.9 Hz, 1H), 5.94 (d, J=17.6 Hz, 1H), 5.48 (d, J=11.1 Hz, 1H), 4.24~4.17 (m, 1H), 3.50~3.43 (m, 1H), 2.97~2.83 (m, 4H), 2.68~2.62 (m, 1H), 2.09~2.06 (m, 1H), 1.84~1.78 (m, 1H), 1.76~1.70 (m, 2H), 1.58~1.51 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.7, 132.8, 131.8, 129.4, 124.8, 123.8, 117.0, 116.0, 114.6, 112.0, 96.1, 56.3, 47.5, 46.7, 25.9, 20.3; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C18H22N3O: 296.176 3, found: 296.176 5。
(R)-8-环丙基-N-(奎宁-3-)中氮茚-2-甲酰胺(17b)合成步骤同7a, 收率为29.5%, 淡黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.80 (s, 1H), 7.76 (d, J=6.8 Hz, 1H), 6.82 (s, 1H), 6.48 (t, J=6.8 Hz, 1H), 6.40~6.28 (m, 2H), 4.26~4.18 (m, 1H), 3.51~3.43 (m, 1H), 3.08~3.00 (m, 1H), 2.94~2.83 (m, 3H), 2.74~2.67 (m, 1H), 2.13~2.08 (m, 1H), 2.07~2.01 (m, 1H), 1.88~1.80 (m, 1H), 1.78~1.70 (m, 2H), 1.59~1.50 (m, 1H), 1.00 (d, J=7.2 Hz, 2H), 0.76 (d, J=4.5 Hz, 2H); 13C NMR (101 MHz, CDCl3) δ 164.9, 134.7, 134.4, 123.3, 114.5, 113.1, 112.0, 95.7, 56.0, 47.5, 46.7, 46.6, 25.8, 25.7, 20.2, 12.2, 6.6, 6.6; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C19H24N3O: 310.191 9, found: 310.191 8。
(R)-8-甲基-N-(奎宁-3-)中氮茚-2-甲酰胺(17c)合成步骤同7a, 收率为28.7%, 淡黄色油状物。1H NMR (400 MHz, CDCl3) δ 7.80~7.72 (m, 2H), 6.60 (s, 1H), 6.54~6.44 (m, 2H), 6.31 (d, J=6.9 Hz, 1H), 4.24~4.16 (m, 1H), 3.47~3.40 (m, 1H), 3.00~2.78 (m, 4H), 2.67~2.64 (m, 1H), 2.39 (s, 3H), 2.10~2.05 (m, 1H), 1.86~1.78 (m, 1H), 1.76~1.68 (m, 2H), 1.57~1.49 (m, 1H); 13C NMR (101 MHz, CDCl3) δ 164.9, 134.1, 129.0, 123.4, 123.2, 117.4, 114.5, 112.1, 95.7, 56.1, 47.5, 46.7, 46.6, 25.8, 25.8, 20.3, 18.0; HR-MS (ESI-TOF+) m/z [M+H]+ Calcd. for C17H22N3O: 284.176 3, found: 284.176 7。
2 活性评价实验用的卵母细胞来源于非洲爪蟾(Xenopus laevis), 通过麻醉爪蟾后用外科手术方式取出, 用不含Ca2+的OR2溶液(mmol·L-1: 82.5 NaCl、2.5 KCl、1 MgCl2、5 HEPES, pH 7.4)洗涤, 然后加入2 mg·mL-1胶原酶-OR2溶液(Sigma type Ⅱ, Sigma-Aldrich Inc., MO, USA), 25 ℃孵育20 min, 选取出Ⅴ期和Ⅵ期卵母细胞用于显微注射。将pBluescript KSM为载体的质粒线性化之后, 用T3 mMESSAGEmMACHINE试剂盒(Ambion, Austin, TX, USA)进行体外转录得到人α7 nAChR的cRNA。向卵母细胞中注入20 ng cRNA, 在ND96溶液(mmol·L-1: 96 NaCl、2 KCl、1.8 CaCl2、1 MgCl2、5 HEPES, NaOH调节至pH 7.4) 17 ℃孵育48 h。
用两个微电极(0.5~1.0 MΩ)刺穿卵母细胞, 微电极中的40 μL记录槽中为3 mol·L-1 KCl。将细胞膜电压钳设置在-90 mV。工作液为Ringer溶液(mmol·L-1: 115 NaCl、2.5 KCl、10 HEPES、1.8 CaCl2、1 MgCl2、0.0005阿托品)。在室温条件下, 用Gene Clamp 500B放大器(Axon Instruments, Union City, CA, USA)记录电流。
初筛的单一剂量评价实验中, 先用100 μmol·L-1乙酰胆碱灌流, 记录引起的电流变化, 检测α7 nAChR是否表达成功, 并作为阳性参照。用Ringer溶液冲洗除去残留后, 再用10 μmol·L-1待测化合物灌流, 记录电流变化。
在剂量-效应实验中, 化合物溶于DMSO配成浓度为100 mmol·L-1的母液, 用Ringer溶液稀释到6个浓度(μmol·L-1: 0.1、0.3、1、3、10和30)。3 mmol·L-1乙酰胆碱作为阳性参照, 待测化合物的样品由低浓度到高浓度依次测量引起的电流变化。给药之间控制一定的时间间隙以保证蛙卵的稳定性。绘制剂量-效应曲线, 用Hill方程拟合, 计算得出EC50, 结果表示为平均值±S.E.M.。
| [1] | Le Novere N, Changeux JP. The ligand gated ion channel database[J]. Nucleic Acids Res , 1999, 27 :340–342. DOI:10.1093/nar/27.1.340 |
| [2] | Dani JA, Bertrand D. Nicotinic acetylcholine receptors and nicotinic cholinergic mechanisms of the central nervous system[J]. Annu Rev Pharmacol Toxicol , 2007, 47 :699–729. DOI:10.1146/annurev.pharmtox.47.120505.105214 |
| [3] | Gahring LC, Rogers SW. Neuronal nicotinic acetylcholine receptor expression and function on nonneuronal cells[J]. AAPS J , 2005, 7 :E885–E894. DOI:10.1208/aapsj070486 |
| [4] | Lukas RJ, Changeux JP, Le Novere N, et al. International Union of Pharmacology. XX. current status of the nomenclature for nicotinic acetylcholine receptors and their subunits[J]. Pharmacol Rev , 1999, 51 :397–401. |
| [5] | Jensen AA, Frolund B, Liljefors T, et al. Neuronal nicotinic acetylcholine receptors:structural revelations, target identifications, and therapeutic inspirations[J]. J Med Chem , 2005, 48 :4705–4745. DOI:10.1021/jm040219e |
| [6] | Paterson D, Nordberg A. Neuronal nicotinic receptors in the human brain[J]. Prog Neurobiol , 2000, 61 :75–111. DOI:10.1016/S0301-0082(99)00045-3 |
| [7] | Wang H, Yu M, Ochani M, et al. Nicotinic acetylcholine receptor α7 subunit is an essential regulator of inflammation[J]. Nature , 2003, 421 :384–388. DOI:10.1038/nature01339 |
| [8] | Picciotto MR, Caldarone BJ, Brunzell DH, et al. Neuronal nicotinic acetylcholine receptor subunit knockout mice:physiological and behavioral phenotypes and possible clinical implications[J]. Pharmacol Ther , 2001, 92 :89–108. DOI:10.1016/S0163-7258(01)00161-9 |
| [9] | Young JW, Geyer MA. Evaluating the role of the alpha-7 nicotinic acetylcholine receptor in the pathophysiology and treatment of schizophrenia[J]. Biochem Pharmacol , 2013, 86 :1122–1132. DOI:10.1016/j.bcp.2013.06.031 |
| [10] | Mazurov A, Hauser T, Miller CH. Selective α7 nicotinic acetylcholine receptor ligands[J]. Curr Med Chem , 2006, 13 :1567–1584. DOI:10.2174/092986706777442011 |
| [11] | Xie BX, Zhang GS, Zhang LR. Advances on α7 nAChR as targets for drug development[J]. Chin J Med Chem (中国药物化学杂志) , 2015, 25 :313–323. |
| [12] | Kitagawa H, Takenouchi T, Azuma R, et al. Safety, pharmacokinetics, and effects on cognitive function of multiple doses of GTS-21 in healthy, male volunteers[J]. Neuropsychopharmacology , 2003, 28 :542–551. DOI:10.1038/sj.npp.1300028 |
| [13] | Freedman R, Olincy A, Buchanan RW, et al. Initial phase 2 trial of a nicotinic agonist in schizophrenia[J]. Am J Psychiatry , 2008, 165 :1040–1047. DOI:10.1176/appi.ajp.2008.07071135 |
| [14] | Feuerbach D, Pezous N, Weiss M, et al. AQW051, a novel, potent and selective α7 nicotinic ACh receptor partial agonist:pharmacological characterization and phase I evaluation[J]. Br J Pharmacol , 2015, 172 :1292–1304. DOI:10.1111/bph.2015.172.issue-5 |
| [15] | Prickaerts J, van Goethem NP, Chesworth R, et al. EVP-6124, a novel and selective α7 nicotinic acetylcholine receptor partial agonist, improves memory performance by potentiating the acetylcholine response of α7 nicotinic acetylcholine receptors[J]. Neuropharmacology , 2012, 62 :1099–1110. DOI:10.1016/j.neuropharm.2011.10.024 |
| [16] | Huang M, Felix AR, Flood DG, et al. The novel α7 nicotinic acetylcholine receptor agonist EVP-6124 enhances dopamine, acetylcholine, and glutamate efflux in rat cortex and nucleus accumbens[J]. Psychopharmacology (Berl) , 2014, 231 :4541–4551. DOI:10.1007/s00213-014-3596-0 |
| [17] | Barbier AJ, Hilhorst M, Van Vliet A, et al. Pharmacodynamics, pharmacokinetics, safety, and tolerability of encenicline, a selective α7 nicotinic receptor partial agonist, in single ascending-dose and bioavailability studies[J]. Clin Ther , 2015, 37 :311–324. DOI:10.1016/j.clinthera.2014.09.013 |
| [18] | Deardorff WJ, Shobassy A, Grossberg GT. Safety and clinical effects of EVP-6124 in subjects with Alzheimer's disease currently or previously receiving an acetylcholinesterase inhibitor medication[J]. Expert Rev Neurother , 2015, 15 :7–17. DOI:10.1586/14737175.2015.995639 |
| [19] | Beinat C, Banister SD, Herrera M, et al. The therapeutic potential of α7 nicotinic acetylcholine receptor (α7 nAChR) agonists for the treatment of the cognitive deficits associated with schizophrenia[J]. CNS Drugs , 2015, 29 :529–542. DOI:10.1007/s40263-015-0260-0 |
| [20] | Nicolotti O, Altomare C, Pellegrini-Calace M, et al. Neuronal nicotinic acetylcholine receptor agonists:pharmacophores, evolutionary QSAR and 3D-QSAR models[J]. Curr Top Med Chem , 2004, 4 :335–360. DOI:10.2174/1568026043451384 |
| [21] | Bunnelle WH, Dart MJ, Schrimpf MR. Design of ligands for the nicotinic acetylcholine receptors:the quest for selectivity[J]. Curr Top Med Chem , 2004, 4 :299–334. DOI:10.2174/1568026043451438 |
| [22] | Tang JS, Xie BX, Bian XL, et al. Identification and in vitro pharmacological characterization of a novel and selective α7 nicotinic acetylcholine receptor agonist, Br-IQ17B[J]. Acta Pharmacol Sin , 2015, 36 :800–812. DOI:10.1038/aps.2015.9 |
| [23] | Xue Y, Tang JS, Ma XZ, et al. Synthesis and biological activities of indolizine derivatives as alpha-7 nAChR agonists[J]. Eur J Med Chem , 2016, 115 :94–108. DOI:10.1016/j.ejmech.2016.03.016 |
 2016, Vol. 51
2016, Vol. 51







