乙型病毒性肝炎(乙肝)是一种由乙型肝炎病毒(hepatitis B virus, HBV)引起的肝脏感染。可造成急性或慢性疾病, 并伴随引发多器官损害, 成为我国乃至世界范围内危害最为严重的传染病之一[1, 2]。我国不仅有约1亿的慢性乙型肝炎病毒携带者, 且每年新发的感染者多达10万。因此, 乙型肝炎感染以及引起的慢性肝病是严重威胁我国国民健康的一大“杀手”。治疗乙型肝炎是要长期抑制HBV复制, 清除HBV, 缓解肝脏炎症和肝损伤, 预防向肝硬化和肝癌恶化[3]。目前临床应用最广泛的是核苷类的抗病毒药物。核苷类常用药物有拉米夫定(3TC)、阿德福韦酯、恩替卡韦、替比夫定、替诺福韦酯等, 但是它们大部分都具有用药周期长、易发生耐药性、停药容易反复等缺点[4−8]。因此, 研发新型结构的疗效高、不良反应少、耐药性小的抗HBV药物仍是医药学界世界性的研究热点。
肟类化合物是一类具有多种生物活性的化合物, 肟醚基团是常用的活性基团之一。肟醚化合物在抗菌、杀螨、杀虫、除草、抗癌、抗病毒和免疫调节方面有重要应用。Qu等[9]合成的[1-(4-吗啉基)羰基亚甲基苯并咪唑-2-基]氰基甲酮肟醚对生菜灰霉菌与番茄菌核菌具有较高抑制活性。Yang等[10]合成的吡唑肟醚类化合物显示出良好杀蚊虫、豆蚜和杀螨活性。Hamzeh等[11]合成的一系列肟醚化合物对鳞翅目夜蛾(Spodopteralitura)有较好的灭杀作用。Park等[12]合成的吡唑肟醚系列衍生物尤其是5-苯氧基吡唑对人结肠癌细胞(HCT15)和人类中枢神经系统肿瘤细胞(xf-498)表现出强有效的抑制活性。Chen等[13]合成的一系列新的1-芳基-5-杂环1, 4-戊二烯-3-酮肟醚类化合物, 表现出一定的抗烟草病毒活性。Luo等[14]合成的查耳酮肟具有较强的免疫抑制活性。但是肟类化合物在抗乙肝病毒的活性方面却很少见报道。Liu等[15]合成的一系列苯丙素类肟酯化合物具有较好的抗HBV活性, 利用分子对接软件Molecular Operating Environment (MOE)与人类白细胞抗原HLA-A*02:03进行反向对接, 发现此类化合物中的肟基-O-N=C与靶蛋白氨基酸残基之间形成氢键, 从而推测-O-N=C是小分子配体与蛋白受体结合的关键药效基团。以此为基础, 根据药物设计的生物活性基团拼接原理, 设计出一系列肟类衍生物。设计的化合物, 利用MOE软件进行虚拟筛选。以苯、甲苯、甲氧基苯、氯苯为原料, 经傅克反应、酯化反应、肟化反应合成了12个未见文献报道的化合物(合成路线1), 并对目标化合物用1H NMR、13C NMR和MS确证化学结构。以HepG2 2.2.15细胞为模型, 测试目标化合物的细胞毒性及对表面抗原(HBsAg)与e抗原(HBeAg)的抑制活性, 并进行初步的构效关系分析。实验结果显示, 大部分化合物具有一定的抗HBV活性且毒性较低。
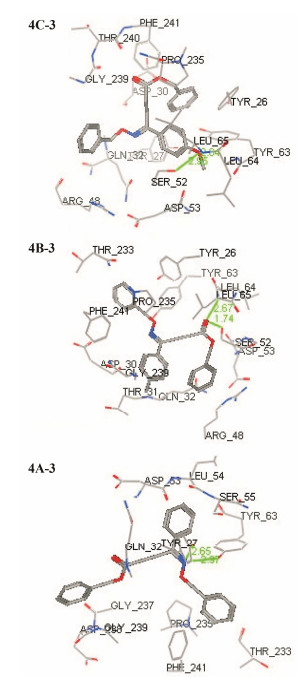
结果与讨论 1 虚拟筛选化合物4A-1~4D-3与人类白细胞抗原3OX8靶点对接结果如表 1所示, 多数化合物的对接作用部位集中在肟基-O-N=C, 这与文献[15]结论一致, 由此可以推测这些化合物可能具有潜在抗HBV活性。其中化合物4C-3、4B-3和4A-3的结果最好, 其分别与靶蛋白相互作用如图 1所示。
|
Schemes1 Reagents and conditions: (a) Succinic anhydride, AlCl3, CH2Cl2, 0.5 h 0 ℃; 6 h rt; (b) Phenylcarbinol, p-CH3C6H4SO3H(TsOH), CH2Cl2, 4 h 70 ℃, reflux; (c) Hydroxylamine hydrochloride (methoxylamine hydrochloride, benzylhydroxylamine hydrochloride), pyridine, CH2Cl2, overnight 65 ℃, reflux. |
| Table 1 Docking results of synthesized compounds with 3OX8 |
|
Figure 1 3D representation showing the binding mode of compounds 4C-3, 4B-3 and 4A-3 into the binding site of 3OX8 |
由表 1可得活性预测顺序为肟类 < 甲氧肟醚类 < 苄氧肟醚类, 且预测活性普遍高于3TC组。当初始原料取代基(R1)不同时, 活性预测顺序为:甲氧基取代 > 甲基取代 > 无取代 > 氯取代。
2 化学合成本文以苯、甲苯、甲基苯、氯苯为初始原料按合成路线1进行合成, 得到了12个目标化合物, 经1H NMR、13C NMR和MS确证了其化学结构。部分中间产物的数据如表 2所示。目标化合物的理化常数及波谱数据见表 3。
| Table 2 Partial experimental results of compounds 2A−2D and 3A−3D |
| Table 3 Physicochemical constants and spectral data of compounds 4A-1−4D-3 |
以HepG2 2.2.15细胞为模型, 细胞毒性实验(MTT法)检测目标化合物的细胞毒性; 用酶联免疫法(ELISA法)检测HepG2 2.2.15细胞培养液中HBsAg和HBeAg的表达。细胞毒性及活性结果见表 4。
| Table 4 Anti-HBV activity and cytotoxicity of the target compounds in vitro. SI > 2: High efficiency; 1 < SI < 2: Low efficiency and toxic; SI < 1: No efficiency and strong toxicity |
毒性实验结果表明, 除4A-1、4B-1、4C-1和4D-1四个肟类化合物之外, 其他化合物的毒性均小于3TC组。活性实验结果表明, 除4A-1、4B-1、4C-1和4D-1四个肟类化合物对HepG2 2.2.15细胞的HBsAg和HBeAg抑制活性较小外, 其他目标化合物均具有一定的抑制活性。4A-1、4B-1、4C-1和4D-1四个肟类化合物对HBsAg和HBeAg治疗指数SI均小于2, 且小于3TC组, 属于低效或无效药物。整体来看, 肟醚类化合物都表现出较低的毒性, 且毒性低于3TC组, 同时表现出较强的抑制HepG2 2.2.15细胞的HBsAg和HBeAg的分泌活性, 且抑制作用大于3TC组。其中以化合物4B-2活性最好, 其HBsAg IC50=81.15 μmol·L−1, HBeAg IC50=90.66 μmol·L−1, 治疗指数分别为SIHBsAg=9.20和SIHBeAg=8.24。
4 小结活性结果最好的化合物4B-2与靶点3OX8对接相互作用3D图如图 2。从对接结合能来说, 化合物4B-2为−20.138 9 kcal·mol−1, 残基Tyr27与-O-N=C的N原子间形成氢键, 距离为2.64 。与具有较好对接结果的苄氧肟醚化合物相比, 甲氧肟醚化合物具有更高的HBsAg和HBeAg的抑制活性。

|
Figure 2 3D representation showing the binding mode of compound 4B-2 into the binding site of 3OX8 |
利用MOE-dock分子对接结果预测活性顺序为:肟 < 甲氧基肟醚 < 苄氧基肟醚, 体外活性测试结果显示活性顺序为:肟 < 苄氧基肟醚 < 甲氧基肟醚。横向比较得知, 预测结果为: (R1基团)甲氧基取代 > 甲基取代 > 无取代 > 氯取代, 体外活性测试结果为: R1为甲基时最好, 无取代时最差。活性测试结果与利用MOE软件计算预测的活性结果有所出入, 说明模拟对接的靶点可能与化合物的实际作用靶点不同。未来可以将活性较好的化合物与HBV有关蛋白进行反向对接, 确定其作用靶点, 为虚拟筛选此类化合物提供更准确的靶点蛋白。
基于目标化合物的抗HBV活性初步测试结果, 甲氧肟醚类化合物抗HBV活性较好。本文从优化化合物结构方面探索抗HBV活性药物具有一定的指导意义。
实验部分 1 分子对接计算软件使用MOE 2008.10版本, 对接程序应用MOE-dock模块。
选取人类白细胞抗原HLA-A*02:03[21]为靶点蛋白, 来源蛋白质数据库protein data bank (PDB http:// www.rcsb.org/pdb/home/home.do。ID:3OX8), 对设计的化合物进行虚拟筛选。
在MOE中对靶点蛋白进行Protonate 3D加氢加电荷操作, 进行能量最小化操作, 删除水分子、离子等操作。之后进行Site Finder操作, 获取活性位点。在相同条件下, 将设计的化合物与靶点蛋白分别对接。
2 主要仪器与试剂Bruker 600 Avance Ⅲ核磁共振仪(以CDCl3或CDOD3为溶剂, Sigma公司, TMS为内标); Thermo Scientific ITQ 1100质谱仪(Thermo Fisher); WRX-4显微熔点仪(未经过校正); 薄层色谱硅胶(青岛海洋化工有限公司); 其他试剂均为分析纯。
生物活性试验中主要仪器与试剂: Elx800型酶联免疫检测仪(美国BIO-TEK公司); 高糖DMEM (Gibco); MTT (Amresco); G418 (Sigma); 谷氨酰胺(Sigma); 胎牛血清(胎牛血清); HBsAg、HBeAg试剂盒(上海科华生物工程股份有限公司); 3TC (葛兰素史克制药有限公司); 其他试剂均为分析纯。
3 化学合成 3.1 2A~2D的制备将25 mmol (1 equiv)取代苯溶于30 mL二氯甲烷中, 加入25 mmol (1 equiv)丁二酸酐, 冰水浴搅拌条件下, 在30 min内分批加入37.5 mmol (1.5 equiv)无水AlCl3, 之后常温反应6 h。薄层色谱检测跟踪反应, 反应结束后加入冰盐酸淬灭, 搅拌10 min, 抽滤, 用适量70%乙醇溶液重结晶, 干燥得产物2A~2D。
3.2 3A~3D的制备取15 mmol (1 equiv)化合物2A~2D和2 g对甲苯磺酸溶于20 mL二氯甲烷中, 加热到70 ℃, 回流, 加入30 mmol (2 equiv)苄醇。恒温磁力搅拌回流4 h, 薄层色谱检测跟踪反应。反应结束后, 减压旋干二氯甲烷, 用去离子水洗涤, 乙酸乙酯(20 mL×3)萃取, 合并有机层, 用无水硫酸钠干燥, 减压蒸除溶剂, 得粗品。粗品进行柱色谱分离(石油醚−乙酸乙酯, 6:1)得到产物3A~3D。
3.3 4A-1~4D-3的制备将化合物3A~3D (1 equiv, 3.84 mmol)和盐酸羟胺(或甲氧胺盐酸盐、苄氧胺盐酸盐) (2 equiv, 7.7 mmol)溶于20 mL二氯甲烷中, 加热回流65 ℃, 加入2 mL吡啶, 恒温下磁力搅拌回流过夜, 薄层色谱检测基本反应完全。冷却至室温, 减压蒸去剩余的吡啶, 加入20 mL乙酸乙酯, 用饱和食盐水(20 mL×3)洗涤, 有机相经无水硫酸钠干燥, 过滤, 浓缩得粗品。之后进行柱色谱分离(乙酸乙酯−石油醚, 1:5~1:13)得到产物4A-1~4D-3。
4 体外抗HBV活性实验参考文献[22]的方法, 检测目标化合物的细胞毒性和对HBsAg、HBeAg的抑制活性。
用GraphPad Prism 5软件计算半数有毒浓度(CC50)和半数抑制浓度(IC50)。治疗指数SI=CC50/ IC50。
| [1] | Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures[J]. J Viral Hepat , 2004, 11 :97–107. DOI:10.1046/j.1365-2893.2003.00487.x |
| [2] | Gitlin N. Hepatitis B:diagnosis, prevention, and treatment[J]. Clin Chem , 1997, 43 :1500–1506. |
| [3] | Yu LC, Wan MB, Chen CW. American Institute of Liver Diseases of chronic hepatitis B Practice Guidelines (2007) Essentials[J]. Chin Hepatol (肝脏) , 2007 (S1) :58–77. |
| [4] | Liu SJ. Research progress of anti-HBV drugs[J]. Chin Community Doctors (中国社区医师) , 2006, 22 :19–20. |
| [5] | Tan J, Degertekin B, Wong SN, et al. Tenofovir monotherapy is effective in hepatitis B patients with antiviral treatment failure to adefovir in the absence of adefovir-resistant mutations[J]. J Hepatol , 2008, 48 :391–398. DOI:10.1016/j.jhep.2007.09.020 |
| [6] | Feng PM, Chen Q, Chen L, et al. Meta-analysis on the validity of integrated treatment of entecavir and traditional Chinese medicine to CHB[J]. Mod Prev Med (现代预防医学) , 2015, 42 :180–183. |
| [7] | Liu CY, Xie ZY, Qin L. An unusual reaction to telbivudine:rhabdomyolysis[J]. Adv Drug React J (药物不良反应杂志) , 2009, 11 :201–203. |
| [8] | Zhang JC, Nie QH. New antiviral choice for chronic hepatitis B:tenofovir disoproxil fumarate[J]. World Chin J Digestol (世界华人消化杂志) , 2008, 16 :2679–2688. |
| [9] | Qu ZQ, Li FB, Xing CY, et al. Synthesis and antifungal activity of novel benzimidazol-2-ylcyanoketone oxime ethers containing morpholine moiety[J]. Chin J Org Chem (有机化学) , 2015, 35 :2229–2233. DOI:10.6023/cjoc201504018 |
| [10] | Yang YZ, Lin DY, Fu CR, et al. Synthesis and biological activity evaluation of novel pyrazole oxime ether derivatives containing chlorothiazole group and pyrimidine rings[J]. Chin J Org Chem (有机化学) , 2015, 35 :100–108. DOI:10.6023/cjoc201408004 |
| [11] | Hamzeh I, Balla S, Mohammad AS. Evaluation of substituted oxime ethers for growth regulatory activity against Spodopteralitura (Lepidoptera:Noctuidae)[J]. J Econ Entomol , 2007, 100 :361–365. DOI:10.1603/0022-0493(2007)100[361:EOSOEF]2.0.CO;2 |
| [12] | Park HJ, Lee K, Park SJ, et al. Identification of antitumor activity of pyrazole oxime ethers[J]. Bioorg Med Chem Lett , 2005, 15 :3307–3312. DOI:10.1016/j.bmcl.2005.03.082 |
| [13] | Chen Y, Wang ZB, Zhang X, et al. Synthesis and biological activity of oxime ethers of curcumin derivatives[J]. Chin J Org Chem (有机化学) , 2014, 34 :1662–1668. DOI:10.6023/cjoc201402035 |
| [14] | Luo Y, Song R, Li Y, et al. Design, synthesis, and biological evaluation of chalcone oxime derivatives as potential immunosuppressive agents[J]. Bioorg Med Chem Lett , 2012, 22 :3039–3043. DOI:10.1016/j.bmcl.2012.03.080 |
| [15] | Liu S, Wei WX, Li YB, et al. Design, synthesis, biological evaluation and molecular docking studies of phenylpropanoid derivatives as potent anti-hepatitis B virus agents[J]. Eur J Med Chem , 2015, 95 :473–482. DOI:10.1016/j.ejmech.2015.03.056 |
| [16] | Ikawa T, Sajiki H, Hirota K. Highly chemoselective hydrogenation method using novel finely dispersed palladium catalyst on silk-fibroin:its preparation and activity[J]. Te trahedron , 2005, 61 :2217–2231. DOI:10.1016/j.tet.2004.11.080 |
| [17] | Ali Y, Alam MS, Hamid H, et al. Design and synthesis of butenolide-based amide derivatives as anti-inflammatory agents[J]. Med Chem Res , 2015, 24 :3775–3784. DOI:10.1007/s00044-015-1404-y |
| [18] | Kohno Y, Narasaka K. Oxidative generation of.ALPHA.-radicals of carbonyl compounds from the.ALPHA.-stannyl derivatives and their reactions with electron-rich olefins[J]. Bull Chem Soc Jpn , 1995, 68 :322–329. DOI:10.1246/bcsj.68.322 |
| [19] | Li Z, Wang Y, Tang C, et al. Synthesis of 3-benzoyl acrylates/acrylamides via dehydrogenation of 3-benzoyl propionates/propionamides using IBX/p-TsOH[J]. Chin J Chem (中国化学) , 2010, 28 :1301–1305. DOI:10.1002/cjoc.201090225 |
| [20] | Boger DL, Mathvink RJ. Phenyl selenoesters as effective precursors of acyl radicals for use in intermolecular alkene addition reactions[J]. J Org Chem , 1989, 54 :1777–1779. DOI:10.1021/jo00269a001 |
| [21] | Liu J, Chen KY, Ren EC. Structural insights into the binding of hepatitis B virus core peptide to HLA-A2 alleles:towards designing better vaccines[J]. Eur J Immunol , 2011, 41 :2097–2106. DOI:10.1002/eji.201041370 |
| [22] | Wei JC, Yang XP, Li J, et al. Inhibiting effect of cyclocaryapaliurus extracts on HBsAg and HBeAg expression of the HepG22.2.15 cells[J]. Chin Tradit Pat Med (中成药) , 2012, 7 :1220–1224. |
 2016, Vol. 51
2016, Vol. 51



