2. 青海睿元药物研究所有限责任公司, 青海 西宁 810003
2. Qinghai Ruiyuan Pharmaceutical Research Institute Co. LTD, Xining 810003, China
动脉粥样硬化(atherosclerosis, AS)是冠心病、脑血管病及血栓栓塞性疾病等众多缺血性心脑血管疾病的共同病理基础。大量基础与临床研究表明, 血管内白细胞−内皮细胞黏附是AS发生发展的早期标志。
天然药物中存在许多能够抑制AS的活性成分物质。植物甾醇广泛存在于各种植物油、坚果、植物种子和蔬菜水果中, 可以抑制胆固醇吸收、促进胆固醇降解代谢, 显著降低血液中总胆固醇(TC)和低密度脂蛋白(LDL)含量[1], 具有抗AS的功效, 能够降低心血管疾病发生的风险[2, 3]。山楂(Crataeguspinnatifida Bge)中富含黄酮类成分, 如芦丁、槲皮素和异槲皮苷等, 可以通过降低血脂、保护血管内皮细胞免受自由基伤害等途径防治AS[4]。沙棘(Hippophaerhamnoides Linn)于1977年首次被载入我国药典, 其主要活性成分为黄酮和脂肪酸类化合物, 能有效降低胆固醇和甘油三酯, 促进脂质代谢, 具有防治心脑血管疾病的功效[5]。枸杞多糖是枸杞(Lyciumchinense Miller)发挥药理作用的主要活性成分, 据报道, 枸杞多糖能够降低高脂血症动物的血脂水平, 改善动物主动脉氧化应激状态, 从而延缓AS的发生[6]。脉抒是以山楂、沙棘和枸杞三味中药为主, 并添加多种植物甾醇(β-谷甾醇、豆甾醇和菜油甾醇等)、β-葡聚糖和番茄红素等制备而成的天然药物组方。
本研究利用高脂膳食诱导的载脂蛋白E (ApoE−/−)基因敲除小鼠AS模型, 测定药物处理的模型小鼠血脂水平, 观察主动脉及主动脉根部斑块形成、体内微循环中白细胞滚动速率、AS斑块中胶原纤维聚集及巨噬细胞浸润等改善程度, 以评价脉抒调节血脂、抑制AS形成作用, 并对脉抒的作用机制进行初步探讨。
材料与方法药品、试剂及实验仪器 脉抒由山楂、枸杞、沙棘和植物甾醇等制得, 内含总黄酮、粗多糖、总植物甾醇、β-葡聚糖、番茄红素和类胡萝卜素等主要有效成分, 为棕黄色粉末, 批号20150401, 青海睿元药物研究所有限责任公司提供; 阿托伐他汀(批号J35668, 辉瑞制药有限公司); 普罗布考(批号1070291KL, 齐鲁制药有限公司); TC检测试剂盒、甘油三酯(TG)检测试剂盒(日本积水医疗株式会社); PEG 6000 (Sigma公司); CD68抗体(Abcam公司); 大鼠二步法检测试剂盒、DAB显色试剂盒(中衫金桥公司); 乙腈(色谱纯, Merck公司); 乙酸(HPLC级, 美国Tedia公司); 乙酸铵(分析纯, 国药集团化学试剂有限公司); 实验用水娃哈哈纯净水(杭州娃哈哈公司)。Epoch CHS酶标仪(美国BioTek公司); 多用途低温高速离心机(Eppendorf公司); 微循环观察系统(北京吉安德尔公司); 体视显微镜(德国Leica公司); 冰冻切片机(德国Leica公司); 正置显微镜(日本Olympus公司); Agilent 1200系列快速高分辨液相色谱仪(德国Agilent Technologies公司); QSTARTM Elite四级杆−飞行时间型(Q-TOF)串联质谱仪(美国SCIEX公司)。
实验动物分组及给药 ApoE−/−小鼠及C57BL/6小鼠, 清洁等级SPF级, 雄性, 5~6周龄, 北京维通利华生物科技有限公司提供, 生产许可证号: SCXK (京) 2014-0008。C57BL/6小鼠10只为正常对照组, ApoE−/−小鼠60只, 分别为模型对照组、脉抒给药组3个(1、2和4 g·kg−1)、阿托伐他汀对照组(10 mg·kg−1)、普罗布考对照组(200 mg·kg−1), 每组10只。
脉抒的紫外液相色谱−质谱联用(LC-UV-MS)分析 精密称取脉抒样品粉末10.0 g, 加入75%甲醇水100 mL, 超声提取30 min, 静置后分离上清液, 如此重复提取3次, 合并上清液并过滤, 滤液经旋转蒸发浓缩至10 mL左右后, 用0.22 μm滤膜过滤即得供试品溶液。
色谱条件 Acquity UPLC® HSST3色谱柱(100 mm × 2.1 mm, 1.8 μm); 流动相乙腈(A)−0.2%乙酸水溶液(含10 mmoL·L−1乙酸铵, B), 梯度洗脱, 0~15 min, 2%~15% B; 15~40 min, 15%~35% B; 流速: 300 μL·min−1; 柱温:室温; 检测波长: 190~400 nm; 进样量: 6 μL。
质谱条件 采用电喷雾离子源(ESI), 在负离子模式下检测, 扫描方式: TOF MS和Product ion扫描, 扫描范围: m/z 100~1 000, 离子源温度(TEM)为500 ℃, 喷雾电压为−4.5 kV, 雾化气(N2)压力为60 psi, 辅助气(N2)压力为60 psi, 解簇电压为−65 V, 气帘气(N2)压力为30 psi, 碰撞气(N2)压力为5 psi, 碰撞能量为−30 V。
动脉粥样硬化动物模型建立 动物适应性喂养1周后, 设C57BL/6小鼠为正常对照组, 其他动物按照体重分层随机分组, 分别为模型对照组、阳性对照药物阿托伐他汀(10 mg·kg−1)组、普罗布考(200 mg·kg−1)组、1、2和4 g·kg−1脉抒3个剂量组, 每组10只。除正常对照组外, 动物饲喂高脂饲料并经口灌胃给予相应药物, 每天给药1次, 给药体积为0.01 mL·g−1, 连续给药10周, 正常对照组与模型对照组给予等体积蒸馏水。各组动物自由饮水。
血清TC、TG及高密度脂蛋白胆固醇(HDL-C)测定 末次给药时间点前12 h禁食, 次日给药后30 min眼内眦静脉取血0.5 mL, 静置30 min; 4 500 ×g离心10 min, 得到血清。用TC、TG试剂盒测定各样本吸光度, 计算血清中TC和TG浓度。采用PEG 6000沉淀剂沉淀血清中含有载脂蛋白B (ApoB)的脂蛋白, 获得仅含HDL-C的血清样本并用试剂盒测定HDL-C含量; 计算非高密度脂蛋白胆固醇(NHDL-C)含量:极低密度脂蛋白胆固醇(VLDL-C) +低密度脂蛋白胆固醇(LDL-C)=TC − HDL-C。
小鼠肠系膜微循环白细胞−内皮细胞黏附状况观察 末次给药时间点前12 h禁食, 次日给药后30 min使用3%戊巴比妥钠麻醉小鼠, 剂量为50 mg·kg−1。待小鼠麻醉后, 眼内眦静脉注射0.05%罗丹明6G生理盐水溶液, 注射剂量为2 mg·kg−1。1 min后打开小鼠腹腔, 于玻璃托盘展开肠系膜, 置于37 ℃恒温箱内, 使用荧光正置显微镜观察小鼠肠系膜微静脉血流中白细胞流动状态。每只小鼠随机选取3个观察点, 使用Toupview软件记录血流动态图像, Image Pro Plus软件计算白细胞滚动速率。
小鼠标本取材 上述实验结束时, 仰卧位固定小鼠, 迅速打开小鼠胸腔, 用生理盐水经左心室全身灌流, 再用4%多聚甲醛灌流固定, 去除肋骨, 剔除肺、肝脏、脾脏、消化道和肾脏等器官, 快速分离心脏和自心脏起至下髂动脉分支处的整条动脉, 储存于4%多聚甲醛固定液, 过夜后转入20%蔗糖溶液脱水, 用于后续实验。
主动脉全长油红O染色 从蔗糖溶液中取出心脏及主动脉, 自心脏始发1~2 mm处剪断主动脉, PBS冲洗, 于体视显微镜下剥去血管外膜及小动脉分支, 将血管(含主动脉弓处3个分支)纵向剪开, 暴露其内表面。量取油红O染液60 mL, 加入蒸馏水至100 mL, 混匀静置10 min后浸润整条主动脉, 染色1 h。后用60%异丙醇浸泡标本至斑块底色为白色。蒸馏水清洗后将主动脉于黑色硅胶垫上平铺固定, 拍照, 用Image Pro Plus分析血管内阳性染色面积。
主动脉根部冰冻切片及油红O染色 用OCT包埋剂包埋整个心脏, 自主动脉始发处向心尖部位做横向冰冻切片, 显微观察出现主动脉三瓣膜时, 以10 μm连续切片至瓣膜消失, 每只动物收集6张载玻片冷冻保存。将用于油红O染色的切片恢复室温后使用蒸馏水润洗, 后置于100%丙二醇溶液脱水2 min, 之后用油红O工作液室温下染色1 h。使用60%异丙醇溶液连续漂洗3次, 每次1 min。再用苏木素复染2 min, 自来水冲洗返蓝。室温晾干切片, 甘油明胶封片, 镜检并拍照记录, 使用Image Pro Plus分析主动脉根部阳性染色面积。
主动脉根部冰冻切片天狼星红染色 将主动脉根部冰冻切片恢复室温后用苏木素染色8 min, 自来水冲洗返蓝。之后将切片浸入0.1%天狼星红饱和苦味酸溶液, 室温染色1 h, 酸化水(量取5.0 mL冰醋酸用蒸馏水稀释至1.0 L)冲洗2次。晾干载玻片, 无水乙醇脱水3次, 超安透明剂透明2次, 中性树胶封片, 镜检并拍照保存。
主动脉根部冰冻切片免疫组织化学染色 取出主动脉根部冰冻切片, 室温放置30 min。用抗原修复液(pH 6.0柠檬酸钠溶液)用微波加热法处理切片。用PBS润洗3次, 每次2 min。稍甩干后滴加3% H2O2, 室温避光孵育10 min后甩掉液体, PBS润洗3次, 每次2 min。甩干, 滴加一抗(货号ab53444) 1 mL·kg−1, 37 ℃孵育2 h, PBS润洗3次, 每次2 min。滴加二抗(货号pv-6004), 37 ℃孵育30 min, PBS润洗3次, 每次2 min。滴加显色液(货号ZLI-9018), 室温避光显色10 min, 观察, 适当调整显色时间, 用蒸馏水终止显色。稍甩干后苏木素复染3~5 s, 自来水冲洗返蓝, 甘油明胶封片, 镜检, 拍照。
数据统计 数据用x±s表示, 组间均数比较采用单因素方差分析(one-way ANOVA), P < 0.05被认为有统计学差异。实验图表运用Graphpad Prism 5.0软件绘制。
结果 1 脉抒成分的LC-UV-MS分析采用LC-UV-MS法, 参考黄酮类化合物的质谱裂解规律, 结合高分辨质谱数据、二级质谱数据, 推断脉抒中可能含2, 6-二甲氧基查尔酮、黄烷酮醇、绿原酸、剌芒柄花素和芦丁等化学成分(图 1, 表 1)。分析表明, 脉抒内含总黄酮9.5%、总植物甾醇23.8%、β-葡聚糖8.4%、枸杞多糖0.5%、番茄红素和类胡萝卜素约1.2%等。
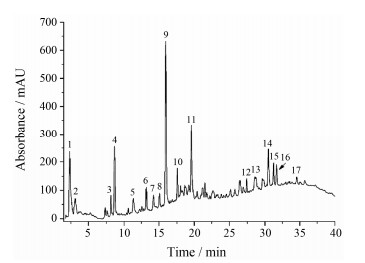
|
Figure 1 UV spectrum of MaiShu extracts at 340 nm. HPLC analysis was carried out on an Agilent 1200 series rapid-resolution liquid chromatography system with a Waters Acquity UPLC HSS T3 column. The mobile phase consisted of acetonitrile and 0.2% (v/v) aqueous acetic acid containing 10 mmol·L−1 ammonium acetate with liquid flow rate of 0.3 mL·min−1. Numbers 1 to 17 are consistent with the numbers in Table 1 |
| Table 1 17 compounds identified from MaiShu by using LC-UV-MS data |
与正常组比较, 模型对照组血清总胆固醇、甘油三酯含量升高(P < 0.001), 阳性药普罗布考组血清总胆固醇显著降低(P < 0.05)。脉抒给药10周后, 与模型组相比, 高剂量组(4 g·kg−1)动物血清总胆固醇含量显著降低(P < 0.001), 但低、中剂量组(1、2 g·kg−1)下未见降低血清总胆固醇含量作用(表 2)。此外, 与模型组相比, 脉抒低、中、高剂量组均具有显著降低血清甘油三酯作用, 但3组间未表现出量效关系(表 2)。
| Table 2 Effects of MaiShu on serum contents of TC and TG. n=8, x±s. TC: Total cholesterol; TG: Triglyceride; HDL-C: High density lipoprotein cholesterol; NHDL-C: Non-high density lipoprotein cholesterol. ###P < 0.001 vs control group; P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
受血液流变学的影响, 动脉粥样硬化斑块最容易形成于主动脉弓部及主动脉分叉部位。通过主动脉全长油红O染色观察发现, 高脂饲料喂养10周后ApoE−/−小鼠在主动脉弓部和主动脉分叉部位布满红染斑块样物质, 而各给药组均能不同程度降低斑块形成面积(图 2A)。通过对主动脉全长中斑块面积所占血管剖面比例的统计发现, 与模型组比较, 脉抒中剂量(P < 0.01)及高剂量(P < 0.001)均能明显减少主动脉弓和分叉部位动脉粥样硬化斑块的形成, 且脉抒中剂量组效果略优于阿托伐他汀(P < 0.05), 脉舒高剂量组效果明显优于阿托伐他汀(P < 0.05)和普罗布考(P < 0.001) (图 2B)。此外, 从统计学分析来看, 脉抒减少斑块形成作用呈量效关系(图 2B)。
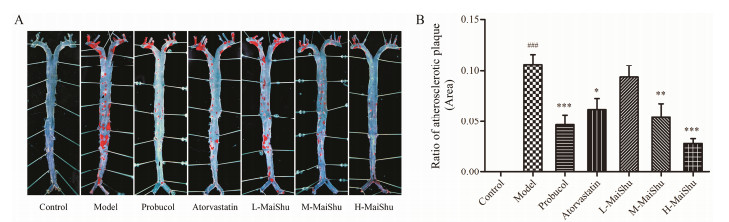
|
Figure 2 Effect of MaiShu on suppression of atherosclerotic lesions in aortas of mice. A: Representative images of atherosclerotic lesions in aortas stained by oil red O; B: Summary data of the ratio of atherosclerotic plaque are provided in column. n=6, x±s; ### P < 0.001 vs control group; *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
主动脉根部即主动脉三瓣膜处, 通过对主动脉根部冰冻切片油红O染色实验发现, 空白对照组主动脉根部未见斑块形成, 模型组主动脉根部斑块面积巨大, 在三瓣膜周围有大量斑块分布, 其余各组高脂饲料喂养组均有不同程度斑块沉积(图 3A)。通过对主动脉根部斑块面积统计发现, 与模型组相比, 给予普罗布考(P < 0.05)、脉抒中剂量(P < 0.01)和高剂量(P < 0.01)后, 主动脉根部斑块面积显著性减少(图 3B)。表明脉抒中剂量和高剂量均能有效缓解动物主动脉根部脂质斑块的形成, 且脉抒中、高剂量效果优于普罗布考(图 3B)。
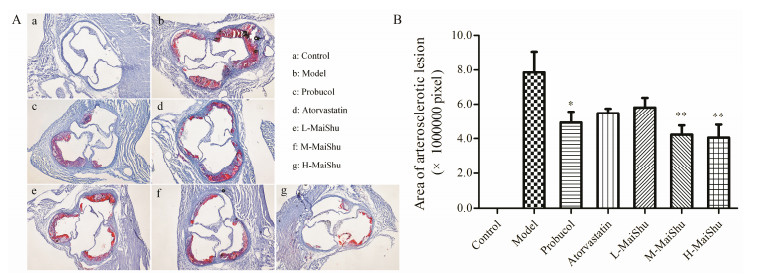
|
Figure 3 Effect of MaiShu on suppression of atherosclerotic lesions at the aortic root of mice. A: Representative images of aortic root lesions stained by oil red O (40 ×); B: Summary data of area of atherosclerotic lesions at aortic root. n=5, x±s. *P < 0.05, **P < 0.01 vs model group |
高脂饲料喂养10周后, 与正常组相比, 模型组小鼠肠系膜微循环中白细胞流动速率显著降低(P < 0.001), 提示高脂血条件下白细胞与血管内皮细胞黏附概率提高, 白细胞与血管内皮黏附是动脉粥样硬化斑块形成的重要诱导因素之一。普罗布考、阿托伐他汀和脉抒中剂量均能不同程度地缓解白细胞运动速率降低, 但未见显著性差异。而脉抒高剂量组(4 g·kg−1)小鼠较模型组白细胞运动速率有显著提高(图 4B), 表明脉抒高剂量能有效降低微循环中白细胞与血管内皮细胞的黏附概率。
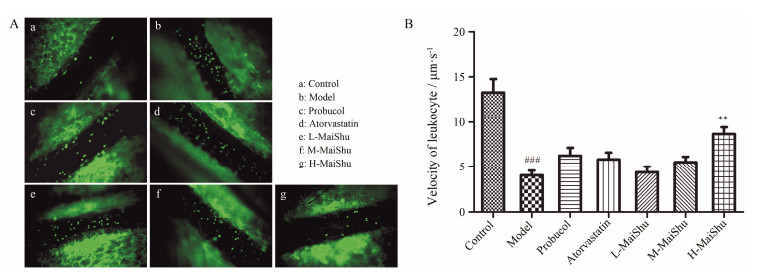
|
Figure 4 Effects of MaiShu on suppression of leukocyte-endothelial cell adhesion in vivo. A: Representative still images are shown for mesenteric artery of mice (40 ×); B: Summary data of the velocity of leukocytes in mesenteric artery. n=8, x±s. ###P < 0.001 vs control group; **P < 0.01 vs model group |
动脉粥样硬化斑块中的胶原含量与斑块的稳定性密切相关。通过天狼星红染色发现, 模型组动物主动脉根部斑块中胶原含量较少, 表现为斑块仅有少部分被染成浅红色(图 5A), 表明模型组主动脉根部斑块稳定性较差。而脉抒低、中、高剂量动物主动脉根部斑块的着色与模型组动物相比有着色加深, 表明脉抒低剂量组具有明显的稳定动脉斑块的作用。
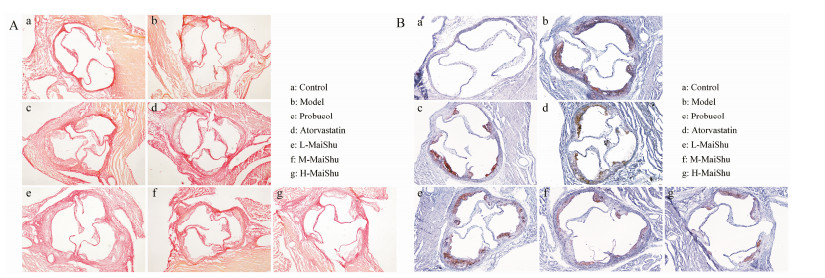
|
Figure 5 Effect of MaiShu on suppression of inflammation at the aortic root of mice. A: Representative images of collagenous fibres in aortic root lesions stained by sirius red (40 ×); B: Representative images of macrophages marked with CD68 in arotic root lesions detected by immunohistochemistry assay (40 ×) |
目前公认的动脉粥样硬化发病机制为血管炎性学说。本实验通过利用免疫组化染色技术特异性标记主动脉根部冰冻切片中的巨噬细胞表面标识CD68, 来观察脉抒是否在缓解主动脉根部动脉粥样硬化斑块形成的同时, 表现出巨噬细胞含量减少。结果发现, 脉抒中、高剂量给药组动物的斑块中, 巨噬细胞较模型组明显减少(图 5B)。说明脉抒能够降低主动脉中的炎症反应程度, 提示脉抒有可能通过抑制血管炎症的途径来发挥抗动脉粥样硬化作用, 但该作用机制仍需进一步研究探讨。
讨论黄酮类化合物种类繁多, 按结构可分为黄酮类、黄酮醇类、查尔酮类、双黄酮类、异黄酮类及其他黄酮类等[7]。近年大量实验研究结果显示, 黄酮类化合物有抗炎、抗氧化、抗衰老、免疫调节及降血脂等作用[8]。本研究利用LC-MS技术对脉抒的化学成分进行分析, 发现脉抒中含2, 6-二甲氧基查尔酮、黄烷酮醇、绿原酸、剌芒柄花素和芦丁等多种黄酮类化合物, 这些化学成分是脉抒发挥药效的重要物质基础。AS发生始动因素主要是动脉壁内皮损伤及脂质沉积[9]。有研究表明脂质的致炎作用是AS发生的诱因之一[10]。本研究结果显示, 高脂膳食诱导的ApoE−/−小鼠AS模型动物血脂水平较正常动物显著升高, 给予临床常用调脂药普罗布考的动物胆固醇水平较模型组显著降低, 提示高脂血症造模成功。虽然在本实验中阿托伐他汀也表现出降低血脂水平的作用, 但差异不显著。黄酮类化合物有显著降脂作用[11], 其可能作用机制:通过抑制肠上皮细胞中脂质结合受体和转运蛋白活性来减少脂肪吸收; 通过激活腺苷酸活化蛋白激酶(adenosine-5'-monophosphate-activated protein kinase, AMPK)途径增强脂质分解; 通过抑制乙酰辅酶A羧化酶(acety1-CoA carboxylase, ACC)、脂肪酸合成酶(fatty acid synthetase, FAS)等减少脂质合成; 调控脂质代谢调节相关的microRNA[12]。脉抒天然组方中富含黄酮类化合物, 在本研究中尽管量效关系不明确但表现出了明显的降血脂作用, 能从源头上降低AS的发病风险。脉抒作用途径可能是上述机制中的一种或几种, 具体机制探索验证工作将在后续研究中完成。
AS斑块的数量和其发生发展的程度有关, 而斑块的稳定性则与其结构中胶原纤维的合成密切相关。ApoE−/−小鼠AS模型能够在胸腹动脉中形成广泛的粥样硬化斑块病变, 且其AS病变的发展同人类发病极其相似[13]。本研究结果显示, 高脂膳食会诱导ApoE−/−小鼠在主动脉弓、胸主动脉、腹主动脉及主动脉根部形成明显斑块。而脉抒干预能明显减少主动脉血管中及血管根部斑块的形成, 能改善斑块中的纤维含量, 对斑块有稳定作用, 说明脉抒具有明显的抗AS作用。
虽然AS发病机制尚未完全明晰, 但在众多的学术假说中, 血管炎症机制在近年的研究和论证中被越来越多的学者所重视和认可[14, 15]。血液中的单核细胞在黏附因子的作用下黏附于内皮细胞与脂肪斑的形成密切相关[16]。本研究通过观察小鼠体内微循环中白细胞流动速率的改变来评价模型动物在给药干预后是否降低了白细胞与内皮细胞的黏附风险, 结果显示脉抒能有效改善模型动物的白细胞流动速率。说明脉抒干预后血管内炎性反应减缓, 白细胞与内皮细胞黏附几率降低, AS的发生风险得到降低。血管内皮黏附分子(vascular cell adhesion molecule-1, VCAM-1)是血管内皮细胞表面表达的重要的黏附因子, 是诱导血液中单核细胞与内皮细胞黏附并进入内膜下的重要环节, 抑制VCAM-1表达可以减少单核细胞−内皮细胞黏附[17, 18]。本研究中脉抒的主要组分黄酮类化合物、植物甾醇已经被证实具有抗炎、抗氧化作用[2, 8, 19], 且黏附分子表达与血管炎症相关[20], 因此脉抒可能是通过抑制血管炎症进而降低VCAM-1的表达来发挥其抑制AS作用的。同时, 本研究中脉抒干预组主动脉根部斑块减少的同时巨噬细胞浸润的减轻, 也表明脉抒可能是通过抑制炎性反应发挥抗AS作用。
脉抒在抑制AS方面表现出显著的效果和潜在的应用前景, 更深入的药理作用及其机制仍在进一步探究中。
| [1] | Moghadasian MH, Frohlich JJ. Effects of dietary phytosterols on cholesterol metabolism and atherosclerosis:clinical and experimental evidence[J]. Am J Med , 1999, 107 :588–594. DOI:10.1016/S0002-9343(99)00285-5 |
| [2] | Santas J, Codony R, Rafecas M. Phytosterols:beneficial effects[M]//Ramawat KG, Mérillon JM. Natural Products. Berlin:Springer, 2013:3437-3464. |
| [3] | Dhankhar J. Cardioprotective effects of phytosterols[J]. Int J Pharm Sci Res , 2013, 4 :590–596. |
| [4] | Suomela JP, Ahotupa M, Yang BR, et al. Absorption of flavonols derived from sea buckthorn (Hippophaёrhamnoides L.) and their effect on emerging risk factors for cardiovascular disease in humans[J]. J Agric Food Chem , 2006, 54 :7364–7369. DOI:10.1021/jf061889r |
| [5] | Yu DH, Bao SR, Yu CM, et al. Reserch progress of pharmacological action of hawthorn leaves flavonoids[J]. J Liaoning Univ Tradit Chin Med (辽宁中医药大学学报) , 2013, 15 :174–177. |
| [6] | Jiang QR, Yao CL, Li GZ. Effects of lyceum barbarum polysaccharides on blood lipid and oxidative stress of aorta in hyperlipemia rat[J]. Ningxia Med J (宁夏医学杂志) , 2010, 32 :504–506. |
| [7] | Hollman PCH, Katan MB. Dietary flavonoids:intake, health effects and bioavailability[J]. Food Chem Toxicol , 1999, 37 :937–942. DOI:10.1016/S0278-6915(99)00079-4 |
| [8] | Ma R, Wu SB. Advances in pharmacological effect and mechanism of flavonoid in traditional Chinese medicine[J]. Chin J Pharmacovigilance (中国药物警戒) , 2013, 10 :286–290. |
| [9] | Williams JK, Sukhova GK, Herrington DM, et al. Pravastatin has cholesterol-lowering independent effects on the artery wall of atherosclerotic monkeys[J]. J Am Coll Cardiol , 1998, 31 :684–691. DOI:10.1016/S0735-1097(97)00537-8 |
| [10] | Tripathy D, Mohanty P, Dhindsa ST, et al. Elevation of free fatty acids induces inflammation and impairs vascular reactivity in healthy subjects[J]. Diabetes , 2003, 52 :2882–2887. DOI:10.2337/diabetes.52.12.2882 |
| [11] | Jia YY, Hoang MH, Jun HJ, et al. Cyanidin, a natural flavonoid, is an agonistic ligand for liver X receptor alpha and beta and reduces cellular lipid accumulation in macrophages and hepatocytes[J]. Bioorg Med Chem Lett , 2013, 23 :4185–4190. DOI:10.1016/j.bmcl.2013.05.030 |
| [12] | Dong LH, Zhang RF, Su DX, et al. Research progress on the hypolipidemic effects of flavonoids and the related molecular mechanism[J]. Chin J Cell Biol (中国细胞生物学学报) , 2016, 38 :81–90. |
| [13] | Szmitko PE, Verma S. C-reactive protein and the metabolic syndrome:useful addition to the cardiovascular risk profile[J]. J Cardiometab Syndr , 2006, 1 :66–69. DOI:10.1111/cms.2006.1.issue-1 |
| [14] | Ross R. Atherosclerosis-an inflamematory disease[J]. New Engl J Med , 1999, 340 :115–126. DOI:10.1056/NEJM199901143400207 |
| [15] | Hansson G. Atherosclerosis--an immune disease:the anitschkov lecture 2007[J]. Atherosclerosis , 2008, 202 :2–10. |
| [16] | Jaipersad AS, Lip GYH, Silverman S, et al. The role of monocytes in angiogenesis and atherosclerosis[J]. J Am Coll Cardiol , 2014, 63 :1–11. DOI:10.1016/j.jacc.2013.09.019 |
| [17] | Gai YT, Shu Q, Chen CX, et al. Anti-atherosclerosis role of Noleoylethanolamine in CB 2[J]. Acta Pharm Sin (药学学报) , 2014, 49 :316–321. |
| [18] | Zheng SG, Zhao MQ, Ren YN, et al. Effects of crocetin on VCAM-1 expression in human umbilical vein endothelial cells and monocyte-endothelial cell adhesion[J]. Acta Pharm Sin (药学学报) , 2015, 50 :34–38. |
| [19] | Guan X, Yao BL. Research progress of pharmacological actions of chalcones[J]. Guangzhou Chem Ind (广州化工) , 2012, 40 :23–25. |
| [20] | Pateras I, Giaginis C, Tsigris C, et al. NF-κB signaling at the crossroads of inflammation and atherogenesis:searching for new therapeutic links[J]. Exp Opin Therapeut Targets , 2014, 18 :1089–1101. DOI:10.1517/14728222.2014.938051 |
 2016, Vol. 51
2016, Vol. 51


