2. 国家食品药品监督管理总局高级研修学院, 北京 100073 ;
3. 中国中医科学院医学实验中心, 北京 100700
2. China Food and Drug Administration Institute of Executive Development, Beijing 100073, China ;
3. The Experimental Research Center, China Academy of Chinese Medical Sciences, Beijing 100700, China
溃疡性结肠炎(UC)是常见的炎症性肠病, 以腹痛腹泻、黏液脓血便持续或反复发作为主要症状。目前该病病因病机不明确, 尚缺乏有效治疗方法[1]。近年来, 本课题组研究证实黄芩汤(HQT, 由黄芩、芍药、炙甘草和大枣组成)来源于汉代张仲景《伤寒论》, 为历代清热止痢、和中止痛的经典方剂, 对UC大鼠模型肠黏膜炎症有较好的改善作用。NF-κB作为重要的转录因子是UC发生发展过程中多种信号传导途径的汇聚点, 在调节炎症反应相关的基因中起关键作用[2]。而作为NF-κB重要的上游通路TLR4/ MyD88是否参与UC的发病机制, 以及黄芩汤对此通路是否有调节作用则不清楚。本实验通过观察HQT对UC大鼠结肠组织TLR4/MyD88蛋白表达, COX-2、iNOS阳性表达及血清细胞因子的影响, 进一步探讨其治疗UC的可能作用机制。
材料与方法动物 6~8周龄、体重180~200 g的雄性清洁级SD大鼠, 由北京维通利华实验动物技术有限公司提供。许可证号: SCXK (京) 2012-0001。动物饲养室保持(23±1.5) ℃, 相对湿度(45±15) %。
药品与试剂 黄芩(Scutellaria baicalensis Georgi)、芍药(Paeonia lactiflora Pall.)、炙甘草(Glycyrrhiza uralensis Fisch.)和大枣(Ziziphus jujuba Mill.)均购自北京仟草药业有限公司, 经中国中医科学院中药研究所李先端研究员鉴定为合格药材。HQT水提物按照文献[3]方法提取得到。经指纹图谱相似度和多成分含量分析控制, 提取率约为39.39%, 与对照图谱相似系数为0.998, 主要含黄酮和萜类化合物, 黄酮类成分占水提物总重量的(22.60±9.95) %, 其中主要活性成分质量分数黄芩苷为10.414 9%, 汉黄芩苷为2.417 9%, 千层纸素A-苷为0.822 9%, 符合课题组确定的质量要求[3]。柳氮磺胺吡啶肠溶片(salazosulfapyridine, SASP, 批号: 09150403, 上海信谊天平药业有限公司); 2, 4, 6-三硝基苯磺酸(TNBS, 美国Sigma公司); IL-17、PGE2、IL-4和IL-10 ELISA试剂盒(上海泛柯实业有限公司); 免疫组化及DAB显色试剂盒(武汉博士德生物工程有限公司); TLR4山羊多克隆抗体(美国Santa Cruz公司); MyD88兔单克隆抗体(美国CST公司); 兔抗鼠COX-2多克隆抗体(美国CST公司); 兔抗鼠iNOS多克隆抗体(英国Abcam公司)。
造模方法 采用Morris等[4]报道的方法制备大鼠UC模型, 大鼠禁食24 h后一次性将TNBS (100 mg·kg−1)和50%乙醇溶液0.25 mL用橡胶输液管缓慢注入距肛门约8 cm处的肠腔内, 捏紧肛门, 倒置几分钟。正常组注入相同体积的生理盐水, 术后常规饲养。
实验分组及样品采集 大鼠按体重随机分为正常组、模型组、阳性药SASP组和HQT高、中、低剂量组, 每组7只。造模3天后开始给药, HQT高、中、低剂量组分别按20、10、5 g·kg−1灌胃给药(生药量/大鼠体重, 按照临床人用剂量27 g/70 kg/天, 大鼠给药剂量相当于临床人用剂量的7.2、3.6、1.8倍), 阳性药SASP混悬液组按0.5 g·kg−1灌胃给药, 正常组和模型组灌胃等剂量的生理盐水, 每日1次, 连续5天。末次给药后大鼠禁食24 h, 其中在第3天各组大鼠眼眶取血, 以3 000 r·min−1离心15 min分离血清, 置−20 ℃冰箱冷冻保存。给药5天后处死大鼠, 取出距肛门8 cm处结肠组织, 沿肠系膜缘剪开肠腔, 用生理盐水冲洗肠内容物, 剪成2段, 一段置于−80 ℃冰箱内保存待用, 另一段置于中性甲醛溶液内固定, 石蜡包埋进行常规病理切片及免疫组化染色。
指标检测及方法外观指标 造模前、造模后和给药后分别观察大鼠精神及活动状况, 记录饮食量。
病理学指标 肉眼及镜下观察结肠组织形态。按常规包埋、切片, 厚度为4 μm, 进行HE染色, 高倍显微镜下选取视野, 根据溃疡大小、炎症浸润和结构损伤程度等进行结肠组织病变损伤程度统计和比较[5, 6]。
血清中炎症因子的测定Griess法测定NO含量, ELISA试剂盒测定IL-17、PGE2、IL-4和IL-10含量, 具体按试剂盒说明书进行操作。
结肠中蛋白的表达 取采集好的大鼠结肠样本, 采用BCA法检测蛋白浓度, 将制备好的蛋白样品SDS-PAGE行电泳分离条带, 转膜, 封闭, TBST (Tris-buffered saline with Tween)洗膜, 加入TLR4和MyD88抗体, 4 ℃反应过夜, 洗涤, 加入二抗并室温下孵育2 h, 洗涤, X线胶片曝光, 图片扫描, 采用凝胶图像处理系统分析条带的灰度值。
免疫组化染色 采用S-P法检测大鼠结肠组织中COX-2和iNOS表达。结肠组织用中性甲醛固定24 h后, 常规脱水、浸蜡、包埋、切片, 然后常规二甲苯脱蜡, 梯度酒精水化, 采用复合消化液和抗原修复液进行抗原修复, PBS洗3次, 用3% H2O2溶液孵育15 min (去除内源性过氧化氢酶活性), 滴加1:600浓度的兔抗鼠COX-2单克隆抗体和iNOS多克隆抗体, 4 ℃过夜, PBS洗3次, 滴加聚合HRP标记抗兔IgG 37 ℃孵育30 min, PBS冲洗, DAB显色, 常规脱水, 用中性树胶封片。每张切片在高倍镜下(400×)随机选取4个视野, 以出现棕黄色染色为阳性信号, 检测COX-2、iNOS积分吸光度值, 以均值表示每个标本积分吸光度值。
统计学方法 实验数据用SPSS 19.0统计软件进行分析, 数据以x±s表示, 各组数据间比较采用t检验进行分析, P < 0.05为差异有统计学意义, P < 0.01为差异极具统计学意义。
结果 1 HQT对UC大鼠精神、活动状况及饮食量的影响经TNBS造模给药的大鼠3天内先后出现不同程度的精神萎靡, 双目暗淡、嗜卧扎堆、竖毛、毛泽无光、体重减轻、进食饮水减少、大便溏或软粒状伴黏冻、个别出现脓血。HQT给药(20、10、5 g·kg−1) 5天后, 上述症状均得到不同程度的改善, 精神萎靡好转、体重增加、大便脓血消失。尤以阳性药SASP混悬液组(0.5 g·kg−1)及HQT高剂量组(20 g·kg−1)改善明显, 而模型组大鼠症状未出现显著改善。
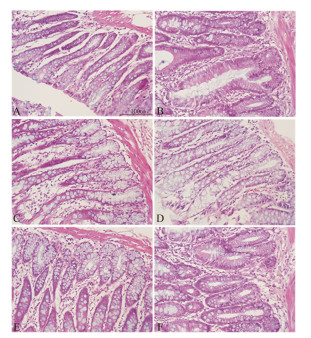
2 病理学指标UC大鼠结肠组织HE染色见图 1, 高倍镜下各组大鼠结肠组织病变损伤情况的统计比较结果见表 1。
|
Figure 1 Microscopic damage of colon tissue of rats (10×40). Effects of Huangqin Tang (HQT) on colon tissue damage of rats. A: Normal control; B: Model control; C: Salazosulfapyridine (SASP) 0.5 g·kg−1; D: HQT 20 g·kg−1; E: HQT 10 g·kg−1; F: HQT 5 g·kg−1 |
| Table 1 Microscopic damage of colon tissue of rats (10 ×40). n=7. "−": Normal colonic mucosa and colonic mucosal gland structure; "±": No focal inflammation under the colonic mucosa; "+": Limited focal inflammation under colonic mucosa gland; "++": Large inflammatory infiltration under colonic mucosa gland |
肉眼观察大鼠结肠组织:正常对照组结肠外观正常, 未见充血, 颜色正常, 浆膜面、黏膜面和肌层未见明显病变; 模型组部分结肠明显充血、瘀血, 并有肠黏膜颜色变褐色, 粪便有节段性充满肠道, 部分味恶臭, 结肠粘连; 阳性药SASP组大鼠结肠未见明显充血、瘀血, 病变明显减轻。HQT各剂量组大鼠结肠充血、瘀血, 肠颜色及肌层厚度与模型组相比有不同程度减轻。
镜下观察大鼠结肠组织:正常组大鼠结肠黏膜完整, 肌层结构正常, 黏膜下没有炎症现象; 模型组大部分大鼠结肠黏膜均有炎症, 肠黏膜内细胞排列紊乱, 且可能由于结肠炎的反复性导致内部细胞大小不均一。部分结肠腺体消失, 被浸润的炎症细胞替代, 以单核细胞、淋巴细胞、嗜酸性细胞代替了正常细胞, 有的黏膜层明显变薄, 个别大鼠结肠的肌层组织炎症较重, 失去了正常结构。与模型组相比, SASP组大鼠结肠黏膜炎症浸润、肠腺溃疡、病变明显减轻; HQT高、中剂量组大鼠黏膜炎症浸润、肠腺溃疡等病变均有不同程度减轻。而HQT低剂量组改善程度不明显。此病理学结果与本课题组前期实验结果一致[2], 说明HQT对改善UC造成的病理损伤具有较好的修复作用。
3 HQT对UC大鼠血清中NO、IL-17、PGE2、IL-4、IL-10含量的影响造成UC模型后, 大鼠连续给药3天, 血清中NO、IL-17、PGE2、IL-4、IL-10含量变化结果如表 2所示。模型组血清中促炎因子NO、IL-17、PGE2含量均显著高于正常组; 抑炎因子IL-4、IL-10含量低于正常组, 但无统计学差异。与模型组相比, 阳性药SASP组与黄芩汤各组血清中NO均有不同程度的降低, 其中HQT高剂量组(20 g·kg−1)较为明显(P < 0.05); HQT各组IL-17、PGE2均显著降低, 其中HQT高剂量组最为明显(P < 0.05, P < 0.01); HQT高、中剂量组血清中IL-4水平有升高的趋势, 但阳性药SASP组和HQT高剂量组的IL-4水平均低于模型组; 阳性药、HQT高、中剂量组血清中IL-10均高于模型组, 但无统计学意义。结果显示, HQT对促炎因子NO、IL-17、PGE2具有抑制作用, 对抑炎因子IL-10具有升高的作用趋势。
| Table 2 Effects of Huangqin Tang (HQT) on concentrations of nitrogen monoxide (NO), interleukin (IL)-4, IL-10, IL-17 and prostaglandin E2(PGE2) after 3 days oral administration on ulcerative colitis rats. n=7, x±s. *P < 0.05, **P < 0.01 vs normal control; △P < 0.05, △△P < 0.01 vs model control |
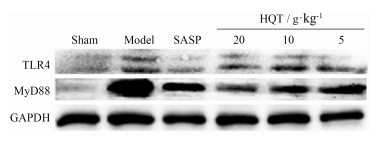
Western blot结果如图 2、表 3所示, 模型组TLR4、MyD88表达均显著高于正常组(P < 0.05)。与模型组相比, 阳性药SASP与HQT高剂量组TLR4表达均显著降低(P < 0.01, P < 0.05); HQT高、中剂量组MyD88表达显著性降低(P < 0.01, P < 0.05)。HQT中、低剂量组TLR4和HQT低剂量组MyD88表达均降低, 但无统计学差异。
|
Figure 2 TLR4 and MyD88 protein expression in colon tissue of rats infected by Western blot |
| Table 3 Toll-like receptor 4 (TLR4) and myeloid differentiation factor 88 (MyD88) protein expression in colon tissue of rats infected by Western blot. Protein levels were standardized against GAPDH levels. n=3, x±s.*P < 0.05 vs normal control; △P < 0.05, △△P < 0.01 vs model control |
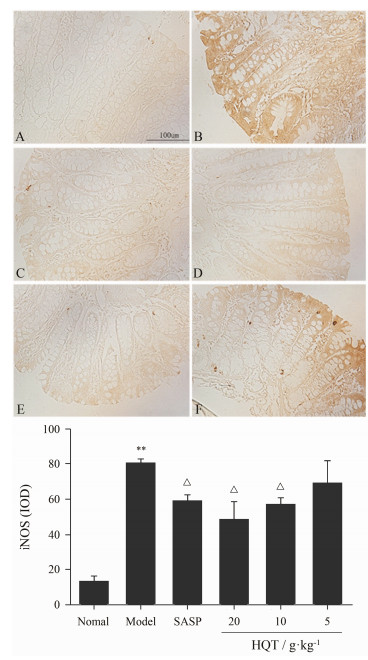
免疫组化检测发现, 各组COX-2和iNOS阳性染色主要位于细胞浆。在正常对照组大鼠结肠组织中仅可见棕黄色颗粒, 模型组可见大量棕黄色和褐色颗粒, 且有由黏膜层向肌层蔓延的趋势, 表达与正常组相比均有显著性升高(P < 0.01)。与模型组相比, 阳性药SASP和HQT高剂量组COX-2表达中棕黄色颗粒向肠外壁蔓延趋势不明显, 表达显著性降低(P < 0.01, P < 0.05), 说明炎症得到了有效控制; 阳性药SASP组和HQT高、中剂量组iNOS表达显著性降低(P < 0.05), HQT低剂量组中COX-2和iNOS表达均无差异性。表明HQT能够抑制UC疾病中COX-2、iNOS的过量表达, 并呈现一定的量效关系。结果见图 3、图 4。

|
Figure 3 Effects of Huangqin Tang (HQT) on express and concentration of COX-2 protein in colon tissue of rats (×400). A: Normal control; B: Model control; C: SASP 0.5 g ·kg−1; D: HQT 20 g·kg−1; E: HQT 10 g·kg−1; F: HQT 5 g·kg−1. n=7, x±s. **P < 0.01 vs normal control; △P < 0.05 vs model control |
|
Figure 4 Effects of Huangqin Tang (HQT) on express and concentration of iNOS protein in colon tissue of rats (×400). A: Normal control; B: Model control; C: SASP 0.5 g ·kg−1; D: HQT 20 g·kg−1; E: HQT 10 g·kg−1; F: HQT 5 g·kg−1. n=7, x±s. ** P < 0.01 vs normal control; △P < 0.05 vs model control |
研究发现, 具有清热止痢和中止痛作用的HQT对UC具有良好的治疗作用[7], 但其防治UC的分子生物学机制尚不明了, 本实验研究HQT对TLR4/ MyD88信号转导通路及IL-4、NO、PGE2等炎症因子的影响, 研究其可能的抗炎机制。
细胞因子可分为促炎细胞因子和抗炎细胞因子两类。抗炎细胞因子主要包括IL-4、IL-10等。促炎细胞因子和抗炎细胞因子之间的平衡失调被视为UC的一个主要发病机制[8, 9]。在体内, PGE2、NO、IL-17均有强烈的促炎反应。COX-2和iNOS是PGE2和NO合成的上游关键酶, 其表达丰度会直接限速下游PGE2和NO的产生[10]。本研究表明, HQT高剂量组IL-4表达低于模型组, Ding等[11]研究结果显示, HQT有效成分配方能升高UC大鼠血清中的IL-4水平, 本研究与其结果相反, 可能与HQT给药时间短, 药物未及充分发挥药效及样本数量有限有关。对于IL-10, HQT对其具有升高的作用。同时, HQT抑制NO、IL-17、PGE2细胞因子及COX-2和iNOS蛋白的表达, 与文献[12, 13]报道一致, 说明HQT能够较好地抑制与UC发病有关的促炎因子及相关蛋白的表达。但有一点值得注意的是, 与课题组前期实验结果[2]对比发现, NO和PGE2虽然呈现的药效趋势基本一致, 但数值有较大出入, 分析不同批次之间大鼠的个体差异可能是造成此差异的主要原因, 推测这也可能是大鼠药理实验重现性差的原因之一。综上所述, 推测HQT能够通过抑制或促进相关细胞因子起到治疗UC的作用。
UC患者存在肠道菌群失调, 在各种微生物抗原刺激下, 各种炎症细胞活化, 产生肠组织的慢性炎症反应。TLR4可通过启动髓样分化因子MyD88进行细胞内信号转导, 最终激活核因子-κB (NF-κB), 引发一系列炎症因子如IL-1β、NO、PGE2表达。破坏机体免疫稳态, 最终导致UC发生[14, 15]。本课题组前期研究显示, HQT组大鼠结肠组织NF-κB p65的表达较模型组显著降低, 说明HQT对溃疡性结肠炎的治疗作用与抑制NF-κB p65活化, 进而下调炎症介质表达有关[16]。本研究发现, 模型组TLR4、MyD88表达均显著高于正常组, 说明UC大鼠结肠中TLR4/ MyD88/NF-κB p65通路被激活。给予不同剂量HQT治疗后, TLR4及MyD88蛋白表达明显降低, 说明HQT对此通路具有较好的抑制作用。
研究表明COX-2基因启动子上具有5' (−455~−428 kb)、NF-κB-3' (−232~−205 kb)两个NF-κB结合位点, iNOS基因24.7 kb上游59-侧翼区也具有NF-κB应答元件[17], 这说明COX-2与iNOS可能是作为炎症相关基因受NF-κB调控。本实验研究显示, COX-2、iNOS与TLR4、MyD88之间的表达密切相关。推测作为上游调节因子的TLR4、MyD88, 在炎症情况下激活NF-κB, 并通过结合这些位点, 从而增强COX-2、iNOS基因转录及蛋白表达, 进而刺激NO、PGE2等炎症因子的释放。而经HQT治疗后的大鼠炎症损伤程度明显减轻, 因此, HQT对TLR4/MyD88通路具有一定的调节作用, 对UC的治疗是有效的, 并从细胞因子和蛋白角度说明了本方剂的作用机制, 反映出中药多环节、多途径和多靶点的作用特点。
综上所述, HQT治疗UC可能通过抑制TLR4蛋白的表达, 影响MyD88引发信号通路下游的基因表达, 从而抑制NF-κB的活化, 减少COX-2及iNOS位点的结合, 减少NO、PGE2和IL-17等促炎因子的释放以及机体免疫系统的过度活化, 这可能是HQT治疗UC的机制之一, 为UC临床机制研究及药物干预提供了参考, 同时由于本研究标本数量较少, 亦缺乏与临床UC患者样本研究的结合, 期待后续大样本与临床UC患者样本深入研究, 以加深对UC机制认识。
| [1] | Wang B, Zhu X, Duan Y, et al. Effect of paeoniflorin on colon tissue pathological morphology and the balance of antiinflammatory and proinflammatory factors in rats with ulcerative colitis[J]. Chin J Integr Tradit West Med Dig (中国中西医结合消化杂志) , 2013, 21 :1–4. |
| [2] | Wang YW, Zhang HH, Wang YL, et al. Effect of Huangqin Tang on the regulatory NF-κB p65 signal pathway in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报) , 2015, 50 :21–27. |
| [3] | Li T, Zhuang SX, Wang YW, et al. Flavonoid profiling of a traditional Chinese medicine formula of Huangqin Tang using high performance liquid chromatography[J]. Acta Pharm Sin B , 2016, 6 :148–157. DOI:10.1016/j.apsb.2016.01.001 |
| [4] | Morris GP, Beck PL, Herridge MS, et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon[J]. Gastroenterology , 1989, 96 :795–803. DOI:10.1016/S0016-5085(89)80079-4 |
| [5] | Vigorita VJ. Practical surgical pathology[J]. Bull NY Acad Med , 1986, 62 :287–288. |
| [6] | Yuan BJ, Wang ZQ. The Preclinical Safety Evaluation and Practice[M]. Beijing: Malitary Medical Sciences Publishing House, 1997 : 78 -80. |
| [7] | Yang M, Wu D. The granule of Huangqin Tang combines Mesalamine on the clinical curative effect of ulcerative colitis[J]. Chin J Integr Tradit West Med Dig (中国中西医结合消化杂志) , 2016, 24 :221–223. |
| [8] | MacDonald TT, Monteleone G, Pender SLF. Recent developments in the immunology of inflammatory bowel disease[J]. Scand J Immunol , 2000, 51 :2–9. DOI:10.1046/j.1365-3083.2000.00658.x |
| [9] | Podolsky DK. Inflammatory bowel disease[J]. New Engl J Med , 1991, 325 :928–937. DOI:10.1056/NEJM199109263251306 |
| [10] | Zhao HG, Luo FL. Effects of tetrandrine on COX-2/PGE2, iNOS/NO expression in LPS-stimulated RAW264.7 cells[J]. J China Pharm Univ (中国药科大学学报) , 2011, 42 :141–144. |
| [11] | Ding XG, Fu YL. Experimental research on the effects of the formula consisting of active components of Huangqin decoction on experimental ulcerative colitis in rats[J]. J Beijing Univ Tradit Chin Med (北京中医药大学学报) , 2003, 26 :45–48. |
| [12] | Chi HG, Zou Y, Dai SX, et al. Effect of Huangqin Tang on IL23/IL17 pathway in TNBS induced colitis[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志) , 2013, 19 :211–215. |
| [13] | Zhang K, Deng CS, Zhu YP, et al. Significance of nuclear factor-κB, cyclooxygenase 2 and inducible nitrcoxide synthase expression in human ulcerative colitis tissues[J]. World Chin J Digestol (世界华人消化杂志) , 2002, 10 :575–578. |
| [14] | Baldwin AS Jr. Series introduction:the transcription factor NF-κB and human disease[J]. J Clin Invest , 2001, 107 :3–6. DOI:10.1172/JCI11891 |
| [15] | Li XL, Cai YQ, Qin H, et al. Therapeutic effect and mechanism of proanthocyanidins from grape seeds in rats with TNBS-induced ulcerative colitis[J]. Canadian J Physiol Pharm , 2008, 86 :841–849. DOI:10.1139/Y08-089 |
| [16] | Zhang HH. Anti-inflammatory Effect and Mechanism of Huangqin Tang (黄芩汤抗炎药效及其作用机制研究)[D]. Beijing:China Academy of Chinese Medical Sciences, 2014. |
| [17] | Tak PP, Firestein GS. NF-κB:a key role in inflammatory diseases[J]. J Clin Invest , 2001, 107 :7–11. DOI:10.1172/JCI11830 |
 2016, Vol. 51
2016, Vol. 51


