三阴乳腺癌(triple negative breast cancer, TNBC)为雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)和人表皮生长因子受体2 (human epidermal growth factor receptor-2, HER-2)均为阴性的乳腺癌[1], 在所有乳腺癌中占有10%~15%的比例, 治疗效果最差[2]。Ras/Raf/MEK/ERK (ERK1/2)和PI3K/AKT/mTOR (PI3K)信号通路在促进肿瘤启动和肿瘤发展等方面起着重要的作用。体外实验证明, TNBC对小分子MEK1/2抑制剂引起的生长抑制非常敏感。TNBC的基因表达特性与已知的KRAS突变型肿瘤相似, 因此Ras/Raf/MEK/ERK信号通路的高活性可以认为是TNBC的主要特征[3]。PI3K/ AKT/mTOR信号通路在乳腺癌中也异常活跃, 主要由于受体酪氨酸激酶(receptor tyrosine kinase, RTK)的过度表达以及PIK3CA、AKT和PTEN等基因突变而造成[4]。
然而目前研究表明, MEK1/2抑制剂在作用于TNBC细胞时表现出了一定的耐药性。其可能的作用机制之一为MEK1/2抑制剂负反馈引起了PI3K/AKT/ mTOR信号通路的激活。这种激活在单一的TNBC细胞系MDA-MB-231细胞中证明可能是由表皮生长因子受体(epidermal growth factor receptor, EGFR)来调节[3]。目前有研究结果显示MEK1/2抑制剂与PI3K抑制剂联合治疗TNBC, 表现出了一定的协同抗肿瘤作用, 其中多数为PI3K抑制剂敏感的TNBC细胞系[5]。其次, MEK1/2抑制剂和EGFR抑制剂的联合也有协同抑制肿瘤细胞生长的作用[6]。对于PI3K抑制剂不敏感的TNBC细胞系, AKT蛋白的表达量较低是主要特点, 这类TNBC细胞需要选择PI3K/AKT/ mTOR信号通路中的其他靶点。因此, 考察MEK1/2抑制剂与PI3K/AKT/mTOR信号通路中下游的mTOR1/2抑制剂的联合作用对于TNBC的影响, 对发展新型的药物治疗方案具有非常重要的意义。本研究联合mTOR1/2抑制剂(AZD8055)与MEK1/2抑制剂(PD0325901)作用于TNBC细胞系MDA-MB-231和MDA-MB-435细胞, 考察二者的联合作用效果。其中MDA-MB-435细胞是由黑丝素瘤转移至乳腺并含有BRAFV600E突变的TNBC细胞[7, 8]。
实验方法细胞培养 人乳腺癌细胞系MDA-MD-231和MDA-MD-435细胞购自北京协和细胞资源中心, 使用含有10% FBS (Fetal Bovine Serum)的细胞培养液DMEM (Dulbeco’s Modified Eagle Medium), 在37 ℃、5% CO2的潮湿条件下培养。FBS购自Hyclone公司; DMEM购自MACGENE公司; mTOR1/2抑制剂(AZD8055)、PI3K/mTOR1/2抑制剂(PI103)、PI3K抑制剂(ZSTK474)和MEK1/2抑制剂(PD0325901)购自Selleck生物科技有限公司。
细胞增殖抑制实验 细胞增殖抑制实验使用SRB (sulforhodamine B)方法。MDA-MB-231和MDA-MB-435细胞铺于96孔板, 每孔各为8×103和4×103。用不同浓度的小分子抑制剂分别或者联合给药, 孵育72 h后, 将待检测的96孔板, 分别用4 ℃的10%三氯乙酸固定1 h, 加入含0.4% SRB的1%乙酸溶液50 μL孵育15 min, 再加入10 mmol·L−1 Tris溶液100 μL溶解, 最后用酶标仪测定540 nm的OD值。IC50值由GraphPad Prism软件计算得到。
Western blot实验 MDA-MB-231和MDA-MB-435细胞铺6孔板, 每孔均为3×105。孵育18 h后给药, 再孵育相应时间后, 收集细胞, 用细胞裂解液[50 mmol·L−1 Tris-HCl (pH 7.4), 5 mmol·L−1 EDTA, 1% Triton X-100, 150 mmol·L−1 NaCl, 5 mmol·L−1 MgCl2, 2 mmol·L−1 Na3VO4, 1×CompleteTM protease inhibitor]在冰上裂解1 h。收集上清液, 蛋白浓度通过Pierce BCA Protein Assay Kit (Thermo Scientific, Rockford, IL, USA)试剂盒在562 nm处测定吸光值定量。通过测定的浓度, 用相同质量(10 μg)的蛋白计算所取蛋白体积。蛋白通过聚丙烯凝胶电泳分离, 浓缩胶为5%, 分离胶为10%。电泳过后将蛋白转移至PVDF膜上, 5%的脱脂奶粉室温封闭1 h, 并用不同的一抗4 ℃孵育过夜。除去一抗后, 加入相应的鼠或者兔来源的二抗, 室温避光孵育3 h, ChemiDocTM XRS System (BIO-RAD, Hercules)采集图片, Image Lab软件处理。
DNA 复制实验 检测前2 h将96孔板中培养基换为100 μL含有50 μmol·L−1 EdU的培养基, 37 ℃、5% CO2孵育2 h; 用含有4%多聚甲醛的PBS固定液50 μL室温孵育30 min; 再用2 mg·mL−1的甘氨酸溶液50 μL摇床孵育5 min; 加入新鲜配制的1×Apollo染色反应液100 μL, 避光、室温摇床孵育30 min; 用渗透剂(0.5% Triton X-100的PBS) 100 μL清洗2、3次, 每次10 min; 加入1×Hoechst 33342反应液避光、室温摇床孵育30 min; 最后用PBS 100 μL清洗1~3次, 加入PBS 100 μL保存待测。全自动倒置荧光显微镜(Olympus, IX83)检测以及图片处理。EdU试剂盒购自广州锐博生物科技公司。
细胞周期实验 6孔板孵育一定时间后, 用预冷的70%乙醇在4 ℃固定过夜。离心除去上清, 加入PBS 200 μL, 再加入10 μg·mL−1 RNase A, 37 ℃水浴孵育30 min, 再加入PI染料10 μL和Triton X-100溶液10 μL, 过筛后用FACS Calibur单激光流式细胞仪(Becton-Dickinson)进行检测, 用Modfit软件进行分析。
联合指数计算及统计学分析 联合指数采用Chou-Talalay的方法[9]进行计算。当计算两个药物联合作用时, 其计算公式为CI=CA/CX, A + CB/CX, B, 其中CA和CB为A药和B药联合时达到x%抑制率时的浓度, CX, A和CX, B分别为单独使用时达到x%抑制率时的浓度。通过CI值的大小可以定量判断药物间相互作用的性质(CI > 1为拮抗作用, CI=1为相加作用, CI < 1协同作用)[9]。联合组和单独组的细胞存活率差异显著性分析采用t检验, P < 0.05表示差异具有显著性意义。
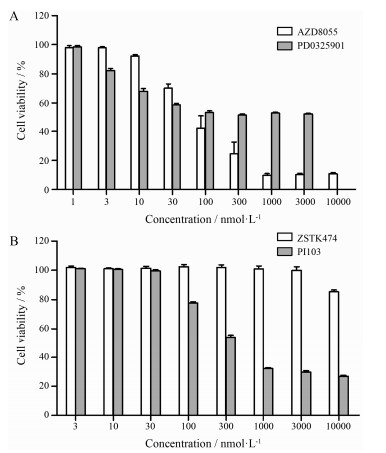
结果与讨论 1 不同小分子抑制剂单独作用于TNBC细胞mTOR1/2抑制剂AZD8055、PI3K/mTOR1/2抑制剂PI103、PI3K抑制剂ZSTK474以及MEK1/2抑制剂PD0325901分别作用于MDA-MB-231和MDA-MB-435细胞时, 除ZSTK474对于MDA-MB-231和MDA-MB-435细胞几乎没有抑制作用, AZD8055和PI103都能显著抑制这两组细胞株的增殖。PI103为PI3K和mTOR1/2双重抑制剂, 实验表明主要是抑制mTOR1/2活性, 实现对这两株细胞的增殖抑制(图 1, 2)。因此, 在MDA-MB-231和MDA-MB-435细胞中, 选择mTOR1/2抑制剂AZD8055和MEK1/2抑制剂PD0325901联合抑制PI3K和ERK信号通路。

|
Figure 1 Cell proliferation study of AZD8055 and PD0325901 (A), and ZSTK474 and PI103, on the MDA-MB-231 cell line. The cell line was treated with different drugs for 72 h. Cell proliferation was determined by SRB assay |
|
Figure 2 Cell proliferation study of ZSTK474, PI103, AZD8055 and PD0325901 on the MDA-MB-435 cell line. The cell line was treated with different drugs for 72 h. Cell proliferation was determined by the SRB assay |
AZD8055抑制MDA-MB-231和MDA-MB-435细胞增殖的IC50值分别为315.70±113.40 nmol·L−1和59.4±11.7 nmol·L−1; PD0325901作用于MDA-MB-231和MDA-MB-435细胞的IC50值分别为78.67±34.63 nmol·L−1和4.91±0.83 nmol·L−1。
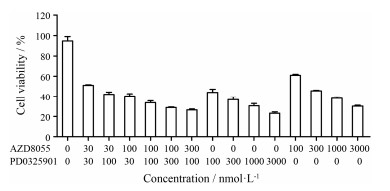
选择IC50值附近的浓度进行联合, 并通过统计学分析选出单独给药和联合给药的存活率有无显著性差异的几组数据(图 3, 表 1)。
|
Figure 3 Combination effect of AZD8055 and PD0325901 on the cell proliferation of MDA-MB-231 cell line. The cell line was treated with AZD8055 and/or PD0325901 for 72 h. Cell proliferation was determined by SRB assay |
| Table 1 The statistical analysis of AZD8055 (A) and PD0325901 (P) on MDA-MB-231 cells line |
通过计算得到3组无统计学差异的数据(P > 0.05), 第1组为A(100)+P(100)、A(1000)和P(300);第2组为A(30)+P(100)、A(300)和P(100);第3组为A(100)+ P(300)、A(3000)和P(1000)。将这3组数据中的浓度带入公式中进行计算, 得出CI值(表 2)。其中100 nmol·L−1 AZD8055和100 nmol·L−1 PD0325901联合以及100 nmol·L−1 AZD8055和300 nmol·L−1 PD0325901联合时对MDA-MB-231细胞具有联合作用。本实验选择在MDA-MB-231细胞中, 前一条件作为联合给药的药物浓度。
| Table 2 The combination indexes of AZD8055 and PD0325901 on MDA-MB-231 cell line. CI: Combination index |
当100 nmol·L−1 AZD8055和30 nmol·L−1 PD0325901作用于MDA-MB-435细胞时, 细胞存活率抑制到30%, 再增加PD0325901浓度, 细胞存活率不再降低。因此选取100 nmol·L−1 AZD8055和30 nmol·L−1 PD0325901为MDA-MB-435细胞的联合作用浓度, 在该联合浓度下具有协同抑制作用(图 4)。

|
Figure 4 Combination effect of AZD8055 and PD0325901 on the proliferation of MDA-MB-435 cell line. The cell line was treated with AZD8055 and/or PD0325901 for 72 h. Cell proliferation was determined by SRB assay |
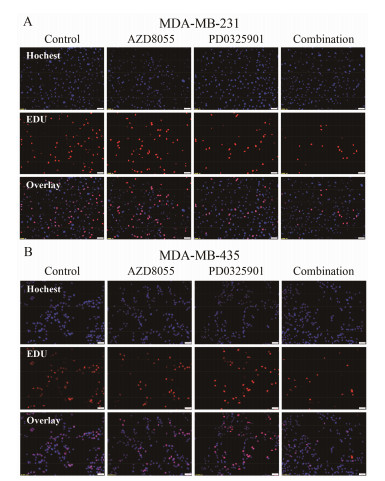
从荧光显微镜图可以看出, 24 h时PD0325901有一定抑制MDA-MB-231细胞的DNA复制的作用, 但是AZD8055的抑制作用并不明显, 而二者联合给药后抑制作用有一定增加。24 h时PD0325901和AZD8055单独给药对MDA-MB-435细胞的抑制作用都不明显, 而当二者联合后的抑制明显增加(图 5)。DNA复制实验结果证明, ERK1/2通路和PI3K通路对于MDA-MB-435细胞的增殖具有非常显著的协同作用。
|
Figure 5 DNA replication study of on MDA-MB-231 and MDA-MB-435 cell lines by EDU method. MDA-MB-231 cells were treated with 100 nmol·L−1 of AZD8055 and/or 100 nmol·L−1 PD0325901 for 24 h. MDA-MB-435 cells were treated with 100 nmol·L−1 of AZD8055 and/or 30 nmol·L−1 PD0325901 for 24 h |
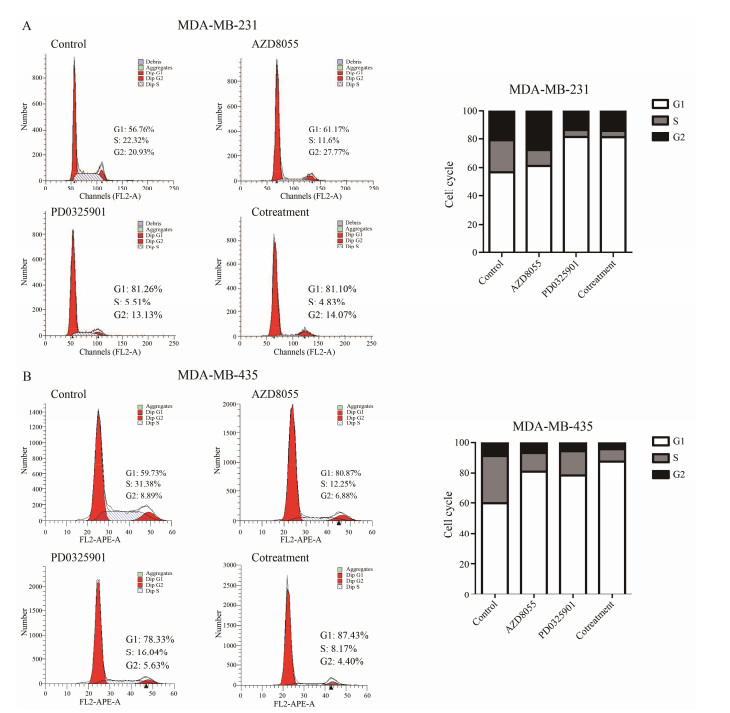
24 h细胞周期实验结果显示, PD0325901能明显引起MDA-MB-231细胞的G1期阻滞, 而与AZD8055联合没有产生协同抑制G1期阻滞的作用(图 6A)。而MDA-MB-435细胞中, PD0325901和AZD8055均能引起G1期的阻滞。联合组G1期的阻滞显著高于PD0325901和AZD8055单独给药的影响(图 6B)。
|
Figure 6 Cell cycle study of on MDA-MB-231 (A) and MDA-MB-435 (B) cell lines by FACS. MDA-MB-231 cells were treated with 100 nmol·L−1 of AZD8055 and/or 100 nmol·L−1 PD0325901 for 24 h. MDA-MB-435 cells were treated with 100 nmol ·L−1 of AZD8055 and/or 30 nmol·L−1 PD0325901 for 24 h |
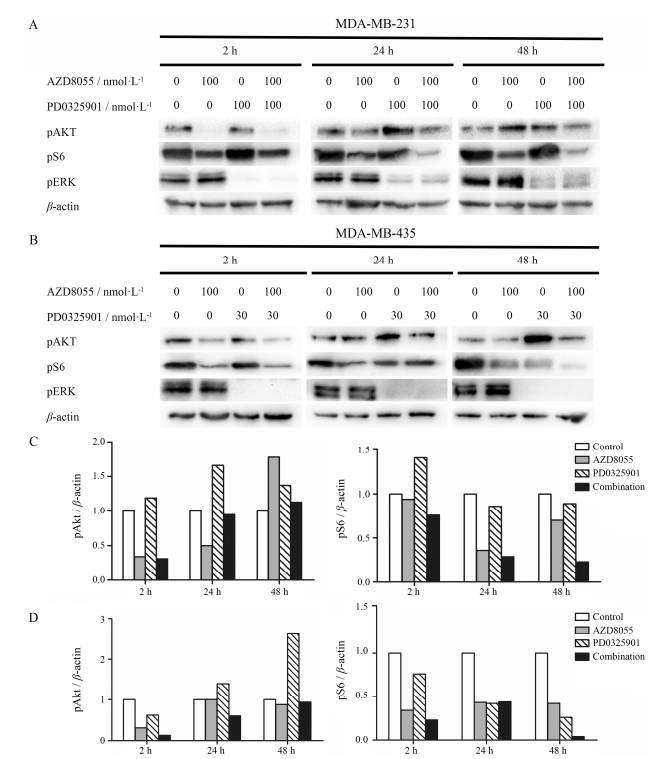
PI3K通路主要为PI3K → AKT → mTORC1 → S6K → S6的信号传导过程, 以及mTORC2 → AKT的信号传导。AZD8055主要抑制mTORC1的活性, 从而降低S6的磷酸化, 同时AZD8055还通过抑制mTORC2的活性而抑制AKT的磷酸化。ERK通路主要为Ras → Raf → MEK1/2 → ERK1/2的信号传导过程, PD0325901是特异性MEK1/2激酶抑制剂, 能有效抑制下游通路的ERK1/2蛋白的磷酸化。本实验通过考察细胞内pAKT、pS6以及pERK等蛋白的表达水平, 考察药物对ERK1/2通路和PI3K通路的影响情况。
从Western blot实验结果可以看出(图 7A, 7C), 24 h后PD0325901单独给药一定程度调高了MDA-MB-231细胞内pAKT的表达量, 48 h后有所降低。AZD8055单独给药2 h后pAKT表达量有明显抑制, 但随时间增加也有显著的增加, 48 h时pAKT表达量高于对照组。而联合给药后对抑制的情况与AZD8055单独给药相似, 随时间增加抑制率逐渐降低。2 h时pAKT表达量最低, 24 h时恢复至对照组表达水平。PD0325901或AZD8055单独给药对MDA-MB-231细胞pS6表达量抑制不显著, 而联合给药对pS6表达量抑制非常明显, 且随时间增加抑制程度增加。说明AZD8055和PD0325901联合给药虽然能抑制细胞增殖, 但对PI3K通路的活性影响并不显著, 可能通过抑制pS6表达量而实现。
|
Figure 7 Combination effect of AZD8055 and PD0325901 on both PI3K/AKT/mTOR and Ras/Raf/MEK/ERK signaling pathways in MDA-MB-231 (A) and MDA-MB-435 (B) cell lines. MDA-MB-231 cells were treated with 100 nmol·L−1 of AZD8055 and/or 100 nmol·L−1 PD0325901 for 2, 24 and 48 h. MDA-MB-435 cells were treated with 100 nmol·L−1 of AZD8055 and/or 30 nmol·L−1 PD0325901 for 2, 24 and 48 h. Western blot analyses of two cell lines lysates were performed for pAKT, pS6 and pERK. β-Actin served as loading control. C: Relative quantification of pAKT/ β-actin and pS6/β-actin in MDA-MB-231 cells. D: Relative quantification of pAKT/β-actin and pS6/β-actin in MDA-MB-435 cells |
单独以及联合给药对MDA-MB-435细胞的两条通路影响情况不同。PD0325901或AZD8055单独给药在2 h内能显著抑制MDA-MB-435的pAKT表达量, 联合组最强。但pAKT表达量随着时间的增加逐渐增加, 特别是PD0325901会负反馈引起pAKT表达量的增加, 48 h时的pAKT表达量能达到对照的2.64倍。联合后AZD8055抑制了由于PD0325901引起的pAKT负反馈增加。但不同于药物作用于MDA-MB-231细胞, 联合组高于AZD8055单独给药的pAKT表达量的时间为2~24 h内(图 7B, 7D)。PD0325901或AZD8055单独给药都能显著抑制pS6的表达, 两药联合后抑制效果更强。AZD8055单独给药对pS6的表达抑制不随时间变化, 而PD0325901单独给药对pS6的表达抑制随时间变化显著。联合给药在48 h后能完全抑制pS6的表达。
目前研究[3]表明, MEK1/2抑制剂作用于TNBC细胞, 会引起PI3K/AKT/mTOR信号通路的负反馈激活。对于PI3K抑制剂敏感的TNBC细胞, 联合PI3K抑制剂和MEK1/2抑制剂作用时, 具有协同抑制作用[5], 而对于PI3K抑制剂不敏感的TNBC细胞, 进行mTOR抑制剂和MEK1/2抑制剂的联合作用研究并不多。
本研究通过联合mTOR1/2抑制剂(AZD8055)和MEK1/2抑制剂(PD0325901)作用于两种TNBC细胞(MDA-MB-231和MDA-MB-435细胞)。用细胞增殖抑制实验, 筛选出两种药物最佳的联合浓度, 通过Chou-Talalay的方法[9]证明两种药物具有协同抑制细胞增殖的作用。联合给药能有效抑制MDA-MB-435细胞的DNA复制, 这一结果与细胞增殖抑制结果相对应, 并且更能协同引起MDA-MB-435细胞周期中的G1期阻滞。
AZD8055为mTOR1/2抑制剂, 同时抑制mTORC1和mTORC2激酶的活性。AZD8055对于MDA-MB-231和MDA-MB-435细胞作用后, 都能一定程度影响PI3K通路下游S6蛋白的磷酸化, 对MDA-MB-435细胞的pS6表达抑制更强, 随时间变化不断增加。而对于AZD8055的PI3K通路上游蛋白AKT的磷酸化在早期有抑制作用, 24 h后却增加了pAKT的表达量。特别是对MDA-MB-231细胞的作用, 48 h时pAKT表达显著增加, 可能存在PI3K通路自身负反馈。虽然AZD8055和PD0325901联合作用MDA-MB-231细胞有增殖协同抑制效果, 但引起AKT磷酸化增加的情况, 对DNA复制没有影响的结果, 说明这二者联合使用并不适合于MDA-MB-231细胞, 可能需要MEK1/2抑制剂与PI3K/AKT/mTOR信号通路的其他靶点进行联合。而对于MDA-MB-435细胞, AZD8055和PD0325901的联合作用显著抑制了pS6的表达, 且表现了明显的协同抑制作用。AZD8055给药后均能减少pAKT的表达, 不存在自身的负反馈作用。PD0325901作用于MDA-MB-435细胞时, 也引起PI3K/AKT/mTOR信号通路的反馈性, 导致上游AKT蛋白的磷酸化。而当PD0325901与AZD8055联合使用时, pAKT表达量降低至对照水平, 证明在MDA-MB-435细胞中, AZD8055可以抑制由PD0325901引起的负反馈激活。
综上所述, 联合MEK1/2抑制剂和mTOR1/2抑制剂治疗三阴乳腺癌具有一定的效果, 在不同细胞表现各不同。对于MDA-MB-231细胞, 联合抑制效果不明显。而对MDA-MB-435细胞, 两药联合不仅能够协同抑制ERK1/2和PI3K通路下游pS6蛋白的表达, 完全抑制ERK1/2和PI3K通路的活性, 而且还能协同抑制肿瘤细胞的DNA复制, 诱导G1期阻滞等, 具有非常显著的联合治疗效果。由于MDA-MB-435细胞是由黑丝素瘤转移至乳腺癌的细胞并含有BRAFV600E突变的TNBC细胞, 因此本实验设计的联合用药对于该转移的细胞具有特异性, 为临床上黑色素瘤转移至乳腺癌的治疗提供一定的基础。
| [1] | Higgins MJ, Baselga J. Targeted therapies for breast cancer[J]. J Clin Invest , 2011, 121 :3797–3803. DOI:10.1172/JCI57152 |
| [2] | Gordon V, Banerji S. Molecular pathways:PI3K pathway targets in triple-negative breast cancers[J]. Clin Cancer Res , 2013, 19 :3738–3744. DOI:10.1158/1078-0432.CCR-12-0274 |
| [3] | Qiu SP, Li HL, Shi HL, et al. Notoginsenoside Ft1 downregulates HIF-1α, inhibits cell proliferation, decreases migration and promotes apoptosis in breast cancer cells by regulating Akt/mTOR/p70S6K and MAPK pathways[J]. Acta Pharm Sin (药学学报) , 2016, 51 :1091–1097. |
| [4] | Saini KS, Sherene L, Evandro DA, et al. Targeting the PI3K/AKT/mTOR and Raf/MEK/ERK pathways in the treatment of breast cancer[J]. Cancer Treat Rev , 2013, 39 :935–946. DOI:10.1016/j.ctrv.2013.03.009 |
| [5] | Britten CD. PI3K and MEK inhibitor combinations:examining the evidence in selected tumor types[J]. Cancer Chemother Pharmacol , 2013, 71 :1395–1409. DOI:10.1007/s00280-013-2121-1 |
| [6] | Maiello MR, D'Alessio A, Bevilacqua S, et al. EGFR and MEK blockade in triple negative breast cancer cells[J]. J Cell Biochem , 2015, 116 :2778–2785. DOI:10.1002/jcb.v116.12 |
| [7] | Wang X, Osada T, Wang Y, et al. CSPG4 protein as a new target for the antibody-based immunotherapy of triplenegative breast cancer[J]. J Natl Cancer Inst , 2010, 102 :1496–1512. DOI:10.1093/jnci/djq343 |
| [8] | Wang J, Chen J, Miller DD, et al. Synergistic combination of novel tubulin inhibitor ABI-274 and vemurafenib overcome vemurafenib acquired resistance in BRAFV600E melanoma[J]. Mol Cancer Ther , 2014, 13 :16–26. |
| [9] | Chou TC. Drug Combination studies and their synergy quantification using the Chou-Talalay method[J]. Cancer Res , 2010, 70 :440–446. DOI:10.1158/0008-5472.CAN-09-1947 |
 2016, Vol. 51
2016, Vol. 51


