近年来, 众多药物由于心脏突发死亡事件而被撤出市场(表 1)[1, 2]。在药物临床前研究阶段, 24%的药物由于心血管毒副作用终止开发, 45%的药物由于引起心脏毒副作用而撤市[3, 4]。药物引起心脏毒性的主要原因为:阻断心脏的快速延迟整流电流(IKr), 造成心脏动作电位时程中QT间期延长, 进而诱发尖端扭转性室性心动过速(TdP), 严重时可引起突然死亡。IKr由hERG基因编码的Kv11.1钾离子通道传导, 在整个动作电位时程中起到至关重要的作用[5], 各国的药物监管部门规定新化学实体必须按照国际协调会议(ICH)指南进行全面的hERG活性和QT间期评价。尽早有效地预测、评价、优化, 避免药物对hERG钾通道的抑制活性, 有助于降低药物开发的成本, 提高药物开发的成功率。
| 表 1 Withdrawal of marketed drugs due to prolonging QT interval or leading torsades de pointes (Tdp) |
hERG钾通道是由KCNH2基因编码的4个相同亚单位所构成的四聚体结构。每个亚单位由α-亚基(6个跨膜结构域S1~S6)和β-亚基(细胞膜内侧N端和C端)构成。主要功能区α-亚基上的S1~S4结构域是hERG钾通道的电压传感器, S4链带6个正电荷, 随膜电压的变化在膜内移动, 调节孔道的开放与关闭。S5到S6结构域及中间的链接区P链上的氨基酸残基(关键氨基酸残基Phe656和Tyr652)构成了hERG钾通道的中心疏水孔道, 形似漏斗结构。P链和S6结构域上3个氨基酸残基(Thr623、Ser624和Val625)构成了hERG钾通道上方的选择性滤膜。hERG钾通道属于电压门控型离子通道, 存在3种构象状态, 分别为:关闭态(closed)、开放态(open)和失活态(inactive), 在动作电位的不同阶段hERG钾通道开放、关闭的速度和程度不同, 呈现动态的构象变化[6]。
1.2 药物诱导的QT间期延长的可能机制药物引起QT间期延长的作用机制主要分为:①直接抑制hERG钾通道; ②阻碍hERG钾通道蛋白转运。
绝大多数撤市药物均能直接作用于hERG钾通道, 降低IKr, 影响心肌动作电位复极化, 进而诱发TdP, 严重时造成突然死亡。临床上主要表现为心电图(ECG)上QT间期延长[7]。大量同源模建和定点突变实验研究表明:药物中的脂溶性片段或芳杂环能够与疏水性hERG钾通道中的氨基酸残基Phe656形成π-π疏水作用; 药物分子中的碱性氮原子在生理条件质子化后, 与氨基酸残基Tyr652形成π-阳离子相互作用; 此外, 药物还可以与过滤膜区的氨基酸残基如Thr623、Ser624和Val625产生相互作用[8]。药物在hERG通道开放状态进入孔道, 随后hERG钾通道立即进入失活状态, 离子孔道的空间变小, 与药物的结合变强。
此外, 近期研究表明一些药物还可以通过抑制内质网上hERG钾通道蛋白的转运[9], 减少心肌细胞膜表面hERG钾通道的表达, 缓慢地降低IKr, 从而影响心脏的复极化, 造成QT间期延长。例如:降血脂药物普罗布考[10]、抗抑郁药氟西汀[11]、抗真菌药酮康唑[12]等通过阻碍hERG钾通道蛋白转运, 降低IKr。近来, Wang等[13]研究表明:微小RNA (miR-17-5p)在慢性氧化应激条件下, 通过靶向多个压力相关的分子伴侣(Hsp70、Hsc70、CANX和Golga2), 阻碍hERG钾通道蛋白转运。
1.3 降低药物hERG心脏毒性策略采用计算机辅助药物设计(CADD)预测药物潜在hERG毒性, 指导药物设计与改造, 方便、快捷且成本较低。研究人员开发了很多预测hERG毒性的模型和工具[14, 15]。预测药物hERG毒性模型的构建方法主要分为两类:一类是基于配体的构建方法。如中国药科大学尤启冬等[16]开发了3D-QSAR药效团和2D-QSAR联合模型, 表明强效的hERG抑制剂具有类似高级脂肪胺的药效团模型。中国科学院上海药物研究所新药设计发现中心构建了Bayesian分类模型, 论述了药物抑制hERG钾通道的活性与化合物的相对分子质量、脂溶性、极性表面积和碱性等性质的相关性, 概括总结了一系列对hERG钾通道具有较强抑制活性的药效团片段[17], hERG抑制剂多为脂溶性高、碱性强、缺乏氢键受体、柔性较大的分子。另一类是基于受体的预测模型构建方法。由于hERG钾通道的晶体结构尚未被解析, 研究人员通过钾通道的同源模建和分子对接, 研究药物与hERG钾通道的相互作用, 并总结概括hERG钾通道为疏水型构象多变的离子孔道[18]; hERG抑制剂与钾通道氨基酸残基可形成π-π疏水、π-阳离子等相互作用。采用计算方法预测药物潜在hERG心脏毒性的优点在于快速、方便、节约合成及测试成本。但由于构建模型多样、建模数据库不统一(样本数目、实际测试方法涉及配体结合、电生理膜片钳等)、内源hERG钾通道构象多变的特点, 同源模建和分子对接的精准度仍是目前钾离子通道研究的一大难点[19]。
目前, 通过先导化合物结构优化解决药物的hERG抑制问题, 仍是改善心脏毒性最为直接和有效的策略。Jamieson[20]、Kerns[21]和You等[22]分别于2006、2008和2011年对降低药物hERG抑制活性的结构修饰策略进行了综述。
本文基于前人的工作, 重点综述了2010年之后降低hERG抑制作用的结构优化策略, 具体包括:降低脂溶性、降低碱性、引入氢键受体或可生成负离子的基团以及构象限制等。本文通过对典型实例分析, 直观地反映了所采用的化学结构修饰对改造前后药物的理化性质、靶标活性、hERG抑制活性(off-target效应)以及药代性质等多方面的综合影响, 为新药开发中解决药物潜在的心脏毒性问题提供一些思路和参考。
2 化学修饰降低药物hERG心脏毒性的策略 2.1 降低脂溶性Levoin等[23]通过QSAR分析指出分子的脂溶性(clogP、clogD或极性表面积PSA)和芳香性与hERG抑制活性关系密切。药物分子中的脂溶性芳香环, 与hERG钾通道产生π-π疏水作用。降低分子的脂溶性, 如在药物分子的芳环上引入吸电子基团或者极性基团、或通过电子等排将苯环替换成杂环等, 可以有效地阻碍该疏水作用, 降低hERG抑制活性。
腺苷受体A2A拮抗剂可用于治疗帕金森, 化合物1是默克公司报道的A2A拮抗剂先导化合物(IC50=5.5 nmol·L-1), 对腺苷受体A1具有较好的选择性, 但具有较强的hERG抑制活性(IC50=1.5 μmol·L-1)。采用降低脂溶性的策略[24], 将末端苯环替换为吡唑得到化合物1a和1b, 脂溶性clogP分别下降1.9和0.7个单位, hERG抑制活性显著下降(IC50 > 60 μmol·L-1), 同时保持了化合物对A2A的活性及对A1的选择性(表 2)。
| 表 2 Reducing hERG inhibitory activity through attenuation of lipophilicity on adenosine A2A receptor antagonists 1 |
化合物2是广谱的抗菌药物, 抑菌活性较好, 对拓扑异构酶IV具有较强的抑制作用, hERG抑制活性IC50为3 μmol·L-1。将氮杂喹啉等排替换为极性更大的喹诺酮得到化合物2a~2c[25], 脂溶性logD7.4下降0.6~1.6个单位, hERG抑制活性显著下降(IC50 > 30 μmol·L-1) (表 3)。
| 表 3 Reducing hERG inhibitory activity through attenuation of lipophilicity on antibiotics 2 |
增加极性表面积(PSA)和降低clogP, 可以协同作用降低脂溶性, 用于改善hERG抑制作用。组胺H3受体拮抗剂3, IC50达到2.4~3.5 nmol·L-1, 但hERG抑制活性较强(IC50=1.1 μmol·L-1), 将末端苯环替换成二甲基取代的噁唑环[26], clogP和clogD下降0.3~0.4个单位, 同时噁唑环上二甲基取代使得PSA增加近一倍, 化合物3a的脂溶性下降, 其hERG钾通道的抑制活性显著降低(IC50=37 μmol·L-1), 同时对H3受体拮抗活性有所提高(IC50=0.1~0.8 nmol·L-1) (表 4)。
| 表 4 Reducing hERG inhibitory activity through attenuation of lipophilicity on histamine H3 receptor antagonists 3 |
将苯环替换为含有氮或氧的脂肪杂环, 如哌啶、哌嗪、四氢吡喃等, 可以有效地降低药物分子的脂溶性(clopP), 阻碍药物分子与hERG钾通道的疏水相互作用。化合物4是阿斯利康公司研发的CCR5拮抗剂(IC50=0.32 nmol·L-1), hERG钾通道抑制活性为7.3 μmol·L-1。在口服给予50 mg·kg-1剂量下, 化合物4在犬模型上引起QT间期延长。采用降低脂溶性的结构改造策略[27], 将苯环替换成哌啶或哌嗪, logD7.4下降0.7~1.0个单位, hERG抑制活性大大降低(IC50=24 μmol·L-1), 同时CCR5拮抗活性保持(表 5)。
| 表 5 Reducing hERG inhibitory activity through attenuation of lipophilicity on CCR5 antagonists 4 |
类似的策略也被成功应用于H3受体拮抗剂5的结构优化中。化合物5对H3受体的拮抗活性为1.2~16.5 nmol·L-1, hERG抑制活性较强(IC50=0.48 μmol·L-1)。将苯环替换成四氢吡喃环[28], clogP下降2.3个单位, hERG抑制活性降为原来的1/39 (IC50=18.9 μmol·L-1), 同时化合物5a对H3受体上的拮抗活性提高(IC50为0.8~1.0 nmol·L-1) (表 6)。
| 表 6 Reducing hERG inhibitory activity through attenuation of lipophilicity on histamine H3 receptor antagonists 5 |
降低碱性是先导化合物结构优化降低hERG抑制活性的一个重要策略。一些药物分子碱性较强, 在生理条件下可质子化, 同源模建和定点突变实验研究表明可与hERG钾通道中的氨基酸残基Tyr652形成较强的π-阳离子相互作用。降低药物的碱性(pKa), 可阻碍该π-阳离子相互作用, 使hERG抑制活性降低。降低碱性(pKa)包括:引入吸电子基团(如引入F、磺酰基、杂原子、羰基、酰胺等); 或将氨基替换为酰胺、磺酰胺等。图 1总结了这些策略对于降低氨基碱性(pKa)的作用[29]。通过引入极性片段(如羰基和氧杂环等)降低pKa时, 也会导致脂溶性(logD)的下降, 因此, 降低碱性和降低脂溶性相互联系相互影响。然而有时降低药物分子中氨基的碱性, 会对活性和理化性质造成影响, 因为有些氨基与靶标蛋白发生关键的氢键相互作用, 而另一些则作为成盐位点, 用于改善药物的溶解性, 此为该方法的一些局限性, 在实际应用中应加以注意。
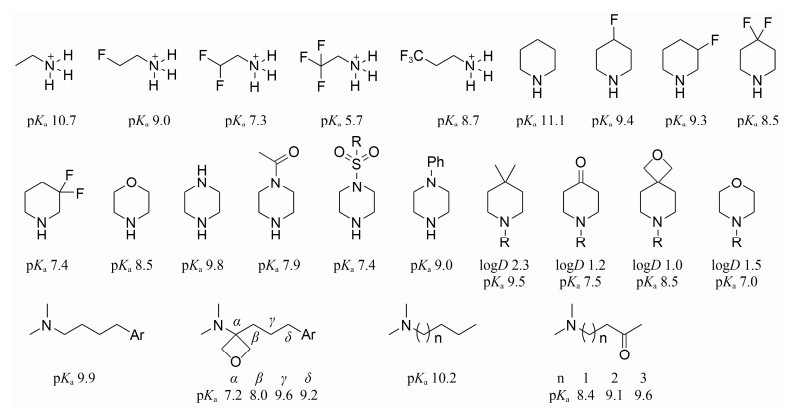
|
Figure 1 Introduction of withdrawing group to reduce pKa |
广谱抗菌药物化合物6对拓扑异构酶IV具有较好的抑制活性(IC50=3.2 nmol·L-1), hERG抑制活性IC50为44 μmol·L-1, 但在几内亚猪模型上会引起QT间期延长。在哌啶环上引入吸电性的氟原子[30], pKa降低1.3个单位, hERG抑制活性降至1/5 (IC50=233 μmol·L-1), 同时抗菌活性保持不变(表 7)。
| 表 7 Attenuation of pKa to reuduce hERG inhibitory activity on antibacterial agents 6 |
化合物7是环己基胺类DDP-IV抑制剂(IC50达到0.5 nmol·L-1), hERG抑制活性较强(IC50=4.8 μmol·L-1), 在犬模型上会导致QT间期延长。在环己基环上碱性氨基的β位引入氧原子[31], pKa从8.6降低为7.3, hERG抑制活性大大降低(IC50=23 μmol·L-1), 同时对DPP-IV抑制活性不受影响(表 8)。
| 表 8 Attenuation of pKa to reduce hERG inhibitory activity on DPP-IV inhibitors 7 |
化合物8是Merck公司开发的2-氰基嘧啶类组织蛋白酶K (CatK)抑制剂, hERG抑制活性IC50为0.16 μmol·L-1。将结构中哌啶替换成氨基酰胺片段[32], 碱性(pKa)和脂溶性(clogP)分别下降1.8和2.2个单位, hERG抑制活性降为原来的1/30 (IC50=3.16 μmol·L-1), 大鼠给药化合物8a 100 mg·kg-1两周, 未见心脏不良反应(表 9)。
| 表 9 Attenuation of pKa to reduce hERG inhibitory activity on CatK inhibitors 8 |
将氨基替换成酰胺可以显著降低碱性, 改善对hERG钾通道的抑制活性。化合物9和10是Shin等[33]报道的一类三级胺类的T-型钙通道阻滞剂, 是潜在的用于治疗心血管疾病的先导化合物, hERG抑制活性较强, 分别为0.18和1.38 μmol·L-1。将氨基替换成酰胺, 碱性和脂溶性均下降, hERG抑制活性IC50分别降为12.5和16.8 μmol·L-1, 但该方法导致钙通道阻滞活性略微下降(表 10)。
| 表 10 Attenuation of pKa to reduce hERG inhibitory activity on T-type calcium channel blockers 9 and 10 |
羟基是一个强极性氢键供体基团, 引入羟基可以显著地改变分子的理化性质, 降低脂溶性和碱性, 阻碍药物分子与hERG钾通道的疏水作用和π-阳离子相互作用。近年来, 越来越多的研究实例证明引入羟基对于改善hERG抑制活性具有重要作用。
化合物11是黑色素聚集激素受体(MCHR)拮抗剂(IC50为13 nmol·L-1), 但hERG抑制活性极强(IC50=0.002 μmol·L-1)。采用上述降低脂溶性的策略, 将苯环替换成四氢吡喃环, hERG抑制活性下降至11的1/60 (IC50=0.12 μmol·L-1), 抑制活性仍较强。在四氢吡喃环上引入羟基[34], hERG抑制活性进一步下降至11的1/4 000 (IC50=8.24 μmol·L-1), 同时MCHR拮抗活性保持, 可见羟基在改善hERG抑制活性的重要作用(表 11)。
| 表 11 Introducing hydroxy group to reduce hERG inhibition on MCHR antagonists 11 |
N-型钙离子通道(NVDCC)是治疗神经疼痛的潜在靶点, 化合物12是由Ogiyama等[35]报道的有效的N-型钙离子通道阻滞剂(IC50=0.6 nmol·L-1), hERG抑制活性较强(IC50=8.3 μmol·L−1)。采用类似的结构优化策略, 将2-甲氧基取代的苯环替换成羟基取代的环己基片段, hERG活性下降至98 μmol·L−1 (表 12)。
| 表 12 Introducing hydroxy group to reduce hERG inhibition on N-type calcium channel blockers 12 |
纺锤体蛋白(KSP)抑制剂可用于抗肿瘤。化合物13是Merck公司开发的KSP抑制剂(IC50=4 nmol·L-1), hERG抑制活性较强(IC50=1.2 μmol·L-1)。在二氢吡咯2-位引入羟甲基得到化合物13a, logP从2.5降到1.7, hERG抑制活性下降到原来的1/12 (IC50=14.6 μmol·L-1), 但化合物13a多药耐药性比值(MDR)较高, 易被细胞外排, 通过调节侧链在氨基哌啶引入氟原子, pKa下降1.2~2.2个单位, hERG抑制活性进一步下降(IC50 > 20.5 μmol·L-1), 同时MDR下降至10以下, 细胞活性提高(表 13)[36]。
| 表 13 Introducing hydroxy group to reduce hERG inhibition on kinesin spindle protein inhibitors 13 |
化合物14是一类选择性较高的组织蛋白酶S(CatS)抑制剂(IC50=3 nmol·L-1, CatL/CatS=120)。CatS是一类半胱氨酸蛋白酶, 主要在树突状细胞、B细胞、巨噬细胞和脑小神经胶质细胞上表达, 负责水解蛋白和抗原呈递, 选择性抑制脊髓小胶质的CatS可以逆转神经性疼痛。化合物14过血脑屏障的能力较好, 但hERG抑制活性较强(IC50=0.71 μmol·L-1), 在氨基侧链上引入羟基, 对hERG抑制活性影响不大。通过采用上述的降低碱性的策略, hERG抑制活性达到IC50大于30 μmol·L-1, 但化合物14b过血脑屏障能力下降, 脑中的药物浓度小于13 nmol·L-1。将氨基侧链替换成羟乙基, hERG抑制活性大于30 μmol·L-1, 同时化合物14c在Cat上的活性、选择性以及过血脑屏障的能力均保持(表 14)[37]。
| 表 14 Introducing hydroxy group to reduce hERG inhibition on cathepsin S inhibitor 13. aBrain concentration profiles for several compounds 14-14c in Sprague-Dawley rats (po 10 mg·kg-1, 3 h) |
在药物分子中巧妙地引入酸性片段, 可以与碱性氨基形成内盐, 能够显著降低了分子的脂溶性, 降低分子的碱性, 降低其与疏水性较强的hERG钾通道相互作用; 同时降低化合物的透膜性, 使其难以通过hERG钾通道的滤膜区。酸性片段的引入是阻断小分子配体与hERG通道相互作用直接有效的结构修饰策略, 然而有时引入酸性基团, 对药物分子的理化性质影响较大, 对药物分子的药效学和药代动力学性质产生较大影响。
化合物15是美国安进公司开发的高效选择性黑色素聚集激素受体MCHR1拮抗剂(Ki=0.3 nmol·L-1, IC50=0.5 nmol·L-1), 用于肥胖治疗。化合物15对hERG钾通道具有较强的抑制作用(IC50=0.03 μmol·L-1)。在四氢吡喃的4-位引入羧酸基团得到化合物15a, 其hERG抑制活性下降至1/10 (IC50=0.3 μmol·L-1), 但MCHR1拮抗活性显著下降, 缩短碳链后化合物15b和15c的MCHR的拮抗活性提高。将四氢吡喃替换成环己基得到化合物15c, MCHR活性保持(IC50=0.6 nmol·L-1), 而hERG抑制活性下降到化合物15的1/166之下(IC50 > 5 μmol·L-1), 在大鼠、犬、猴等模型上表现出良好的药代性质, 且未观察到QT间期延长的不良反应[38], 此外, 化合物15c透过血脑屏障的能力较强, 在大鼠、犬、猴等动物模型上均有效[39] (表 15)。
| 表 15 Adding acidic group to reduce hERG inhibition on MCHR1 antagonists 15. aDose: 0.5 mg·kg-1 (iv) and 3 mg·kg-1 (po) |
对药物分子基本骨架进行细微的调整, 比如改变手性、引入甲基、并环扩环或者引入双键增加分子刚性, 限制药物分子构象或减少柔性构象数目, 可有效地阻碍药物分子与hERG钾通道(off-target)相互作用; 同时由于药效团不变, 该策略对药效影响不大。近年来, 通过构象限制改善hERG抑制活性的报道越来越多, 为改善药物hERG抑制活性提供新思路。
2.5.1 改变手性上市药物中手性药物越来越普遍, 手性不同往往会导致药物药效学、药代动力学和毒理等性质各不相同。同样, 手性药物分子的不同异构体对于hERG钾通道的抑制作用不尽相同, 如化合物(R, R)-16和(R, R)-17是法尼基转移酶抑制剂, 体外具有良好的活性(IC50 < 1 nmol·L-1), hERG抑制活性分别为0.08和0.15 μmol·L-1, 改变手性得到化合物(R, S)-16a和(R, S)-17a, hERG抑制活性分别下降为4.7和9.1 μmol·L-1[40]。因此通过改变药物的手性是hERG改造中的一个不容忽视的改造思路(表 16)。
| 表 16 Changing the chiral center to reduce hERG inhibition of farnesyltransferase inhibitors (FTIs) 16 and 17 |
甲基策略在药化结构改造中作用广泛[41], 在分子中引入一个碳原子可以改变分子的线型。化合物18是H3受体拮抗剂, 体外具有良好的活性(Ki=7 nmol·L-1), 但hERG抑制活性较强(IC50=7 μmol·L-1), 在分子中引入一个亚甲基, 使分子由折线型趋向线型, 化合物18a对hERG抑制活性大大降低(IC50 > 30 μmol·L-1) (表 17)[42]。
| 表 17 Reducing the hERG inhibitory activity on H3 receptor (H3R) antagonist 18 |
肾素抑制剂19可用于抗高血压, 但其hERG抑制活性较强(IC50=5 μmol·L-1), 通过并入螺环增加分子刚性[43], 成功限制了芳环平面旋转, 化合物19a hERG抑制活性下降至19的1/5以下(IC50=24 μmol·L-1), 同时肾素抑制活性显著提高。此策略巧妙地实现了骨架跃迁, 降低hERG抑制活性的同时得到结构新颖的候选化合物(表 18)。
| 表 18 Intramolecular cyclization to reduce hERG inhibition on renin inhibitors 19 |
化合物20是白三烯A4水解酶(LTA4H)抑制剂, 具有较强的hERG抑制活性(IC50=1.5 μmol·L-1), 采用上述的杂环替换策略, 脂溶性clogP降低, 化合物20a抑制hERG的活性下降至20的1/6 (IC50=8.9 μmol·L-1)。基于此引入刚性托品烷结构[44], 可以减少化合物20b分子柔性构象数目, hERG抑制活性进一步降低(IC50 > 10 μmol·L-1) (表 19)。
| 表 19 Increasing the rigidity to reduce hERG inhibition on leukotriene A4 hydrolase (LTA4H) inhibitor 20 |
化合物21的乙基季铵盐氯非胺具有抗心律失常作用, 但hERG抑制活性较强(IC50=4.3 nmol·L-1), 结构中存在较强的碱性氮和两个较长的柔性疏水链。Louvel等[45]研究表明碱性氮对抗心律失常活性重要, 因此考察分子骨架刚性和连接链对hERG抑制活性的影响。当引入双键得到的化合物21a, 对构象改变无明显影响, 仍可以与关键的氨基酸残基Tyr652和Phe656发生相互作用, hERG抑制活性较强; 而当引入炔基得到化合物21b~21c, 分子刚性增强, hERG抑制活性下降至1/13~1/110 (表 20)。
| 表 20 Increasing the rigidity to reduce hERG inhibition on antiarrhythmic agent 21 |
降低脂溶性、降低碱性、引入羟基、引入酸性片段和构象限制是降低药物对hERG钾通道抑制的5种常用的化学结构改造策略。由于脂溶性和hERG抑制之间关系紧密, 使其成为降低hERG抑制活性首选的结构优化策略, 应用也最为广泛。其次应用较多的是降低药物分子碱性pKa, 值得注意的是降低碱性和降低脂溶性两种方法具有内在联系, 可以相互影响。合理地引入含氧原子的氢键供体(羟基)可以显著地降低hERG抑制活性。引入酸性片段, 可以显著地改变药物分子的理化性质, 导致hERG抑制活性显著降低, 但局限性在于可能会影响生物利用度和脑透膜性。构象限制是近年来逐渐发展和扩充的策略, 涉及到转变手性、引入甲基、骨架跃迁、增加刚性等新方法, 此类改造对理化性质改变较小, 通过改变构象或限制构象数目阻碍药物分子与hERG钾通道的相互作用, 为先导化合物结构改造提供新的研究思路。随着越来越多药物与hERG钾通道构效关系(SAR)的研究报道以及计算化学的发展, 预测模型精准度的提高, CADD的研究策略将为化合物设计和优化、避免hERG毒性提高更精准的指导。未来减低药物hERG心脏毒性的先导化合物结构优化策略, 将与药效团模型预测、同源模建和分子对接等策略联合使用, 相互影响、相互辅助, 为新药开发中降低潜在心脏毒性提供更加理性和丰富的改造思路。
| [1] | Shah RR. Drug-induced QT interval prolongation:does ethnicity of the thorough QT study population matter?[J]. Br J Clin Pharmacol , 2012, 75 :347–358. |
| [2] | Bowes J, Brown AJ, Hamon J, et al. Reducing safety-related drug attrition:the use of in vitro pharmacological profiling[J]. Nat Rev Drug Discov , 2012, 11 :909–922. DOI:10.1038/nrd3845 |
| [3] | Heijman J, Voigt N, Carlsson LG, et al. Cardiac safety assays[J]. Curr Opin Pharm , 2014, 15 :16–21. DOI:10.1016/j.coph.2013.11.004 |
| [4] | Laverty HG, Benson C, Cartwright EJ, et al. How can we improve our understanding of cardiovascular safety liabilities to develop safer medicines?[J]. Br J Pharmacol , 2011, 163 :675–693. DOI:10.1111/j.1476-5381.2011.01255.x |
| [5] | Fermini B, Fossa AA. The impact of drug-induced QT interval prolongation on drug discovery and development[J]. Nat Rev Drug Discov , 2003, 2 :439–447. DOI:10.1038/nrd1108 |
| [6] | Vandenberg JI, Perry MD, Perrin MJ, et al. hERG K + channels:structure, function, and clinical significance[J]. Physiol Rev , 2012, 92 :1393–1478. DOI:10.1152/physrev.00036.2011 |
| [7] | Redfern W, Carlsson L, Davis A, et al. Relationships between preclinical cardiac electrophysiology, clinical QT interval prolongation and torsade de pointes for a broad range of drugs:evidence for a provisional safety margin in drug development[J]. Cardiovasc Res , 2003, 58 :32–45. DOI:10.1016/S0008-6363(02)00846-5 |
| [8] | Beattie KA, Luscombe C, Williams G, et al. Evaluation of an in silico cardiac safety assay:using ion channel screening data to predict QT interval changes in the rabbit ventricular wedge[J]. J Pharmacol Toxicol Methods , 2013, 68 :88–96. DOI:10.1016/j.vascn.2013.04.004 |
| [9] | Obers S, Staudacher I, Ficker E, et al. Multiple mechanisms of hERG liability:K+ current inhibition, disruption of protein trafficking, and apoptosis induced by amoxapine[J]. Naunyn Schmiedebergs Arch Pharmacol , 2010, 381 :385–400. DOI:10.1007/s00210-010-0496-7 |
| [10] | Guo J, Massaeli H, Li W, et al. Identification of IKr and its trafficking disruption induced by probucol in cultured neonatal rat cardiomyocytes[J]. J Pharmacol Exp Ther , 2007, 321 :911–920. DOI:10.1124/jpet.107.120931 |
| [11] | Rajamani S, Eckhardt LL, Valdivia CR, et al. Drug-induced long QT syndrome:hERG K+ channel block and disruption of protein trafficking by fluoxetine and norfluoxetine[J]. Br J Pharmacol , 2006, 149 :481–489. DOI:10.1038/sj.bjp.0706892 |
| [12] | Takemasa H, Nagatomo T, Abe H, et al. Coexistence of hERG current block and disruption of protein trafficking in ketoconazole-induced long QT syndrome[J]. Br J Pharmacol , 2008, 153 :439–447. DOI:10.1038/sj.bjp.0707537 |
| [13] | Wang Q, Hu W, Lei M, et al. MiR-17-5p impairs trafficking of H-ERG K+ channel protein by targeting multiple ER stressrelated chaperones during chronic oxidative stress[J]. PLoS One , 2013, 8 :e84984. DOI:10.1371/journal.pone.0084984 |
| [14] | Hari Narayana Moorthy NS, Ramos MJ, Fernandes PA. Predictive QSAR models development and validation for human ether-a-go-go related gene (hERG) blockers using newer tools[J]. J Enzyme Inhib Med Chem , 2014, 29 :317–324. DOI:10.3109/14756366.2013.779264 |
| [15] | Jing Y, Easter A, Peters D, et al. In silico prediction of hERG inhibition[J]. Future Med Chem , 2015, 7 :571–586. DOI:10.4155/fmc.15.18 |
| [16] | Tan Y, Chen Y, You Q, et al. Predicting the potency of hERG +K channel inhibition by combining 3D-QSAR pharmacophore and 2D-QSAR models[J]. J Mol Model , 2012, 18 :1023–1036. DOI:10.1007/s00894-011-1136-y |
| [17] | Liu LL, Lu J, Lu Y, et al. Novel Bayesian classification models for predicting compounds blocking hERG potassium channels[J]. Acta Pharmacol Sin , 2014, 35 :1093–1102. DOI:10.1038/aps.2014.35 |
| [18] | Fernandez D, Ghanta A, Kauffman GW, et al. Physicochemical fe atures of the hERG channel drug binding site[J]. J Biol Chem , 2004, 279 :10120–10127. DOI:10.1074/jbc.M310683200 |
| [19] | Wang S, Li Y, Xu L, et al. Recent developments in computational prediction of hERG blockage[J]. Curr Top Med Chem , 2013, 13 :1317–1326. DOI:10.2174/15680266113139990036 |
| [20] | Jamieson C, Moir EM, Rankovic Z, et al. Medicinal chemistry of hERG optimizations:highlights and hang-ups[J]. J Med Chem , 2006, 49 :5029–5046. DOI:10.1021/jm060379l |
| [21] | Kerns EH, Di L. Drug-Like Properties:Concepts, Structure Design and Methods:from ADME to Toxicity Optimization[M]. Burlington: Elsevier Inc., 2008 . |
| [22] | Sun L, Wang XJ, You QD. Process in the research on chemical modification of drugs with low hERG cardiac toxicity[J]. Chin J Pharm (中国医药工业杂志) , 2011, 42 :698–703. |
| [23] | Levoin N, Labeeuw O, Calmels T, et al. Novel and highly potent histamine H 3 receptor ligands. Part 1:withdrawing of hERG activity[J]. Bioorg Med Chem Lett , 2011, 21 :5378–5383. DOI:10.1016/j.bmcl.2011.07.006 |
| [24] | Deng Q, Lim YH, Anand R, et al. Use of molecular modeling aided design to dial out hERG liability in adenosine A2A receptor antagonists[J]. Bioorg Med Chem Lett , 2015, 25 :2958–2962. DOI:10.1016/j.bmcl.2015.05.036 |
| [25] | Reck F, Alm R, Brassil P, et al. Novel N-linked aminopiperidine inhibitors of bacterial Topoisomerase type Ⅱ:broadspectrum antibacterial agents with reduced hERG activity[J]. J Med Chem , 2011, 54 :7834–7847. DOI:10.1021/jm2008826 |
| [26] | Gao ZL, Hurst WJ, Czechtizky W, et al. Identification and profiling of 3, 5-dimethyl-isoxazole-4-carboxylic acid[J]. Bioorg Med Chem Lett , 2013, 23 :6269–6273. DOI:10.1016/j.bmcl.2013.09.081 |
| [27] | Cumming JG, Tucker H, Oldfield J, et al. Balancing hERG affinity and absorption in the discovery of AZD5672, an orally active CCR5 antagonist for the treatment of rheumatoid arthritis[J]. Bioorg Med Chem Lett , 2012, 22 :1655–1659. DOI:10.1016/j.bmcl.2011.12.117 |
| [28] | Gao Z, Hurst WJ, Czechtizky W, et al. Discovery of a potent, selective, and orally bioavailable histamine H3 receptor antagonist SAR110068 for the treatment of sleep-wake disorders[J]. Bioorg Med Chem Lett , 2013, 23 :6141–6145. DOI:10.1016/j.bmcl.2013.09.006 |
| [29] | Wuitschik G, Carreira EM, Wagner B, et al. Oxetanes in drug discovery:structural and synthetic insights[J]. J Med Chem , 2010, 53 :3227–3246. DOI:10.1021/jm9018788 |
| [30] | Reck F, Alm RA, Brassil P, et al. Novel N-linked aminopiperidine inhibitors of bacterial Topoisomerase type Ⅱ with reduced pKa:antibacterial agents with an improved safety profile[J]. J Med Chem , 2012, 55 :6916–6933. DOI:10.1021/jm300690s |
| [31] | Biftu T, Qian XX, Chen P, et al. Novel tetrahydropyran analogs as dipeptidyl peptidase IV inhibitors:profile of clinical candidate (2R, 3S, 5R)-2-(2, 5-difluorophenyl)-5-[J]. Bioorg Med Chem Lett , 2013, 23 :5361–5366. DOI:10.1016/j.bmcl.2013.07.061 |
| [32] | Rankovic Z, Cai J, Kerr J, et al. Optimisation of 2-cyanopyrimidine inhibitors of cathepsin K:improving selectivity over hERG[J]. Bioorg Med Chem Lett , 2010, 20 :6237–6241. DOI:10.1016/j.bmcl.2010.08.101 |
| [33] | Choi YJ, Seo JH, Shin KJ. Successful reduction of off-target hERG toxicity by structural modification of a T-type calcium channel blocker[J]. Bioorg Med Chem Lett , 2014, 24 :880–883. DOI:10.1016/j.bmcl.2013.12.078 |
| [34] | Fox BM, Natero R, Richard K, et al. Novel pyrrolidine melanin-concentrating hormone receptor 1 antagonists with reduced hERG inhibition[J]. Bioorg Med Chem Lett , 2011, 21 :2460–2467. DOI:10.1016/j.bmcl.2011.02.046 |
| [35] | Ogiyama T, Inoue M, Honda S, et al. Discovery of novel tetrahydroisoquinoline derivatives as orally active N-type calcium channel blockers with high selectivity for hERG potassium channels (vol 22, pg 6899, 2014)[J]. Bioorg Med Chem , 2015, 23 :6079. DOI:10.1016/j.bmc.2015.07.033 |
| [36] | Cox CD, Coleman PJ, Breslin MJ, et al. Kinesin spindle protein (KSP) inhibitors. 9. Discovery of (2 S)-4-(2, 5-difluorophenyl)-N-[(3R, 4S)-3-fluoro-1-methylpiperidin-4-yl]-2-(hydroxy methyl)-N-methyl-2-phenyl-2, 5-dihydro-1H-pyrrole-1-carboxamide (MK-0731) for the treatment of taxane-refractory cancer[J]. J Med Chem , 2008, 51 :4239–4252. DOI:10.1021/jm800386y |
| [37] | Irie O, Kosaka T, Kishida M, et al. Overcoming hERG issues fo r brain-penetrating cathepsin S inhibitors:2-cyanopyrimidines. Part 2[J]. Bioorg Med Chem Lett , 2008, 18 :5280–5284. DOI:10.1016/j.bmcl.2008.08.067 |
| [38] | Mihalic JT, Chen XQ, Fan PC, et al. Discovery of a novel series of melanin-concentrating hormone receptor 1 antagonists fo r the treatment of obesity[J]. Bioorg Med Chem Lett , 2011, 21 :7001–7005. DOI:10.1016/j.bmcl.2011.09.110 |
| [39] | Mihalic JT, Fan P, Chen X, et al. Discovery of a novel melanin concentrating hormone receptor 1(MCHR1) antagonist with reduced hERG inhibition[J]. Bioorg Med Chem Lett , 2012, 22 :3781–3785. DOI:10.1016/j.bmcl.2012.04.006 |
| [40] | Bell IM, Gallicchio SN, Abrams M, et al. 3-Aminopyrrolidinone farnesyltransferase inhibitors:design of macrocyclic compounds with improved pharmacokinetics and excellent cell potency[J]. J Med Chem , 2002, 45 :2388–2409. DOI:10.1021/jm010531d |
| [41] | Lian J, Wang J, Sun HF, et al. Application of methyl in drug design[J]. Acta Pharm Sin (药学学报) , 2013, 48 :1195–1208. |
| [42] | Becknell NC, Dandu RR, Lyons JA, et al. Synthesis and evaluation of 4-alkoxy-[J]. Bioorg Med Chem Lett , 2012, 22 :186–189. DOI:10.1016/j.bmcl.2011.11.038 |
| [43] | Chen A, Aspiotis R, Campeau LC, et al. Renin inhibitors fo r the treatment of hypertension:design and optimization of a novel series of spirocyclic piperidines[J]. Bioorg Med Chem Lett , 2011, 21 :7399–7404. DOI:10.1016/j.bmcl.2011.10.013 |
| [44] | Tanis VM, Bacani GM, Blevitt JM, et al. Azabenzthiazole inhibitors of leukotriene A 4 hydrolase[J]. Bioorg Med Chem Lett , 2012, 22 :7504–7511. DOI:10.1016/j.bmcl.2012.10.036 |
| [45] | Louvel J, Carvalho JFS, Yu ZY, et al. Removal of human ether-a-go-go related gene (hERG) K + channel affinity through rigidity:a case of clofilium analogues[J]. J Med Chem , 2013, 56 :9427–9440. DOI:10.1021/jm4010434 |
 2016, Vol. 51
2016, Vol. 51





























