2. 齐齐哈尔市食品药品检验检测中心, 黑龙江 齐齐哈尔 161006 ;
3. 黑龙江中医药大学, 黑龙江 哈尔滨 150040
2. Qiqihar Institute for Food and Drug Control, Qiqihar 161006, China ;
3. Heilongjiang University of Chinese Medicine, Harbin 150040, China
百部为直立百部Stemona sessilifolia (Miq.) Miq.、蔓生百部Stemona japonica (BL.) Miq.和对叶百部Stemona tuberosa Lour.的干燥块根[1]。性味甘、苦,微温,归肺经。具有润肺下气止咳、杀虫的功效,用于新久咳嗽、肺痨咳嗽、百日咳等; 外用头虱、体虱、蛲虫病、阴痒。百部镇咳的活性成分主要是百部属生物碱类[2, 3],能降低呼吸中枢的兴奋性,抑制咳嗽反射,因而具有镇咳作用[4]。蜂蜜具有润肺镇咳作用,蜜炙百部能协同止咳化痰,增强润肺下气止咳作用,临床常以炮制品蜜炙百部入药,常用于阴虚劳咳。2015版药典收载百部的3个品种中对叶百部镇咳活性最强[5],本研究对蜜炙对叶百部进行血清药物化学研究,以期阐明蜜炙对叶百部的药效物质基础。
中药血清药物化学理论是快速、准确地研究确定中药药效物质基础的有效途径,中药所含成分虽然复杂,但只有被吸收入血的成分才能发挥作用[6, 7],通过分析中药口服给药后血液中的成分,确定中药的体内直接作用物质,包括中药所含成分的原形成分和代谢产物。液质联用技术为血中移行成分的检测和鉴定提供了有效的分析手段,能够更全面地获得中药体内直接作用物质的信息[8]。然而,血中内源性成分同时也获得了良好的检测,严重干扰了药物成分的辨识,使用药物代谢物分析软件MetaboLynx并结合代谢途径的预测,可实现数据自动提取与代谢物辅助鉴定[9]。本研究采用UHPLC-QTOF/MS技术和MetaboLynx软件采集处理数据,最后确定蜜炙对叶百部的入血成分及其代谢产物,并进行鉴定实现代谢途径的预测,以探索蜜炙对叶百部可能的药效成分,为进一步研究蜜炙对叶百部的药效奠定基础。
材料与方法仪器 ACQUITY Ultra Performance LCTM超高效液相色谱仪 (美国Waters公司),XEVO G2 UHPLC- QTOF/MS质谱(美国Waters公司); MassLynx V4.1工作站; 固相萃取柱 (SPE,Waters OasisR HLB 3 cc 60 mg); WTL-10K离心机 (湖南湘仪有限公司); SK-1快速混匀器 (江苏金坛医疗器械厂); Mettler Toledo AG 135分析天平 (Mettler公司); 吉尔森微量取样 器,10~100 μL,100~1 000 μL (法国Pipetman公司); Milli-Q超纯水制备仪 (美国Millipore公司)。
药品与试剂 对叶百部饮片购自河北省安国市昌达中药材饮片有限公司,由齐齐哈尔医学院郭丽娜教授鉴定为对叶百部 (Stemona tuberosa Lour.) 的干燥块根。对照品: 对叶百部碱 (tuberostemonine,批号6879-1-2) 购自四川维克奇生物有限公司,新对叶百部碱 (neotuberostemonine,纯度> 90%) 为实验室自制。乙腈、甲醇,色谱级 (美国默克公司); 甲酸,色谱级 (美国霍尼韦尔公司); 戊巴比妥钠 (国药集团化学试剂有限公司); 乙醇,分析纯 (天津市福晨化学试剂厂); 磷酸 (北京试剂公司); 杨槐蜂蜜 (北京百花蜂业科技发展股份公司)。
实验动物 清洁级雄性Wistar大鼠,体重 (200 ± 20) g,6周龄,由黑龙江中医药大学实验动物 中心提供,合格证号SCXK黑2008004。
对照品溶液的制备 取对叶百部碱、新对叶百部碱对照品适量,精密称定,加甲醇溶解制成混合对照品溶液 (含对叶百部碱0.001 mg·mL−1、新对叶百部碱0.002 mg·mL−1)。
蜜炙对叶百部的制备 称取100 g对叶百部与25 g蜂蜜水 (蜂蜜12.5 g与12.5 g开水溶解得到) 拌匀,闷透至水被药材吸尽,置炒制容器内,用文火炒至规定程度时,取出,放凉,即得[10]。
蜜炙对叶百部供试品溶液的制备 取蜜炙对叶百部粉末 (过4号筛) 约20.0 g,精密称定,置具塞锥形瓶中,精密加入75%乙醇160 mL,密塞,称定重量,回流1 h,放冷,再称定重量,用75%乙醇补足失重,摇匀。进样前将储备液用甲醇稀释10倍,经0.22 μm 微孔滤膜滤过,取上清液2 μL,供UPLC分析。
给药与样品采集 Wistar雄性大鼠8只,实验前12 h禁食不禁水,随机选取4只作为给药组,将蜜 炙对叶百部乙醇回流提取液旋转蒸发至无醇味后,加蒸馏水溶解至浓度为0.9 g·mL−1给药溶液,灌胃 给予给药组大鼠 (1 mL/100 g),另4只作为空白,灌胃给予等体积蒸馏水。60 min后2% 戊巴比妥钠腹腔注射麻醉,肝门静脉取血置肝素钠管中,4 ℃、13 000 r·min−1条件下离心10 min,取上清液。
血清样品处理 取空白及给药大鼠离心血清 1 mL,分别加入磷酸20 μL涡旋60 s酸化,上样到预先以甲醇2 mL、水2 mL活化平衡好的固相萃取柱 上,水2 mL淋洗,淋洗液弃去,再以甲醇2 mL洗脱,45 ℃下氮气流吹干,残渣以甲醇100 μL超声5 min溶解,于10 000 r·min−1的条件下离心5 min,取上清液2 μL分析,供UHPLC分析。
色谱条件 Acquity UHPLC BEH C18柱 (2.1 mm × 100 mm,1.7 μm,美国Waters公司); 流动相0.1% 甲酸水 (A)−0.1% 甲酸乙腈 (B); 流速0.40 mL·min−1; 柱温45 ℃; 梯度洗脱,0~6 min,95%~90% A,6~16 min,90%~85% A,16~20 min,85%~60% A; 进样量2 μL。柱色谱洗脱液不经分流直接导入质谱系统检测。
质谱条件 离子源为ESI源,采用正离子扫描检测; 离子源温度110 ℃; 毛细管电压2 800 V; 锥孔电压35 V; 碰撞能3.0 V; 雾化气流量60 L·h−1; 脱溶剂气流量600 L·h−1; 脱溶剂温度350 ℃。
数据处理 采用MassLynx V4.1工作站 (美国Waters公司) 对处理后的血清样品进行扫描,通过Waters代谢物鉴定软件MetaboLynx及MSE数据采集功能,将含药血清UHPLC-QTOF/MS数据文档设置为“Analyte”,空白血清数据文档设置为“Control”,扣除空白背景后,对入血成分进行定性与结构鉴定分析。MetaboLynx主要分析参数设置如下: 扫描色谱图保留时间0.1~20.0 min,质量范围50~1 000 Da; 质量窗口0.1 Da; 峰强度阈值1; 质谱强度阈值20; 假阳性质量匹配窗口1 Da; 保留时间窗口0.5,匹配方式为对照质量保留时间。
结果 1 蜜炙对叶百部体外成分分析对正离子模式下蜜炙对叶百部提取物UHPLC- QTOF/MS色谱图中各峰低碰撞能质谱数据进行直观分析,共检测分析19个化合物峰。通过对照品比对鉴定峰10、峰12为新对叶百部碱和对叶百部碱。其他色谱峰根据低能量通道中一级质谱图提供准分子离子峰的精确分子质量,应用质谱分析软件元素组成分析功能“elemental composition”计算可能的元素组成 (误差小于 ± 10 ppm),并结合相应的同位素丰度比 (i-FIT) 数据,确定化合物的相对分子质量和可能分子式; 通过高能量扫描时产生的碎片离子明确碎片的元素组成,结合化合物的碎片峰信息、通过对分子量、分子式和碎片离子的解析,推测化合物的结构。由于化合物均为百部属生物碱,对结构相似的化合物,通过检索数据库 (Scifinder、Chemspider) 并根据文献[11-23]报道分析生物碱类成分的质谱、保留时间,结合课题组前期对四川产百部化学成分研究[22]建立数据库,最终确定化合物结构。化合物中峰14、峰15具有相同的分子式和完全一致的碎片离子,初步表征为N-氧-对叶百部碱及其同分异构体。相关离子推断见表 1。
| Table 1 Compounds identified in honey-fried Stemona tuberosa Lour. by UHPLC-QTOF/MS in positive ion mode |
以峰12为例,在低能量图谱中,准分子离子峰m/z 376.249 6,MassLynx工作站给出的元素组成为C22H33NO4,检索数据库和对叶百部所含生物碱的相应化学成分信息与对叶百部碱的分子式与相对分子质量相吻合,同时分析峰12的二级质谱离子信息,主要特征碎片为m/z 302、276、206,其中特征离子碎片302 [M+H−C3H6O2]+与文献[5]报道一致,百部类生物碱因含有α-甲基-γ-内酯环,在电喷雾电离质谱能得到 [M+H−74]+ 的特征离子,可推断峰12为对叶百部碱,其高、低碰撞能质谱图见图 1。
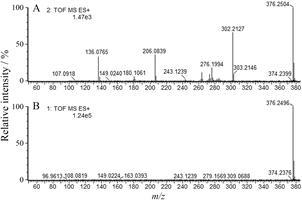
|
Figure 1 The mass spectrum with MSE function at high collision energy (A) and low collision energy (B) of tuberostemonine (peak No.12) |
正离子模式下蜜炙对叶百部提取物含药血清和空白血清样品使用MetaboLynx软件处理,通过已 编辑设定的Ⅰ相及Ⅱ相代谢反应途径对每一个被 检测的化合物进行靶向提取并自动鉴定,处理后的各峰质谱图获得良好的过滤,背景干扰被去除,血中移行成分峰易于识别,并将提取的离子在“Expected Metabolites”窗口中列出,根据同位素峰和碎片离子进一步进行手动排查,所得结果见图 2。共检测到 40个入血成分,包括12个原形成分和28个代谢产物,入血成分的鉴定及结果见表 2。
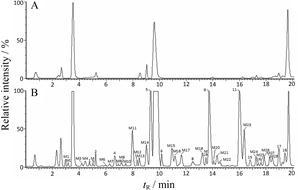
|
Figure 2 UPLC-QTOF/MS chromatograms of rat serum after oral administration (B) of honey-fried Stemona tuberosa Lour. and blank serum (A) in positive ion mode. M1−28: Metabolites |
| Table 2 In vivo metabolites of honey-friedStemona tuberosa Lour. identified by UHPLC-QTOF/MS in positive ion mode |
原形入血成分的质谱裂解规律与体外化合物 相似,正离子模式下碎片离子一般以 [M+H]+、百部 生物碱特征性碎片离子 [M+H−74]+形式存在。通过MetaboLynx软件的自动处理,可快速鉴定代谢物及代谢途径,代谢产物可通过准分子离子、特征碎片离子推测,其鉴定过程简要介绍如下,代谢产物M21 (14.34 min) 准分子离子峰 [M+H]+ 为394,MSE扫描高碰撞能下主要碎片离子为376 (失去一分子水),其余碎片离子m/z 302、m/z 276、m/z 206与对叶百部碱二级离子碎片相同,因此M21鉴定为对叶百部碱水合代谢产物,其MSE质谱图见图 3。共鉴定与表征蜜炙对叶百部入血成分中28个代谢产物,代谢途径主要是原形成分的水合产物、羟基化产物、氧化产物等,代谢途径较单一且全部为Ⅰ相代谢,表明蜜炙对叶百部的原形成分可能是通过这些生物转化方式被机体吸收或极性变大易于排泄。以对叶百部碱为例说 明代谢物的代谢转化途径,根据MetaboLynx软件的分析结果,化合物M18、M20均显示准分子离子峰m/z 392 [M+H]+,比对叶百部碱的准分子离子峰多 16; M21准分子离子峰m/z 394 [M+H]+,比对叶百部碱的准分子离子峰多18; M22准分子离子峰m/z 410 [M+H]+,比对叶百部碱的准分子离子峰多34,化合物M18、M20~M22在MSE谱中显示碎片m/z 376、m/z 302为对叶百部碱的特征峰,因此,推断M18和M20、M21、M22代谢途径分别为羟基化、水合、烯炔形成二氢二醇 (alkenes to dihydrodiol)。

|
Figure 3 MSE spectrum of the metabolite M21 |
液质联用技术能够快速、灵敏地检测和表征中药及复方的血中移行成分,在电喷雾离子源下血清中含有大量内源性物质具有较强的质谱信号,容易掩盖入血成分,严重影响对血中移形成分的识别,因 而,本研究优化洗脱梯度使血清中大量内源性物质在20 min后出峰,大大降低了对血中移行成分的干扰,便于分析。采用代谢物分析软件MetaboLynx与液质联用技术相结合,完成代谢途径的预测,实现数据自动提取与代谢物辅助鉴定,弥补了传统血清药物化学研究方法人工对比图谱过程中主观因素对 实验结果影响,提高对入血成分的辨识能力,更客观、全面地分析蜜炙对叶百部入血成分及代谢产物。本实验质谱扫描模式的选择,分别比较了正、负离子两种扫描模式,结果发现百部属生物碱类成分在正离子模式下质谱响应较强,故实验最终选择在正离子模式下进行。
文献[24]报道金刚大碱和百部新碱具有类似的镇咳作用,而对叶百部碱与之相比显示较弱的镇咳作用,其中对叶百部碱和百部新碱作用于周边咳嗽反射通路,金刚大碱表现出明显的中枢性呼吸抑制作用; 大鼠口服对叶百部提取物后血浆中的百部新碱与静脉注射相比消除慢,说明百部新碱有益于治疗慢性或急性咳嗽[25]; 新斯替宁碱[26]、新对叶百部碱和叶百部碱J[2]均有镇咳作用。这些具有良好镇咳活性的6个成分在本研究中均以原形的形式被检测到,它们最有可能成为蜜炙对叶百部发挥止咳作用的体内物质基础。
本文应用UHPLC-QTOF/MS和MetaboLynx数 据处理技术,表征了蜜炙对叶百部的40个血中移行成分,基本阐明了蜜炙对叶百部的药效物质基础,为其在临床上的广泛应用奠定了理论基础,对叶百部蜜炙炮制的药理作用及其机制仍需进一步研究。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. 2015 ed. Part I. Beijing: China Medical Science Press, 2015: 132-133. |
| [2] | Chung HS, Hon PM, Lin G, et al. Antitussive activity of Stemona alkaloids from Stemona tuberose[J]. Planta Med , 2003, 69 :914–920. DOI:10.1055/s-2003-45100 |
| [3] | Lin LG, Li KM, Tang CP, et al. Antitussive stemoninine alkaloids from the roots of Stemona tuberose[J]. J Nat Prod , 2008, 71 :1107–1110. DOI:10.1021/np070651+ |
| [4] | Lin LG, Yang XZ, Tang CP, et al. Antibacterial stilbenoids from the roots Stemona tuberosa[J]. Phytochemistry , 2008, 69 :457–463. DOI:10.1016/j.phytochem.2007.07.012 |
| [5] | Hu J, Zhang N, Mao Y, et al. Antitussive activity comparison of three kinds of Stemonae Radix in Chinese Pharmacopoeia[J]. China J Chin Mater Med (中国中药杂志) , 2009, 34 :3096–3104. |
| [6] | Zeng HJ, Yang R, Guo C, et al. Pharmacokinetic study of six flavones in rat plasma and tissues after oral administration of ‘JiangYaBiFeng' using SPE-HPLC-DAD[J]. J Pharm Biomed Anal , 2011, 56 :815–819. DOI:10.1016/j.jpba.2011.07.015 |
| [7] | Sun H, Wu FF, Zhang AH, et al. Profiling and identification of the absorbed constituents and metabolites of schisandra lignans by ultra-performance liquid chromatography coupled to mass spectrometry[J]. Biomed Chromatogr , 2013, 27 :1511–1519. DOI:10.1002/bmc.v27.11 |
| [8] | Zhou JL, Qi LW, Li P. Herbal medicine analysis by liquid chromatography/time-of-flight mass spectrometry[J]. J Chromatogr A , 2009, 1216 :7582–7594. DOI:10.1016/j.chroma.2009.05.054 |
| [9] | Xue CS, Zhang AH, Sun H, et al. An improved ultra- performance liquid chromatography-electrospray ionization/ quadrupole time of flight high-definition mass spectrometry method for determining ingredients of herbal Fructus Corni in blood samples[J]. Pharmacogn Mag , 2014, 10 :422–429. DOI:10.4103/0973-1296.141796 |
| [10] | Cai BC. Science of Processing Chinese Materia Medica (中药炮制学)[M]. Beijing: China Traditional Chinese Medicine Press, 2008 : 210 . |
| [11] | Xu RS, Lu YJ, Chu JH, et al. Studies on some new Stemona alkaloids. A diagnostically useful proton NMR line-broadening effect[J]. Tetrahedron , 1982, 38 :2667–2667. DOI:10.1016/0040-4020(82)80020-3 |
| [12] | Jiang RW, Hon PM, Xu YT, et al. Isolation and chemotax-onomic significance of tuberostemospironine-type alkaloids from Stemona tuberosa[J]. Phytochemistry , 2006, 67 :52–57. DOI:10.1016/j.phytochem.2005.10.004 |
| [13] | Zhou Y, Jiang RW, Hon PM, et al. Analyses of Stemona alkaloids in Stemona tuberosa by liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom , 2006, 20 :1030–1038. DOI:10.1002/(ISSN)1097-0231 |
| [14] | Li SL, Jiang RW, Hon PM, et al. Quality evaluation of Radix Stemonae through simultaneous quantification of bioactive alkaloids by high-performance liquid chromatography coupled with diode array and evaporative light scattering detectors[J]. Biomed Chromatogr , 2007, 21 :1088–1094. DOI:10.1002/(ISSN)1099-0801 |
| [15] | Pham HD, Yu BW, Chua VM, et al. Alkaloids from Stemona collinsae[J]. J Asian Nat Prod Res , 2002, 4 :81–85. DOI:10.1080/10286020290027344 |
| [16] | Ueo S, Irie H, Harada H. The structure of stenine, a new alkaloid occurring in Stemona tuberosa[J]. Chem Pharm Bull , 1967, 15 :768–770. DOI:10.1248/cpb.15.768 |
| [17] | Sturm S, Schinnerl J, Greger H, et al. Nonaqueous capillary electrophoresis-electrospray ionization-ion trap-mass spectrometry analysis of pyrrolo-and pyrido[1,2-a]azepine alkaloids in Stemona[J]. Electrophoresis , 2008, 29 :2079–2087. DOI:10.1002/(ISSN)1522-2683 |
| [18] | Zou CY, Li J, Lei HM, et al. A new alkaloid from root of Stemona japonica Miq[J]. J Chin Pharm Sci (中国药学杂志) , 2000, 9 :113–115. |
| [19] | Jovanovic SV, Steenken S, Tosic M, et al. Flovoniods as antioxidants[J]. J Am Chem Soc , 1994, 116 :4846–4851. DOI:10.1021/ja00090a032 |
| [20] | Lin WH, Ye Y, Xu RS. Chemical studies on new Stemona alkaloids, IV. Studies on new alkaloids from Stemona tuberose[J]. J Nat Prod , 1992, 55 :571–576. DOI:10.1021/np50083a003 |
| [21] | Lin WH, Fu HZ. Three new alkaloids from the roots of Stemona tuberosa Lour[J]. J Chin Pharm Sci (中国药学杂志) , 1999, 8 :1–7. |
| [22] | Dong W, Wang P, Meng X, et al. Ultra-performance liquid chromatography-high-definition mass spectrometry analysis of constituents in the root of Radix Stemonae and those absorbed in blood after oral administration of the extract of the crude drug[J]. Phytochem Anal , 2012, 23 :657–667. DOI:10.1002/pca.v23.6 |
| [23] | Chung HS, Hon PM, Lin G, et al. Antitussive activity of Stemona alkaloids from Stemona tuberose[J]. Planta Med , 2003, 69 :914–920. DOI:10.1055/s-2003-45100 |
| [24] | Xu YT, Shaw PC, Jiang RW, et al. Antitussive and central respiratory depressant effects of Stemona tuberosa[J]. J Ethnopharmacol , 2010, 128 :679–684. DOI:10.1016/j.jep.2010.02.018 |
| [25] | Jiang DZ, Yang X, Liu HB, et al. Development and validation of a high-performance liquid chromatographic method for the determination of stemoninine in rat plasma after administration of Stemona tuberosa extracts[J]. Biomed Chromatogr , 2011, 25 :498–502. DOI:10.1002/bmc.v25.4 |
| [26] | Wang P, Liu AL, An Z, et al. Novel alkaloids from the roots of Stemona sessilifolia[J]. Chem Biodivers , 2007, 4 :523–530. DOI:10.1002/(ISSN)1612-1880 |
 2016, Vol. 51
2016, Vol. 51


