阿尔茨海默病是一种大脑神经退行性疾病,也是威胁现代社会老年人健康的重大疾病之一[1]。本病起病隐匿,呈进行性加重,一般起病2~3年后症状明显,病程5~10年[2]。根据国际阿尔茨海默症协会最近3年的报道,目前全球有超过3 600万阿尔茨海默病患者,预计到2050年会增加到1.15亿人,其中绝大多数患者分布在中低收入国家。据统计,在美国仅2015年因阿尔茨海默病导致的费用就高达2 260亿美元[3]。胆碱能神经损伤假说认为,在AD病理过程中,基底前脑区的胆碱能神经元丢失,胆碱乙酰转移酶 (cholineacetyltransferase) 活性下降造成乙酰胆碱 (ACh) 的合成、释放和摄取减少,使患者的学习和记忆力逐渐衰退。因此,改善胆碱能神经系统、增加脑内ACh的水平是治疗AD的重要途径[4]。到目前为止,乙酰胆碱酯酶抑制剂 (AChEI) 已被成功开发成临床上治疗AD的药物,代表药物如石杉碱甲、他克林、多奈哌齐、利斯的明等[5-8]。
丁酰胆碱酯酶 (butyrylcholinesterase,BuChE) 又称假性胆碱酯酶,属于丝氨酸酯酶家族。主要分布于肝脏及血清中,肌肉和脑组织中也有少量存在。BuChE能与有机磷毒剂或杀虫剂结合,并能水解许多酯类、肽类及酰胺类化合物,参与某些药物的代谢过程,它还有促进细胞生长的作用[9]。如果AD治疗药物使BuChE的活性受到抑制将会带来一定的不良反应。现有治疗AD的药物存在AChE与BuChE选择性抑制不理想、肾毒性、肝毒性等问题,从而限制了它们的临床应用[10-13]。
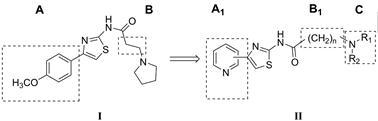
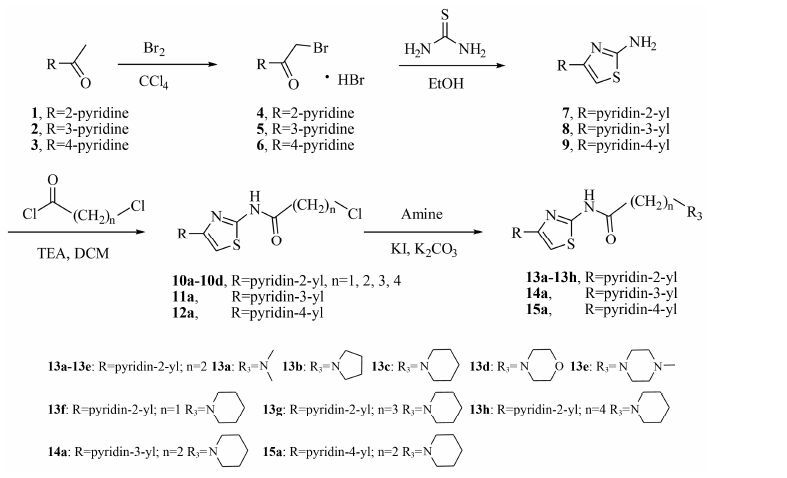
本实验室先前合成了化合物I (图 1),在抑制AChE活性方面有一定的效果[14]。本文将在化合物I的化学结构基础上对其结构进行优化,合成新的化合物II (图 1),并考察它们对AChE的抑制作用。具体的优化过程如下: 将化合物I的A部分替换成A1,即用吡啶环代替苯环,考察引入具有孤电子对配位的吡啶后对生物活性的影响; 同时改变B官能团的长度得到B1 (n = 1,2,3,4),考察碳连长度的改变是否影响其AChE抑制活性,为新的AChEI的开发做探索性研究。化合物II的合成如合成路线1所示。
|
Figure 1 The structure of compound I and II |
|
Scheme1 Synthetic route of target compounds |
合成化合物的结构经1H NMR、HR-MS、IR确证,理化数据见表 1、2。
| Table 1 The 1H NMR data of 10a−10d,11a,12a,13a−13h,14a,15a |
| Table 2 Physical property of compounds 10a−10d,11a,12a,13a−13h,14a,15a |
新化合物的体外AChE抑制活性实验表明,制备的10个化合物中有7个化合物具有一定的体外AChE抑制活性 (表 3)。其中13c表现出较好的AChE抑制活性,其IC50 = 0.15 μmol·L−1,其活性高于先导化合物I和对照药利斯的明。
| Table 3 Inhibition of AChE activity by target compounds |
从新化合物的活性数据可以发现不同官能团与生物活性的部分相互关系如下: 在C处 (图 1中的 化合物II),所连接二级胺为四氢吡咯和哌啶时所合成化合物表现出较好的抑制活性,并且二级胺为哌啶时的活性比四氢吡咯活性高 (13c > 13d); 当二级胺为二甲胺、吗啉、N-甲基哌嗪时,所得化合物体外AChE抑制活性IC50值均大于1×10−4 mol·L−1,活性 较弱。在A1处,吡啶环上不同的取代位置对化合物活性的影响: 当噻唑环在吡啶2位时所得化合物活 性要比其他取代位置的化合物对体外AChE抑制活性好,如化合物IC50值14a、15a > 13c。在B1处,连接碳链长度对化合物活性的影响: 当 (CH2)n官能团中n = 2比n = 1时所合成的化合物活性明显增强,如化合物IC50值13f (n = 1) > 13c (n = 2); 当碳链进一步延长时,化合物的活性并未增强,反而降低,如化合物IC50值13h (n = 3)、13g (n = 4) > 13c (n = 2)。由此推测当碳链为两个亚甲基时化合物的体外AChE抑制活性最高。
从具有较好活性的化合物13c、14a、15a的脂水分配系数 (clogP) 计算值可以看出它们都具有透过血脑屏障发挥治疗AD作用的能力。
3 体外BuChE抑制活性本文对乙酰胆碱酯酶有较高抑制活性的化合物13c、14a、15a进行了体外BuChE抑制活性测试,并与对照药利斯的明及先导化合物I进行了比对,测试结果表明: 化合物13c、14a、15a对BuChE抑制作用较弱 (表 4),表现出对乙酰胆碱酯酶较好的选择性抑制。
| Table 4 Inhibition of BuChE activity by target compounds |
合成的4-吡啶基噻唑-2-胺衍生物中大部分有一定的AChE抑制活性,其中化合物13c的生物活性最好,其IC50值达到了0.15 μmol·L−1,优于对照药物利斯的明和先导化合物I。同时,此类化合物对BuChE抑制作用较弱,表现出良好的AChE的选择性抑制。因此,4-吡啶基噻唑-2-胺衍生物对AChE的选择性抑制作用具有进一步研究意义。
实验部分所有实验材料除另作说明外,均为市售AR或CP。电鳗乙酰胆碱酯酶 (上海源叶生物科技有限公司); 利斯的明 (武汉鼎辉化工有限公司)。SGW X-4显微熔点仪测定熔点 (上海精密科学仪器有限公司,中国); 1H NMR由Bruker AVANCE 600核磁共振仪 (TMS内标) 测定; 高分辨质谱由Bruker Maxis 4G质谱仪测定; 红外光谱采用FTIR-8400S傅里叶变换红外分光光度计测定; 96孔板读取用1420 Victor酶标仪。
1 化合物合成 1.1 化合物1~9的合成 1.2 化合物10a~10d、11a、12a的合成(以10a合成为例) 分别取10 mmol化合物7、30 mmol三乙 胺和50 mL二氯甲烷加入到250 mL圆底烧瓶中。将用30 mL二氯甲烷稀释的12 mmol氯乙酰氯的溶液用恒压滴液漏斗缓慢滴加入体系,冰浴条件下反应 2 h。减压蒸干溶剂,剩余物经硅胶色谱柱 (洗脱剂为甲醇与二氯甲烷,体积比1∶100) 分离纯化得化合物10a。同法制得化合物10b~10d、11a、12a。物理和光谱数据见表 1、2。
1.3 化合物13a~13h、14a、15a的合成(以13a合成为例) 取5 mmol化合物10a、6 mmol二甲胺盐酸盐、12 mmol碳酸钾和0.5 mmol碘化钾加入到100 mL圆底烧瓶中,再加入50 mL乙腈,80 ℃回流2 h。减压旋干溶剂,剩余物用饱和碳酸氢钠溶解调节pH为8~9,二氯甲烷萃取3次,收集有机相,无水硫酸镁干燥,减压蒸干溶剂。剩余物经硅胶色谱柱(洗脱剂为甲醇与二氯甲烷,体积比1∶20) 分离纯化得化合物13a,同法制得13b~13h、14a、15a。物理和光谱数据见表 1、2。
2 体外AChE抑制实验采用Ellman分光光度法[17]在体外考察化合物对电鳗乙酰胆碱酶的抑制作用,设置空白组,分别以化合物I和利斯的明为阳性对照组进行实验。配置Tris缓冲液pH值为7.2,底物ACTI (碘化硫代乙酰胆 碱) 的浓度为0.6 mmol·L−1,显色剂DTNB的浓度为3 mmol·L−1,电鳗AChE为0.35 U·mL−1,化合物13a~13h、14a、15a配制浓度分别为1×10−4、1×10−5、1×10−6、1×10−7、1×10−8 mol·L−1。分别取20 μL Tris缓冲液、10 μL电鳗AChE、10 μL各浓度的抑制剂于96孔板中,37 ℃下保温12 min,然后加入10 μL底物ACTI和50 μL的显色剂DTNB,37 ℃保温5 min后使用1420 Victor多标计数仪在405 nm处读取每孔吸 光度。空白组用10 μL Tris缓冲液B分别代替底物 和抑制剂,标准组用10 μL Tris缓冲液代替抑制剂,每个化合物在不同浓度均实验3次。然后以抑制率I [I = 100 × (A标 − A样品) / (A标 − A空) %] 对抑制剂浓度C作图,进行S型曲线线性拟合,得到半数抑制率IC50对应的浓度Cx,为了得到准确的IC50,然后从1×10−5~1×10−9 mol·L−1中选择最接近Cx的浓度1×10−x mol·L−1,且1×10−x mol·L−1小于Cx。配制1×10−x、3×10−x、5×10−x、7×10−x、9×10−x mol·L−1,同法操作酶抑制实验,然后以抑制率I对抑制剂浓度C作图,进行直线线性拟合,求出IC50。
3 体外BuChE抑制实验取5 mL静脉人血,室温静置1 h,4 ℃放置2 h。2 000 r·min−1离心10 min,取上清液,用做BuChE酶液[18]。其实验具体操作方法与AChE酶活力测定方 法相同,将AChE活力测定中的底物碘化硫代乙酰胆碱换成碘化硫代丁酰胆碱即可。
| [1] | Ferri CP, Manfredi A, Vacchi C, et al. Global prevalence of dementia: a delphi-concensus study[J]. Lancet , 2005, 366 :2112–2117. DOI:10.1016/S0140-6736(05)67889-0 |
| [2] | Wu SM, Zhou LM. The mechanism of pathogenesis and progress in medical treatment of Alzheimer's disease[J]. Sichuan J Physiol Sci (四川生理科学杂志) , 2009, 31 :36–39. |
| [3] | Alzheimer's Association. 2015 Alzheimer's disease facts and figures[J]. Alzheimer's Dement , 2015, 11 :322. |
| [4] | Fang L, Chen Y, Zhang YH. Advances in the researches on cholinesterase inhibitors for the treatment of Alzheimer's disease[J]. Prog Pharm Sci , 2009, 33 :289–296. |
| [5] | Krall WJ, Sramek JJ, Cutler NR. Cholinesterase inhibitors: a therapeutic strategy for Alzheimer disease[J]. Ann Pharmacother , 1999, 33 :441–450. DOI:10.1345/aph.18211 |
| [6] | Rakonczay Z. Potencies and selectivities of inhibitors of acetylcholinesterase and its molecular forms in normal and Alzheimer's disease brain[J]. Acta Biol Hung , 2003, 54 :183–189. DOI:10.1556/ABiol.54.2003.2.7 |
| [7] | Giacobini E. Cholinesterase inhibitors: new roles and thera-peutic alternatives[J]. Pharmacol Res , 2004, 50 :433–440. DOI:10.1016/j.phrs.2003.11.017 |
| [8] | Ballard CG, Greig NH, Guillozet-Bongaarts AL, et al. Cholinesterases: roles in the brain during health and disease[J]. Curr Alzheimer Res , 2005, 2 :307–318. DOI:10.2174/1567205054367838 |
| [9] | Wei WL, Sun MJ. Progress in structure of human butyryl-cholinesterase[J]. Prog Biochem Biophys , 2000, 27 :37–40. |
| [10] | Taylor P. Development of acetylcholinesterase inhibitors in the therapy of Alzheimer's disease[J]. Neurologym , 1998, 51 (Suppl 1) :30–35. |
| [11] | Saiki I, Fujii H, Yoneda J, et al. Role of aminopeptidase N (CD13) in tumor-cell invasion and extracellular matrix degradation[J]. Int J Cancer , 1993, 54 :137–143. DOI:10.1002/(ISSN)1097-0215 |
| [12] | Menrad A, Speicher D, Wackker J, et al. Biochemical and functional characterization of aminopeptidase N expressed by human melanoma cells[J]. Cancer Res , 1993, 53 :1450–1455. |
| [13] | Chen H, Roques BP, Fournie-Zaluski MC. Design of the first highly potent and selective aminopeptidase N(EC 3.4.11.2) inhibitor[J]. Bioorg Med Chem Lett , 1999, 9 :1511–1516. DOI:10.1016/S0960-894X(99)00219-X |
| [14] | Ma ZY, Zhang YG, Yang Q, et al. Design, synthesis and evaluation of acetylcholinesterase inhibitors[J]. Acta Pharm Sin (药学学报) , 2014, 49 :346–351. |
| [15] | Michael PH, Sandra T, Jack UF, et al. 4-Pyridylanilinothiazoles that selectively target Von Hippel-Lindau deficient renal cell carcinoma cells by inducing autophagic cell death[J]. J Med Chem , 2010, 53 :787–797. DOI:10.1021/jm901457w |
| [16] | Cibulka R, Dvorak D, Hampl F, et al. Metallomicellar hydrolytic catalysts containing ligand surfactants drived from alkyl pryidin-2-yl ketoxime[J]. Collect Czech Chem Commun , 1997, 62 :1342–1354. DOI:10.1135/cccc19971342 |
| [17] | Ellman GL, Courtney KD, Andres V, et a1. A new and rapid colorimetric determination of acetylcholinesterase activity[J]. Biochem Pharmacol , 1961, 7 :88–95. DOI:10.1016/0006-2952(61)90145-9 |
| [18] | Song B, Li ZY, Liu YM, et al. Inhibitory effect of radix angellicae pubescentis on activities of acetylcholinesterase and butyrylcholinesterase[J]. Central South Pharm (中南药学) , 2011, 9 :721–724. |
 2016, Vol. 51
2016, Vol. 51



