2. 山西大学 化学化工学院, 山西 太原 030006 ;
3. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China ;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
衰老是机体组织、器官功能随年龄增长而发生的退行性变化,是机体各种生化反应的综合表现,是体内外许多因素 (遗传、精神紧张、心理、社会、环境污染等) 共同作用的结果,其机制涉及神经、内分泌、免疫等多方面的改变。关于衰老的理论有多种[1],包括自由基理论[2]、体细胞突变理论、端粒缩短理论等,其中自由基理论是最有代表性的衰老学说之一。
黄芩为唇形科植物黄芩 (Scutellaria baicalensis Georgi) 的干燥根,用药历史悠久,《中华人民共和国药典》记载黄芩具有“清热燥湿、泻火解毒、止血、安胎”功效。黄芩素 (baicalein) 是黄芩中含量最高的黄酮类成分之一,也是黄芩的主要活性成分。黄芩素药理作用广泛,具有抗炎、抗病毒、清除自由基[3]、抗氧化[4]、解热等作用,然而关于黄芩素是否具有抗衰老作用却鲜有报道。
本研究以果蝇 (Drosophila melanogaster) 为实验动物,考察在自然衰老模型、过氧化氢 (hydrogen peroxide,H2O2) 损伤模型和百草枯 (paraquat) 损 伤模型中,黄芩素对果蝇寿命的影响。对于多因素、多基因复杂性疾病需要干预多个靶点、多条信号通 路才能达到理想的药物治疗效果,因此本研究利用网络药理学[5]的方法寻找黄芩素抗衰老作用相关 的靶点,并对靶点进行通路富集,在此基础上检测 果蝇体内活性氧 (reactive oxygen species,ROS)、丙二醛 (malondialdehyde,MDA) 和氧化型谷胱甘肽 (oxidized glutathione,GSSG) 含量,考察黄芩素对果蝇体内氧化程度的影响。
材料与方法实验动物 W1118品系果蝇 (由山西大学应用生物学研究所提供) 在温度为25 ℃,湿度为75% 的恒温恒湿智能人工气候箱中培养。实验均选用3日内羽化的果蝇。用CO2罐将CO2吹入装有果蝇的培养瓶中,致晕后,放在通有CO2的脱脂棉上,观察果蝇个体特征,分出雌性。
药物及试剂 黄芩素购自南京景竹生物科技有限公司。GSSG、MDA检测试剂盒,购自南京建成生物制品研究所; 2',7'-二氯二氢荧光素二乙酯 (2',7'- dichlorofluorescin-diacetate,DCFH-DA),购自Sigma公司; BCA蛋白定量试剂盒,购自生工生物工程 (上海) 股份有限公司。
主要仪器 FA2004电子天平,上海良平仪器 仪表有限公司; MGC-HP人工气候箱,上海一恒科技有限公司; 果蝇培养管,北京中创宏达科技有限公 司; Infinite M200 Pro多功能酶标仪,瑞士Tecan公 司; LDZX-30KBS立式压力蒸汽灭菌器,上海申安医疗器械厂。
基础培养基的配制 玉米粉85 g,琼脂10 g,蔗糖70 g,酵母粉18 g,丙酸5 mL,蒸馏水1 000 mL。将500 mL水煮沸,将琼脂溶解在少量水中然后加入到沸水中,煮沸后,将蔗糖、玉米粉和500 mL蒸馏水搅拌均匀倒入锅中,同时不断搅拌至黏稠,加入酵母粉并搅拌均匀。停火后加入丙酸,充分搅拌。装入干净灭菌的果蝇管中,每管加入5 mL。
剂量组培养基的配制 在基础培养基的温度降到60 ℃左右,加入黄芩素,充分搅拌,配制成含不同剂量黄芩素 (0.04和0.2 mg·mL-1) 的培养基。
自然衰老实验 收集3日内羽化的雌性果蝇成虫,随机分为3组 (空白对照组、0.04 mg·mL-1黄芩素组、0.2 mg·mL-1黄芩素组),每组15管,每管约25只。在温度25 ℃、湿度75% 的恒温恒湿智能人工气候箱中培养,每隔两天更换一次相应的新鲜培养基。每天记录果蝇死亡只数,直至果蝇全部死亡。绘制果蝇生存曲线,计算果蝇的平均寿命、中位寿命和最高寿命。每组最后剩余10%.果蝇的生存天数均值计为最高寿命。
过氧化氢急性实验 收集3日内羽化的雌性果蝇成虫300只,随机分为3组 (模型组、0.04 mg·mL-1黄芩素组、0.2 mg·mL-1黄芩素组),每组100只,培养两周,饥饿2 h后,将果蝇放入干净灭菌的培养管中,培养管底部放一片圆形的滤纸,加入含有30% H2O2的6% 葡萄糖溶液50 μL[6],记录每1 h果蝇的死亡数,绘制果蝇生存曲线,计算果蝇的平均寿命、中位寿命和最高寿命。
百草枯急性实验 步骤同“过氧化氢急性实验”,用含有20 mmol·L-1百草枯的6% 葡萄糖水溶液[7]替代滤纸条沾取的H2O2溶液。
黄芩素抗衰老作用信号通路的预测 通过HIT数据库[8] (http://lifecenter.sgst.cn/hit/) 收集黄芩素已验证的靶点,并采用nAnnoLyze[9] (http://nannolyze. cnag.cat/nannolyze_web/home.html) 预测黄芩素可能作用的靶点。将这些靶点与人类衰老基因组资源库 (human ageing genomic resources database,HAGR)[10]中的衰老基因进行比对,得到黄芩素发挥抗衰老作用可能相关的靶点。运用Cytoscape软件[11]中的ClueGO[12]插件对这些靶点进行分析,挖掘黄芩素发挥抗衰老作用可能调节的信号通路。
果蝇体内氧化水平的测定 收集3日内羽化的果蝇75只,随机分为3组 (空白对照组、0.04 mg·mL-1黄芩素组、0.2 mg·mL-1黄芩素组),每组25只,培养30天。在第30天,将果蝇放入干净灭菌的培养管中,饥饿2 h后用液氮处理果蝇,按果蝇重量: 生理盐水为1∶19加入生理盐水,冰浴中匀浆,3 500 r·min-1离心15 min,取上清液备用,为5% 的组织匀浆。实验重复4~6次。ROS含量的测定[13, 14]: 取0.5% 组织 匀浆100 μL于黑色96孔板内,加入PBS 98 μL和 1 mmol·L-1 DCFH-DA溶液2 μL,混匀,37 ℃反应 15 min,激发波长485 nm,发射波长535 nm处测定其荧光强度。活性氧含量表示为荧光强度每微克蛋白。按照试剂盒说明测定蛋白含量 (BCA法)、MDA含量和GSSG含量。
数据处理 使用SPSS statistics 16.0,Excel 2013,Graphpad prism 5等软件对实验数据进行统计学分析,实验结果采用平均值±标准误 (x± SEM) 表示。黄芩素给药组与对照组间生存率比较采用Log-rank检验,最高寿命的比较应用one-way ANOVA分析。P < 0.05表示具有统计学意义。
结果 1 黄芩素对雌性果蝇寿命的影响 1.1 黄芩素对自然衰老果蝇寿命的影响对不同时期果蝇存活率进行统计分析,结果显示,前20天,各处理组的存活率并没有表现出明显差异; 20天后,与对照组相比,0.04和0.2 mg·mL-1黄芩素给药组果蝇存活率明显提高 (图 1)。如表 1所示,与对照组相比,膳食中添加0.04、0.2 mg·mL-1黄芩素可显著改善果蝇的寿命情况。其中,0.04、0.2 mg·mL-1黄芩素可分别提高平均寿命6.42% 和8.10%,且分别提高中位生存时间8.57% 和14.29%; 与对照组相比,膳食中添加0.04 mg·mL-1黄芩素可显著提高果蝇最高寿命4.15% (P < 0.05)。
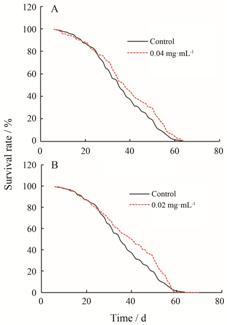
|
Figure 1 Lifespan curves of female Drosophila melanogaster fed diets supplemented with different doses (A and B) of baicalein |
| Table 1 Effects of baicalein on lifespan of female Drosophila melanogaster. P < 0.05 vs Baicalein 0 mg·mL-1 group |
H2O2损伤后,不同时间果蝇存活率的统计分析结果显示,与模型组相比,不同剂量黄芩素处理后果蝇的存活率明显提高 (图 2)。如表 2所示,与模型组相比,膳食中分别添加0.04、0.2 mg·mL-1黄芩素后果蝇平均寿命分别延长了2.8和2.2 h,延长率分别为29.17% 和22.92%; 中位生存时间延长率分别为25.0% 和30.0%; 0.2 mg·mL-1黄芩素可以显著延长最高寿命10.78% (P < 0.001)。

|
Figure 2 Different doses of baicalein (A and B) inhibits damage induced by H2O2 in female Drosophila melanogaster |
| Table 2 Effect of baicalein on H2O2-induced damage in female Drosophila melanogaster. n = 100,x± SEM. ***P < 0.001 vs baicalein 0 mg·mL-1 group |
百草枯损伤后,不同时间果蝇存活率的统计分析结果显示,与模型组相比,不同剂量黄芩素处理后果蝇的存活率明显提高 (图 3)。如表 3所示,与模型组相比,膳食中分别添加0.04、0.2 mg·mL-1黄芩素后果蝇平均寿命均延长了2.3 h,延长率均为15.23%; 中位生存时间延长率均为16.67%; 与模型组相比,膳食中分别添加0.04、0.2 mg·mL-1黄芩素可分别显著提高果蝇最高寿命8.09% 和13.62% (P < 0.001)。
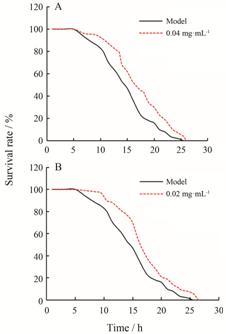
|
Figure 3 Different doses of baicalein (A and B) inhibits damage induced by paraquat in female Drosophila melanogaster |
| Table 3 Effect of baicalein on paraquat-induced damage in female Drosophila melanogaster. n = 100,x± SEM. ***P < 0.001 vs baicalein 0 mg·mL-1 group |
应用HIT数据库挖掘和nAnnoLyze预测得到31个黄芩素抗衰老相关靶点,黄芩素的作用靶点分布于不同的信号通路,相互协调、共同调节黄芩素抗衰老的作用机制,通过ClueGO进行靶点通路富集,共得到15条信号通路,其中与氧化应激相关的4条信号通路: 细胞对氧化应激的应答 (cellular response to oxidative stress)、细胞对氧含量的应答 (cellular response to oxygen levels)、活性氧代谢过程的正向调节 (positive regulation of reactive oxygen species metabolic process) 和活性氧代谢过程的调节 (regulation of reactive oxygen species metabolic process) 所占比例为33.2%。4条信号通路共作用于28个靶点,涵盖了黄芩素作用的大多数衰老靶点 (图 4)。

|
Figure 4 The putative targets-pathways network. (▲ ) targets (■) pathways |
与对照组相比,不同黄芩素剂量组均能显著降低果蝇体内ROS的含量 (P < 0.01),其中0.2 mg·mL-1黄芩素组能使ROS含量下降31.67% (图 5A); 不同黄芩素剂量组均能降低果蝇体内脂质过氧化物MDA的含量,其中0.04 mg·mL-1黄芩素剂量组能显著降低MDA的含量 (P < 0.05) (图 5B); 不同黄芩素剂量组均能显著降低果蝇体内GSSG的含量 (P < 0.05) (图 5C)。
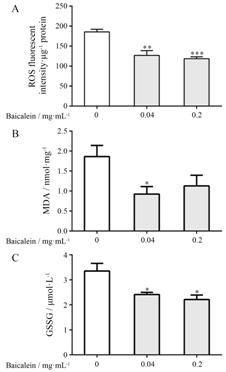
|
Figure 5 Effects of baicalein on reactive oxygen species (ROS) level (A),malondialdehyde (MDA) level (B),and oxidized glutathione (GSSG) level (C) in female flies. n = 4-6, x± SEM. P < 0.05,**P < 0.01,***P < 0.001 vs control group |
果蝇由于生存期短、繁殖力强、饲养简便、基因组简单并且与人类基因同源性高[15, 16]等特点,成为抗衰老研究较为理想的模式动物。目前用于研究衰 老的果蝇模型有自然衰老模型、过氧化氢或百草枯 损伤模型、高脂损伤模型以及转基因模型等。目前姜黄素[17]、小檗碱[18]、白藜芦醇[19]等药物的抗衰老作用都在模式生物果蝇体内进行了研究。
前期研究结果表明,黄芩素能显著提高自然衰老模型雄性果蝇的寿命[20]。本研究结果表明,黄芩素不仅能延长自然衰老模型雌性果蝇的平均寿命及最高寿命,同时在急性氧化损伤模型上也表现出显著的效果。H2O2是一种活性氧,在某些金属离子存在 的情况下可以产生羟基自由基 (•OH)[21],而羟基自由基是活性最强的自由基,可与活细胞中所有的功能性生物大分子起反应,导致其产生功能性衰退,从而对机体造成氧化损伤。过量自由基诱导果蝇产生急性氧化应激损伤。本研究结果表明,黄芩素可以有效减弱H2O2引起的急性氧化应激损伤,从而延长雌性果蝇的寿命。百草枯具有较强毒性,它能够通过机体的代谢反应产生超氧阴离子自由基 (O2-·)[22],进而造成机体的氧化损伤。黄芩素可以有效减弱百草枯引起的急性氧化应激损伤,从而延长该模型中果蝇的寿命。
本研究应用HIT数据库和nAnnoLyze发现31个黄芩素抗衰老相关靶点,对黄芩素作用的31个靶点进行ClueGO分析,借助网络药理学的方法对黄芩素抗衰老作用机制进行探讨,发现其多靶点、多通路作用特点。ClueGO分析结果表明,黄芩素主要通过作用于氧化应激通路发挥抗衰老作用。自由基理论认为,生物体经过正常的代谢,会产生大量的ROS,ROS是含有氧分子的自由基,包括羟基,过氧化氢,超氧阴离子等。黄芩素能抑制ROS生成,并降低果蝇体内MDA、GSSG的含量,表明黄芩素具有强的清除自 由基的能力,并能降低体内的氧化程度。Havermann等[23]也发现黄芩素可以通过激活氧化应激相关的Nrf2/SKN-1通路延长线虫的寿命。
综上所述,黄芩素能够延长自然衰老模型、H2O2损伤模型和百草枯损伤模型果蝇的寿命,其机制可能是通过抑制ROS生成,降低果蝇体内MDA、GSSG的含量而实现的。然而,本研究仅考察了黄芩素对果蝇体内氧化应激水平的影响,并没有考察黄芩素对这31个靶点的直接作用,其具体的分子机制还需进行深入研究。
| [1] | López-Otín C, Blasco MA, Partridge L, et al. The hallmarks of aging[J]. Cell , 2013, 53 :1194–1217. |
| [2] | Harman D. About "Origin and evolution of the free radical theory of aging: a brief personal history, 1954-2009"[J]. Biogerontology , 2009, 10 :783. DOI:10.1007/s10522-009-9253-z |
| [3] | Hamada H, Hiramatsu M, Edamatsu R, et al. Free radical scavenging action of baicalein[J]. Arch Biochem Biophys , 1993, 306 :261–266. DOI:10.1006/abbi.1993.1509 |
| [4] | Kang KA, Zhang R, Piao MJ, et al. Baicalein inhibits oxidative stress-induced cellular damage via antioxidant effects[J]. Toxicol Ind Health , 2012, 28 :412–421. DOI:10.1177/0748233711413799 |
| [5] | Hopkins AL. Network pharmacology: the next paradigm in drug discovery[J]. Nat Chem Biol , 2008, 4 :682–690. DOI:10.1038/nchembio.118 |
| [6] | Peng C, Zuo Y, Kwan KM, et al. Blueberry extract prolongs lifespan of Drosophila melanogaster[J]. Exp Gerontol , 2012, 47 :170–178. DOI:10.1016/j.exger.2011.12.001 |
| [7] | Jimenez-Del-Rio M, Guzman-Martinez C, Velez-Pardo C. The effects of polyphenols on survival and locomotor activity in Drosophila melanogaster exposed to iron and paraquat[J]. Neurochem Res , 2010, 35 :227–238. DOI:10.1007/s11064-009-0046-1 |
| [8] | Ye H, Ye L, Kang H, et al. HIT: linking herbal active ingredients to targets[J]. Nucleic Acids Res , 2011, 39 :D1055–1059. DOI:10.1093/nar/gkq1165 |
| [9] | Martinez-Jimenez F, Marti-Renom MA. Ligand-target prediction by structural network biology using nAnnoLyze[J]. PLoS Comput Biol , 2015, 11 :e1004157. DOI:10.1371/journal.pcbi.1004157 |
| [10] | Tacutu R, Craig T, Budovsky A, et al. Human ageing genomic resources: integrated databases and tools for the biology and genetics of ageing[J]. Nucleic Acids Res , 2013, 41 :D1027–1033. DOI:10.1093/nar/gks1155 |
| [11] | Smoot ME, Ono K, Ruscheinski J, et al. Cytoscape 2.8: new features for data integration and network visualization[J]. Bioinformatics , 2011, 27 :431–432. DOI:10.1093/bioinformatics/btq675 |
| [12] | Bindea G, Mlecnik B, Hackl H, et al. ClueGO: a cytoscape plug-in to decipher functionally grouped gene ontology and pathway annotation networks[J]. Bioinformatics , 2009, 25 :1091–1093. DOI:10.1093/bioinformatics/btp101 |
| [13] | Pandey A, Vimal D, Chandra S, et al. Long-term dietary exposure to low concentration of dichloroacetic acid promoted longevity and attenuated cellular and functional declines in aged Drosophila melanogaster[J]. Age (Dordr) , 2014, 36 :9628. DOI:10.1007/s11357-014-9628-1 |
| [14] | Zhao HW, Zhou D, Haddad GG. Antimicrobial peptides increase tolerance to oxidant stress in Drosophila melanogaster[J]. J Biol Chem , 2011, 286 :6211–6218. DOI:10.1074/jbc.M110.181206 |
| [15] | Lloyd TE, Taylor JP. Flightless flies: Drosophila models of neuromuscular disease[J]. Ann N Y Acad Sci , 2010, 1184 :e1–20. DOI:10.1111/j.1749-6632.2010.05432.x |
| [16] | Reiter LT, Potocki L, Chien S, et al. A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster[J]. Genome Res , 2001, 11 :1114–1125. DOI:10.1101/gr.169101 |
| [17] | Shen LR, Xiao F, Yuan P, et al. Curcumin-supplemented diets increase superoxide dismutase activity and mean lifespan in Drosophila[J]. Age (Dordr) , 2013, 35 :1133–1142. |
| [18] | Navrotskaya VV, Oxenkrug G, Vorobyova LI, et al. Berberine prolongs life span and stimulates locomotor activity of Drosophila melanogaster[J]. Am J Plant Sci , 2012, 3 :1037–1040. DOI:10.4236/ajps.2012.327123 |
| [19] | Wang C, Wheeler CT, Alberico T, et al. The effect of resveratrol on lifespan depends on both gender and dietary nutrient composition in Drosophila melanogaster[J]. Age (Dordr) , 2013, 35 :69–81. DOI:10.1007/s11357-011-9332-3 |
| [20] | Gao L, Duan DD, Zhang JQ, et al. A bioinformatic approach for the discovery of antiaging effects of baicalein from Scutellaria baicalensis Georgi[J]. Rejuvenation Res , 2016 . DOI:10.1089/rej.2015.1760. |
| [21] | Desagher S, Glowinski J, Premont J. Pyruvate protects neurons against hydrogen peroxide-induced toxicity[J]. J Neurosci , 1997, 17 :9060–9067. |
| [22] | Dinis-Oliveira RJ, Remiao F, Carmo H, et al. Paraquat exposure as an etiological factor of Parkinson's disease[J]. Neurotoxicology , 2006, 27 :1110–1122. DOI:10.1016/j.neuro.2006.05.012 |
| [23] | Havermann S, Rohrig R, Chovolou Y, et al. Molecular effects of baicalein in Hct116 cells and Caenorhabditis elegans: activation of the Nrf2 signaling pathway and prolongation of lifespan[J]. J Agric Food Chem , 2013, 61 :2158–2164. DOI:10.1021/jf304553g |
 2016, Vol. 51
2016, Vol. 51


