2. 浙江大学附属第二医院, 浙江 杭州 310009 ;
3. 江苏大学药学院, 江苏 镇江 212013
2. Second Affiliated Hospital of Zhejiang University, Hangzhou 310009, China ;
3. College of Pharmaceutical Sciences, Jiangsu University, Zhenjiang 212013, China
光动力治疗(photodynamic therapy,PDT) 作为一种新型的治疗技术,是指联合利用光及特殊药物 (光敏剂) 用于病变细胞及组织治疗的一种方法。在光照射下,光敏剂产生具有细胞毒性的活性氧簇 (reactive oxygen species,ROS),从而杀伤病变细胞[1],达到治疗目的。所使用的光敏剂应具有良好的活性 氧产率,包括有机光敏剂和无机光敏剂。前者具有良好的生物相容性,但在光稳定性方面存在一定缺陷; 后者具有良好的光稳定性,同时具有更广的吸收波段、更窄的发射波长、更高的激发效率及更好的体 内稳定性[2-3],近年来成为研究热点。TiO2作为一种无毒着色剂,广泛应用于光催化、光降解等领域,其在生物领域特别是抗肿瘤治疗领域的应用逐渐受到重视,针对不同肿瘤细胞的研究已经开展,包括宫颈癌细胞 (HeLa)[4]、膀胱癌细胞 (T24)[5]、结肠癌细胞 (Ls-174-t)[6]、乳腺上皮癌细胞 (MCF-7)[7]和神经胶质瘤细胞 (U87)[8]等。
由于肿瘤细胞的多药耐药性,单纯使用一种治疗方法很难完全抑制肿瘤组织的生长。多种治疗方法的联合应用,成为提高肿瘤治疗效果的重要手段,包括放疗-化疗、热疗-化疗等,由于放疗的不良反应较大,临床应用受到一定限制。PDT为局部特异性治疗,具有治疗效果好、毒副作用小的特点,开展PDT与化疗的联合应用研究,将为肿瘤的治疗提供新的思路。本文构建了Fe3O4-TiO2纳米粒,对其进行了相关表征,并开展了载药及释放实验,同时考察了PDT-化疗联合治疗效果,以期为该新型治疗方法的应用提供一定的研究基础。
材料与方法药品与试药 六水合三氯化铁 (FeCl3·6H2O)、乙二醇 (EG)、无水乙醇、柠檬酸三钠、三水合醋酸钠 (NaAc·3H2O)、钛酸四丁酯 (TBOT) (国药化学试剂有限公司); 盐酸多柔比星 (DOX,北京华奉联博科技有限公司); 人口腔表皮样癌细胞 (KB,中国科学院上海生化与细胞研究所); 四甲基氮唑蓝 (MTT,上海普飞生物技术有限公司); 其他试剂均为分析纯。
仪器 UVA灯管 (上海荣波照明电器有限公司); 紫外-可见分光光度仪 (北京普析通用仪器有限公司); 透射电子显微镜 (TEM,JEM-1200EX,日本电子株式会社); 酶标仪 (Thermo MK3,美国赛默飞世尔科技公司); 纳米粒径仪 (马尔文ZS90,英国马尔文仪器有限公司); 激光共聚焦显微镜 (Zeiss LSM710,德国Zeiss公司)。
Fe3O4纳米粒的制备 取FeCl3·6H2O0.675 g、柠檬酸三钠0.20 g溶于35 mL乙二醇 (EG) 中,待 完全溶解后,加入NaAc 1.93 g,加热至170 ℃并强力搅拌1 h,然后转移至带聚四氟乙烯内胆的高压反应釜中,200 ℃反应16h后,自然冷却至室温,利用外加磁场收集黑色沉淀,并用乙醇和去离子水洗涤数遍,备用。
Fe3O4-TiO2纳米粒的制备 采用溶胶-凝胶法,通过钛酸四丁酯水解制备Fe3O4-TiO2纳米粒。取制备的Fe3O4纳米粒30 mg分散于120 mL溶剂中 (乙醇90mL、乙腈30 mL),加入浓氨水 (28%) 0.5 mL,超声15 min,然后在搅拌下缓慢滴加钛酸四丁酯0.5 mL,反应1.5 h后利用磁铁收集分离产物,并用乙醇洗涤数次。
Fe3O4-TiO2纳米粒的表征 纳米粒的形态应用TEM进行观察,使用Formar为支撑膜的铜网,将适宜浓度的样品滴加到铜网表面,晾干后进行观察,电压为120 kV。将样品分散于水中,制备成适宜浓度的混悬液,利用纳米粒径仪测定纳米粒的粒径。
DOX的负载取Fe3O4-TiO2纳米粒混悬液 (400 μg·mL-1) 10 mL分别加入10 mL不同浓度的DOX溶液(31.5、63、94.5、126和189 μg·mL-1),室温下搅拌24 h,11 000 r·min-1离心10min后收集载药纳米粒,沉淀用磷酸盐缓冲液 (PBS) 洗涤数次直至上清液变成无色。收集合并上清液,利用紫外-可见分光光度计测定吸光度值,并计算载药量。
DOX的体外释放研究 精密称取Fe3O4-TiO2- DOX纳米粒适量,分别分散于2 mL的pH 5.0、pH 7.4介质中,在37 ℃下恒温振荡 (100 r·min-1)一定时间 (1、2、4、6、8、10和12 h) 后,11 000 r·min-1离心10min,取出上清液,同时补充新鲜释放介质,上清液于488 nm测定吸收度值,计算累积释放百分率。
细胞摄取研究 取对数生长期的KB细胞,按照细胞数约1×105个/孔接种于6孔培养板中,培养板中预置20 mm盖玻片,在37 ℃、5% CO2培养24h后,加入Fe3O4-TiO2-DOX或DOX的PBS溶液,使得DOX终质量浓度约为10 μg·mL-1,一定时间后吸去培养液,PBS洗涤3次,加入Hoechst染色15 min,再用PBS洗涤3次,加4% 多聚甲醛固定30 min,PBS洗涤后用激光共聚焦显微镜观察。
细胞毒性研究 采用MTT法考察Fe3O4-TiO2的细胞毒性,取对数生长期的KB细胞,按照细胞数4×103个/孔种入96孔培养板中,置于37 ℃、5% CO2条件下孵育24 h,待细胞完全贴壁后,每孔加入不同浓度的空白载体的PBS溶液,使得最终质量浓度为20、50、100、200、500和1 000 μg·mL-1,继续孵育24 h后,加入MTT溶液继续培养4 h,吸出上清液,加入二甲基亚砜 (DMSO) 200 μL,15 min后用酶标仪检测各孔在570 nm处的吸收度值 (A)。
PDT-化疗联合治疗效果研究 将KB细胞按4×103个/孔种入96孔中,培养24 h后加入Fe3O4-TiO2-DOX、DOX的PBS溶液,使得DOX质量浓度为20 μg·mL-1,6 h后吸出,并用PBS洗涤3次,采用紫外灯 (5 mW·cm-2) 照射20 min后,继续培养24 h,以未照射的样品作为对照,采用MTT法测定细胞存活率。
结果与讨论 1 Fe3O4-TiO2纳米粒的表征利用TEM对所制备的磁性Fe3O4及Fe3O4-TiO2纳米粒的形态进行表征。如图 1所示,Fe3O4外观呈 类球形、粒径均一、分散良好和无明显团聚现象。从图中可见,所制备的纳米粒Fe3O4-TiO2具有明显的核壳结构,且无团聚现象,外层TiO2厚度约为80 nm。粒径分布结果表明 (图 2),Fe3O4纳米粒的平均粒径约为181 nm,呈正态分布,多分散性指数 (PDI) 为0.067,表明粒径分布较窄,粒径均一。Fe3O4-TiO2的平均粒径约为365 nm,再次证明TiO2成功包裹于Fe3O4纳米粒表面,其厚度约为90 nm,与TEM结果基本一致。

|
Figure 1 Transmission electron microscopy (TEM) image of Fe3O4 (a) and Fe3O4-TiO2 (b) |

|
Figure 2 Particle size distribution of Fe3O4 and Fe3O4-TiO2 |
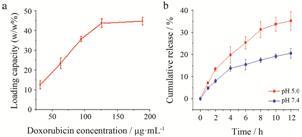
为了优化DOX的负载浓度,将Fe3O4-TiO2与不同浓度DOX孵育,考察DOX浓度对载药量的影响。从图 3a中可以看出,随着药物浓度的增加,载药量呈非线性增加,当DOX质量浓度超过126μg·mL-1时,载药量基本不再增加,因此优选126 μg·mL-1作为DOX负载浓度。在此浓度条件下,DOX载药量达到约43%,说明Fe3O4-TiO2对DOX具有良好的亲和力。
Fe3O4-TiO2-DOX的释放曲线见图 3b,从图中看出,在低pH条件下,药物释放速率加快,这主要是由于酸性条件下DOX以解离状态存在,溶解度较高; 当pH较高时,DOX疏水性增加,其与Fe3O4-TiO2之间的疏水作用随之增加,因此释放速率减慢[9]。由于在肿瘤细胞外环境及溶酶体中pH较低,因此具有pH敏感释放的载体将有利于实现DOX在肿瘤部位的突释,从而产生更强的抗肿瘤作用。
|
Figure 3 Drug loading and release. a: Quantification of doxorubicin (DOX) loading at different DOX concentrations. b: DOX release from Fe3O4-TiO2 over time in buffers at two pH values. Error bars were based on standard deviations of triplicated samples |
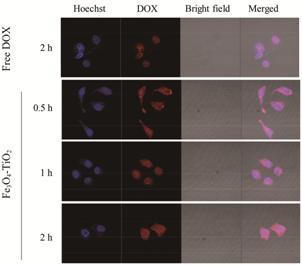
为了研究载体在细胞内的分布及胞内释药情况,考察了Fe3O4-TiO2-DOX在KB细胞中的摄取情况,结果见图 4。从图中可以看出,孵育2 h后,DOX主要分布于细胞核中,细胞质中基本观察不到DOX荧光,说明游离DOX对细胞核具有良好的亲和性。从Fe3O4- TiO2-DOX的摄取图中可以看到,与DOX的摄取相比,Fe3O4-TiO2分布于整个细胞,说明Fe3O4-TiO2-DOX可被KB细胞有效摄取,并且其摄取具有时间依赖性。在0.5 h时,细胞核中荧光较弱,随着孵育时间延长,细胞核中荧光逐渐增强,这可能是由于DOX开始释放进入细胞核的原因。
|
Figure 4 Fluorescence visualization of DOX intracellular accumulation. KB cells were incubated with free DOX or Fe3O4-TiO2-DOX for 0.5,1 and 2 h. Scale bars correspond to 20 μm |
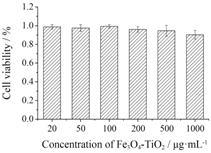
为考察空白载体的细胞毒性,将不同浓度的载体与KB细胞孵育24 h后,测定细胞存活率,结果见图 5。各浓度空白纳米粒处理的细胞存活率均超过85%,当浓度高达1 000 μg·mL-1时,细胞存活率仍未见明显下降。根据细胞相对增殖率 (存活率) 与细胞毒性分级关系可知[10],各浓度下纳米粒对KB细胞的细胞毒性均为1级,表明Fe3O4-TiO2具有较低的细胞毒性。
|
Figure 5 Cell viability curves of KB cells incubated with different concentrations of Fe3O4-TiO2 nanoparticles for 24 h |
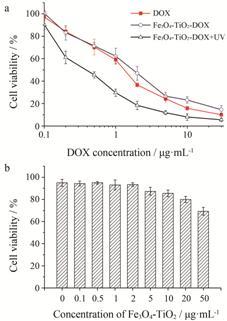
为评价光动力治疗与化疗联合应用的治疗效 果,分别考察DOX、Fe3O4-TiO2-DOX和Fe3O4-TiO2-DOX+UV对KB存活率的影响。由图 6a可以看出,3组均表现出明显的剂量依赖性毒性。Fe3O4-TiO2-DOX组较DOX组毒性稍弱,可能是由于在Fe3O4-TiO2-DOX组中,DOX需要释放出来并扩散到细胞后才能产生毒性,因此较DOX组毒性稍弱。在联合治疗组,细胞存活率较其他两组显著下降,表明PDT可增加化疗药物的作用。图 6b显示,在单纯UV照射及低浓度空白纳米粒组未表现出明显毒性,当浓度增加时,表现出一定的细胞毒性,说明治疗效果由PDT与化疗共同产生,同时也说明PDT与化疗具有潜在的联合应用前景,为PDT与化疗的联合应用提供了思路。
|
Figure 6 Cell viability after incubated with free DOX and Fe3O4-TiO2-DOX with or without UV (a). Cell viability after incubated with Fe3O4-TiO2 with UV (b) |
本文首先采用水热法合成粒径均一的磁性Fe3O4纳米粒, 平均粒径约为181 nm,再通过溶胶-凝胶法包裹TiO2,制备具有核壳结构的Fe3O4-TiO2,粒径 约为365 nm,该纳米粒具有良好的生物相容性及较高的载药性能,载药量可达43%。体外释放结果表明,Fe3O4-TiO2-DOX的体外释放具有pH敏感性。在酸 性条件下,DOX释放较快,在正常生理pH下释放缓慢,这种释放特性有利于促进药物在肿瘤酸性微环境下快速释放,从而提高杀伤效果,同时减少药物对正常组织的损伤。
从实验结果可以看出,PDT与化疗联合应用显示出良好的协同作用,这可能是由于DOX杀伤肿瘤细胞的主要机制为通过氧化作用损伤肿瘤细胞的脱氧核糖核酸 (DNA),从而诱导细胞凋亡[11],而PDT主要是通过产生强氧化性的ROS产生作用,因此两者可同时对肿瘤细胞DNA产生破坏作用,进而产生协同效果。本文通过对PDT与化疗联合应用的考察,为后期两者联合应用的深入研究提供了一定的理论基础。
| [1] | Deng CY, Long YY, Liu X, et al. Construction of biotinmodified polymeric micelles for pancreatic cancer targeted photodynamic therapy[J]. Acta Pharm Sin (药学学报) , 2015, 50 :1038–1044. |
| [2] | Resch-Genger U, Grabolle M, Cavaliere-Jaricot S, et al. Quantum dots versus organic dyes as fluorescent labels[J]. Nat Methods , 2008, 5 :763–775. DOI:10.1038/nmeth.1248 |
| [3] | Yaghini E, Seifalian AM, MacRobert AJ. Quantum dots and their potential biomedical applications in photosensitization for photodynamic therapy[J]. Nanomedicine , 2009, 4 :353–363. DOI:10.2217/nnm.09.9 |
| [4] | Cai RX, Kubota Y, Shuin T, et al. Induction of cytotoxicity by photoexcited TiO2 particles[J]. Cancer Res , 1992, 52 :2346–2348. |
| [5] | Kubota Y, Shuin T, Kawasaki C, et al. Photokilling of T-24 human bladder cancer cells with titanium dioxide[J]. Brit J Cancer , 1994, 70 :1107–1111. DOI:10.1038/bjc.1994.456 |
| [6] | Zhang AP, Sun YP. Photocatalytic killing effect of TiO2 nanoparticles on Ls-174-t human colon carcinoma cells[J]. Wo rld J Gastroenterol , 2004, 10 :3191–3193. DOI:10.3748/wjg.v10.i21.3191 |
| [7] | Yang J, Dai J, Chen C, et al. Effects of hydroxyl radicals and oxygen species on the 4-chlorophenol degradation by photoelectrocatalytic reactions with TiO2-film electrodes[J]. J Photochem Photobiol A , 2009, 208 :66–77. DOI:10.1016/j.jphotochem.2009.08.007 |
| [8] | Wang C, Cao S, Tie X, et al. Induction of cytotoxicity by photoexcitation of TiO2 can prolong survival in glioma-bearing mice[J]. Mol Biol Rep , 2011, 38 :523–530. DOI:10.1007/s11033-010-0136-9 |
| [9] | Shen S, Wu L, Wang CR, et al. Preparation and in vitro evaluation of doxorubicin-loaded magnetic iron oxide nanoparticles[J]. Acta Pharm Sin (药学学报) , 2013, 48 :1844–1849. |
| [10] | Lavasanifar A, Samuel J, Kwon GS. Poly (ethylene oxide)-block-poly (L-amino acid) micelles for drug delivery[J]. Adv Drug Deliv Rev , 2002, 54 :169–190. DOI:10.1016/S0169-409X(02)00015-7 |
| [11] | Mizutani H, Tada-Oikawa S, Hiraku Y, et al. Mechanism of apoptosis induced by doxorubicin through the generation of hydrogen peroxide[J]. Life Sci , 2005, 76 :1439–1453. DOI:10.1016/j.lfs.2004.05.040 |
 2016, Vol. 51
2016, Vol. 51


