2. 西南大学-西藏农牧学院药用植物联合研发中心, 重庆 400715 ;
3. 西藏大学农牧学院药用植物研究中心, 西藏 林芝 860000 ;
4. 西南大学药学院, 重庆 400715
2. SWU-TAAHC Medicinal Plant Joint R & D Centre, Chongqing 400715, China ;
3. Medicinal Plants Research Centre, Agriculture and Animal Husbandry College, Tibet University, Nyingchi 860000, China ;
4. College of Pharmaceutical Sciences, Southwest University, Chongqing 400715, China
青蒿素 (artemisinin) 是从青蒿 (Artemisia annua L.) 中提取的一种具有独特过氧桥结构的倍半萜内酯。青蒿素联合疗法 (artemisinin-based combination therapies,ACTs) 是世界卫生组织推荐治疗疟疾的首选方法[1],这使得青蒿素的商业需求量巨大。然而,由于青蒿中青蒿素含量很低 (约0.01%~0.8%),无法满足青蒿素的大量商业需求。青蒿素分子结构较为复杂,很难采用全化学合成的方法生产青蒿素[2]。2013年,Paddon等[3]在《Nature》发表了其团队的研究成果,在酵母中重建青蒿素的生物合成途径,并利用发酵工程技术能够大幅提高青蒿酸的含量,然后利用化学合成生产青蒿素。这种方法虽然能够合成青蒿素,但是其生产成本依然较高,难以满足市场需求。因 此,寻求新的方法提高青蒿中青蒿素的含量具有重大意义。随着青蒿素生物合成途径相关研究的深入,利用代谢工程技术提高青蒿素含量是最为有效的方法。青蒿素生物合成的基本前体物质为异戊烯焦磷酸 (isopentenyl diphosphate,IPP) 和其同分异构体二甲基烯丙基焦磷酸 (dimethylallyl diphosphate,DMAPP)。IPP和DMAPP合成来自位于细胞质的甲羟戊酸 (mevalonate,MVA) 途径和位于质体的MEP (2-C- methyl-D-erythritol-4-phosphate,MEP)途径[4]。在青蒿中,MVA和MEP途径都为青蒿素生物合成提供基本前体。目前,青蒿素生物合成下游途径相关基因都已经报道,但关于MEP途径的相关基因研究十分薄弱。
2-C-甲基-D-赤藓醇-4-磷酸胱氨酰转移酶 (2- C-methyl-D-erythritol 4-phosphate cytidylyltransferase,MCT) 是MEP途径的第3个关键酶,催化2-C-甲基- D-赤藓醇-4-磷酸 (2-C-methyl-D-erythritol-4-phosphate,MEP) 生成4 -(5'-焦磷酸胞苷)-2-C-甲基-D-赤藓醇 [4- (cytidine 5'-diphospho)-2-C-methyl-D-erythritol,CDP- ME]。本研究以青蒿为材料,首次从青蒿中克隆了MCT基因 (AaMCT) 并进行了生物信息学分析,研究了AaMCT基因组织表达和诱导表达情况; 确定了AaMCT的亚细胞定位; 最后在拟南芥中超量表达AaMCT,考察其对相关代谢产物合成的影响。AaMCT基因克隆和功能研究有助于阐明MEP途径在青蒿素生物合成中的作用并为基于MEP途径实现青蒿素代谢工程提供候选功能基因。
材料与方法材料 青蒿、拟南芥和烟草种子,由本实验室保存并萌发成为实生苗。MeJA处理青蒿的方法参照Wang等[5]的方法。青蒿分泌型腺体分离参照Teoh 等[6]的方法。
RNA提取及 cDNA合成 取适量青蒿材料在液氮中研磨,按照植物RNA提取试剂盒说明书提取RNA。使用3',5' RACE试剂盒反转录获得cDNA,用于基因克隆。
基因克隆 根据AaMCT基因EST (EY033242) 序列,分别设计5' RACE引物和3' RACE引物。按 照RACE试剂盒说明书开展RACE。将所得到的3' RACE、5' RACE序列和AaMCT的EST序列在Vector NTI 8.0软件中拼接,即获得AaMCT全长cDNA的电子拼接全长。根据电子拼接全长设计两条特异性引物扩增AaMCT物理全长序列。本研究所有引物见表 1。
| Table 1 Primers used in this study |
生物信息学分析 用Vector NTI Suite 8.0软件查找编码区并进行翻译,然后对所得氨基酸序列进行相似性和一致性分析; 用CLUXTALX进行多重序列比对,并借助于MEGA4.1软件采用邻位相联法 (Neighbor-joining,NJ) 构建进化树; 使用Expasy网站对蛋白质的理化性质进行预测及分析; PBIL网站预测二级结构; NCBI上预测保守结构域; ChloroP 1.1 Prediction Server进行转运肽分析。
基因表达量检测 使用iScriptTM cDNA Synthesis Kit试剂盒将青蒿各组织 (根、茎、叶、花、分泌型腺体) 和MeJA处理的青蒿材料的RNA进行反转录,得到cDNA,作为荧光定量PCR检测的模板。以GAPDH和UBQ作为内参[7]。
亚细胞定位 将AaMCT编码区连接至p1300- GFP载体上GFP的N端。重组质粒p1300-AaMCT- GFP,并将其转入农杆菌中,获得工程菌。然后将工程菌瞬时转化烟草[8]。弱光培养48 h后拍照。
植物表达载体构建和叶绿素 a 、叶绿素 b 、类胡萝卜素的测定将AaMCT编码区连接至pHB载体 中,得到重组质粒pHB-AaMCT,并将其转入农杆菌中,获得工程菌。用蘸花法转化拟南芥[9]。基因组 PCR用于确认T1和T2代转基因拟南芥。按照Marr方法[10]测定2周大小T2代转基因拟南芥叶绿素a、叶绿素b和类胡萝卜素含量。
结果 1 AaMCT基因克隆和生物信息学分析AaMCT的cDNA全长为1 176 bp (GenBank登录号: KU365210),包含906 bp编码区,101 bp 5' UTR,169 bp 3' UTR,polyA长度为18 bp,编码302个氨基酸 (图 1A)。AaMCT蛋白质,预测分子质量为33.5 kD,等电点为7.66。结构域预测表明AaMCT含有CDP- ME合成酶特征性结构域,属于糖基转移酶GTA型超家族。二级结构预测,表明AaMCT有20.86% α螺旋、30.13% 延伸链、11.59% β-折叠和37.42%无规则卷曲。亚细胞定位预测AaMCT定位于叶绿体中,与MEP途径定位于质体吻合。序列相似性分析结果表明,AaMCT与其他植物MCTs氨基酸序列具有较 高相似性。如与甜叶菊MCT相似性为81.1%,一致性为76.0%; 与长春花MCT相似性为75.5%,一致性 为69.2%; 与拟南芥MCT相似性为74.8%,一致性为67.0%。AaMCT与其他植物MCT在氨基酸序列上较高相似性表明,该基因就是青蒿MCT。分子系统树 构建结果表明,植物MCT分为裸子植物和被子植物两个类群,AaMCT属于被子植物类群和同科植物甜叶菊MCT亲缘关系最近。进化树上的距离与其所属类别的亲缘关系基本一致 (图 1B)。
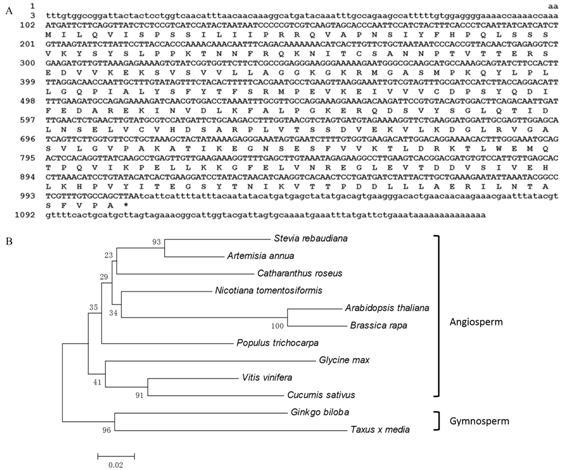
|
Figure 1 A: The full-length cDNA sequence of the AaMCT gene from Artemisia annua. The coding sequence and the amino acid sequence were shown by capital letters; the stop codon was marked with a star; the untranslated regions were shown by small letters. B: A phylogenetic tree of MCT from different organisms constructed by neighbor-joining method on MEGA 4.1. GenBank accession numbers are as follows: Stevia rebaudiana,ABB88837.2; Catharanthus roseus,ACI16377.1; Nicotiana tomentosiformis,XP_009607716.1; Arabidopsis thaliana,NP_565286.1; Brassica rapa,XP_009129141.1; Populus trichocarpa,ACD70398.1; Glycine max,XP_006600265.1; Vitis vinifera,CAN80766.1; Cucumis sativus,XP_011650586.1; Ginkgo biloba,AAZ80386.1; Taxus x media,ABU48538.1; Artemisia annua,KU365210 |
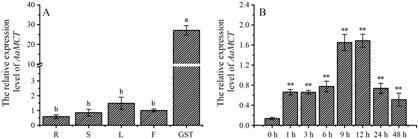
在青蒿根、茎、叶、花和分泌型腺体 (GST) 中,都能够检测到AaMCT表达,且在根、茎、叶、花中表达量无显著差异。分泌型腺体 (GST) 是青蒿素合成部位,AaMCT在该组织表达量远高于其他组织 (图 2A),为其他组织中表达量的18~47倍。青蒿素生物合成下游基因ADS、CYP71AV1、DBR2和ALDH1在GST中表达量都比较高[11]。表明在GST中MEP途径更活跃,有利于青蒿素合成。对MeJA处理后的0、1、3、6、9、12、24、48 h基因在叶片中的表达情况进行分析,结果表明,MeJA处理后,AaMCT表达量均有极显著提高 (P < 0.01),并且在9和12 h基因表达量达到最高 (图 2B),为0 h表达量的12倍。由此可见,AaMCT受MeJA诱导性表达。AaMCT和青蒿素生物合成途径中的其他结构基因的表达呈现出高度一致的组织特异性和诱导表达协同性,有利于青蒿素的生物合成。

|
Figure 2 The tissue (A) and MeJA-responsive (B) profiles of AaMCT. R: Root; S: Stem; L: Leaf; F: Flower; GST: Glandular secretory trichomes. Different letters indicate statistical differences among means by Duncan’s multiple rang test (P < 0.05). **P < 0.01 vs 0 h level |
将AaMCT蛋白融合在绿色荧光蛋白(GFP) 的N端,获得p1300-AaMCT-GFP工程菌,瞬时转化烟草叶片。结果表明,AaMCT-GFP融合蛋白在488 nm波长的激发光下GFP发出绿色荧光 (图 3A); 烟草叶片中的叶绿体在559 nm波长的激发光下自发出红色荧光 (图 3C)。将二者叠加,两种荧光能够完全重叠并呈现黄色荧光 (图 3D)。同样,将p1300-GFP工程菌瞬时转化烟草叶片作为阴性对照。结果表明,GFP在488 nm波长的激发光下发出的绿色荧光分布在细胞膜、细胞质、内质网、细胞核等位置 (图 3E),与烟草叶片中叶绿体在559 nm波长的激发光下自发的红色荧光 (图 3G) 不能重叠 (图 3H)。由此可知AaMCT编码的蛋白质定位于叶绿体中,这与在ChloroP 1.1 Prediction Server上预测AaMCT的N端转运肽定位于叶绿体中一致,也与MEP途径定位于质体的事实相符[3]。
|
Figure 3 Plastidial localization of AaMCT. A-D: Subcellular localization of the GFP protein fused with AaMCT. E-H: Subcellular localization of the GFP protein alone as control. A and E: GFP in green fluorescence; B and F: Bright-field; C and G: Chlorophyll in red fluorescence; D and H: The merged pictures of green (GFP),bright-field and red (chlorophyll fluorescence). Scale bar = 20 μm |
T2代转AaMCT拟南芥中能够同时检测到AaMCT和潮霉素筛选基因特异性片段; 野生型拟南芥中未检测到AaMCT和潮霉素筛选标记基因。在阴性对照 (转pHB质粒) 中只能检测到潮霉素筛选标记基因。PCR结果表明用于代谢产物分析的拟南芥为转AaMCT拟南芥 (图 4)。在AaMCT超量表达的拟南芥植株中叶绿素a、叶绿素b和类胡萝卜素的含量和对照相比有极显著提高 (P < 0.01) (图 5)。阴性对照拟南芥叶绿素a的含量为0.449 ± 0.014 mg·g-1,转基因拟南芥3个株系的叶绿素a含量分别为0.548 ± 0.023、0.523 ± 0.011、0.543 ± 0.009 mg·g-1,与对照相比分别提高了22.09%、16.60% 和21.05%; 阴性对照拟南芥的叶绿素b的含量为0.136 ± 0.03 mg·g-1,转基因拟南芥3个株系的叶绿素b含量分别为0.168 ± 0.04、0.160 ± 0.04和0.159 ± 0.04 mg·g-1,与对照相比分别提高了23.70%、18.00% 和17.43%; 阴性对照拟南芥的类胡萝卜素的含量为0.103 ± 0.005 mg·g-1,转基因拟南芥3个株系的类胡萝卜素含量分别为0.122 ± 0.005、0.114 ± 0.001、0.125 ± 0.002 mg·g-1,与对照相比分别提高了18.60%、11.53% 和21.45%。这3种产物含量的提高可能是由于AaMCT超量表达给叶绿素a、叶绿素b和类胡萝卜素的生物合成提供更多前体物质而引起的结果。

|
Figure 4 Electrophoresis of AaMCT and hygr genes. M: DL2000 marker; +: Positive control; -: Negative control; V1-V3: Transgenic Arabidopsis thaliana with the empty plasmid pHB; T1-T3: Transgenic Arabidopsis thaliana lines with overexpression of AaMCT |

|
Figure 5 The content of chlorophyll a,chlorophyll b and carotenoids. MCT1-MCT3: Transgenic Arabidopsis thaliana lines with overexpression of AaMCT; pHB: Transgenic Arabidopsis thaliana with the empty plasmid pHB; **P < 0.01 vs pHB |
IPP和DMAPP是包括青蒿素等倍半萜类物质生物合成的主要前体物质,这两种前体的生物合成来源于MVA和MEP两个途径。在光照条件下,MEP途径在萜烯类产物的合成过程中起着主要作用[12]。Towler等[4]研究发现,专一性阻断MEP途径上的基因能够使青蒿素的含量出现大幅度的下降。2010年,Graham等[1]在《Science》上报道了青蒿EST测序结果,推测DXR是青蒿素依赖于MEP途径合成的关键酶; 随后本实验室采用转基因技术证明,过量表达MEP途径上的DXR能够提高青蒿中青蒿素含量[13]。表明MEP途径在青蒿素的前体生物合成中起着重要作用。本 研究成功的从青蒿中克隆了AaMCT基因。该基因在青蒿的根、茎、叶、花和分泌型腺体中均有表达。研究表明分泌型腺体是青蒿素生物合成的主要场所,也是其他萜烯类物质合成和储藏的主要部位[14]。而AaMCT在分泌型腺体中大量表达,提示该基因可能与青蒿素的生物合成密切相关。
MeJA作为常见的植物激素,它能够影响多种植物次生代谢产物的合成[15]。本实验室研究证实,外源的MeJA能显著提高青蒿中青蒿素的含量,并且能够使青蒿素生物合成途径上游 (DXS、DXR、HDR),下游 (ADS、CYP71AV1、DBR2、ALDH1) 及参与调控青蒿素合成的转录因子 (ORA、ERF1) 等多个基因的表达量大幅上调[16]。一般来说,对MeJA响应的基因是代谢工程中候选基因的主要参考。本研究中AaMCT受到MeJA强烈诱导,提示该基因可能与某些次生代谢产物的合成有关,但其具体作用还需深入研究。
AaMCT是MEP途径上的第3个酶,该酶是否是MEP途径上的限速酶,还需确定。如果该酶是这个途径上的限速酶,那么通过超量表达该基因就很有可能解除该酶带来的瓶颈效应,推动代谢流往目标产物方向流动。反之,超量表达不能促进目标产物的合成。本研究中将AaMCT在拟南芥中超量表达,导致以异戊二烯为基本单元合成的叶绿素a、叶绿素b和类胡萝卜素的含量显著提高,表明AaMCT对萜类物质的合成具有重要作用,并且能够推动代谢流向下游流动。该实验为后期在青蒿中超量表达AaMCT提供理论依据。AaMCT基因的克隆和分析为深入研究青蒿素生物合成的分子调控机制奠定基础,并为青蒿素代谢工程提供了一个新的候选基因。
| [1] | Graham IA, Besser K, Blumer S, et al. The genetic map of Artemisia annua L.identifies loci affecting yield of the antimalarial drug artemisinin[J]. Science , 2010, 327 :328–331. DOI:10.1126/science.1182612 |
| [2] | Abdin M, Israr M, Rehman R, et al. Artemisinin,a novel antimalarial drug:biochemical and molecular approaches for enhanced production[J]. Planta Med , 2003, 69 :289–299. DOI:10.1055/s-2003-38871 |
| [3] | Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin[J]. Nature , 2013, 496 :528–532. DOI:10.1038/nature12051 |
| [4] | Towler MJ, Weathers PJ. Evidence of artemisinin production from IPP stemming from both the mevalonate and the nonmevalonate pathways[J]. Plant Cell Rep , 2007, 26 :2129–2136. DOI:10.1007/s00299-007-0420-x |
| [5] | Wang H, Ma C, Li Z, et al. Effects of exogenous methyl jasmonate on artemisinin biosynthesis and secondary metabolites in Artemisia annua L[J]. Ind Crop Prod , 2010, 31 (214) :218. |
| [6] | Teoh KH, Polichuk DR, Reed DW, et al. Artemisia annua L.(Asteraceae) trichome-specific cDNAs reveal CYP71AV1,a cytochrome P450 with a key role in the biosynthesis of the antimalarial sesquiterpene lactone artemisinin[J]. FEBS Lett , 2006, 580 :1411–1416. DOI:10.1016/j.febslet.2006.01.065 |
| [7] | Liu W, Zhao T, Wang H, et al. Reference gene selection in Artemisia annua L.,a plant species producing anti-malarial artemisinin[[J]. Plant Cell Tiss Organ Cult , 2015, 121 :141–152. DOI:10.1007/s11240-014-0690-2 |
| [8] | Kapila J, De Rycke R, Van Montagu M, et al. An Agrobacterium-mediated transient gene expression system for intact leaves[J]. Plant Sci , 1997, 122 :101–108. DOI:10.1016/S0168-9452(96)04541-4 |
| [9] | Clough SJ, Bent AF. Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J]. Plant J , 1998, 16 :735–743. DOI:10.1046/j.1365-313x.1998.00343.x |
| [10] | Marr IL, Suryana N, Lukulay P, et al. Determination of chlorophyll a and b by simultaneous multi-component spectrophotometry[J]. Fresen J Anal Chem , 1995, 352 :456–460. DOI:10.1007/BF00323366 |
| [11] | Maes L, Van Nieuwerburgh FC, Zhang Y, et al. Dissection of the phytohormonal regulation of trichome formation and biosynthesis of the antimalarial compound artemisinin in Artemisia annua plants[J]. New Phytol , 2011, 189 :176–189. DOI:10.1111/j.1469-8137.2010.03466.x |
| [12] | Cordoba E, Salmi M, León P. Unravelling the regulatory mechanisms that modulate the MEP pathway in higher plants[J]. J Exp Bot , 2009, 60 :2933–2943. DOI:10.1093/jxb/erp190 |
| [13] | Xiang L, Zeng L, Yuan Y, et al. Enhancement of artemisinin biosynthesis by overexpressing dxr,cyp71av1 and cpr in the plants of Artemisia annua L[J]. Plant Omics , 2012, 5 :503–507. |
| [14] | Duke MV, Paul RN, Elsohly HN, et al. Localization of artemisinin and artemisitene in foliar tissues of glanded and glandless biotypes of Artemisia annua L[J]. Int J Plant Sci , 1994, 155 :365–372. DOI:10.1086/297173 |
| [15] | De Geyter N, Gholami A, Goormachtig S, et al. Transcriptional machineries in jasmonate-elicited plant secondary metabolism[J]. Trends Plant Sci , 2012, 17 :349–359. DOI:10.1016/j.tplants.2012.03.001 |
| [16] | Xiang L, Zhu S, Zhao T, et al. Enhancement of artemisinin content and relative expression of genes of artemisinin biosynthesis in Artemisia annua by exogenous MeJA treatment[J]. Plant Growth Regul , 2015, 75 :435–441. DOI:10.1007/s10725-014-0004-z |
 2016, Vol. 51
2016, Vol. 51


