2. 安徽省中药日化产品工程技术研究中心, 安徽 芜湖 241000
2. Anhui Provincial Engineering Technology Research Center of Traditional Chinese Medicine Daily Supplies, Wuhu 241000, China
常用传统皮类中药牡丹皮 (Moutan Cortex) 为毛茛科 (Ranunculaceae) 芍药属 (Paeonia) 牡丹 (Paeonia suffruticosa Andr.) 的干燥根皮[1]; 安徽铜 陵地区 (包括南陵丫山) 所产牡丹皮特称凤丹皮,是著名的道地药材[2]。中药材历来注重道地性[3, 4]。基原相同的中药材质量可因产地不同而存在明显差异,这些与植物、土壤和微生物所构建的土壤生态系统密切相关,包括细菌、放线菌、真菌在内的土壤微生物在物质分解、养分循环、土壤肥力形成等过程中起着关键性作用,中药材道地性应研究不可忽视的基原根际微生物[5-7]。但依靠传统培养方法获得的土壤微生物不足1%[8]。Biolog技术是一种广泛应用于土壤测试与环境微生物群落功能的方法,能有效反映有关微生物群落总体活性的信息[9, 10],避开微生物分离培养难点的宏基因组学技术可从环境中直接提取微生物遗传物质并测序,以高通量、高准确性等特点而被广泛用于海洋生物、植物、土壤、医药等研究领域,但鲜有用于中药材道地性方面的研究报道[11-16]。本文选择牡丹皮道地产区 (安徽铜陵和南陵) 和非道地产区 (安徽亳州、山东菏泽和河南洛阳) 药用牡丹为研究对象[2, 17],运用Biolog方法以及454宏基因组测序技术,研究不同生长发育时期药用牡丹根际土壤微生物活性差异以及真菌的多样性,旨在为中药材道地性理论提供科学的实验证据。
材料与方法材料 于2012年4月 (花期)、7月 (果期)、10月 (地上部分枯萎期) 和2013年1月(萌芽期),在安徽省铜陵市铜陵县顺安镇、芜湖市南陵县河湾镇、亳州市谯城区十八里镇、山东省菏泽市牡丹区小留镇、河南省洛阳市孟津县麻屯镇,随机选择正常生长的3年生药用牡丹 (经作者鉴定为Paeonia suffruticosa Andr.,凭证标本存安徽师范大学生命科学学院/中药资源研究所),震荡根部以去掉大块的土壤和有机质后收集仍粘附在根表面的土壤作为根际土壤样品。每个样品由各产区各时期随机选择的5株植物根际土壤混合均匀而成。每样品3个重复。采回样品置于4 ℃冰箱保存并尽快用于测试。
微生物活性测定 参考Lin[10],称取10 g土壤样品入90 mL 0.85% NaCl无菌溶液三角瓶中振荡30 min (70 r·min-1),按10倍稀释法制成1×10-3土壤稀释 液倒入已灭菌的V型槽中; 使用8通道移液器接种,Biolog微孔板每微孔注入150 μL稀释液,25 ℃条件下培养7天,每隔12 h测定吸光度 (590 nm)。微平板每孔平均颜色变化率 (average well color development,AWCD) 按下列公式计算,利用Microsoft Excel 2003完成数据分析。单因素方差One-WayANOVA用SPSS13.0处理。
真菌基因组DNA提取与扩增每组称取0.5 g土壤样品研磨成粉末状并充分混匀,采用FastDNASpin Kit for Soil (MP Biomedicals,CA,USA) 试剂盒提取DNA,采用UV-1700(Japan) 紫外分光光度计检测DNA浓度并用0.8% 的琼脂糖凝胶电泳检测其质量。以引物F (5'-CTTGGTCATTTAGAGGAAGTAA-3') 和R (5'-TCCTCCGCTTATTGATATGC-3') 扩增土壤真菌rDNA基因内转录间隔 (internal transcribed spacer,ITS) 区全长。
PCR反应体系: 灭菌超纯水14.375 μL; Buffer (10×) 2.50 μL; dNTP (2.5 mmol·L-1)2.00 μL; 模板 (20 ng·μL-1) 4.00 μL; Forward引物(10 μmol·L-1) 1.00 μL; Reverse引物 (10 μmol·L-1)1.00 μL; TaKaRa Pyrobest酶 (5 U·μL-1) 0.125 μL; 总体积25.00 μL。
PCR扩增程序: 94 ℃预变性5 min; 94 ℃变性1 min; 47 ℃退火40 s; 共30个循环。72 ℃延伸1min; 72 ℃延伸7 min。
每样品重复3次,混合同一样品PCR产物,经1.5% 琼脂糖凝胶电泳检测,割胶纯化。
宏基因组测序及数据处理 实验流程: 宏基因组DNA样品和PCR引物准备、Amplicon文库制备、emPCR扩增、Roche 454 GS FLX+测序仪上机测序。对Roche 454 GS FLX+的测序数据进行质量控制,舍弃低质量序列并筛选序列长度200~1 000 bp、连续相同碱基 < 8、模糊碱基N < 1、Q25,获得最终用于分析的优质序列。
根据97% 的相似性,应用Qiime将序列归为多个可操作分类单元 (operational taxonomic unit,OTU)。Qiime调用uclust对序列进行聚类,选取每个类最长的序列为代表序列。采用Blast方法比对UNITE数据库,得到每个OTU分类学信息。OTU产出后,统计各样品含有OTU情况。根据获得的OTU数据作出每个样品稀释曲线,用于表明每个样品的取样深度,并运用Mouther计算Alpah多样性指数包括物种丰富度Chaol指数和多样性Shannon指数以及克隆文库的覆盖率Coverage指数。应用软件MEGAN4构建物种进化树及丰度信息图。利用基于unifrac的主坐标分析 (PCoA,principal co-ordinate analysis)、Cluster 3.0及Java Treeview制作的热图分析 (heatmap) 比较五产区牡丹4个生长时期根际土壤真菌的组成以及群落结构的相似性和差异性。
结果 1 牡丹根际土壤微生物活性及功能多样性特征基于SPSS 13.0对不同产区同一生长时期AWCD值所进行的两两之间的显著性差异分析,五产区牡丹4个生长时期根际土壤AWCD值呈升高趋势 (图 1)。其中萌芽期铜陵AWCD值最高,而且铜陵、南陵、亳州、菏泽四产区两两之间差异不显著,但均与洛阳存在显著差异 (P < 0.05);花期AWCD值也是铜陵最高,且铜陵、洛阳两产区与亳州、菏泽之间存在显著差异 (P < 0.05);果期AWCD值为南陵最高,且南陵与其他四产区存在显著差异 (P < 0.05);地上部分枯萎期铜陵、南陵、菏泽、亳州四产区AWCD值持续高于洛阳,但五产区两两之间差异不显著 (P > 0.05)。
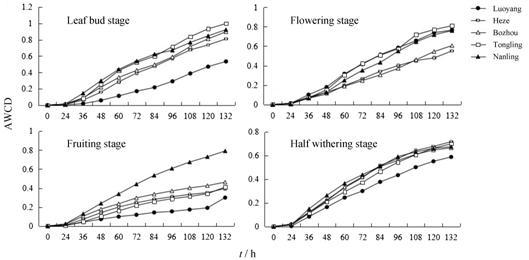
|
Figure 1 The value of average well color development (AWCD) from the rhizosphere soil of P. suffruticosa in five regions during four growth stages |
采用454宏基因组测序技术对来自五产区20个样品真菌rDNA ITS区全长进行测序,获得328 102条有效序列、272 463条优质序列,按照相似性97% 的分类标准共分为9 703个OTU。4个时期数据均以萌芽期、花期、果期、地上部分枯萎期次序分析。其中9.4、9.1、9.2、9.3分别代表安徽铜陵产区3年生牡丹萌芽期、花期、果期、地上部分枯萎期根际土壤样品; 3.4、3.1、3.2、3.3分别代表安徽芜湖南陵产区3年生牡丹萌芽期、花期、果期、地上部分枯萎期根际土壤样品; 6.4、6.1、6.2、6.3分别代表安徽亳州产区3年生牡丹萌芽期、花期、果期、地上部分枯萎期根际土壤样品; 7.4、7.1、7.2、7.3分别代表山东菏泽产区3年生牡丹萌芽期、花期、果期、地上部分枯萎期根际土壤样品; 8.4、8.1、8.2、8.3分别代表河南洛阳产区3年生牡丹萌芽期、花期、果期、地上部分枯萎期根际土壤样品。其中南陵产区4个时期样品OTU数介于407~486,亳州产区介于940~1 193,菏泽产区介于309~1 002,洛阳产区介于747~2 346,铜陵产区介于1 019~1 595(表 1)。
| Table 1 Sequencing data statistics of 20 samples |
20个样品中除洛阳果期、铜陵萌芽期样品外,其他三产区不同生长发育时期样品稀释曲线均趋于平坦 (图 2)。
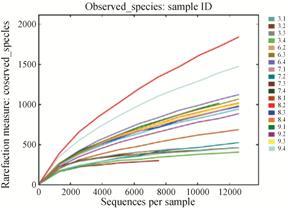
|
Figure 2 Rarefaction curves of 20 samples at similarity of 97% |
从萌芽期至果期,产自铜陵和亳州土壤样本中真菌丰富度指数Chaol值呈现减小趋势,而到地上部分枯萎期Chaol值则增大。南陵产区从萌芽期至果期Chaol值略有增大,而至地上部分枯萎期呈减小趋势。菏泽产区从萌芽期至花期Chaol值呈增大趋势,到果期和地上部分枯萎期则一直在减小。但就反映物种丰富度及均匀度的Shannon指数而言,从萌芽期至花期,铜陵、南陵、洛阳产区Shannon值均呈减小趋势,至果期Shannon值增大,而到地上部分枯萎期呈减小趋势。亳州产区从萌芽期至花期Shannon值略有减小,到果期和地上部分枯萎期有所增大。菏泽从萌芽期至果期Shannon值呈减小趋势,到地上部分枯萎期呈增大趋势 (表 2)。
| Table 2 Sequencing data statistics of 20 samples |
测序所得9 703个OTU,有超过81% 的OTU (7 927个) 仅在单个产区中发现: 有606个OTU仅在南陵产区中发现,1 402个OTU仅在亳州产区中发现,822个OTU仅在菏泽产区中发现,而只在洛阳产区和铜陵产区中发现的OTU分别有2 440个和2 656个。仅有89个OTU同时在五产区中发现 (图 3)。其中g3代表南陵产区,g6代表亳州产区,g7代表菏泽产区,g8代表洛阳产区,g9代表铜陵产区。

|
Figure 3 OTU venn diagram from rhizosphere soil of P. suffruticosa in five different regions. g3: Nanling; g6: Bozhou; g7: Heze; g8: Luoyang; g9: Tongling |
牡丹皮五产区4个时期已检测到的真菌分布于子囊菌门 (Ascomycota)、担子菌门 (Basidiomycota)、壶菌门 (Chytridiomycota)、球囊菌门 (Glomeromycota)、接合菌门 (Zygomycota) 5个门,隶属22纲、70目、139科、266属,其中5个门在各产区的含量不同且以Ascomycota所占比例最高 (约25.4%~76.7%) (图 4)。
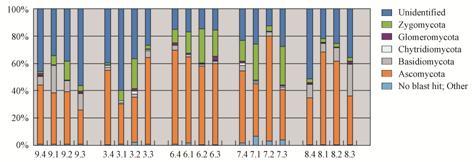
|
Figure 4 Fungi from rhizosphere soil of P. suffruticosa distributed at phyla level |
就属层次而言,各产区4个生长发育时期检测到的真菌总数量及含量 (百分数保留到小数点后一位) 在1%以上 (包含1%) 的详见图 5,其中环形图由内而外依次为萌芽期、花期、果期和地上部分枯萎期。
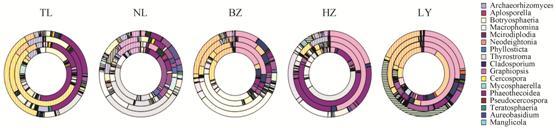
|
Figure 5 Fungi from rhizosphere soil of P. suffruticosa at the level of genus. TL: Tongling; NL: Nanling; BZ: Bozhou; HZ: Heze; LY: Luoyang |
在属层次上,铜陵产区萌芽期98属 [Botryosphaeria (3.4%)、Exophiala (7.3%)、Monacrosporium (1.1%)、Coltricia (1.1%)、Trichosporon (1.4%)]、花期63属[Exophiala (5.0%)、Guehomyces (16.2%)、Cryptococcus(1.6%)]、果期68属 [Botryosphaeria (1.9%)、Exophiala (5.5%)、Guehomyces (3.0%)、Cryptococcus (1.1%)、Trichosporon (1.2%)]、地上部分枯萎期88属 [Exophiala (4.2%)、Guehomyces(8.5%)]; 南陵产区萌芽期46属[Aspergillus (2.7%)、Fusarium (3.4%)]、花期51属[Fusarium (1.1%)]、果期40属[Fusarium (2.2%)、Neonectria(1.0%)]、地上部分枯萎期56属[Exophiala (1.0%)、Hamigera (1.2%)、Fusarium (6.9%)、Neonectria (2.1%)、Tomentella (1.4%)]; 亳州产区萌芽期42属[Leptosphaeria (1.7%)、Guehomyces (1.2%)、Cryptococcus (1.3%)]、花期48属 [Leptosphaeria (2.1%)]、果期55属、地上部分枯萎期56属 [Cryptococcus (1.3%)]; 菏泽产区萌芽期53属 [Leptosphaeria (1.4%)、Exophiala (4.6%)、Aspergillus (1.2%)、Fusarium (18.3%)、Neonectria (2.5%)、Podospora (1.4%)、Pestalotiopsis (1.6%)、Coprinus (1.3%)、Guehomyces (1.4%)]、花期64属[Leptosphaeria(4.4%)、Exophiala (10.7%)]、果期48属 [Leptosphaeria (9.5%)、Exophiala (4.8%)、Guehomyces (1.2%)、Trichosporon (1.7%)]、地上部分枯萎期36属[Leptosphaeria (4.7%)、Exophiala (3.5%)、Pseudaleuria (1.3%)、Neonectria (2.8%)、Wardomyces (4.1%)]; 洛阳产区萌芽期63属 [Leptosphaeria (1.8%)、Lophiostoma (7.0%)、Kurtzmanomyces (1.0%)、Guehomyce (1.4%)、Cryptococcus (4.2%)]、花期62属 [Leptosphaeria (11.0%)、Cryptococcus (4.0%)]、果期90属 [Leptosphaeria (6.4%)、Alternaria (1.5%)、Exophiala (1.6%)、Penicillium (2.3%)、Cryptococcus (6.8%)]、地上部分枯萎期73属 [Leptosphaeria (7.3%)、Penicillium (1.7%)、Ceratobasidium (12.8%)、Cryptococcus (5.4%)]。其中,各产区均有分布的真菌有24属 (表 3),但在道地产区铜陵和南陵均有分布的仅6属(表 4)。
| Table 3 Content of shared genus in five regions during different stages (unit: %) |
| Table 4 Content of genus shared only in Tongling and Nanling regions (unit: %) |
应用软件MEGAN4 (http://ab.inf.uni-tuebingen.de/ software/megan) 将测序所得物种丰度信息回归至数据库的分类学系统关系树中生成物种进化树及丰度信息并比对不同产区样品在不同分类学分支上序列的数量差异 (图 6),图中饼面积代表相应物种在该样品中的丰度,有色面积代表以相应颜色表示的样品对该物种丰度的贡献。五产区根际土壤真菌分为Blastocladiales、Chytridiomycota、Dikarya、Glomeromycetes四大支系,整体上亳州和菏泽两产区对真菌丰度贡献最大,铜陵和南陵次之,洛阳最小。
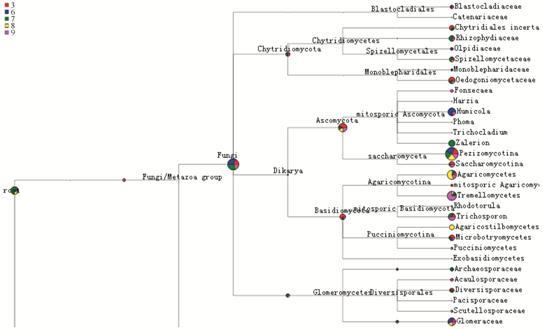
|
Figure 6 Phylogenetic tree and abundance of fungi from the rhizosphere soil |
采用Weightedunifrac PCoA定量分析基于系统发育距离的五产区4个生长发育时期样品的相似性,第一、第二轴分别能够解释数据中29.55%、15.56%的变量 (图 7),在坐标轴上的距离相近的有: 铜陵、南陵4个发育时期样品与菏泽萌芽期、果期样品; 菏泽花期和地上部分枯萎期样品; 亳州4个发育时期样品; 洛阳萌芽期和地上部分枯萎期样品以及花期和果期样品。其中紫色正方形代表铜陵产区、红色三角形代表南陵、蓝色三角形代表亳州、橙色三角形代表菏泽、绿色圆形代表洛阳。
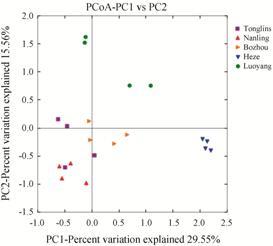
|
Figure 7 PCoA analysis of soil fungal community |
利用基于系统发育的聚类分析对五产区4个时期牡丹根际土壤真菌群落相似性进行分析构建出的热图heatmap分为两大支系: 铜陵和南陵产区的4个生长发育时期处于同一分支,亳州、菏泽、洛阳产区的4个生长发育时期处于另一分支 (图 8)。
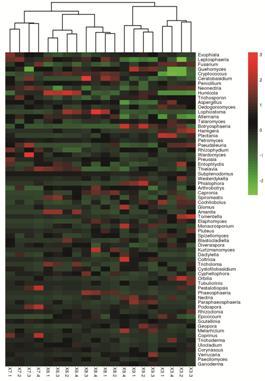
|
Figure 8 Heatmap analyses of fungi from the rhizosphere soil at genus level |
关于牡丹土壤微生物的研究很多,但围绕中药材道地性方面的研究相对缺乏[18-21]。本文采用Biolog技术和454测序技术,检测中药材牡丹皮五产区4个生长发育时期的牡丹根际土壤微生物整体活性以及真菌多样性,是探讨中药材道地性与土壤微生物相关性的有益尝试。
研究表明,碳源AWCD在培养早期各处理间的差异不大,但随着培养时间延长至72 h,不同产区牡丹根际土壤微生物的AWCD值出现显著差异,萌芽期和花期均以铜陵产区最高,果期以南陵产区最高,地上部分枯萎期在五个产区之间并无显著差异。
测序中所有样品覆盖率指数均高于90%,说明样品中占主要优势的真菌均已得到分析,可以反映所采集土壤样品真菌群落的多样性,这一结果与稀疏曲线分析一致; 20个样品中有12%~58%的未名真菌并且洛阳果期和铜陵萌芽期样品继续测序还可能产生较多新的OUT,预示牡丹土壤根际真菌新类群丰富。
植被、土壤类型、气候甚至一些人为因素等均可能影响土壤微生物的多样性[22-25]。同一生长发育时期的chaol值,萌芽期、花期、地上部分枯萎期均以铜陵最大,果期以洛阳最大,表明萌芽期、花期和地上部分枯萎期铜陵产区牡丹根际土壤真菌的物种数量最多,而果期洛阳产区牡丹根际土壤真菌的物种数量最多; 同一发育时期shannon值,萌芽期以铜陵最大,花期以菏泽最大,果期和地上部分枯萎期以洛阳最大,表明萌芽期铜陵产区牡丹根际土壤真菌多样性最高,花期菏泽产区牡丹根际土壤真菌多样性最高,果期和地上部分枯萎期洛阳产区牡丹根际土壤真菌多样性最高。造成不同产区牡丹根际土壤真菌丰富度和多样性差异的主导因素还需深入研究。
本研究所检测的五产区真菌种类、数量以及各真菌在属层次上所占比例存在差异且各产区优势菌群也不尽相同,其中铜陵产区萌芽期和果期优势菌群相同 (均为Exophiala),花期和地上部分枯萎期优势菌群相同 (均为Guehomyces); 南陵产区4个时期优势菌群为Fusarium; 亳州产区萌芽期和花期优势菌群均为Leptosphaeria,果期和地上部分枯萎期优势菌群均为Cryptococcus; 菏泽产区萌芽期优势菌群为Fusarium,花期为Exophiala,果期和地上部分枯萎期均为Leptosphaeria; 洛阳产区萌芽期和果期优势菌群均为Cryptococcus,花期为Leptosphaeria,地上部分枯萎期为Ceratobasidium。Curvularia、Paraconiothyrium、Cylindrocarpon、Macrophomina、Xylaria、Otospora 6属真菌仅分布于铜陵和南陵产区。有研究表明,从Curvularia中提取的生物碱具有较强的抗菌活性[26, 27],Paraconiothyrium有保护宿主且可抑制常见植物病原体生长的作用[28],Cylindrocarpon培养基中提取的化合物对枯草芽孢杆菌等有抗菌活性[29]; 这些真菌对药用牡丹的生长乃至牡丹皮的药材品质有着怎样的影响有待进一步研究。
PCoA分析表明铜陵、南陵4个生长发育时期和菏泽萌芽期、果期牡丹根际土壤真菌组成较近。Heatmap图显示在系统发育上,铜陵和南陵产区的真菌群落结构相似,亳州、菏泽和洛阳三产区的相似; 这与通过构建NJ邻接树及遗传距离分析得出洛阳和菏泽牡丹属同一分支的结果一致[30]。两道地产区与3个非道地产区之间根际土壤真菌群落结构差异性较大,不同产区牡丹根际土壤真菌存在差异性地理分布格局。
综合上述,基于Biolog方法的研究显示牡丹皮道地产区微生物整体活性高于非道地产区; 基于rDNA ITS测序的宏基因组测序研究表明五产区牡丹根际土壤真菌具有丰富的系统发育多样性,潜在真菌新类群丰富,在不同产区大多存在特异性分布。研究结果可以为中药材道地性理论提供实验依据。
| [1] | Chinese Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S].2015 ed.Part.Ⅰ Beijing:China Medical Science Press,2015:172. |
| [2] | Hou YR, Liu W, Zheng Y. Research on geo-authentic fe atures of moutan cortex from Yashan Mountain in Nanling city,Anhui Province[J]. J Chin Med Mater (中药材) , 2014, 37 :1485–1488. |
| [3] | Wu P (Wei Dynasty) dictated, Sun XY et Sun FY (Qing Dynasty). Shen Nong's Herbal Classic (神农本草经)[M]. Beijing: People's Medical Publishing House, 1982 . |
| [4] | Huang LQ, Guo LP, Ma CY, et al. Top-geoherbs of traditional Chinese medicine:commom traits,quality characteristics and formation[J]. Front Med , 2011, 5 :185–194. DOI:10.1007/s11684-011-0141-y |
| [5] | Huang LQ, Zhang RX. Biology discussion of "top-geoherbs of traditional Chinese medicine"[J]. Chin Pharm J (中国药学杂志) , 1997, 32 :563–566. |
| [6] | Zheng Y. Soil rhizosphere micro-organism and geo-authentic medicinal materials[J]. Res Pract Chin Med (现代中药研究与实践) , 2007, 21 :60–63. |
| [7] | Jiang S, Duan JA, Qian DW, et al. Effects of microbes in plant rhizosphere on geoherbalism[J]. Soils (土壤) , 2009, 41 :344–349. |
| [8] | Torsvik V, Øvreås L. Microbial diversity and function in soil:from genes to ecosystems[J]. Curr Opin Micobiol , 2002, 5 :240–245. DOI:10.1016/S1369-5274(02)00324-7 |
| [9] | Zabinski CA, Gannon JE. Effects of recreational impacts on soil microbial communities[J]. Environ Manage , 1997, 21 :233–238. DOI:10.1007/s002679900022 |
| [10] | Lin XG. Principles and Methods of Soil Microbiology Research (土壤微生物研究原理与方法)[M]. Beijing: Higher Education Press, 2010 : 170 -171. |
| [11] | Li Y, Sun C, Luo HM, et al. Transcriptome characterization for Salvia miltiorrhiza using 454 GS FLX[J]. Acta Pharm Sin (药学学报) , 2010, 45 :524–529. |
| [12] | Fierer N, Leff JW, Adams BJ, et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Proc Natl Acad Sci USA , 2012, 109 :21390–21395. DOI:10.1073/pnas.1215210110 |
| [13] | Ottesen AR, González PA, White JR, et al. Baseline survey of the anatomical microbial ecology of an important food plant:So lanum lycopersicum (tomato)[J]. BMC Microbiol , 2013, 13 :114. DOI:10.1186/1471-2180-13-114 |
| [14] | Larsbrink J, Rogers TE, Hemsworth GR, et al. A discrete genetic locus confers xyloglucan metabolism in select human gut Bacteroidetes[J]. Nature , 2014, 506 :498–502. DOI:10.1038/nature12907 |
| [15] | Yuan XF, Peng SM, Wang BL, et al. Differences of fungal diversity and structure in rhizosphere of Fritillaria thunbergii from different provenances[J]. China J Chin Mater Med (中国中药杂志) , 2014, 39 :4304–4310. |
| [16] | Sanli K, Bengtsson-Palme J, Nilsson RH, et al. Metagenomic sequencing of marine periphyton:taxonomic and functional insights into biofilm communities[J]. Front Microbiol , 2015, 6 :1192. |
| [17] | Xu GJ, Xu LS. Species Systematization and Quality Evaluation of Commonly Used Chinese Traditional Drugs(常用中药材品种整理和质量研究)[M]. Fuzhou: Fujian Science and Technology Publishing House, 1997 : 634 -636. |
| [18] | Guo SX, Zhang YG, Wang LY, et al. Isolation and identification of arbuscular mycorrhizal fungi in the rhizosheric soil of tree-peony grown in the main cultivation area of China[J]. J Qingdao Agric Unive (Nat Sci)(青岛农业大学学报:自然科学版) , 2010, 27 :105–109. |
| [19] | Chen DM, Guo N, Guo SX. Effects of arbuscular mycorrhizal fu ngi on growth and some physiological indices of Paeonia suffruticosa[J]. Acta Bot Boreal Occid Sin (西北植物学报) , 2010, 30 :0131–0135. |
| [20] | Xu WJ.The Study of Tree Peony Rhizosphere Soil Enzyme Activity and Microbial Community (牡丹根际土壤酶活性及微生物群落的研究)[D].Zhengzhou:Henan Agricultural University,2014. |
| [21] | Huang X, Xue D, Xue L. Changes in soil microbial functional diversity and biochemical characteristics of tree peony with amendment of sewage sludge compost[J]. Environ Sci Pollut Res Int , 2015, 22 :11617–11625. DOI:10.1007/s11356-015-4407-9 |
| [22] | Zhou J, Lei T. Review and prospects on methodology and affecting factors of soil microbial diversity[J]. Biodiv Sci (生物多样性) , 2007, 15 :306–311. DOI:10.1360/biodiv.070069 |
| [23] | Sun F, Zhao CC, He QJ, et al. Effects of fertilization and diversity of weed species on the soil microbial community[J]. Acta Ecol Sin (生态学报) , 2015, 35 :6023–6031. |
| [24] | Yang N, Yang MY, Lei YL, et al. Scasonal variations of soil microbial communities on sloping-land with purple soils[J]. Ecol Environ Sci (生态环境学报) , 2015, 24 :34–40. |
| [25] | Zhang GY.Microbial Diversity in Soils (Iron-Manganese Nodules) from Several Habitats (几种生境土壤(铁锰结核)中微生物多样性的研究)[D].Wuhan:Huazhong Agricultural University,2015. |
| [26] | Han WB, Lu YH, Zhang AH, et al. Curvulamine,a new antibacterial alkaloid incorporating two undescribed units from a Curvularia species[J]. Org Lett , 2014, 16 :5366–5369. DOI:10.1021/ol502572g |
| [27] | Shen XY, Cheng YL, Cai CJ, et al. Diversity and antimicrobial activity of culturable endophytic fungi isolated from moso bamboo seeds[J]. PLoS One , 2014, 9 :e95838. DOI:10.1371/journal.pone.0095838 |
| [28] | Combès A, Ndoye I, Bance C, et al. Chemical communication between the endophytic fungus Paraconiothyrium variabile and the phytopathogen Fusarium oxysporum[J]. PLoS One , 2012, 7 :e47313. DOI:10.1371/journal.pone.0047313 |
| [29] | Kawaguchi M, Fukuda T, Uchida R, et al. A new ascochlorin derivative from Cylindrocarpon sp.FKI-4602[J]. Antibiot (Tokyo) , 2013, 66 :23–29. DOI:10.1038/ja.2012.75 |
| [30] | Xu G, Yu C, Yang Y, et al. Genetic profiling of Paeonia species from different geographical origins by nuclear ribosomal ITS sequence analysis[J]. Nat Prod Res Dev (天然产物研究与开发) , 2009, 21 :225–230. |
 2016, Vol. 51
2016, Vol. 51


